旅行者腹泻(traveler's diarrhea,TD)指在旅行期间或旅行后,每天有3次及以上未成形便,同时伴随腹痛、恶心、呕吐、发热或血便、粘液便的急性肠道传染病,全球TD发病率为30%~50%。调查发现,80%~90%的TD由细菌感染,其中40%~70%病原菌为产肠毒素大肠杆菌(enterotoxigenic Escherichia coli,ETEC)[1-2]。青壮年由于接触范围广为旅行者腹泻易感人群,另外老人、小孩、孕妇等免疫力低下者感染后症状较严重,可能引起心血管疾病、低血糖或脱水等症状[3]。ETEC感染后在黏附素作用下黏附、定殖于肠道上皮细胞,通过释放肠毒素引起细胞过度凋亡,破坏上皮细胞正常生理功能,导致肠道通透性和渗透性增加,造成肠道屏障受损,从而引起炎症和腹泻。同时,肠道屏障的损伤更有利于ETEC的定殖和肠毒素分泌入胞内,使其致病性增强,加剧肠道炎症与腹泻症状[4-5]。
益生菌是指足量摄入时能够对宿主产生健康益处的活性微生物,能够定植于肠道发挥多种益生功能[6-7]。其中,乳酸菌的特定菌株可以通过调节肠道微生态平衡、增强肠道屏障、改善机体免疫功能等多种机制改善肠道健康,是公认的有益菌[8-9]。大量研究表明,乳酸菌对腹泻具有缓解作用。臧凯丽等[10]研究发现,植物乳杆菌(Lactobacillus plantarum)和嗜酸乳杆菌(Lactobacillus acidophilus)能够改善便秘和腹泻人群的肠道菌群结构及相关症状。ŁUKASIK J等[11-12]研究发现,植物乳杆菌(Lactiplantibacillus plantarum)、副干酪乳杆菌(Lacticaseibacillus paracasei)、乳双歧杆菌(Bifidobacterium lactis)、鼠李糖乳杆菌(Lactobacillus rhamnosus)等乳酸菌能够降低儿童抗生素腹泻发病风险,并恢复营养不良婴儿的肠道菌群结构减少腹泻的发生。另外,OKSANEN P等[13-14]研究发现,服用乳酸杆菌和鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)能够显著降低TD发病率。但不同种属乳酸菌对旅行者腹泻的缓解效果具有差异性,其具体调控机制尚不明确。
因此,本研究采用肠道体外发酵模拟系统,通过考察不同种属乳酸菌对ETEC抑制效果,调节水通道蛋白-3(aquaporin-3,AQP-3)表达和免疫因子分泌能力,以及拮抗ETEC造成的肠道屏障损伤方面的作用效果,进一步探明不同种属乳酸菌对TD的干预机制及效果差异。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与细胞
植物乳杆菌(Lactobacillus plantarum)LP45、嗜酸乳杆菌(Lactobacillus acidophilus)La28、鼠李糖乳杆菌(Lactobacillus rhamnosus)LR519、乳双歧杆菌(Bifidobacterium lactis)BAL531、嗜热链球菌(Streptococcus thermophilus)S131、S709、S869、产肠毒素大肠杆菌(ETEC)、人体结肠癌细胞系HT-29细胞株:河北一然生物科技股份有限公司。
1.1.2 化学试剂
胎牛血清、胰蛋白酶细胞消化液(0.25%,含乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA),不含酚红)、磷酸盐缓冲液(phosphate buffer solution,PBS):武汉普诺赛生命科技有限公司;细胞/细菌总核糖核酸(ribonucleic acid,RNA)提取试剂盒、FastKing互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)第一链合成试剂盒、SuperReal 荧光定量预混试剂增强版(SYBR Green)试剂盒:天根生化科技有限公司;IL-8酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒:北京四正柏生物科技有限公司;0.25%胰蛋白酶溶液(含乙二胺四乙酸(EDTA),溶于磷酸盐缓冲液PBS):武汉普诺赛生命科技有限公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8):生工生物工程(上海)股份有限公司。
1.1.3 培养基
HT-29细胞完全培养基、McCoy's 5A培养基:武汉普诺赛生命科技有限公司;MRS肉汤培养基、LB培养基、哥伦比亚血平板:北京陆桥技术股份有限公司。
基础发酵培养基:参考文献[15]配制,调节pH至6.5,然后厌氧条件下在10 mL的西林瓶中分装5 mL培养基,密封后于115 ℃高压灭菌25 min。
1.2 仪器与设备
Mini细胞计数仪:美国Nexcelom公司;Multiskan Sky酶标仪、Fresco21型高速离心机:赛默飞世尔科技公司;CKX41倒置显微镜:日本奥林巴斯公司;DH-160HI二氧化碳培养箱、LRH-250F生化培养箱:昆山一恒仪器有限公司;9700型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:杭州博日科技有限公司;LM2 012实时荧光定量PCR(realtime fluorescent quantitative PCR,RT-fqPCR)分析仪:上海复星医学检测设备有限公司。
1.3 实验方法
1.3.1 乳酸菌、ETEC及HT-29细胞的培养
菌株活化:植物乳杆菌LP45、嗜酸乳杆菌La28、鼠李糖乳杆菌LR519、乳双歧杆菌BAL531、嗜热链球菌S131、S709、S869以3%(V/V)的接种量接种于MRS肉汤培养基,于37 ℃恒温培养箱中培养18 h,连续传代3次;ETEC以3%(V/V)的接种量接种于LB培养基中,37 ℃恒温培养箱中培养18 h,连续传代3次。
菌悬液浓度调整:取第3代培养18 h以恢复菌种活力后的各菌株调整菌液浓度。3代菌种4 ℃、5 000 r/min离心5 min,收集菌体用PBS洗涤2次4 ℃、5 000 r/min离心5 min后,去除上清,用MyCoy's 5A培养基重悬,利用细胞计数仪调整菌株LP45、La28、LR519、BAL531、S131、S709、S869 及ETEC菌体浓度均为108 CFU/mL,备用。
细胞培养:将在-80 ℃超低温冰箱中保存的细胞HT-29取出,37 ℃恒温水浴迅速解冻复苏,培养瓶中加入一定量的HT-29细胞完全培养基,5%CO2培养箱中37 ℃培养24 h至细胞长满培养瓶底面积80%后,加入1 mL胰蛋白酶细胞消化液消化处理1 min至细胞悬浮后加入2mL HT-29细胞完全培养基终止消化,细胞悬液于12 000 r/min离心2 min后收集细胞并转移至75 mL中号培养瓶中补充HT-29细胞完全培养基至15 mL,重复上述操作传代3次进行后续实验。
1.3.2 体外发酵实验分组及发酵液的制备
取正常人新鲜粪便用生理盐水按照1∶10(g∶mL)比例稀释过滤得到粪便接种液,取500 μL粪便接种液接种到基础发酵培养基中,按照表1分组及接种ETEC与各乳酸菌菌悬液,于37 ℃培养24 h后得到发酵液,将发酵液于9 000 r/min离心3 min,上清液经0.22 μm膜过滤后备用。
表1 体外发酵实验分组及接种
Table 1 Grouping and inoculation of fermentation experiments in vitro

分组 接种方法对照组(Control) 仅接种粪便接种液培养24 h ETEC组(ETEC)治疗组(ETEC+菌株)接种粪便接种液后接种等量的ETEC菌悬液培养24 h接种粪便接种液后接种等量的ETEC菌悬液培养12 h后分别接种等量的各乳酸菌菌悬液培养12 h
1.3.3 发酵液与HT-29细胞共培养
将1.3.1节中活化HT-29细胞浓度调整为2×105个/mL,每孔2 mL细胞液接于24孔板中,培养16~20 h细胞贴壁后,更换2 mL新鲜培养液。对照组、ETEC组及治疗组分别每孔接种1.3.2节中各分组发酵上清液200 μL于24孔板,接种200 μL HT-29细胞培养液为空白组,置于5%CO2培养箱中37 ℃培养12 h后每孔加入100 μL胰蛋白酶消化处理1 min至细胞悬浮,加入200 μL HT-29细胞完全培养基终止消化,收集细胞悬液于12 000 r/min离心2 min后分别收集细胞及上清液,-80 ℃贮藏待用。
1.3.4 不同种属乳酸菌抑制ETEC能力测定
采用牛津杯双层平板法,按照1.3.1将调整浓度后的ETEC涂布到哥伦比亚血平板上,立即放入牛津杯,加入菌体浓度均为108 CFU/mL的各乳酸菌菌悬液100 μL,以生理盐水为对照,37 ℃培养18 h,采用游标卡尺测量抑菌圈直径,当抑菌圈直径>8 mm表示有抑菌作用[16]。
1.3.5 HT-29细胞免疫因子质量浓度的测定
使用1.3.3节中所收集的细胞上清液再次于12 000 r/min离心2 min,取上清分装至无酶PE管中,按照ELISA试剂盒说明书测定各样品细胞因子质量浓度,细胞培养基作为空白孔。
1.3.6 实时荧光定量PCR分析
按照RNA Easy Fast动物组织/细胞RNA提取试剂盒操作说明提取1.3.3节中共培养后HT-29细胞RNA,并通过Fast King cDNA第一链合成试剂盒操作说明反转录为cDNA,并在-80 ℃保存。使用Super Real 荧光定量预混试剂增强版(SYBR Green)试剂盒进行RT-fqPCR,分析黏蛋白(mucin,MUC)(MUC2、MUC5AC)、水通道蛋白-3(aquaporin-3,AQP-3)基因与紧密连接蛋白基因,包括闭合小环蛋白-1/2(zonula occluden-1/2,ZO-1/2)及咬合蛋白(occludin)相对表达水平,RT-fqPCR引物序列见表2。
表2 RT-fqPCR引物序列
Table 2 Primer sequences of RT-fqPCR

引物 引物序列(5'-3')β-actin MUC2 MUC5AC AQP-3 ZO-1 ZO-2 occludin F:5'-TTTTAGGATGGCAAGGGACTT-3'R:5'-GATGAGTTGGCATGGCTTTA-3'F:5'-GACCCGCACTATGTCACCTT-3'R:5'-GGACAGGACACCTTGTCGTT-3'F:5'-CCAGCTCTGTGGCTTACTCC-3'R:5'-TCGGAGGTGGATATTGAAGG-3'F:5'-AGACAGCCCCTTCAGGATTT-3'R:5'-TCCCTTGCCCTGAATATCTG-3'F:5'-ATCCCTCAAGGAGCCATTC-3'R:5'-CACTTGTTTTGCCAGGTTTTA-3'F:5'-AAAGCAGAGCGAACGAAGAG-3'R:5'-TTTAGTTGCCAGACCCGTTC-3'F:5'-CCAATGTCGAGGAGTGGG-3'R:5'-CGCTGCTGTAACGAGGCT-3'
参照SYBR Green试剂盒说明书要求进行加样。加样后进行RT-fqPCR扩增,扩增体系、扩增参数参考张秋月等[17]的研究并加以修改:95 ℃、15 s,60 ℃、30 s,72 ℃、30 s,循环45次。溶解曲线分析步骤为65~95 ℃,每步升0.5 ℃,保持5 s。以β-actin基因为内参基因,采用2-ΔΔCt法计算各实验组相对于对照组各基因的相对表达倍数。
1.3.7 细胞增殖能力测定
将活化HT-29细胞浓度调整为2×105个/mL,每孔100 μL细胞液接于96孔板中,于5%CO2培养箱中37 ℃培养16~20 h细胞贴壁后,更换新鲜培养液,每孔接种分组发酵上清液10 μL于96孔板,接种10 μL细胞培养液为空白组,置于5%CO2培养箱中37 ℃培养12 h后参考CCK-8试剂盒说明书检测细胞增殖情况:每孔内加入10 μL的CCK-8溶液,细胞培养箱内孵育1 h,在波长450 nm处测定吸光度值(OD450 nm值。细胞相对增殖率计算公式如下:
式中:As表示实验组OD450nm值,Ac表示空白对照组OD450nm值。
1.3.8 数据统计分析
所有实验均设置3组平行,数据以“平均值±标准差”表示。采用Origin 9.5软件绘图,采用Excel 2016、SPSS 23.0软件对数据进行分析处理。
2 结果与分析
2.1 不同种属乳酸菌对ETEC的抑制能力
由图1可知,菌株LP45、La28、LR519、BAL531、S131、S709及S869抑菌圈直径均>8 mm,表现出明显的抑制ETEC的作用,其中嗜热链球菌S131抑菌圈直径达到(18.00±0.59)mm,抑菌作用最显著(P<0.05)。表明不同种属乳酸菌均具有良好的抑制致病菌、缓解TD的能力。相关研究表明[18-19],乳酸菌通过分泌抑菌物质,如短链脂肪酸,降低环境pH从而抵抗致病菌,或与致病菌竞争营养物质及黏附位点等方式阻断致病菌黏附与增殖。不同菌株生长过程中合成短链脂肪酸能力与黏附能力不尽相同,这可能是不同乳酸菌抑制致病菌能力存在差异的原因。
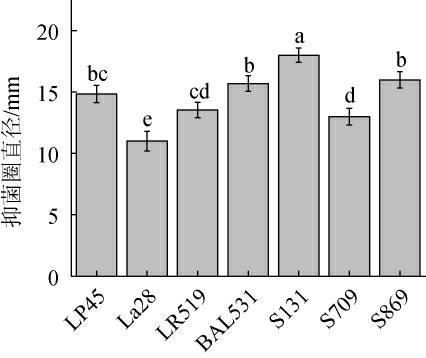
图1 不同种属乳酸菌对产肠毒素大肠杆菌的抑制能力
Fig.1 Inhibition ability of different species of lactic acid bacteria on enterotoxigenic Escherichia coli
不同字母表示各菌株抑菌作用差异显著(P<0.05)。下同。
2.2 不同种属乳酸菌拮抗ETEC引起的HT-29细胞炎症因子表达
细菌感染性腹泻中,致病菌ETEC影响了肠道屏障,侵入肠壁固有层,破坏免疫稳态,引发炎性病变,导致脓血渗出性腹泻,损害肠道健康[20-21]。由图2可知,ETEC组促炎因子白细胞介素-8(interleukin,IL-8)浓度相较于Control组显著增加了(20.82±5.70)%(P<0.05),表现出较高的促炎作用,可能引起炎症病变。菌株LP45、La28、BAL531、S131、S709、S869的干预使得IL-8浓度相较于ETEC组分别下降了(24.46±2.51)%、(30.45±4.05)%、(6.13±1.56)%、(30.16±4.34)%、(12.99±2.75)%和(35.07±3.19)%,其中菌株S869抑制作用显著(P<0.05)。与该结果相似,YANG J等[22-23]研究发现,乳杆菌属能够有效抑制ETEC刺激HT-29细胞产生炎症因子。大量动物实验也表明,乳酸菌能够降低仔猪或小鼠体内炎症因子水平,从而降低炎症反应[24-25]。结果表明,上述菌株能够抑制ETEC刺激HT-29细胞产生的促炎因子IL-8,从而抑制炎症发生、提高肠道免疫力,有效缓解ETEC感染造成的肠道炎症及渗出性腹泻。
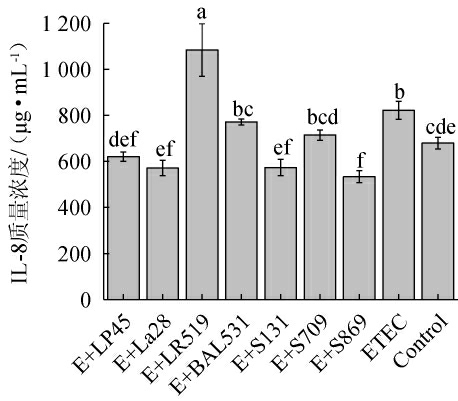
图2 不同种属乳酸菌拮抗产肠毒素大肠杆菌引起的HT-29细胞炎症因子表达
Fig.2 Different species of lactic acid bacteria antagonized the expression of inflammatory factors in HT-29 cells induced by enterotoxigenic Escherichia coli
2.3 不同种属乳酸菌对HT-29细胞AQP-3表达的影响
致病菌能够直接侵入肠道上皮细胞,引起细胞功能障碍,同时破坏肠道微绒毛减少肠道吸收面积,造成吸收障碍,从而引起吸收障碍性或渗出性腹泻[26-27]。水通道蛋白(aquaporins,AQPs)是位于细胞膜上的蛋白质,能够调节水在细胞中的转运,调节AQP-3表达能够有效改善便秘或腹泻症状[28-29]。由图3可知,与Control相比,ETEC使HT-29细胞AQP-3 mRNA相对表达下调至(34±7)%。与ETEC相比,除菌株S869外,其余各乳酸菌的干预均可改善ETEC造成的AQP-3表达下调,其中菌株LP45及S709提升作用显著,分别使AQP-3 mRNA相对表达显著提升(2.77±0.60)倍、(2.39±0.14)倍(P<0.05)。虽然ETEC引起腹泻的水外流机制尚未明确,但其可能与AQP-3表达下调有关,各乳酸菌通过恢复AQP-3的表达、提高肠道吸水能力,降低粪便含水量,从而改善ETEC造成的腹泻。该结果与IKARASHI N等[30-31]鼠李糖乳杆菌LB1改善ETEC引起仔猪腹泻的机制相似。
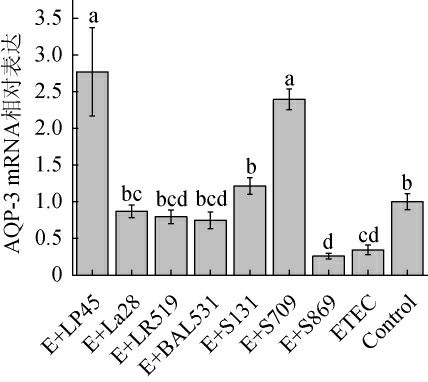
图3 不同种属乳酸菌对HT-29细胞AQP-3表达的影响
Fig.3 Effect of different species of lactic acid bacteria on AQP-3 expression in HT-29 cells
2.4 不同种属乳酸菌对HT-29细胞黏蛋白表达的影响
肠道中的杯状细胞能够分泌黏蛋白形成一层黏液屏障,黏液屏障作为肠道机械屏障的重要组成之一,能够保护肠道上皮细胞免受病原菌和有害物质的侵袭、一定程度上能够阻止致病菌的黏附,同时对肠上皮细胞保护及肠道转运过程至关重要[32-33]。由图4可知,与Control相比,ETEC分别使HT-29细胞MUC2、MUC5AC mRNA相对表达水平下调至(75±5)%(P>0.05)和(52±1)%(P<0.05),而各乳酸菌的干预能够改善ETEC对黏蛋白基因的抑制。其中,植物乳杆菌LP45能够显著提升MUC2信使核糖核酸(messenger ribonucleic acid,mRNA)相对表达至(2.39±0.15)倍(P<0.05),嗜热链球菌S709显著提升MUC5AC mRNA相对表达至(1.89±0.21)倍(P<0.05),从而增加肠道的黏液分泌,改善ETEC感染造成的黏液屏障损伤,增强肠道屏障、恢复黏膜屏障功能。
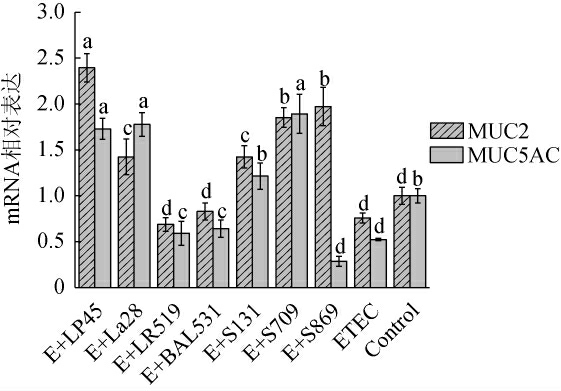
图4 不同种属乳酸菌对HT-29细胞黏蛋白表达的影响
Fig.4 Effect of different species of lactic acid bacteria on mucin expression in HT-29 cells
不同字母表示同一指标不同菌株差异显著(P<0.05)。
2.5 不同种属乳酸菌对HT-29细胞紧密连接蛋白表达的影响
紧密连接的肠道上皮细胞是肠道机械屏障的基础,能够有效避免致病菌或大分子物质透过细胞间隙,而致病菌可通过改变紧密连接蛋白结构与功能等方式破坏肠道屏障[33-34]。由图5可知,与Control相比,ETEC对紧密连接蛋白表达的抑制效果并不明显,仅使HT-29细胞ZO-2 mRNA相对表达下调至(63±4)%。另外,各乳酸菌的干预能够在ETEC存在的情况下上调各紧密连接蛋白的相对表达,其中嗜热链球菌S869分别使ZO-1、occludin mRNA相对表达显著上调(15.24±0.93)倍、(9.06±0.09)倍(P<0.05),鼠李糖乳杆菌LR519和乳双歧杆菌BAL531分别使ZO-2 mRNA相对表达显著上调(14.83±1.60)倍、(13.27±1.01)倍(P<0.05),表示各乳酸菌均可上调细胞紧密连接蛋白表达,增强肠上皮细胞的紧密连接,恢复肠道屏障功能,但其作用效果存在一定的菌株差异。这与朱翠等[35-36]研究发现,乳酸菌能够调节肠上皮细胞紧密连接蛋白表达及其在胞内的分布,肠道内双歧杆菌、乳杆菌分泌的短链脂肪酸能够维持肠黏膜上皮细胞紧密连接、保护肠道机械屏障的结果相似。
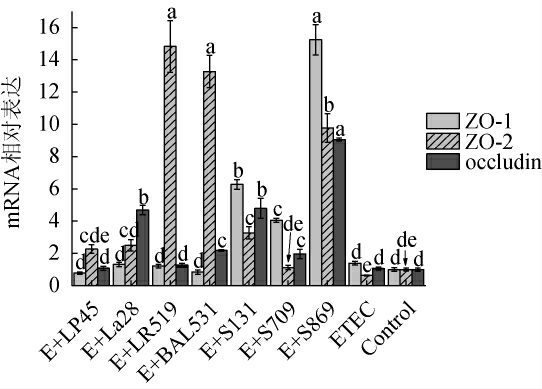
图5 不同种属乳酸菌对HT-29细胞紧密连接蛋白表达的影响
Fig.5 Effect of different species of lactic acid bacteria on tight junction protein expression in HT-29 cells
2.6 不同种属乳酸菌拮抗ETEC造成的HT-29细胞损伤
肠上皮细胞是肠道机械屏障的另一组成部分,其完整性对肠道吸收营养物质、阻挡致病菌和内毒素的入侵至关重要[37]。由图6可知,ETEC组HT-29细胞增殖率降低(2.06±0.08)%(P<0.05)。除菌株S869外,各乳酸菌的干预可改善ETEC造成的肠上皮细胞损伤,其中嗜热链球菌S131能够使HT-29细胞的相对增殖率显著提高至(21.07±1.21)%(P<0.05),结果表明,上述乳酸菌能够清除ETEC产生的毒素类物质,产生有益于肠上皮细胞生长的物质,从而拮抗ETEC对肠上皮细胞的损伤。该结果与VON MENTAER A等[38-39]研究发现,ETEC通过破坏细胞骨架、引起炎症反应等机制对宿主肠道上皮细胞造成损伤结论一致。
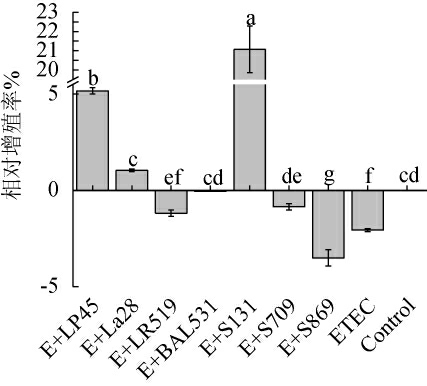
图6 不同种属乳酸菌拮抗产肠毒素大肠杆菌造成的HT-29细胞损伤
Fig.6 Different species of lactic acid bacteria antagonized the damage of HT-29 cells caused by enterotoxigenic Escherichia coli
3 结论
植物乳杆菌LP45、嗜酸乳杆菌La28、鼠李糖乳杆菌LR519、乳双歧杆菌BAL531、嗜热链球菌S131、S709可以通过抑制致泻性大肠杆菌ETEC,拮抗ETEC感染造成的AQP-3表达下调、炎症因子分泌增加及上皮细胞凋亡,提高肠道吸水能力、增强肠道免疫,从而改善腹泻症状,缓解水样便或脓血便。此外,上述乳酸菌均在不同程度上缓解ETEC感染造成的肠道黏膜屏障与紧密连接损伤,增强肠道机械屏障,从而维持基本肠道健康。综合来说,菌株LP45、La28、LR519、BAL531、S131、S709及S869能够通过抑制肠道致病菌,恢复肠道通透性及正常肠道屏障生理功能,降低肠道炎症等机制缓解TD腹泻症状,但不同乳酸菌在各机制下的作用效果存在一定差异。
[1]LEVI M E,FNP,WHNP,et al.Identification and management of Traveler's Diarrhea[J].J Midwifery Wom Heal,2021,66(3):380-384.
[2]WANG L P,ZHOU S X,WANG X,et al.Etiological,epidemiological,and clinical features of acute diarrhea in China[J].Nat Commun,2021,12:2464.
[3]ADLER A V,CICCOTTI H R,TRIVITT S J H,et al.What's new in travellers' diarrhoea: updates on epidemiology, diagnostics, treatment and long-term consequences[J].J Travel Med,2022,29(1):taab099.
[4]赵玥明,侯艳梅,赵怡晴.鼠李糖乳杆菌MP108缓解细菌性腹泻的作用研究[J].食品工业科技,2022,43(21):20-27.
[5]李保良,庞胜美,吕林芬,等.产肠毒素大肠杆菌诱导肠上皮细胞凋亡的研究进展[J].微生物学报,2023,63(6):2340-2349.
[6]张彦位,路江浩,鄢梦洁,等.益生菌对微生态系统的改善作用及其应用研究进展[J].食品工业科技,2021,42(4):369-379.
[7]VAN DER HEE B,WELLS J M.Microbial regulation of host physiology by short-chain fatty acids[J].Trend Microbiol,2021,29(8):700-712.
[8]胡明珍.副干酪乳杆菌NXU--19004发酵枸杞汁的条件优化及其对小鼠便秘的改善作用研究[D].银川:宁夏大学,2021.
[9] LEW L C, LIONG M T.Bioactives from probiotics for dermal health:functions and benefits[J].J Appl Microbiol,2013,114(5):1241-1253.
[10]臧凯丽,江岩,孙勇,等.益生菌剂调整肠道疾病人群菌群结构丰度水平的研究[J].食品科学,2018,39(13):133-143.
[11]ŁUKASIK J,DIERIKX T,BESSELING-VAN VAN DER VAART I,et al.Multispecies probiotic for the prevention of antibiotic-associated diarrhea in children:a randomized clinical trial[J].JAMA Pediatr,2022,176(9):860-866.
[12]CASTRO-MEJIA J L,O'FERRALL S,KRYCH L,et al.Restitution of gut microbiota in Ugandan children administered with probiotics (Lactobacillus rhamnosus GG and Bifidobacterium animalis subsp.lactis BB-12)during treatment for severe acute malnutrition[J].Gut microbes,2020,11(4):855-867.
[13] OKSANEN P, SALMINEN S, SAXELIN M.Prevention of traveller's diarrhoea by Lactobacillus GG[J].Annals of Medicine, 1990, 22(1):53-66.
[14]SALMINEN S,DEIGHTON M.Lactic acid bacteria in the gut in normal and disorders states[J].Digest Dis Sci,1992,10(4):227-238.
[15]陈军奎,刘伟,王欣,等.成年人不同阶段肠道菌群及其代谢差异的研究[J].胃肠病学和肝病学杂志,2019,28(3):276-281.
[16]张秀红,刘婷婷.具广谱抑菌活性乳酸菌的筛选[J].乳业科学与技术,2010,33(2):56-59.
[17]张秋月,王刚,陈坤朋,等.嗜酸乳杆菌在初始弱酸碱条件下对HT-29细胞免疫因子的调节作用[J].食品科学,2020,41(19):197-197.
[18]李海新,寇秀颖,谢新强,等.高抗菌活性乳酸菌拮抗食源性致病菌的研究进展[J].微生物学报,2022,62(10):3732-3740.
[19]康慎敏,武瑞赟,穆文强,等.乳酸菌拮抗食源性致病菌的研究及应用进展[J].食品科学,2022,43(1):250-259.
[20]XU C L,YAN S Q,GUO Y,et al.Lactobacillus casei ATCC 393 alleviates enterotoxigenic Escherichia coli K88-induced intestinal barrier dysfunction via TLRs/mast cells pathway[J].Life Sci,2020,244:117281.
[21]DE LA FUENTE-NUNEZ C,MENEGUETTI B T,FRANCO O L,et al.Neuromicrobiology: How microbes influence the brain[J].ACS Chem Neurosci,2018,9(2):141-150.
[22]YANG J,QIU Y,HU S,et al.Lactobacillus plantarum inhibited the inflammatory response induced by enterotoxigenic Escherichia coli K88 via modulating MAPK and NF-κB signalling in intestinal porcine epithelial cells[J].J Appl Microbiol,2021,130(5):1684-1694.
[23]GAO J C,CAO S T,XIAO H,et al.Lactobacillus reuteri 1 enhances intestinal epithelial barrier function and alleviates the inflammatory response induced by enterotoxigenic Escherichia coli K88 via suppressing the MLCK signaling pathway in IPEC-J2 cells[J].Front Immunol,2022,13:897395.
[24] LEE J S, AWJI E G, LEE S J, et al.Effect of Lactobacillus plantarum CJLP243 on the growth performance and cytokine response of weaning pigs challenged with enterotoxigenic Escherichia coli[J].J Animal Sci,2012,90(11):3709-3717.
[25]YUE Y,HE Z J,ZHOU Y H,et al.Lactobacillus plantarum relieves diarrhea caused by enterotoxin-producing Escherichia coli through inflammation modulation and gut microbiota regulation[J].Food Funct,2020,11:10362-10374.
[26]STEPHEN J.Pathogenesis of infectious diarrhea[J].Can J Gastroenterol,2001,15(10):669-683.
[27]吴狄.厦大新生旅行者腹泻流行病学及三仁汤干预机理研究[D].厦门:厦门大学,2018.
[28] ZHOU Z Y, ZHAN J S, CAI Q Y, et al.The water transport system in astrocytes-aquaporins[J].Cells,2022,11(16):2564.
[29]YE Y W,RAN J H,YANG B X,et al.Aquaporins in digestive system[J].Adv Exp Medi Biol,2023,1398:145-154.
[30]IKARASHI N,KON R,IIZASA T,et al.Inhibition of aquaporin-3 water channel in the colon induces diarrhea[J].Biol Pharm Bull,2012,35(6):957-962.
[31]WU T,SHI Y T,ZHANG Y Y,et al.Beneficial effects of Lactobacillus zeae on the gut health of piglets challenged with Enterotoxigenic Escherichia coli[J].Res Square,2020:1-12.
[32]GUSTAFSSON J K,JOHANSSON M E V.The role of goblet cells and mucus in intestinal homeostasis[J].Nat Rev Gastroenterol Hepatol,2022,19:785-803.
[33]吴姚平.肠道微生物对肠道屏障影响的初步探究[D].南昌:南昌大学,2017.
[34]DÍAZ-CORÁNGUEZ M,LIU X,ANTONETTI D A.Tight junctions in cell proliferation[J].Int J Mol Sci,2019,20(23):5972.
[35]朱翠,师子彪,蒋宗勇,等.乳酸杆菌在调节肠道屏障功能中的作用[J].中国畜牧兽医,2012,39(9):118-122.
[36]PENG L Y,LI Z R,GREEN R S,et al.Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers[J].J Nutr,2009,139(9):1619-1625.
[37]ANGULO-URARTE A,VAN D W T,HUVENEERS S.Cell-cell junctions as sensors and transducers of mechanical forces[J].Biochim Biophys Acta Biomembr,2020,1862(9):183316.
[38]VON MENTAER A,CONNOR T R,WIELER L H,et al.Identification of enterotoxigenic Escherichia coli(ETEC)clades with long-term global distribution[J].Nat Genet,2014,46(12):1321-1326.
[39]ISIDEAN S D,RIDDLE M S,SAVARINO S J,et al.A systematic review of ETEC epidemiology focusing on colonization factor and toxin expression[J].Vaccine,2011,29(37):6167-6178.