羊肚菌(Morchella sextelata)隶属于子囊菌亚门(Ascomycota)、盘菌纲(Discomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae)、羊肚菌属(Morchella)[1-3],是世界四大珍贵食用菌之一。羊肚菌富含氨基酸、多糖、矿质元素等多种营养成分,而且具有增强免疫力、抗菌、抗肿瘤、保护心血管等功效[4-5]。目前我国羊肚菌栽培面积已超过8 000 hm2且仍在不断增加,然而每年仍有50%~70%的种植者无法稳定盈利、重返贫困或负债[6-7]。其中,羊肚菌菌种易老化退化(如交配型丢失、线粒体功能衰退等)、产量不稳定等成为制约我国羊肚菌产业健康稳定发展的关键因素[8-10]。
羊肚菌菌丝细胞是一种异宗结合的多核菌丝体,每个细胞含有15~42个细胞核,每个细胞核含有一种交配型,其子囊孢子也为多核,每个孢子含有18~32个细胞核[11-13],这些情况十分不利于羊肚菌遗传育种工作的开展。原生质体单核化技术在大球盖菇(Stropharia rugoso-annulata)[14]、香菇(Lentinus edodes)[15-17]、斑玉蕈(Hypsizygus marmoreus)[18]、真姬菇[19]、阿魏菇[20]、平菇[21]、灵芝[22]、玉木耳[23]等担子菌的单交配型菌株的分离和遗传育种研究中得到广泛应用并取得良好效果;而子囊菌类食药用菌的原生质体单核化菌株的分离和杂交育种研究报道较少,如蛹虫草(Cordyceps militaris)[24]、梯棱羊肚菌(Morchella importuna)[25-26]等;LIU W等[25]利用原生质体单细胞技术分离到梯棱羊肚菌的单交配型同核体,贺国强[26]利用梯棱羊肚菌的单交配型子囊孢子进行杂交试验成功得到杂交菌株,目前还没有看到利用原生质体单核化再生菌株进行六妹羊肚菌杂交育种的研究报道。
本研究在对六妹羊肚菌(Morchella sextelata)原生质体单核化再生菌株的分离、交配型鉴定的基础上,对单交配型再生菌株进行对峙培养杂交实验制备杂交菌株,以菌株生长势、抗鞣酸能力和菌核产生能力为技术指标,对单核化再生菌株及杂交菌株的多态性进行分析,并对杂交菌株的交配型进行检测,以期探索六妹羊肚菌原生质体再生菌株杂交的科学性和可行性,为六妹羊肚菌的杂交育种工作提供新技术路线。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与引物
70株单交配型六妹羊肚菌:河南省科学院生物研究所有限责任公司微生物工程重点实验室通过原生质体单核化技术分离保存的单交配型菌株[27],其中部分菌株为紫外线(ultraviolet,UV)(编号带“UV”的菌株)或亚硝基胍(nitrosoguanidine,NTG)(编号带“5G”的菌株)诱变和原生质体单核化分离获得的。交配型基因的上游引物(P6-1F、P8-4F)及下游引物(P6-1R、P8-4R)参照贺国强[26]的序列:由华大基因公司提供合成服务。其中引物对(P6-1F/P6-1R)用于检测交配型MAT1-2-1基因,引物对(P8-4F/P8-4R)扩增交配型MAT1-1-1基因。
1.1.2 试剂
葡萄糖、硝酸钠、胰蛋白胨、酵母提取物(粉)、琼脂糖、鞣酸、乙醇、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、乙酸锂(均为分析纯或生化试剂):天津市致远化学试剂有限公司;电泳缓冲液、GenSTAR Stain RED核酸染料:北京康润诚业生物科技有限公司;2×ES Taq Master Mix试剂盒:北京天根生化科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:上海莱枫生物科技有限公司。
1.1.3 培养基
完全酵母提取物培养基(complete yeast extract medium,CYM):葡萄糖2%、蛋白胨0.2%、酵母粉0.1%、硫酸镁0.05%、磷酸二氢钾0.046%、磷酸氢二钾0.1%、琼脂1.5%,蒸馏水配制,pH值自然。
土豆汁葡萄糖琼脂(potato juice dextrose agar,PDA)培养基:将200 g土豆切片并煮沸10 min,3~4层纱布过滤;取滤液加入葡萄糖2%,琼脂1.5%,蒸馏水定容至1 L,pH值自然。
PDA(鞣酸)培养基:在PDA培养基的基础上,添加4 mmol/L鞣酸。
基本培养基(minimal medium,MM):葡萄糖2%、硝酸钠0.4%、磷酸二氢钾0.1%、七水硫酸镁0.05%、氯化钾0.05%、碳酸钙0.01%、硫酸亚铁0.001%、硫酸锌0.001%、硫酸铜0.001%、琼脂1.5%,蒸馏水配制,pH值自然。
上述四种培养基均采用121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-2D型双人净化工作台:上海沪净净化设备有限公司;TCYQ型全温摇瓶柜:太仓市豪诚公司;DDY-6C型电泳仪:北京市六一仪器厂;ChemiDocTMXRS+化学发光凝胶成像系统:美国BIO-RAD公司;MIKRO 22R离心机:德国Hettich公司;Tpersonal聚合酶链式反应(polymerase chain reaction,PCR)仪:法国Biometra公司。
1.3 方法
1.3.1 原生质体单交配型再生菌株的多态性分析
选取实验室保藏的35株六妹羊肚菌MAT1-1-1交配型原生质体再生菌株和35株六妹羊肚菌MAT1-2-1交配型原生质体再生菌株进行生长势、抗鞣酸能力及菌核产生能力测定,目的是为后续杂交实验提供菌株材料和分析数据。
1.3.2 原生质体单交配型再生菌株的对峙培养杂交
对六妹羊肚菌原生质体单交配型再生菌株进行对峙培养杂交,参照贺国强[26]的方法并有所修改:将单交配型斜面菌株转接至PDA平板上23 ℃培养3~4 d后,用直径10 mm无菌打孔器转接1块圆形菌丝块至新PDA平板上进行对峙培养,菌丝块之间距离约2.5 cm,23 ℃培养3~4 d;然后挑取两个菌丝块中间的菌丝(约2~3 mm2)至MM平板上培养3~4 d;再挑取菌落尖端幼嫩菌丝至新MM上,连续挑取3次;将第3次的菌落尖端菌丝转接至CYM斜面上,23 ℃培养13~15 d,低温保藏。
1.3.3 原生质体杂交菌株的多态性分析
对杂交菌株进行多态性分析,对其生长势、抗鞣酸能力及菌核产生能力进行测定。
(1)生长势的测定
将实验菌株转接至PDA平板上,23 ℃培养3~4 d;然后用直径10 mm打孔器移取一块圆形菌丝块至PDA(鞣酸)培养基平板上,每个平板等距离放置三个菌丝块,23~24 ℃培养15~16 d。采用精度1 mm的钢尺测量每株菌的菌丝带宽度(mm)。菌丝带宽度(mm)=(菌落直径-10)/2。
(2)抗鞣酸能力的测定
抗鞣酸能力一定程度上反映菌株的漆酶活性[28]。本实验用褐变圈直径反映菌株的抗鞣酸能力;用精度1 mm的钢尺测量每株菌的褐变圈直径(mm)。
(3)菌核产生能力的测定
菌核产生与否是羊肚菌菌丝生长阶段的一个重要指标,本实验观察并比较了每株菌在CYM斜面上的菌核数量,共分为五个级别,由少到多依次为:“0”表示看不见菌核,“+”表示可见少量菌核,“++”表示菌核数量一般,“+++”表示菌核较多,“++++”表示菌核很多或只有菌核。
1.3.4 杂交菌株生长类型的测定
根据菌株在CYM斜面上的菌丝生长和菌核产生情况,将杂交菌株大致划分为菌核型(sclerotia,S)、菌丝型(hyphae,H)和混合型(mixture of sclerotia and hyphae,M)三种生长类型:“菌核型(S)”表示斜面上有大量菌核产生或全部长满菌核的类型;“菌丝型(H)”表示斜面上看不见菌核或只有少量菌核的情况;“混合型(M)”则表示斜面上菌丝和菌核均有生长、可见的中间类型。
1.3.5 杂交菌株的交配型测定
按照刘彬等[27]的方法测定杂交菌株的交配型,并根据检测结果区分真杂交菌株或假杂交菌株。交配型电泳结果:“+”表示扩增出条带,“-”表示没有扩增出条带。
2 结果与分析
2.1 原生质体单交配型再生菌株的多态性分析结果
35株六妹羊肚菌MAT1-1-1交配型原生质体再生菌株和35株MAT1-2-1交配型原生质体再生菌株在PDA(鞣酸)平板上的多态性进行分析,结果见表1。
表1 六妹羊肚菌原生质体单交配型再生菌株的多态性分析结果
Table 1 Polymorphism analysis results of Morchella sextelata protoplast single mating type regeneration strains

注:菌株编号中加粗的菌株是后续杂交实验采用的菌株。
交配型MAT1-1-1菌株菌株编号 褐变圈直径/mm 菌丝带宽度/mm 6M2P-22 6M2P-19 6M2P-18 6M2P-5 6M2P-30 6M2P-33 6M2P-29 6M2P-21 6M2P-23 6M2P-32 6M2P-2 6M2P-9 6M2P-17 6M2P-15 6M2P-31 6M24-5G-7(1)6M24-5G-1 6M24-5G-14 6M24-5G-16 UV111 UV5 2UV168 UV104 UV21 UV106 UV114 UV23 UV105 UV157 UV17 UV161 UV151 UV18 UV159 UV112平均值22 28 28 30 29 24 32 31 18 28 27 27 26 30 30 30 28 29 28 35 28 32 26 27 25 26 24 33 31 29 28 24 34 26 25 27.94 545524662367366556363618855836421 062 4.91菌核数量+00+0++(分散)0+00++0+0++++(分散)+++00++++++++++(分散)0++++++++(分散)++(块状)+交配型MAT1-2-1菌株菌株编号 褐变圈直径/mm 菌丝带宽度/mm 菌核数量6M2P-11 6M2P-16 6M2P-13 6M2P-25 6M24-5G-6(2)6M24-5G-15 6M24-5G-4 6M24-5G-6(1)6M24-5G-13 3PK67 3PK64 3PK66 3PK61 3PK62 3PK63 3PK72 3PK71 3PK70 UV19 UV24 UV32 UV102 UV66 UV101 UV8 UV52 UV6 UV31 UV7 UV7-sector UV25 2UV123 2UV129 2UV158 2UV121平均值32 31 27 20 24 30 11 34 23 25 29 29 26 25 23 25 30 26 25 32 11 22 16 35 12 33 25 38 25 17 22 32 28 32 22 25.63 54243608244333123334050511++++0++0+00000++00000+00+++0433126481++++++++++++++++++0++3.43
由表1可知,褐变圈直径与菌丝带宽度二者之间呈正相关,褐变圈直径越大、菌丝带宽度也较大;单交配型交配型菌株MAT1-1-1、交配型菌株MAT1-2-1的菌丝带宽度均为0~10 mm,表明其生长势相近;菌株MAT1-1-1的褐变圈直径为18~34 mm,菌株MAT1-2-1的褐变圈直径为11~38 mm,而且单交配型菌株中褐变圈直径≥32 mm的菌株有12株(占比17.14%),表明其抗鞣酸能力有明显差异;不同菌株的菌核数量差异较大,产生块状聚合的菌核或分散状态菌核或不产生菌核。结果表明,六妹羊肚菌不同原生质体再生菌株的生长势、抗鞣酸能力之间有明显差异和多态现象。这种单交配型原生质体再生菌株之间的多态现象与香菇[17]、阿魏菇[20]、平菇[21]、灵芝[22]、玉木耳[23]等的原生质体再生菌株的情况相类似。
在不同单交配型菌株多态性分析的基础上,选取了20株MAT1-1-1单交配型原生质体再生菌株(褐变圈直径25~34 mm、菌丝带宽度2~10 mm、无菌核或产生菌核)和17株MAT1-2-1单交配型原生质体再生菌株(褐变圈直径23~34 mm、菌丝带宽度1~10 mm、无菌核或产生菌核)等表现较好的单交配型原生质体再生菌株(表1中加粗的菌株)进行杂交实验。
2.2 杂交菌株的多态性分析结果
杂交菌株的多态性分析结果见表2。
表2 六妹羊肚菌原生质体单核化再生菌株的杂交结果
Table 2 Hybridization results of Morchella sextelata protoplast monokaryotic regeneration strains
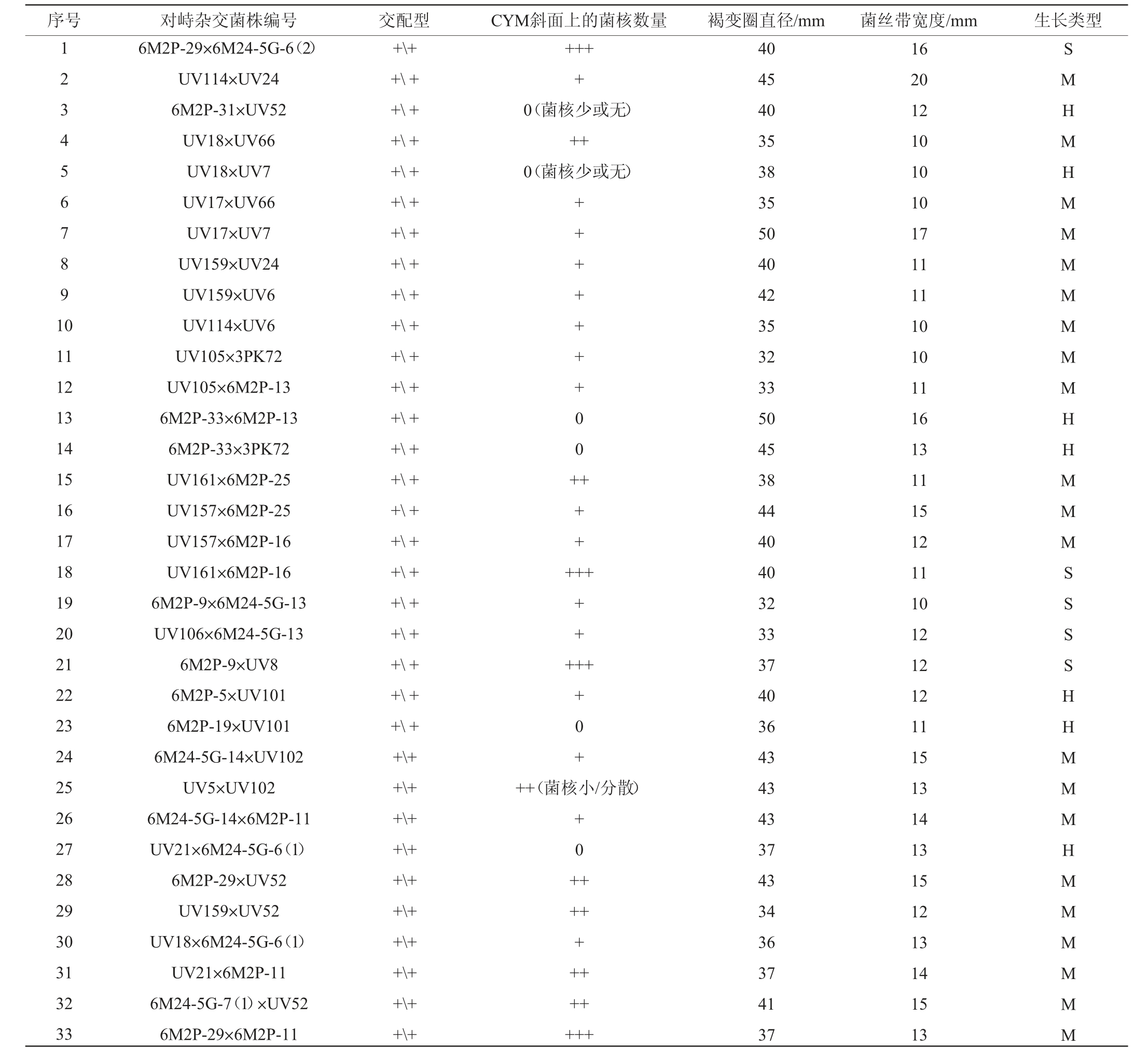
序号 对峙杂交菌株编号 交配型 CYM斜面上的菌核数量 褐变圈直径/mm 菌丝带宽度/mm 生长类型1 2 3 4 5 6 7 8 9 1 0++++0(菌核少或无)++0(菌核少或无)11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 6M2P-29×6M24-5G-6(2)UV114×UV24 6M2P-31×UV52 UV18×UV66 UV18×UV7 UV17×UV66 UV17×UV7 UV159×UV24 UV159×UV6 UV114×UV6 UV105×3PK72 UV105×6M2P-13 6M2P-33×6M2P-13 6M2P-33×3PK72 UV161×6M2P-25 UV157×6M2P-25 UV157×6M2P-16 UV161×6M2P-16 6M2P-9×6M24-5G-13 UV106×6M24-5G-13 6M2P-9×UV8 6M2P-5×UV101 6M2P-19×UV101 6M24-5G-14×UV102 UV5×UV102 6M24-5G-14×6M2P-11 UV21×6M24-5G-6(1)6M2P-29×UV52 UV159×UV52 UV18×6M24-5G-6(1)UV21×6M2P-11 6M24-5G-7(1)×UV52 6M2P-29×6M2P-11+\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++\++++++++00+++++++++++++0+++(菌核小/分散)+0++++++++++++40 45 40 35 38 35 50 40 42 35 32 33 50 45 38 44 40 40 32 33 37 40 36 43 43 43 37 43 34 36 37 41 37 16 20 12 10 10 10 17 11 11 10 10 11 16 13 11 15 12 11 10 12 12 12 11 15 13 14 13 15 12 13 14 15 13 SMHMHMMMMMMMHHMMMSSSSHHMMMHMMMMMM
续表

序号 对峙杂交菌株编号 交配型 CYM斜面上的菌核数量 褐变圈直径/mm 菌丝带宽度/mm 生长类型34 35 36 37 38 39 40 UV18×6M2P-11 6M2P-29×6M24-5G-6(1)UV21×UV52 UV159×6M2P-11 6M24-5G-7(1)×UV102 UV105×UV52 6M24-5G-7(1)×6M2P-11平均值+\++\++\++\++\++\++\++++0++++++++++40 32 39 36 38 39 37 38.88 15 11 14 13 14 12 13 12.8 MHMMMSS
由表2可知,实验通过对杂交菌株的菌落尖端菌丝的3次连续转接和菌株交配型测定,从63株“杂交”菌株中得到了40株具有双交配型的杂交菌株,剔除了23株假杂交菌株(单交配型,数据略);杂交成功率达63.5%。贺国强[26]通过对梯棱羊肚菌不同交配型的子囊孢子进行对峙培养杂交,获得1株杂交菌株;贺新生等[29]研究指出,羊肚菌同一单孢菌株的菌丝是自体融合的,子囊孢子的单孢菌株中存在交配型分离、假同宗结合“异核体”和大量营养体不亲和的现象。本研究使用六妹羊肚菌同一母本(双交配型)的原生质体单核化再生菌株进行多态性分析的过程中,虽然发现少数原生质体再生菌株之间存在不亲和拮抗现象,但大多数再生菌株之间是亲和的;而且通过对峙培养杂交和尖端菌丝的连续转接,获得了高比例的杂交菌株。后续拟采取更精准的方法如核荧光标记[34]等技术对这些杂交菌株作进一步鉴别。
由表2亦可知,杂交菌株在PDA(鞣酸)平板上的生长势、抗鞣酸能力以及在CYM斜面上菌核数量方面存在明显差异,杂交菌株的菌丝带宽度均≥10 mm,褐变圈直径为32~54mm,而单交配型亲本菌株的菌丝带宽度均≤10mm,因此杂交菌株在生长势、抗逆能力等方面均显著优于单交配型亲本菌株,异核体杂交优势明显。原因可能是由于羊肚菌菌丝生长迅速,菌株生长速度可达8.0~19.5 mm/d[27],但在常规培养条件下不易发现单交配型和双交配型杂交菌株之间的差异性,而本实验通过在培养基中添加鞣酸大幅度降低了六妹羊肚菌菌丝的生长势(菌株生长速度均≤2.0 mm/d)、增加了菌丝致密度,加上菌丝块间的营养竞争,使得单交配型菌株和双交配型杂交菌株之间的差异性和杂交优势表现得更充分、更明显和易于观察到。
杂交菌株的产菌核能力有明显差异,杂交菌株、单交配型亲本菌株都能产菌核或不产菌核,产菌核能力与菌株交配型没有相关性,该结果与蒋林林等[31]在减数分裂后代中发现的情况和看法相一致;根据40株六妹羊肚菌杂交菌株在斜面培养基上的菌丝和菌核的丰度差异,可以将其分为菌核型、菌丝型和混合型三种生长类型。
2.3 杂交菌株的交配型测定结果
由以上结果可知,从63株“杂交”菌株中得到了40株具有双交配型的杂交菌株及23个单交配型杂交菌株,部分杂交菌株的交配型电泳结果见图1。由图1可知,UV101×UV57杂交菌株只有一条扩增带,因此进行剔除(数据略),其他杂交菌株有两条扩增带,为真杂交菌株,由此可知,六妹羊肚菌原生质体单核化再生菌株的杂交成功率较高。实验发现,直接挑取PDA(鞣酸)平板上的菌丝体进行交配型检测,无法得到交配型基因的扩增条带;而将该菌丝体进一步转接到不含鞣酸的CYM斜面上培养则又可以重新检测到交配型基因的扩增条带;可见羊肚菌交配型能否检出或缺失问题不仅与羊肚菌组织结构[8]、菌核及继代培养[30-31]、减数分裂及子囊孢子形成[32-33]等生命过程有关,还可能会受到菌丝生理状态或生长抑制物存在与否、细胞核是否降解[34]等因素的影响。
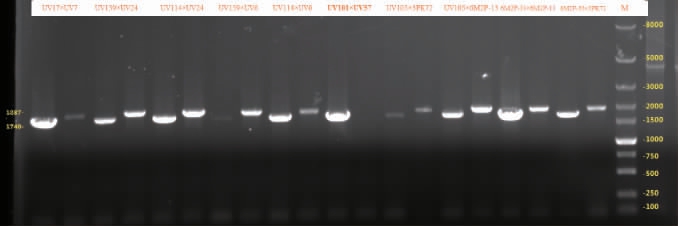
图1 部分杂交菌株的交配型电泳结果
Fig.1 Mating type electrophoresis results of some hybrid strains
图中UV17×UV7、UV159×UV24、UV114×UV24、UV159×UV6、UV114×
UV6、UV101×UV57(单交配型MAT1-2-1,一株被淘汰的假杂交菌株)、UV105×3PK72、UV105×6M2P-13、6M2P-33×6M2P-13、6M2P-33×3PK72
等分别为不同单交配型菌株之间杂交获得的杂交菌株编号;其中同一
菌株左侧的泳道是P6-1F/P6-1R引物对的PCR扩增结果,即交配型
MAT1-2-1基因条带(1 740 bp),右侧的泳道是P8-4F/P8-4R引物对的
PCR扩增结果,即交配型MAT1-1-1基因条带(1 837 bp)。
3 结论
本研究对六妹羊肚菌原生质体单核化再生菌株的多态性进行了分析,对其进行对峙培养杂交实验制备杂交菌株。结果表明,不同原生质体单核化再生菌株的生长势和抗鞣酸能力等存在差异和多态性;从63组对峙培养杂交实验中获得40株杂交菌株(占全部杂交菌株的63.5%),杂交菌株(双交配型)比单交配型亲本菌株具有更强的生长势和抗鞣酸能力;根据六妹羊肚菌在斜面培养基上菌丝和菌核的差异,可以将杂交菌株分为菌核型、菌丝型和混合型三种生长类型。本实验研究为六妹羊肚菌的原生质体单核化菌株多态性分离和杂交育种进行了有益探索。
[1]贺新生.羊肚菌生物学基础、菌种分离制作与高产栽培技术[M].北京:科学出版社,2017:18-34.
[2]朱林,程显好,田吉腾.羊肚菌的研究进展[J].安徽农业科学,2008,36(10):4054-4057.
[3]贺新生,张锐杰,李小勇,等.中国羊肚菌属种类及名称[J].食用菌,2021,43(1):11-14.
[4]孙巧弟,张江萍,谢洋洋,等.羊肚菌营养素、功能成分和保健功能研究进展[J].食品科学,2019,40(5):323-328.
[5] WANG Z, WANG H L, KANG Z L, et al.Antioxidant and anti-tumour activity of triterpenoid compounds isolated from Morchella mycelium[J].Arch Microbiol,2020,202:1677-1685.
[6]DU X H,ZHAO Q,XIA E H,et al.Mixed-reproductive strategies,competitive mating-type distribution and life cycle of fourteen black morel species[J].Sci Rep,2017,7:1493.
[7]赵琪.我国羊肚菌产业发展现状、前景及建议[J].食药用菌,2018,26(3):148-151.
[8]刘伟,蔡英丽,何培新,等.羊肚菌组织分离物交配型基因缺失现象分析[J].食用菌学报,2020,27(3):1-6.
[9]刘璐,邓百万,兰阿峰,等.羊肚菌菌种退化机理研究[J].食品研究与开发,2020,41(10):57-61.
[10]刘伟,何培新,蔡英丽,等.羊肚菌衰老特征的测定分析[J].食药用菌,2021,29(1):44-49.
[11]刘伟,蔡英丽,何培新,等.粗腿羊肚菌子囊孢子萌发过程及其细胞核行为[J].食用菌学报,2017,24(1):18-20.
[12] CHAI H M, CHEN W M, ZHANG X L, et al.Structural variation and phylogenetic analysis of the mating-type locus in the genus Morchella[J].Mycologia,2019,111(4):551-562.
[13]石建森,郭明慧,陈淑霞.尖顶羊肚茵菌丝、分生孢子及原基显微观察与分析[J].山西农业科学,2019,47(4):577-579,601.
[14] YAN P S, JIANG J H, CUI W S, et al.Characterization of protoplasts prepared from the edible fungus,Stropharia rugoso-annulata[J].World J Microb Biot,2004,20:173-177.
[15]孙佳星,杨红,孙晓东,等.基于响应面法对香菇原生质体制备条件的优化[J].菌物学报,2022,41(5):837-846.
[16]刘娜,张敏,宋莹,等.香菇原生质体杂交后代的遗传分析[J].江苏农业科学,2018(17):106-109.
[17]宋莹,刘俊杰,张敏,等.采用原生质体单核体杂交技术创新香菇种质资源[J].北方园艺,2017,19:165-169.
[18]潘越,陈辉,冯志勇,等.斑玉蕈不同交配型的原生质体单核菌株差异分析[J].生物技术通报,2014(9):131-135.
[19]余梅,杜军华,张宝静,等.真姬菇交配型的遗传学鉴定[J].热带作物学报,2021,42(7):1905-1910.
[20]努尔孜亚·亚力买买提,罗影,郝敬喆,等.新疆野生阿魏菇原生质体的再生与单核菌株交配型测定[J].新疆农业科学,2022,59(5):1245-1251.
[21]努尔孜亚·亚力买买提,赵梦然,罗影,等.平菇原生质体单核化菌株的制备及其培养特征分析[J].新疆农业科学,2019,56(4):731-739.
[22]丛倩倩,崔晓,王庆武.灵芝原生质体单核菌株的制备及形态特性比较[J].食用菌,2019,41(2):34-36.
[23]崔玮洁,赵一橦,宋冰,等.玉木耳原生质体制备条件的优化及再生菌株的变异检测[J].新疆农业科学,2019,56(4):731-739.
[24]娄海伟,余颖豪,林俊芳,等.基于蛹虫草单核芽生孢子的原生质体制备条件的优化[J].中国食品学报,2020,20(6):129-136.
[25]LIU W,CHEN L F,CAI Y L,et al.Opposite polarity monospore genome de novo sequencing and comparative analysis reveal the possible heterothallic life cycle of Morchella importuna[J].Int J Mol Sci,2018,19(9):2525.
[26]贺国强.梯棱羊肚菌单孢分离、交配型基因鉴定及其菌丝融合杂交研究[J].中国种业,2021(2):58-62.
[27]刘彬,刁文涛,周伏忠,等.六妹羊肚菌原生质体再生菌株交配型的分离鉴定[J].中国酿造,2023,42(1):121-125.
[28]宋安东,吕洋,尤晓颜,等.几种食用菌产木质素降解酶类研究[J].中国食用菌,2004,24(2):39-41.
[29]贺新生,赵苗,王亚洲,等.羊肚菌菌丝间融合与不融合现象研究[J].食药用菌,2019,27(4):244-252.
[30]刘萍,马渊浩,赵永昌,等.羊肚茵单孢菌株的性亲和与营养体亲和特性[J].食用菌学报,2021,28(1):40-47.
[31]蒋林林,钱宇洪,凌嘉,等.羊肚菌菌核的交配型[J].菌物研究,2021,19(4):255-262.
[32]刘伟,蔡英丽,何培新,等.梯棱羊肚菌单孢及杂交群体的栽培出菇试验和极性分析[J].菌物研究,2019,17(4):43-49.
[33]张娇娇,刘梦潜,杨涛,等.野生和人工栽培蛹虫草的交配型[J].食用菌学报,2021,28(6):38-46.
[34]RUIZ-ROLDÁN M C,KÖHLI M,RONCERO M I G,et al.Nuclear dynamics during germination,conidiation,and hyphal fusion of Fusarium oxysporum[J].Eukaryot Cell,2010,9(8):1216-1224.