酸粥一般以小米、大米或糜米等谷物为原料经自然发酵制成的极具地方特色的谷物发酵制品,口感酸爽细腻,具有开胃助消化的功效,在内蒙古、广西、山西和陕西等地较为常见[1-3]。谷物在发酵过程中会改变自身原有的形态、风味以及营养结构,并产生氨基酸、维生素和有机酸等丰富的营养物质,从而使其更易于消化[4-6]。为保证其品质及食用方便性,多地尝试将其开发成商业化产品,然而,目前酸粥的生产仍主要依赖于家庭作坊式制作[7]。该模式一般采用自然发酵,由于受到地域、气候等的影响,不同地区生产的产品所包含的微生物多样性不同[8];此外,发酵过程使用的容器多不密封且不能人为控制温度,发酵料液内部微生物群亦需较长时间才能达到平衡,增大了有害微生物侵袭的可能性[9]。巴彦淖尔或称“巴盟”,属内蒙古自治区,该地区发酵酸粥所用原料一般为糜米,制作工艺主要为糜米加水蒸煮,在米粒完全煮透前取适量米汤放凉,置于桶内或玻璃罐中,自然发酵24~30 h即可。每次将发酵好的酸粥预留一部分作为下一次发酵的“引子”,因而明确该地区传统发酵食品酸粥样品中微生物资源构成极其重要。
越来越多的学者认识到微生物的多样性与食品中各种风味之间存在着重要联系。自21世纪以来,以Illumina MiSeq为代表的第二代高通量测序技术因其准确率高、通量高和速度快等优点使其在食品微生物多样性研究领域得以广泛应用[10-11]。电子鼻技术是一种用来检测挥发性风味物质的技术手段,具有实时、无损和快速等特点[12]。电子舌技术是一种用来检测滋味的技术手段,具有客观性强、检测响应快和标准化控制等特点[13]。向凡舒等[14]基于该技术解析了利川腌菜细菌群落结构,并采用电子鼻技术研究腌菜的风味品质,结果表明,腌菜特征风味物质的形成可能由变形杆菌属(Proteus)、嗜冷杆菌属(Psychrobacter)和肠球菌属(Enterococcus)等多种微生物共同作用产生;CAI W C等[15]利用高通量测序技术和电子感官技术综合评估了3种低温大曲的微生物结构、微生物功能和风味特征,结果表明,低温大曲中高温放线菌属(Thermoactinomyces)、芽孢杆菌属(Bacillus)、糖多孢菌属(Saccharopolyspora)、链霉菌属(Streptomyces)和乳杆菌属(Lactobacillus)主要影响低温大曲的滋味,而嗜热子囊菌属(Thermoascus)和复膜孢酵母属(Saccharomycopsis)主要影响其风味。张青等[16]利用高通量测序技术研究了巴彦淖尔酸粥细菌构成,发现乳杆菌属(Lactobacillus)和醋杆菌属(Acetobacter)为其优势细菌属,表明该方法应用于酸粥类谷物发酵食品可行且地域因素对同类型发酵食品微生物组成存在一定影响,因此有必要对巴彦淖尔酸粥品质或微生物与产品品质之间的关联性开展深入研究。
本研究使用高通量测序技术对巴彦淖尔酸粥进行细菌群落结构解析,同时结合电子鼻和电子舌仿生学技术对其气味和滋味品质进行分析,并对优势细菌属与风味品质之间的相关性进行研究,为酸粥菌株发掘和品质提升提供理论依据。
1 材料与方法
1.1 材料与试剂
酸粥:于2021年6月中旬采集自内蒙古自治区中西部巴彦淖尔市(E105°12′~109°53′,N40°13′~42°28′),共7份样品,编号为BM1~BM7。
DNeasy mericon Food Kit 脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;引物338F/806R:由武汉天一辉远生物科技有限公司合成;5×TransStartTM FastPfu Buffer、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTPs)Mix和FastPfu Fly DNA聚合酶:北京全式金生物技术有限公司;参比溶液、阴离子溶液、阳离子溶液和内部溶液:日本Insent公司。
1.2 仪器与设备
MiSeq PE300高通量测序平台:美国Illumina公司;Nanodrop2000紫外可见分光光度计:美国Nano Drop公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;UVPCDS8000凝胶成像分析系统:美国ProteinSimple公司;PEN3电子鼻(配置10个金属氧化传感器):德国Airsense公司;SA 402B电子舌:日本Insent公司。
1.3 实验方法
1.3.1 MiSeq高通量测序
将酸粥样品振荡均匀,使用DNeasy mericon Food Kit DNA基因组提取试剂盒从酸粥样品中提取细菌基因组DNA,并采用Nanodrop 2000紫外可见分光光度法测量其浓度和质量,将条带清晰且OD260 nm/OD280 nm值介于1.8~2.0之间的DNA进行细菌16S rRNA V3-V4区的PCR扩增,其中正向引物为338F(5'-ACTCCTACGGGAGCAGCAG-3'),反向引物为806R(5'-GGACTACHVGGGTWTCTAAT-3'),参照WANG Y R等[17]的PCR扩增体系及PCR扩增程序进行扩增,扩增后使用1%的琼脂糖凝胶电泳(120 V,30 min)进行检测,将检测合格的扩增产物寄送至上海美吉生物有限公司使用Illumina MiSeq测序仪完成双末端测序。
1.3.2 生物信息学分析
根据GUO Z等[18]的序列质控条件进行质控以获得高质量序列:根据双端序列的重叠关系首先对下机序列进行合并、去除嵌合体以及采用两步UCLUST法构建操作分类单元(operational taxonomic units,OTU),通过Greengenes v13.5、核糖体数据库项目(ribosomal database project,RDP)v11.5和SILVA v132数据库对每个OTU进行同源性比对注释和微生物多样性解析[19]。
1.3.3 基于电子鼻技术对酸粥样品气味的测定
采用电子鼻对酸粥样品的气味进行测定。将酸粥样品摇匀,吸取15 mL样品于电子鼻样品瓶中,45 ℃水浴保温30 min,于室温静置15 min后进行测试,并重复3次。按照RUSINEK R等[20]的方法,选取49 s、50 s和51 s时的响应值为数据点,并求其平均值为最终结果。其中,电子鼻配置的10个传感器分别为W1C(芳香型化合物)、W5S(氮氧化合物)、W3C(芳香型化合物)、W6S(对氢气有选择性)、W5C(烷烃芳香成分)、W1S(甲烷)、W1W(有机硫化物和萜烯类)、W2S(乙醇)、W2W(有机硫化物)和W3S(烷烃类)。
1.3.4 基于电子舌技术对酸粥样品滋味的测定
采用电子舌对酸粥样品的滋味进行测定。将酸粥样品8 000 r/min 离心15 min后,取上清液于样品瓶中,4 ℃备用。按照GAO B H等[21]的方法对样品中5个基本味(酸、苦、涩、咸、鲜)和3个回味(苦味、涩味和鲜味的回味)进行测定,重复测定4次,选取后3次有效数据并求取平均值作为最终结果。
1.3.5 数据处理
使用Origin 2017软件对酸粥样品中优势细菌门、属以及核心OTU的相对含量和电子鼻、电子舌雷达图进行分析,并对各样品中OTU的出现次数进行水平阶梯图的绘制;使用R软件的“vioplot”安装包对样品中各滋味品质的响应值进行小提琴图绘制;使用Cytoscape软件对酸粥中优势细菌属与各气味、滋味指标之间相关系数绝对值>0.5的相关性进行网络图的绘制。
2 结果与分析
2.1 酸粥样品的细菌菌群结构分析
以细菌16S rRNA V3-V4区为测序靶点,通过Illumina MiSeq高通量测序后7份酸粥样品共产生了265 424条高质量序列,经两步UCLUST分析,共得到1 633个OTU,序列分别隶属于3个门、5个纲、10个目、16个科和24个属。将平均相对含量≥1.00%的细菌门或属归为优势细菌门或属,相对含量<1.00%的细菌门或属归为其他。基于门水平的酸粥样品中细菌菌群组成相对含量见图1。
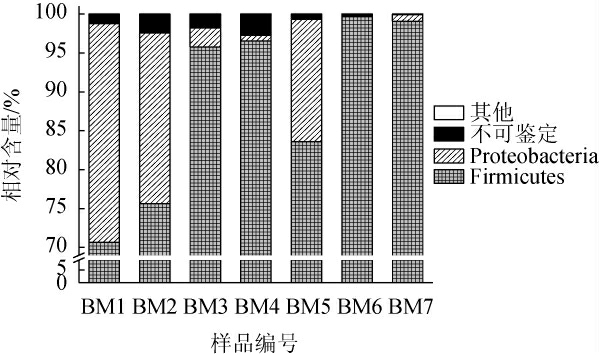
图1 基于门水平的酸粥样品中细菌菌群组成
Fig.1 Bacterial community composition in sour porridge samples based on phylum level
由图1可知,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为酸粥样品中的优势细菌门,其平均相对含量分别为88.71%和9.97%,且各样品中Firmicutes的相对含量均>70.00%,其中,样品BM3、BM4、BM6和BM7中Firmicutes的相对含量较高,分别为95.79%、96.55%、99.65%和99.07%;不同样品中Proteobacteria的相对含量有一定差异,其在样品BM4、BM6和BM7中其相对含量均<1.00%,由此可见,不同样品间细菌门组成存在一定的差异。本研究进一步在属水平上对其细菌菌群组成进行解析,基于属水平的酸粥样品中细菌菌群的相对含量见图2。
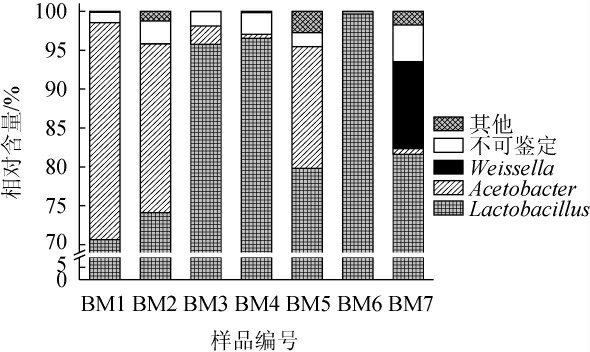
图2 基于属水平的酸粥样品中细菌菌群组成
Fig.2 Bacterial community composition in sour porridge samples based on genus level
由图2可知,乳杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)和魏斯氏菌属(Weissella)为酸粥样品中的优势细菌属,其平均相对含量分别为85.45%、9.81%和1.60%,且所有样品中Acetobacter和Weissella的相对含量均存在明显差异。在样品BM1、BM2和BM5中Acetobacter的相对含量均>15.0%,而在样品BM4、BM6和BM7中相对含量均<1.0%;Weissella仅存在于样品BM7中,其相对含量为11.19%。由此可见,同一地区不同酸粥样品间其细菌属组成亦存在一定的差异。Lactobacillus和Weissella均为乳酸菌属,隶属于厚壁菌门,可在密闭条件下快速生长繁殖,生成大量乳酸,在形成酸性无氧环境后,随着好氧菌的死亡,进一步将碳水化合物转化成乳酸、乙酸和丙酸等,以改善食品的风味并延长其保质期[22];此外,Weissella是兼性厌氧化学螯合菌,在食品发酵过程中,其可以合成酯类、有机酸和短链脂肪酸等风味物质,从而提高发酵食品的产品质量[23]。Acetobacter隶属于Proteobacteria,可将乙醇和乳酸氧化为乙酸和乙酰丁酸[24]。说明酸粥样品中存在绝对优势的产酸菌,该研究结果与张青等[16]所分析基于门、属水平的酸粥样品中细菌菌群的群落组成基本一致。
2.2 基于OTU水平的细菌群落结构分析
本研究在细菌门、属水平解析酸粥样品细菌菌群组成的基础上,进一步分析7份酸粥样品中OTU的出现次数及核心OTU(在所有样品中均存在的OTU)的相对含量,结果见图3。
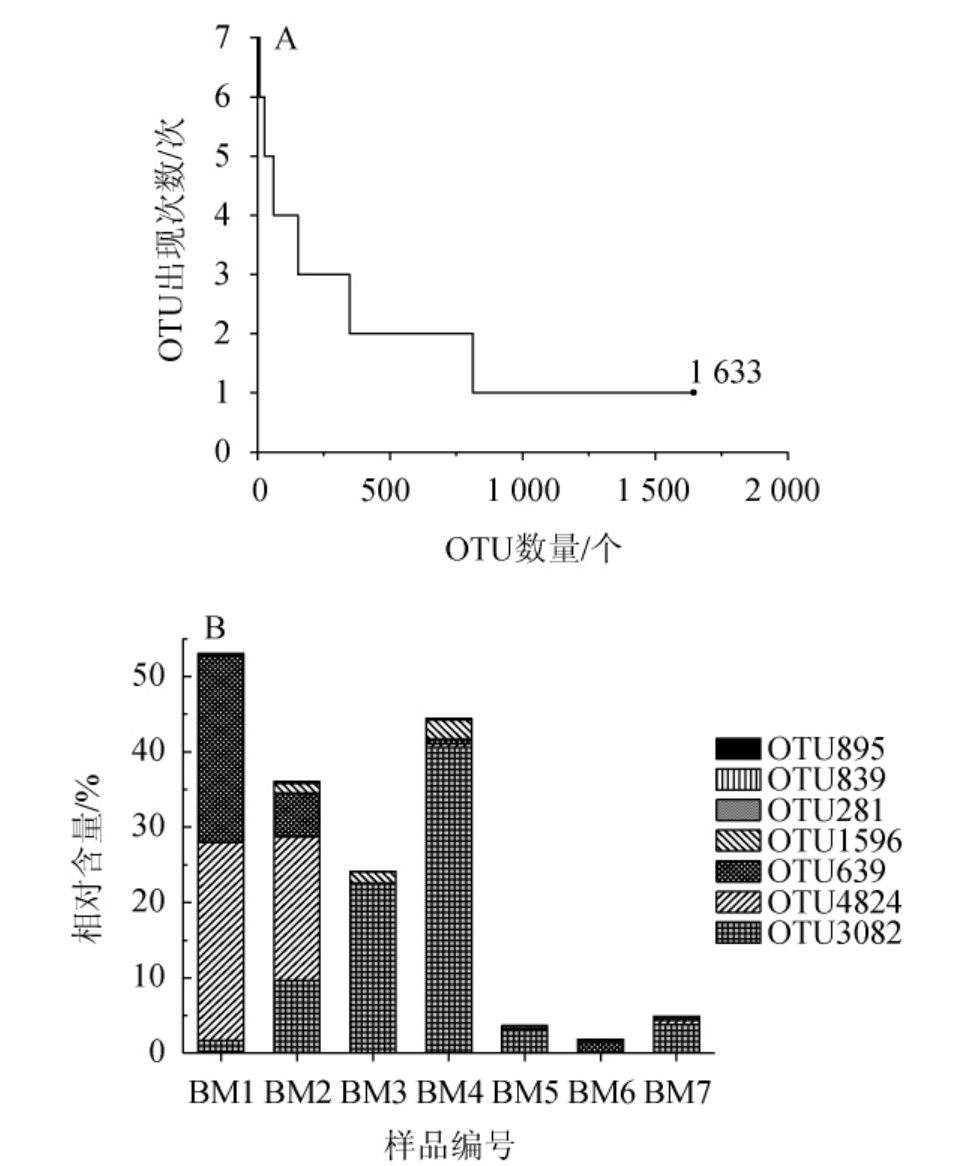
图3 酸粥样品中操作分类单元的出现次数(A)及核心操作分类单元相对含量(B)
Fig.3 Occurrence times of operational taxonomic unit (A) and relative content of core operational taxonomic unit (B) in sour porridge samples
由图3A可知,7份样品中共产生了1 633个OTU,然而核心OTU(OTU3082、OTU4824、OTU639、OTU1596、OTU281、OTU839和OTU895)仅有7个,占OTU总数的0.43%,但其中包含了63 755条高质量序列,占质控后合格序列总数的24.02%;在样品中出现1次的OTU有822个,占OTU总数的50.34%,其中包含13 297 条高质量序列,仅占质控合格序列总数的5.01%。由图3B可知,OTU3082、OTU4824、OTU639、OTU1596、OTU281、OTU839和OTU895平均相对含量分别为11.63%、6.63%、4.78%、0.83%、0.09%、0.04%和0.03%。而平均相对含量>1.0%的核心OTU仅有3个,其中2个核心OTU隶属于Lactobacillus,分别为OTU3082和OTU639;1个核心OTU隶属于Acetobacter,为OTU4824。该结果进一步说明,在巴彦淖尔酸粥样品中,Lactobacillus和Acetobacter为核心细菌属。
2.3 酸粥样品感官特性测定结果
2.3.1 基于电子鼻技术酸粥样品的气味检测结果
本研究进一步采用电子鼻测定酸粥样品气味,电子鼻响应雷达图见图4。
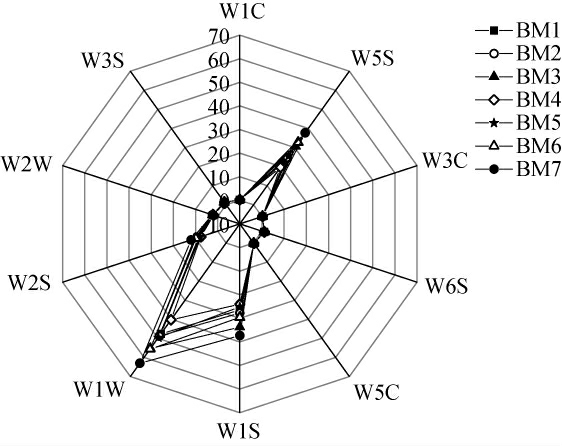
图4 酸粥样品气味电子鼻传感器响应雷达图
Fig.4 Response radar diagram of sour porridge samples ordor by electronic nose sensor
由图4可知,纳入本研究的酸粥样品在不同传感器上的响应强度不同,仅有W1W(有机硫化物和萜烯类)、W5S(氮氧化合物)和W1S(甲烷)这3个传感器对酸粥响应强度较大,均>19,而其他7个传感器对酸粥响应强度较小。其中W1W、W5S和W1S这3个传感器对样品BM7的响应强度均为最大,分别为63.02、37.75和37.31;对样品BM4的相应强度均为最小,分别为40.27、19.63和24.03。为进一步探究各样本间的气味的异同,本研究对各传感器所测数值进行处理,结果见表1。
表1 电子鼻各传感器对酸粥样品气味的响应强度
Table 1 Response intensity of electronic nose sensors to the odor of sour porridge samples
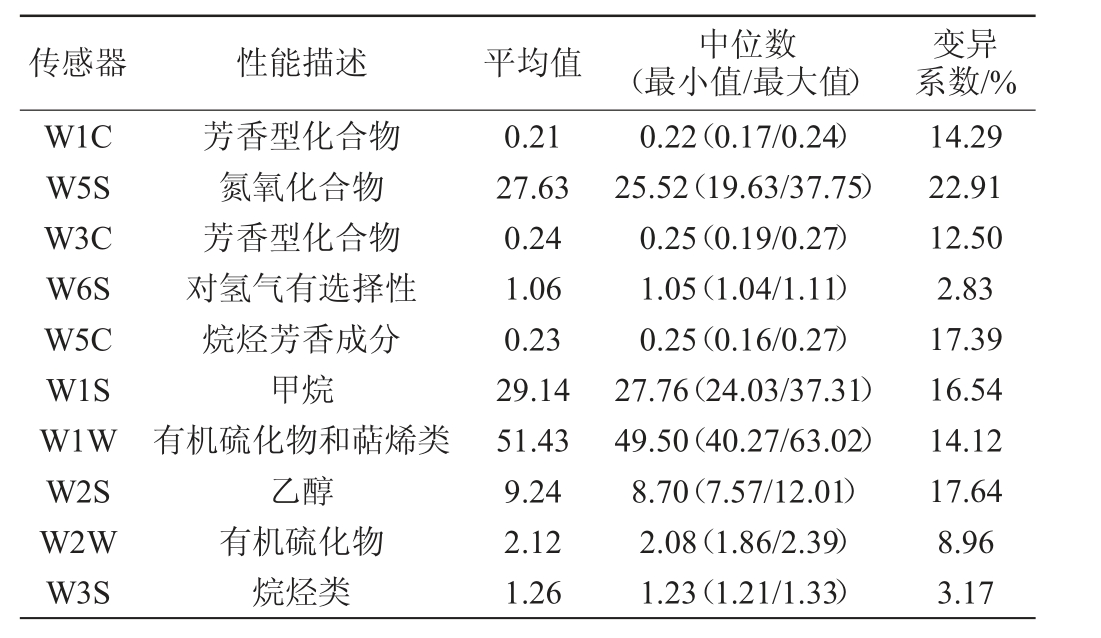
传感器 性能描述 平均值 中位数(最小值/最大值)变异系数/%W1C W5S W3C W6S W5C W1S W1W W2S W2W W3S芳香型化合物氮氧化合物芳香型化合物对氢气有选择性烷烃芳香成分甲烷有机硫化物和萜烯类乙醇有机硫化物烷烃类0.21 27.63 0.24 1.06 0.23 29.14 51.43 9.24 2.12 1.26 0.22(0.17/0.24)25.52(19.63/37.75)0.25(0.19/0.27)1.05(1.04/1.11)0.25(0.16/0.27)27.76(24.03/37.31)49.50(40.27/63.02)8.70(7.57/12.01)2.08(1.86/2.39)1.23(1.21/1.33)14.29 22.91 12.50 2.83 17.39 16.54 14.12 17.64 8.96 3.17
由表1可知,巴彦淖尔酸粥在W1W、W5S和W1S这3个传感器上的平均响应值分别为51.43、27.63和29.14。由此可见,酸粥挥发性风味物质中有机硫化物和萜烯类物质、氮氧化合物和甲烷的含量较为丰富。除W6S和W3S外,其他8个传感器对酸粥样品的响应值差异均较大,变异系数均>8.0%,由此可见,7份酸粥样品在气味方面存在较大差异。
2.3.2 基于电子舌技术对酸粥样品滋味的检测结果
酸粥样品的电子舌检测结果见图5。由图5A可知,酸粥样品在酸味、咸味、鲜味的回味和鲜味指标上的差异较大。其中,样品BM7在酸味指标上的响应值最大,为7.45;样品BM3在酸味指标上的响应值最小,为-22.64,但其在鲜味指标上的响应值最大,为7.38;样品BM4在咸味指标上的响应值最大,为12.21,其在鲜味的回味指标上的响应值亦最大,为9.05。由图5B可知,酸粥在各滋味指标中差异最大的是酸味,极差值为28.37;其次是咸味、鲜味的回味、涩味和鲜味,极差值分别为14.01、10.96、9.18和8.43;而在涩味回味和苦的回味上的差异较小。Lactobacillus和Acetobacter作为酸粥中的优势细菌属,可以产生大量的有机酸来降低pH,从而增加酸度[21,25]。由此可知,酸粥样品中滋味品质的差异主要是由酸味引起的。
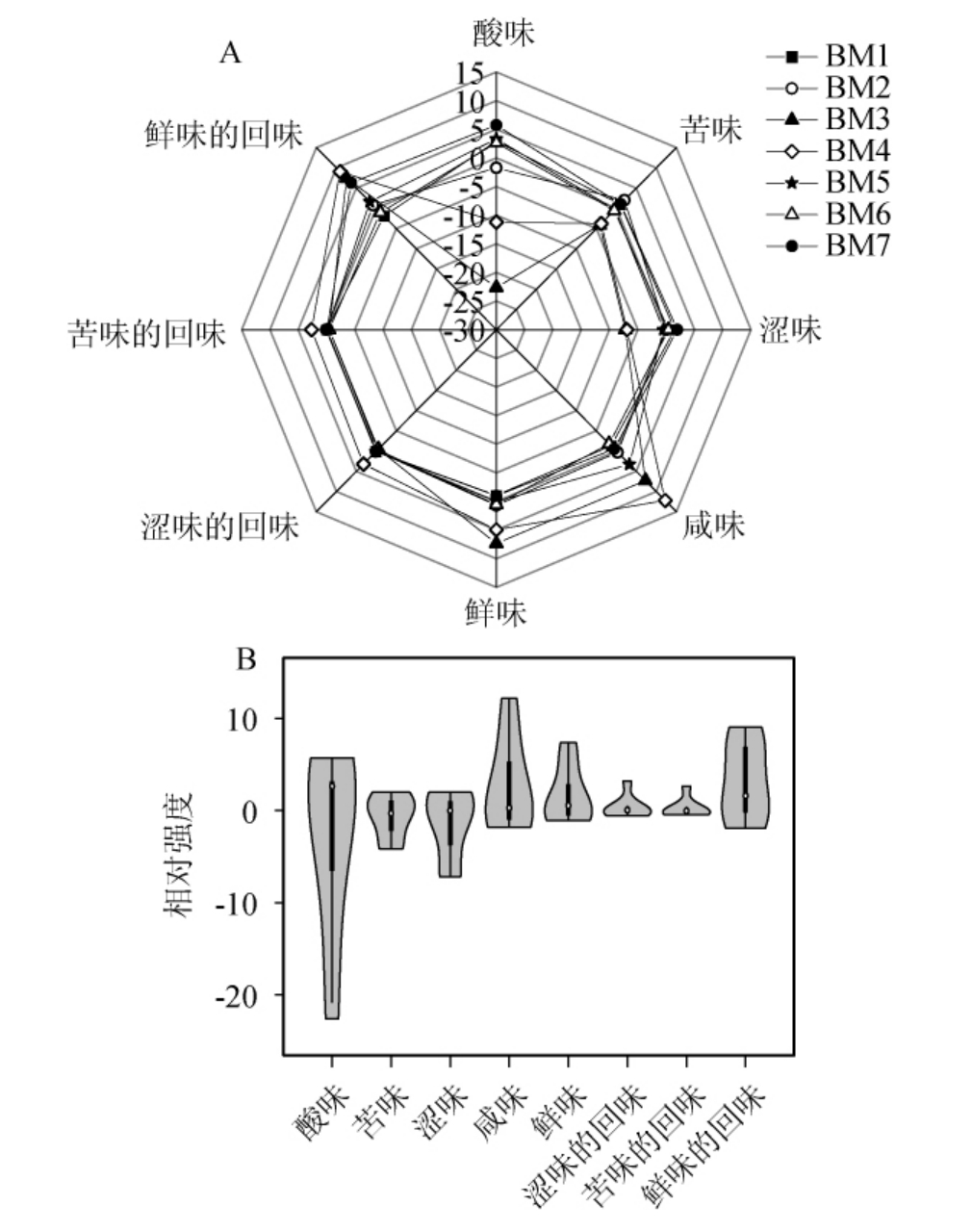
图5 酸粥样品滋味电子舌响应雷达图(A)及小提琴图(B)
Fig.5 Response radar diagram (A) and violin diagram (B) of sour porridge samples taste by electronic tongue
2.4 优势细菌属与风味的相关性分析
酸粥样品风味特征与其发酵菌群息息相关,为探究不同菌群对自然发酵酸粥滋味和气味的影响,本研究对样品中优势细菌属与气味物质、滋味进行相关性分析,其相关性网络图见图6。
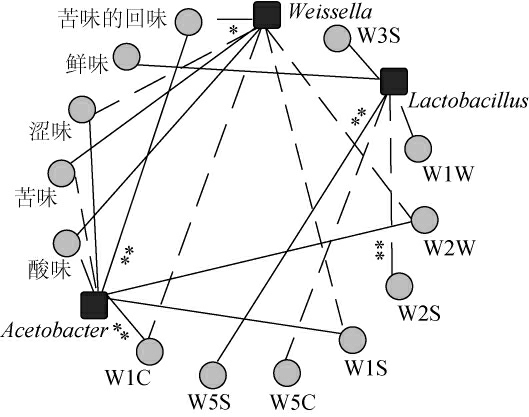
图6 酸粥样品优势细菌属与气味及滋味的相关性
Fig.6 Correlation between dominant bacterial genera and odor and taste of sour porridge samples
实线表示呈正相关,虚线表示呈负相关,线越粗代表相关性越大。“*”表示相关性显著(P<0.05),“**”表示相关性极显著(P<0.01)。
由图6可知,Weissella与酸粥的涩味呈现显著负相关(P<0.05),相关系数R2=0.998;Acetobacter与芳香型化合物的生成呈极显著正相关(P<0.01),相关系数R2=0.999,与苦的回味呈极显著正相关(P<0.01),相关系数R2=0.999;Lactobacillus与氮氧化合物的生成呈现显著正相关(P<0.05),相关系数R2=0.999,与乙醇类物质的生成呈极显著负相关(P<0.01),相关系数R2=0.999。由此可见,Acetobacter和Lactobacillus对于酸粥中芳香类风味物质和氮氧化合物的形成有着积极的作用,Weissella对于酸粥中酸味的形成亦发挥着积极影响。
3 结论
巴彦淖尔自然发酵酸粥样品的细菌菌群组成存在一定差异,优势细菌门为Firmicutes和Proteobacteria,优势细菌属为Lactobacillus、Acetobacter和Weissella,所有样品包含7个核心OTU。就气味和滋味品质而言,其挥发性物质的差异主要集中在氮氧化合物、甲烷和萜类化合物上,而其滋味差异主要体现在酸味方面。经相关性分析得知,Acetobacter和Lactobacillus对酸粥芳香类风味物质和氮氧化合物的产生具有积极作用,Weissella对酸粥酸味的形成亦具有积极影响,在后续发酵酸粥工艺中,可进一步为其滋味品质的提升进行研究,完善酸粥风味和滋味品质的双向促进,优化酸粥的生产工艺条件,提升工业化生产。
[1]折米娜,王玉荣,刘康玲,等.毕赤酵母对酸粥滋味品质形成的评价[J].中国酿造,2018,37(6):85-90.
[2]GUO H X,SUN Z Y,HAO Y,et al.Correlation between bacterial communities and organic acids in the fermentation stage of traditional Chinese acidic gruel[J].Int J Food Prop,2020,23(1):1430-1440.
[3]王玉荣,折米娜,刘康玲,等.内蒙古鄂尔多斯地区酸粥真菌多样性研究[J].中国酿造,2018,37(8):50-55.
[4]秦慧彬,黄志伟,张志强,等.传统食品酸粥的发酵工艺[J].食品与发酵工业,2019,45(17):111-116.
[5]任宇婷,陈春利,朱永亮,等.广西扶绥酸粥中微生物组成及营养成分分析[J].食品与发酵工业,2021,47(20):37-43.
[6]郭昊翔,满都拉,任宇婷,等.传统酸粥发酵过程中营养成分及风味的变化规律[J].食品与发酵工业,2020,46(12):166-172.
[7]WANG C,XU Y H,YU B,et al.Analysis of acidic gruel microbiota and improvement of cooking quality via pure culture fermentation using Lacticaseibacillus paracasei strain SZ02[J].Front Microbiol,2021,12:712189.
[8]LIU Y B,LIN Q,YAN D M,et al.Analysis of microbial diversity in soy sauce fermented grains by Illumina high-throughput sequencing technique[J].IOP Conf Ser: Earth Environ Sci,2020,440(2):022044.
[9]PARK J,SUNG J M,CHOI Y S,et al.Effect of natural fermentation on milled rice grains:Physicochemical and functional properties of rice flour[J].Food Hydrocolloid,2020,108:106005.
[10]NYGAARD A B,TUNSJØ H S,MEISAL R,et al.A preliminary study on the potential of Nanopore MinION and Illumina MiSeq 16S rRNA gene sequencing to characterize building-dust microbiomes[J].Sci Rep,2020,10:3209.
[11] ZHANG Y J, WANG P C, LONG Z F, et al.Research progress of soil microorganism application based on high-throughput sequencing technology[J].IOP Conf Ser: Earth Environ Sci,2021,692(4):042059.
[12]许文娟,赵晗,王洪涛,等.电子鼻在食品安全检测领域的研究进展[J].食品工业,2022,43(2):255-260.
[13]吴钰,饶智,陈彦坤,等.基于仿生技术对不同产地当归阿魏酸含量与滋味的关联性研究[J].中国食物与营养,2022,28(2):37-43.
[14]向凡舒,梅洋,邓长阳,等.利川腌菜细菌菌群多样性及其与风味相关性研究[J].中国酿造,2020,39(1):45-49.
[15] CAI W C,WANG Y R,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[16]张青,郭淑文,苏靖,等.基于高通量测序技术巴彦淖尔市酸粥中细菌多样性分析[J].中国酿造,2020,39(9):101-105.
[17]WANG Y R,SHE M N,LIU K L,et al.Evaluation of the bacterial diversity of inner mongolian acidic gruel using Illumina Miseq and PCR-DGGE[J].Curr Microbiol,2020,77(3):434-442.
[18] GUO Z, WANG Y R, XIANG F S, et al.Bacterial diversity in pickled cowpea (Vigna unguiculata [Linn.] Walp) as determined by Illumina MiSeq sequencing and culture-dependent methods[J].Curr Microbiol,2021,78(4):1286-1297.
[19] WANG Y B, LI F, CHEN J, et al.High-throughput sequencing-based characterization of the predominant microbial community associated with characteristic flavor formation in Jinhua Ham[J].Food Microbiol,2021,94:103643.
[20]RUSINEK R,SIGER A,GAWRYSIAK-WITULSKA M,et al.Application of an electronic nose for determination of pre-pressing treatment of rapeseed based on the analysis of volatile compounds contained in pressed oil[J].Int J Food Sci Technol,2020,55(5):2161-2170.
[21]GAO B H,HU X B,LI R L,et al.Screening of characteristic umami substances in preserved egg yolk based on the electronic tongue and UHPLCMS/MS[J].LWT-Food Sci Technol,2021,152:112396.
[22]YOU S,DU S,GE G,et al.Selection of lactic acid bacteria from native grass silage and its effects as inoculant on silage fermentation[J].Agronomy J,2021,113(4):3169-3177.
[23]LI Q Y,FANG F,DU G C,et al.The application of Weissella strains in fermented food[J].Food Ferment Ind,2017,43(10):241-247.
[24] CHAIRUL, MURIA S R, ROHAYA.The effect of sugar concentration and time for Nypa Sap fermentation into acetic acid using Acetobacter pasteurianus[J].J Physics: Conf Ser,2020,1655(1):012105.
[25]石晖琴,张工,张彦民,等.大红浙醋醋酸菌分离及其产酸关键氨基酸分析[J].中国酿造,2022,41(2):34-39.