颜色是评价葡萄酒品质重要的指标之一,可直接影响消费者的喜好,反映该葡萄酒类型、陈酿时间以及陈酿潜力等信息[1-2]。花色苷是红葡萄酒主要呈色物质,以游离、结合和聚合形态存在于葡萄酒中[3-4]。新鲜葡萄酒的主要呈色物质是游离态花色苷,陈酿葡萄酒的颜色主要由花色苷聚合作用决定[5]。目前葡萄酒中已经检测到花色苷有300多种,这些花色苷在葡萄酒的酿造和陈酿过程中不断变化,葡萄酒的颜色也相应地发生变化,随着游离花色苷减少,结合和聚合花色苷增多,葡萄酒的颜色逐渐由鲜艳的紫红色或宝石红色转变为陈酿酒的砖红色甚至棕褐色[6-8]。
花色苷易受外界环境影响发生降解,使得红葡萄酒色度变浅、颜色稳定性不佳[9]。如何提高红葡萄酒色度和增强葡萄酒的颜色稳定性是葡萄酒行业倍受关注的焦点[10]。辅色素添加是一种绿色自然且安全的葡萄酒增色法,花色苷分子与辅色素通过“π-π”疏水堆叠形成较为稳定的复合体,进而增强葡萄酒色泽、提高颜色稳定性。辅色素包括类黄酮、其他酚类物质、生物碱等[10-11]。研究发现,不同辅色素对葡萄酒的辅色效果不同,黄酮醇的辅色效果最好[8]。唐柯等[5]研究表明,咖啡酸、表焙儿茶素与槲皮素3种不同类型辅色素对葡萄酒颜色稳定性作用效果最好的是槲皮素。SCHWARZ M等[12]研究表明,添加不同辅色素可影响葡萄酒花色苷的辅色作用,其中芦丁或对香豆酸对赤霞珠葡萄酒的辅色效果更明显。因此,在葡萄酒发酵前添加适宜的辅色素,可以有效增强红葡萄酒的颜色稳定性[13]。
桂葡6号葡萄(Vitis sp.)是经驯化筛选的广西本地野生红色酿酒葡萄品种。酿造的葡萄酒呈宝石红色,果香醇正,酒体平衡[14-15]。本团队前期围绕桂葡6号葡萄果实和葡萄酒花色苷组成特征及栽培方式对其影响等开展了大量工作。研究结果表明,桂葡6号葡萄酒的花色苷总量随瓶储期的增加呈显著降低趋势,双糖苷是其中最主要的花色苷类型,而双糖苷在葡萄酒中更易发生褐变[15-19]。提高桂葡6号葡萄酒的色泽和稳定性对于提升广西原生品种葡萄酒品质具有重要意义。本研究选用槲皮素和芦丁两种辅色素,在桂葡6号葡萄酒发酵前进行添加,以不添加辅色素为对照,对不同葡萄酒基酒理化指标进行测定,并研究其在瓶储期内(1、3、6、9个月)颜色参数及花色苷含量的变化。以期比较辅色素添加对葡萄酒花色苷及颜色参数的影响,为生产中提高桂葡6号葡萄酒色泽及稳定性提供理论依据。
1 材料与方法
1.1 材料与试剂
桂葡6号葡萄:采摘于广西农业科学院葡萄与葡萄酒研究所科研基地(22°50′59″N,108°14′35″E)。于2014年定植,整形方式为一字型,栽植密度为2.5 m×1.5 m,南北行向,常规田间管理。
二甲花翠素-3-O-葡萄糖苷标准品(纯度>98%):美国Sigma-Aldrich公司;甲醇、甲酸、乙腈(均为色谱纯):美国Fisher公司;Lalvin 71B活性干酵母:法国Lallemand公司;芦丁(纯度98%)、槲皮素(纯度95%):西安三江生物工程有限公司;果胶酶(酶活力8 600 U/g):法国Laffort公司。
1.2 仪器与设备
UV-1801紫外分光光度计:北京瑞利分析仪器公司;TGL-16M高速冷冻离心机:湘仪离心机仪器有限公司;LC-20AD高效液相色谱-质谱(high performance liquid chromatography-mass spectrometer,HPLC-MS)仪:日本岛津公司。
1.3 试验方法
1.3.1 发酵葡萄酒样品的制备
酿酒葡萄原料经除梗破碎后入罐(30 L,共9个罐),每罐中添加20 g/t果胶酶和30 mg/L H2SO3,将发酵罐于温度15 ℃条件下放置24 h,接着向罐内加入200 mg/L Lalvin 71B活性干酵母启动酒精发酵,期间温度控制在24~26 ℃,发酵期间每天进行压帽处理,并测定发酵酒液比重和残留还原糖,直到残糖<4 g/L判定酒精发酵结束。酒精发酵结束后进行一次倒罐,除去底部酒泥,进入后发酵阶段(20 ℃、1个月),再进行一次倒罐,取样测定基酒理化指标,重复3次。随后装瓶进行为期9个月的瓶储,瓶储环境温度控制为15 ℃。于瓶储1、3、6与9个月的时候取样,每次取样重复3次,取样后置于-20 ℃冰箱保存,用于花色苷及颜色参数测定。
1.3.2 辅色素添加对葡萄酒样品品质的影响
于发酵前在发酵罐中添加芦丁、槲皮素,添加浓度为1.0 mmol/L,对照组不作任何添加,分别为对照组、芦丁组、槲皮素组,每个处理重复3次。
1.3.3 理化指标测定
pH值、酒精度、干浸出物、总酸、总糖、挥发酸、单宁、总酚含量按照参考文献[20]进行测定,重复3次。
1.3.4 颜色参数的测定
采用CIELab法测定酒样颜色参数[21],以L*值、a*值、b*值和C*值表示葡萄酒颜色的参数和饱和度,其中L*值表示明亮度;a*值表示红绿色调;b*值表示黄蓝色调;C*值表示颜色饱和度。利用1 mm比色皿在波长440 nm、530 nm和600 nm条件下测定酒样吸光度值,计算方法参考文献[21]。
1.3.5 花色苷的检测
参照成果[22]方法测定。酒样经0.45 μm水系滤膜过滤后进样,采用HPLC-MS进行花色苷检测,每个样品重复进样3次。
高效液相色谱条件:Zorbax Eclipse SB C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为2%甲酸与6%乙腈的水溶液,流动相B为2%甲酸与54%乙腈的水溶液。梯度洗脱条件为90%~75%A,10%~25%B,18 min;75%A,25%B,2 min;75%~60%A,25%~40%B,10 min;60%~30%A,40%~70%B,5 min;30%~0A,70%~100%B,5 min;流速1.0 mL/min;进样量30 μL,柱温50 ℃;检测波长525 nm。
质谱条件:采用电喷雾离子源,正离子模式,质量扫描范围100~1 500 m/z;雾化器压力35 psi;干燥气流速12 L/min;干燥气温度300 ℃。
定性定量分析:依照中国农业大学葡萄酒研究中心建立的“葡萄与葡萄酒花色苷HPLC-UV-MS指纹谱库”,将测定酒样的图谱中的质谱信息、光谱信息及保留时间与之进行对比分析[23],从而对花色苷进行定性。采用外标法进行定量,以二甲花翠素-3-O-葡萄糖苷的含量(x)为横坐标,以其峰面积(y)为纵坐标建立二甲花翠素-3-O-葡萄糖苷标准曲线,得到其标准曲线回归方程为y=112 650x-49 628(相关系数R2>0.998),其他花色苷以相当于二甲花翠素-3-O-葡萄糖苷的含量计。
1.3.6 数据分析
使用Microsoft Excel 2010进行数据处理,采用SPSS 20.0软件进行统计分析,采用Prism 8.0软件作图。
2 结果与分析
2.1 辅色素添加对葡萄酒基本理化指标的影响
桂葡6号葡萄酒理化指标检测结果见表1。由表1可知,酒精度为8.0%vol~8.6%vol,符合GB 15037—2006《葡萄酒》规定(要求酒精度≥7.0%vol);总酸含量为3.86~3.98 g/L;挥发酸含量为0.20~0.21 g/L,低于GB 15037—2006《葡萄酒》规定(1.2 g/L)。总糖含量为2.04~2.71 g/L(<4.0 g/L),葡萄酒发酵彻底,根据GB 15037—2006《葡萄酒》判定为干型;pH值表示葡萄酒中酸的强弱,对于葡萄酒的稳定性与感官质量均有重要作用,葡萄酒的pH值一般为2.8~3.8[20],桂葡6号葡萄酒pH值为3.54~3.64。干浸出物含量为21.7~23.1 g/L,符合GB 15037—2006《葡萄酒》关于红葡萄酒的规定(要求干浸出物含量≥18.0 g/L)。各葡萄酒样的酒精度、干浸出物、总酸、挥发酸及单宁含量无显著差异(P>0.05),表明辅色剂添加不会影响以上理化指标。辅色素添加可引起葡萄酒总酚含量的变化,各酒样总酚含量之间存在显著差异(P<0.05),槲皮素组葡萄酒的总酚含量最高,芦丁组次之,对照组最低。这可能是由于辅色素添加在发酵过程中加强了多酚物质的浸出,同时,槲皮素和芦丁可促进辅色复合体的形成,减少花色苷的氧化降解。
表1 辅色素添加对葡萄酒理化指标的影响
Table 1 Effect of copigments addition on physicochemical indexes of wines
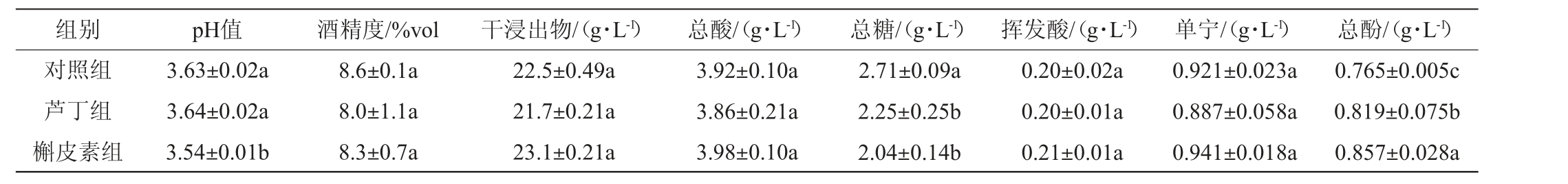
注:同列字母不同表示差异显著(P<0.05)。下同。
组别 pH值 酒精度/%vol 干浸出物/(g·L-1) 总酸/(g·L-1) 总糖/(g·L-1) 挥发酸/(g·L-1) 单宁/(g·L-1) 总酚/(g·L-1)对照组芦丁组槲皮素组3.63±0.02a 3.64±0.02a 3.54±0.01b 8.6±0.1a 8.0±1.1a 8.3±0.7a 22.5±0.49a 21.7±0.21a 23.1±0.21a 3.92±0.10a 3.86±0.21a 3.98±0.10a 2.71±0.09a 2.25±0.25b 2.04±0.14b 0.20±0.02a 0.20±0.01a 0.21±0.01a 0.921±0.023a 0.887±0.058a 0.941±0.018a 0.765±0.005c 0.819±0.075b 0.857±0.028a
2.2 辅色素添加对瓶储过程中葡萄酒颜色参数的影响
辅色素对瓶储过程中葡萄酒颜色参数的影响见图1。由图1A可知,槲皮素组葡萄酒的L*值在整个瓶储期呈下降趋势,葡萄酒颜色逐渐加深。瓶储1~3个月时,对照组及芦丁组葡萄酒的L*值逐渐升高;瓶储3个月之后,各组L*值下降,当瓶储结束时,对照组、芦丁组及槲皮素组葡萄酒的L*值分别为84.30、84.56和83.34(P>0.05)。由图1B可知,瓶储1~3个月时,对照组及芦丁组葡萄酒的a*值下降;瓶储3个月之后,其a*值上升,即葡萄酒红色色调先降低后上升,且两者之间差异不显著(P>0.05)。瓶储1~6个月时,槲皮素组葡萄酒a*值上升;瓶储6个月之后,a*值下降,当瓶储结束时,对照组、芦丁组及槲皮素组葡萄酒的a*值分别为19.98、19.22和21.11,槲皮素组葡萄酒a*值显著高于其他两个处理组(P<0.05)。由图1C可知,3个处理组葡萄酒b*值在瓶储过程中呈不断上升趋势,黄色色调不断上升,当瓶储结束时,对照组、芦丁组及槲皮素组的b*值分别为4.69、5.11和3.16。这可能是由于游离态花色苷通过与其他物质结合成更复杂的花色苷色素衍生物,使葡萄酒黄色色调增强[24]。由图1D可知,3个处理组葡萄酒的C*值在瓶储过程中变化趋势与a*值一致,当瓶储结束时,对照组、芦丁组及槲皮素组的C*值分别为20.53、19.89和21.38。
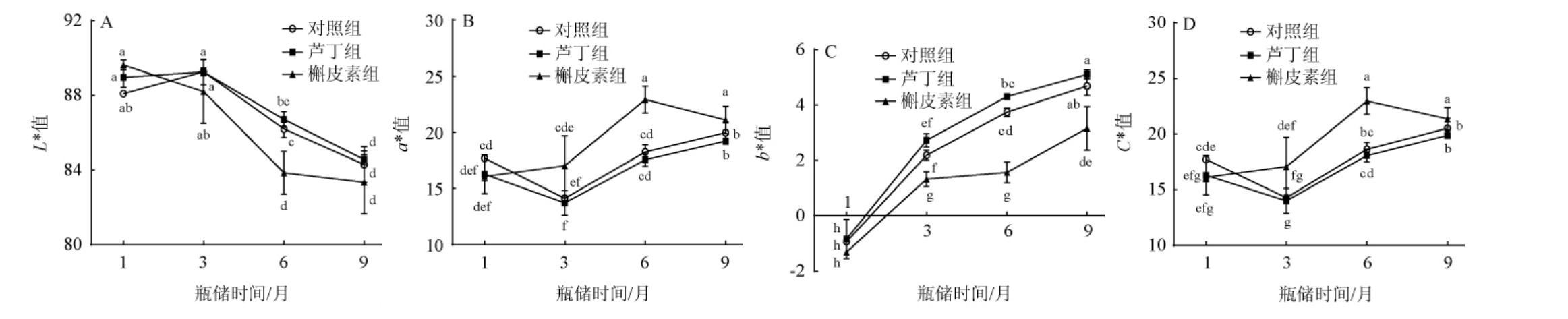
图1 辅色素添加对瓶储过程中葡萄酒颜色参数的影响
Fig.1 Effect of copigments addition on wine color parameters during bottle storage periods
字母不同表示各样品间差异显著(P<0.05)。
总体来说,随着瓶储期延长,桂葡6号葡萄酒明亮度L*降低,红色色调和黄色色调增强,颜色更加饱满。槲皮素添加可增强葡萄酒红色色调,减缓黄色色调的上升,对葡萄酒具有色泽保护的作用,这与唐柯等[10]研究结果一致。芦丁的辅色作用较弱,在瓶储结束时颜色参数与对照之间无显著差异(P>0.05),这可能与酿酒品种以及不同辅色剂的最佳使用浓度不同有关。总体来说,槲皮素添加的桂葡6号葡萄酒颜色表现较好。
2.3 葡萄酒花色苷组成特点
葡萄酒样品中花色苷的HPLC-MS的分子离子与碎片离子信息见表2。
表2 葡萄酒样品中花色苷HPLC-MS分析的分子离子与碎片离子信息
Table 2 Molecular and fragmentation ions of anthocyanins in wines using HPLC-MS
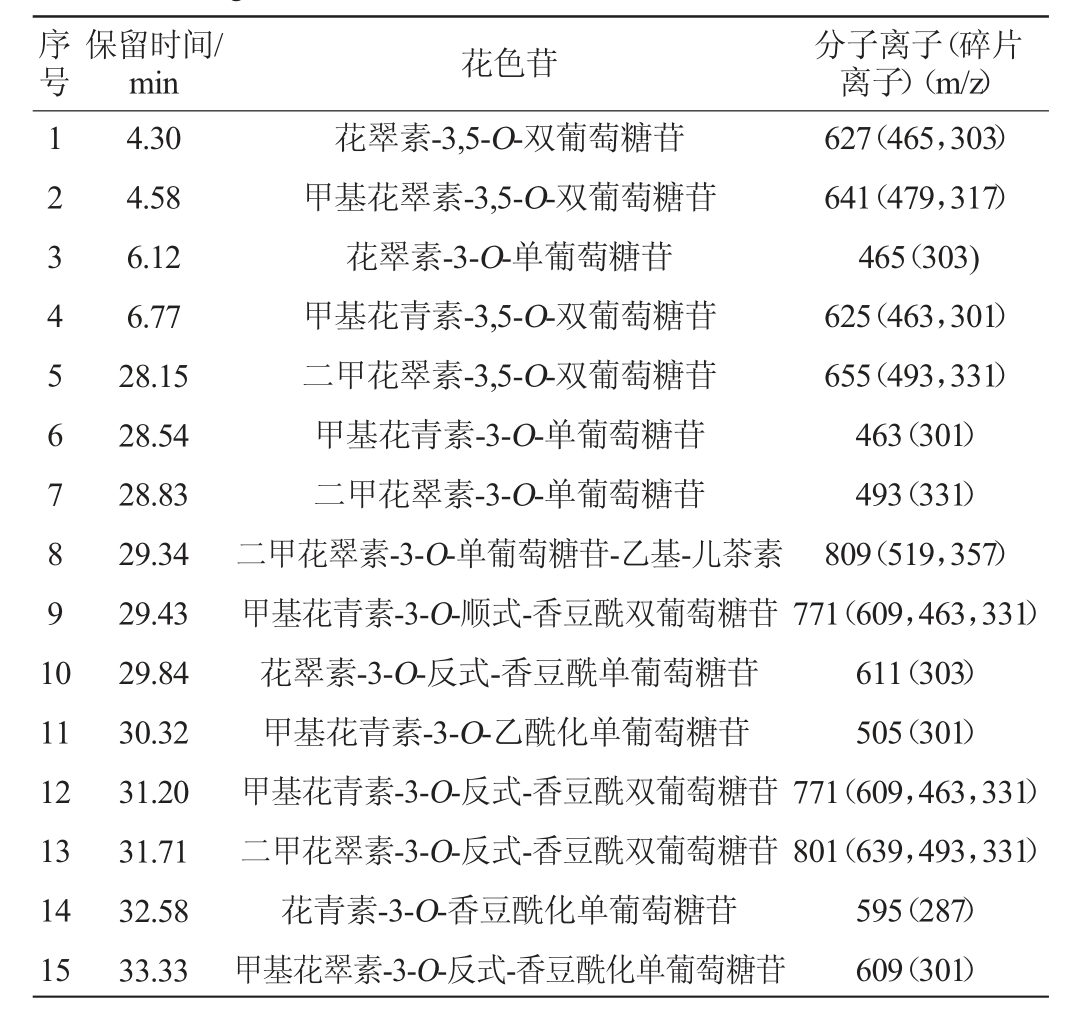
序号保留时间/min 花色苷 分子离子(碎片离子)(m/z)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 4.30 4.58 6.12 6.77 28.15 28.54 28.83 29.34 29.43 29.84 30.32 31.20 31.71 32.58 33.33花翠素-3,5-O-双葡萄糖苷甲基花翠素-3,5-O-双葡萄糖苷花翠素-3-O-单葡萄糖苷甲基花青素-3,5-O-双葡萄糖苷二甲花翠素-3,5-O-双葡萄糖苷甲基花青素-3-O-单葡萄糖苷二甲花翠素-3-O-单葡萄糖苷二甲花翠素-3-O-单葡萄糖苷-乙基-儿茶素甲基花青素-3-O-顺式-香豆酰双葡萄糖苷花翠素-3-O-反式-香豆酰单葡萄糖苷甲基花青素-3-O-乙酰化单葡萄糖苷甲基花青素-3-O-反式-香豆酰双葡萄糖苷二甲花翠素-3-O-反式-香豆酰双葡萄糖苷花青素-3-O-香豆酰化单葡萄糖苷甲基花翠素-3-O-反式-香豆酰化单葡萄糖苷627(465,303)641(479,317)465(303)625(463,301)655(493,331)463(301)493(331)809(519,357)771(609,463,331)611(303)505(301)771(609,463,331)801(639,493,331)595(287)609(301)
由表2可知,3个处理组葡萄酒样品中均检测出15种不同类型的花色苷,其中花色素双糖苷及其酰化衍生物7种、花色素单糖苷及其酰化衍生物7种及聚合花色苷1种。与桂葡6号葡萄果实相比[16],葡萄酒中形成了新的低聚体和聚合物色素,如二甲花翠素-3-O-单葡萄糖苷-乙基-儿茶素(8)与甲基花青素-3-O-乙酰化单葡萄糖苷(11)。其原因可能是,葡萄酒中花色苷主要来源于葡萄果实,通过浸渍从果皮转移到酒体中,并在葡萄酒中成熟和陈酿过程中有新的聚合和修饰形式出现[25-26]。
为了更直观分析桂葡6号葡萄酒瓶储期花色苷组成特点,对各组酒样瓶储期检测的花色苷进行聚类分析,结果见图2。
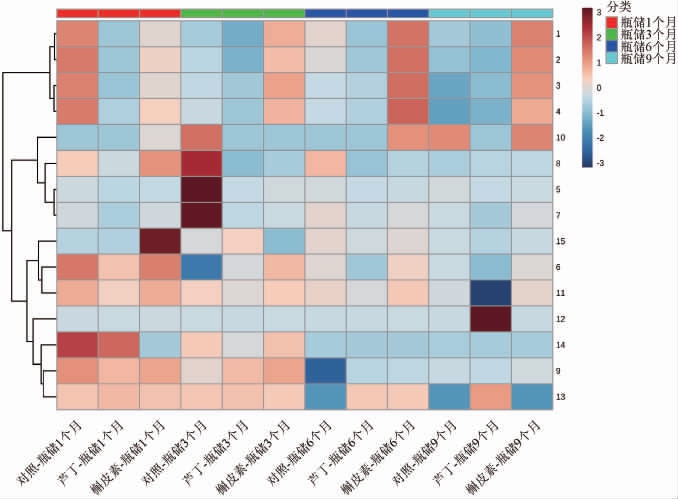
图2 桂葡6号葡萄酒瓶储期各类花色苷含量聚类分析结果
Fig.2 Cluster analysis results of each anthocyanin contents of Guipu 6 wines during bottle storage periods
图中数字对应表2中葡萄酒检测到的花色苷序号。
所有酒样中甲基花青素-3-O-单葡萄糖苷(6)、甲基花青素-3-O-顺式-香豆酰双葡萄糖苷(9)、甲基花青素-3-O-乙酰化单葡萄糖苷(11)、甲基花青素-3-O-反式-香豆酰双葡萄糖苷(12)、二甲花翠素-3-O-反式-香豆酰双葡萄糖苷(13)、花青素-3-O-香豆酰化单葡萄糖苷(14)、甲基花翠素-3-O-反式-香豆酰化单葡萄糖苷(15)随瓶储期延长整体呈逐渐降低的趋势。槲皮素组酒样中花翠素-3,5-O-双葡萄糖苷(1)、甲基花翠素-3,5-O-双葡萄糖苷(2)、花翠素-3-O-单葡萄糖苷(3)与甲基花青素-3,5-O-双葡萄糖苷(4)随瓶储期延长呈逐渐上升的趋势。
同一瓶储阶段的酒样中各类花色苷含量聚类分析结果存在差异。瓶储1个月,花翠素-3,5-O-双葡萄糖苷(1)、甲基花翠素-3,5-O-双葡萄糖苷(2)、花翠素-3-O-单葡萄糖苷(3)与甲基花青素-3,5-O-双葡萄糖苷(4)在对照中含量最高;二甲花翠素-3-O-单葡萄糖苷-乙基-儿茶素(8)和甲基花翠素-3-O-反式-香豆酰化单葡萄糖苷(15)在槲皮素组酒样中含量最高;芦丁组中各类花色苷含量较低。瓶储3个月,二甲花翠素-3,5-O-双葡萄糖苷(5)、二甲花翠素-3-O-单葡萄糖苷(7)及二甲花翠素-3-O-单葡萄糖苷-乙基-儿茶素(8)在对照组酒样中含量较高,辅色素组酒样中含量较低。在瓶储6、9个月,槲皮素组酒样花翠素-3,5-O-双葡萄糖苷(1)、甲基花翠素-3,5-O-双葡萄糖苷(2)、花翠素-3-O-单葡萄糖苷(3)与甲基花青素-3,5-O-双葡萄糖苷(4)、花翠素-3-O-反式-香豆酰单葡萄糖苷(10)含量较高。花色苷化学性质不稳定,在瓶储过程中,易受pH、光、热等因素影响发生降解[9],本研究中,槲皮素在瓶储初期与花色苷形成复合物产生辅色作用,至瓶储9个月,辅色作用仍明显。
2.4 辅色素添加对瓶储过程中葡萄酒花色苷含量的影响
辅色素添加对瓶储过程中葡萄酒花色苷含量的影响见图3。由图3A可知,各组酒样的花色苷总量随瓶储期延长的变化趋势存在差异。瓶储1~9个月时,槲皮素组酒样花色苷总量呈先上升后降低的趋势,在瓶储6个月时显著高于瓶储3和9个月(P<0.05)。对照组与芦丁组酒样在瓶储过程中花色苷总量呈逐渐降低趋势。这可能是由于随着瓶储期的延长,花色苷随着酒石酸盐的沉淀而沉淀,氧化和水解使葡萄酒中花色苷含量减少[27]。由图3B~图3I可知,对照组与芦丁组酒样中花色素双糖苷及单糖苷、花翠素类、花青素类、酰化类、未酰化类、甲基化类及未甲基化类花色苷含量在瓶储过程中的变化趋势基本与花色苷总量一致,而槲皮素组酒样花色素单糖苷和酰化类花色苷含量随瓶储期延长整体呈降低趋势;花色素双糖苷及花翠素类、未酰化类、甲基化类和未甲基化类花色苷含量在瓶储过程中的整体变化趋势与花色苷总量一致。这是因为在瓶储过程中,单糖苷容易发生降解、聚合、沉淀或其他反应引起含量的下降[28]。槲皮素组酒样大多数种类花色苷含量呈现先增加后降低的趋势,与槲皮素主要在瓶储6个月前发挥辅色作用有关。

图3 辅色素添加对瓶储过程中葡萄酒花色苷含量的影响
Fig.3 Effect of copigments addition on anthocyanin content of wine during bottle storage periods
同一瓶储阶段的各组酒样中各类花色苷含量的比较结果存在差异。瓶储1个月时,花色苷总量、花色素双糖苷及花青素类、未酰化类和未甲基化类花色苷含量在对照酒样中显著高于另两组酒样(P<0.05),花色素单糖苷及花翠素类、酰化类和甲基化类花色苷含量在槲皮素组酒样中与对照间差异不显著(P>0.05)。在瓶储3个月,槲皮素组酒样中花色素双糖苷及花青素类、未酰化类和未甲基化类花色苷含量显著高于对照(P<0.05),而花翠素类花色苷显著低于对照(P<0.05),其他种类花色苷在二者之间差异不显著(P>0.05)。芦丁组酒样的各类花色苷含量在瓶储3个月最低。在瓶储6、9个月时,槲皮素酒样中花色苷总量和各类花色苷含量显著高于对照组与芦丁组(P<0.05),芦丁与对照差异不显著(P>0.05)。
分析结果表明,与对照组及芦丁组相比,槲皮素可以延缓葡萄酒花色苷含量在瓶储阶段下降,尤其在瓶储期6个月时抑制效果更显著(除花色素单糖苷和酰化类花色苷外);当瓶储时间>6个月,槲皮素辅色作用减弱,但仍优于对照组和芦丁组。与王晓月等[29]研究结果较一致,随着陈酿时间的延长,辅色效应也相应减弱。槲皮素添加在瓶储6个月内保持各种花色苷含量,瓶储9个月时,辅色效应相对减弱。
2.5 辅色素添加对葡萄酒中不同种花色苷占比的影响
辅色素添加对葡萄酒中不同种花色苷占比的影响见表3。
表3 辅色素添加对葡萄酒中不同种花色苷占比的影响
Table 3 Effect of copigments addition on the proportion of different anthocyanins in wines%
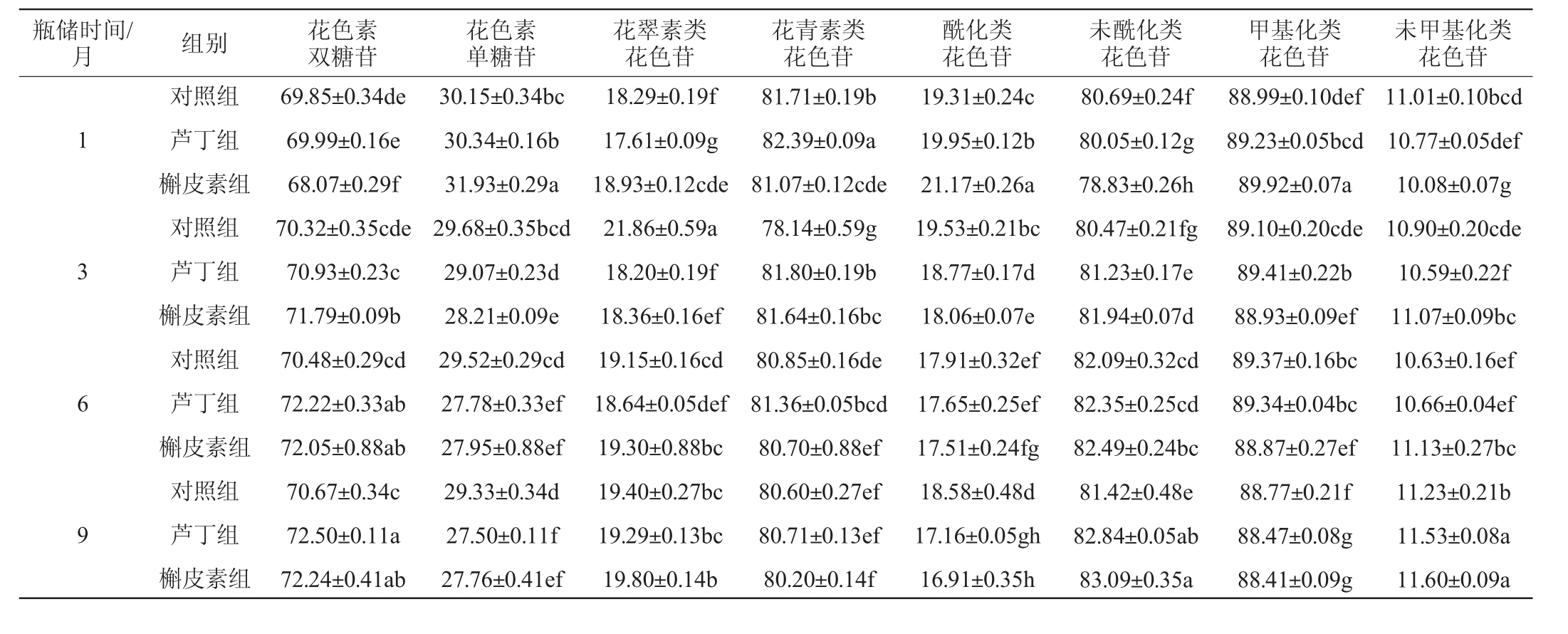
瓶储时间/月 组别1 3 6 9对照组芦丁组槲皮素组对照组芦丁组槲皮素组对照组芦丁组槲皮素组对照组芦丁组槲皮素组花色素双糖苷69.85±0.34de 69.99±0.16e 68.07±0.29f 70.32±0.35cde 70.93±0.23c 71.79±0.09b 70.48±0.29cd 72.22±0.33ab 72.05±0.88ab 70.67±0.34c 72.50±0.11a 72.24±0.41ab花色素单糖苷30.15±0.34bc 30.34±0.16b 31.93±0.29a 29.68±0.35bcd 29.07±0.23d 28.21±0.09e 29.52±0.29cd 27.78±0.33ef 27.95±0.88ef 29.33±0.34d 27.50±0.11f 27.76±0.41ef花翠素类花色苷18.29±0.19f 17.61±0.09g 18.93±0.12cde 21.86±0.59a 18.20±0.19f 18.36±0.16ef 19.15±0.16cd 18.64±0.05def 19.30±0.88bc 19.40±0.27bc 19.29±0.13bc 19.80±0.14b花青素类花色苷81.71±0.19b 82.39±0.09a 81.07±0.12cde 78.14±0.59g 81.80±0.19b 81.64±0.16bc 80.85±0.16de 81.36±0.05bcd 80.70±0.88ef 80.60±0.27ef 80.71±0.13ef 80.20±0.14f酰化类花色苷19.31±0.24c 19.95±0.12b 21.17±0.26a 19.53±0.21bc 18.77±0.17d 18.06±0.07e 17.91±0.32ef 17.65±0.25ef 17.51±0.24fg 18.58±0.48d 17.16±0.05gh 16.91±0.35h未酰化类花色苷80.69±0.24f 80.05±0.12g 78.83±0.26h 80.47±0.21fg 81.23±0.17e 81.94±0.07d 82.09±0.32cd 82.35±0.25cd 82.49±0.24bc 81.42±0.48e 82.84±0.05ab 83.09±0.35a甲基化类花色苷88.99±0.10def 89.23±0.05bcd 89.92±0.07a 89.10±0.20cde 89.41±0.22b 88.93±0.09ef 89.37±0.16bc 89.34±0.04bc 88.87±0.27ef 88.77±0.21f 88.47±0.08g 88.41±0.09g未甲基化类花色苷11.01±0.10bcd 10.77±0.05def 10.08±0.07g 10.90±0.20cde 10.59±0.22f 11.07±0.09bc 10.63±0.16ef 10.66±0.04ef 11.13±0.27bc 11.23±0.21b 11.53±0.08a 11.60±0.09a
由表3可知,桂葡6号葡萄酒中花色素双糖苷占比约为70%,以花色素双糖苷为主,这主要是因为桂葡6号葡萄果皮中花色苷以双糖苷为主[16],通过压榨和发酵等过程从葡萄皮中进入酒中发挥一系列化学作用[26]。各酒样的花色素双糖苷比例随瓶储期延长升高,单糖苷比例的变化趋势相反,芦丁组及槲皮素组葡萄酒样品的两类花色苷占比在瓶储6、9个月之间均没有显著差异(P>0.05)。双糖苷比同类型单糖苷更加稳定,但颜色浅[30]。瓶储1个月时,槲皮素组酒样中花色素双糖苷占比显著低于对照和芦丁(P<0.05),在瓶储3、6、9个月时,其占比显著高于对照组(P<0.05)。结合上述结果,其原因可能是由于花翠素-3,5-O-双葡萄糖苷(1)与甲基花青素-3,5-O-双葡萄糖苷(4)在槲皮素组酒样的瓶储期含量较高。
桂葡6号葡萄酒以花青素类花色苷为主,约占花色苷总含量的80%,对照组花翠素类花色苷占比在瓶储3个月时最高,芦丁组和槲皮素组中花翠素类花色苷占比随瓶储期延长总体呈升高趋势,花青素类花色苷占比变化趋势相反。花翠素类花色苷含量越高则蓝紫色色调更强[31],芦丁组和槲皮素组酒样的颜色逐渐加深。对照组与槲皮素组酒样中花翠素占比高于芦丁组,花青素结果相反;在瓶储9个月时,各酒样花翠素与花青素占比均无显著差异(P>0.05)。
桂葡6号葡萄酒以未酰化类花色苷为主,约占花色苷总含量的80%。各酒样的酰化类花色苷占比随瓶储期延长总体呈降低趋势,未酰化花色苷占比变化趋势相反。在瓶储1个月时,槲皮素组酒样中酰化类花色苷占比显著高于对照组和芦丁组(P<0.05),在瓶储3、6、9个月时,槲皮素组酒样中酰化类花色苷占比低于对照组和芦丁组,而未酰化花色苷结果相反。花色苷经酰基化修饰可增加其在酸性和中性条件下的稳定性[15],槲皮素添加对瓶储初期葡萄酒的酰化比例增加起到积极作用。
桂葡6号葡萄酒以甲基化类花色苷为主,约占花色苷总含量的88%。在酸性条件下,类黄酮结构骨架中B环上的取代基对花色苷的颜色影响很大,羟基越多颜色越红,甲氧基越多颜色越紫,稳定性也越强[32]。甲基化花色苷主要包括甲基花青素、甲基花翠素和二甲花翠素[22]。在瓶储1个月时,槲皮素组酒样甲基化类花色苷占比显著高于对照组和芦丁组(P<0.05),在瓶储3、6、9个月时低于对照组和芦丁组,而未甲基化花色苷占比结果相反。这表明槲皮素添加在瓶储1个月时对葡萄酒甲基化类花色苷比例有积极的稳定作用。
综上所述,桂葡6号葡萄酒以花色素双糖苷及花青素类、未酰化类、甲基化类花色苷占比为主,瓶储1个月时,槲皮素组酒样花色素单糖苷及花翠素类、酰化类与甲基化类花色苷占比显著高于对照组及芦丁组(P<0.05)。瓶储3、6、9个月时,槲皮素组花色素双糖苷、未酰化与未甲基化类花色苷占比高于对照组和芦丁组。槲皮素辅色效应明显,可影响瓶储期各类花色苷占比。
3 结论
槲皮素添加可稳定桂葡6号葡萄酒瓶储期的颜色,槲皮素组基酒酒样的总酚含量最高(0.857 g/L),pH值及总糖含量最低,其他指标无显著差异(P>0.05);瓶储结束时,该组别葡萄酒酒样颜色参数指标最佳;各组酒样中均含有15种不同类型的花色苷,槲皮素组酒样花色苷总量及各类花色苷(除花色素单糖苷和酰化类花色苷外)含量在瓶储6个月时达最大值;瓶储3、6、9个月时,槲皮素组酒样花色素双糖苷、未酰化与未甲基化类花色苷占比高于对照组和芦丁组。因此,在生产中可通过发酵前添加槲皮素对桂葡6号葡萄酒进行辅色,从而提高桂葡6号葡萄酒的花色苷的含量及颜色稳定性,这对于提升桂葡6号葡萄酒色泽品质和市场竞争力具有重要作用。
[1]ZHANG X K,LAN Y B,HUANG Y,et al.Targeted metabolomics of anthocyanin derivatives during prolonged wine aging:Evolution,color contribution and aging prediction[J].Food Chem,2020:127795.
[2]葛谦,刘正庭,陈翔,等.赤霞珠葡萄酒酿造过程中花色苷及颜色参数变化规律[J].中国酿造,2018,37(2):137-141.
[3]张波,韩舜愈,马腾臻,等.红葡萄酒中花色苷衍生物结构研究进展[J].食品科学,2018,39(5):284-295.
[4] TANG K,LIU T T, HAN Y H, et al.The importance of monomeric anthocyanins in the definition of wine colourproperties[J].S Afr J Enol Vitic,2017,38(1):1-10.
[5]唐柯,张小倩,李记明,等.基于超高效液相色谱串联三重四级杆质谱的不同产区赤霞珠葡萄酒花色苷特征性研究[J].食品与发酵工业,2019,45(5):208-212.
[6]MORATA A,GOMEZ-CORDOVES M,CALDERON F,et al.Effects of pH,temperature and SO2 on the formation of pyranoanthocyanins during red wine fermentation with two species of Saccharomyces[J].Int J Food Microbiol,2006,106(2):123-129.
[7] KALLITHRAKA S, TSOUTSOURAS E, TZOUROU E, et al.Principal phenolic compounds in Greek red wines[J].Food Chem, 2006, 99(4):784-793.
[8]刘婷婷.辅色素对葡萄酒花色苷辅色作用及颜色影响的研究[D].无锡:江南大学,2014.
[9]张波,祝霞,盛文军,等.红葡萄酒中花色苷辅色化反应研究进展[J].中国农业科技导报,2017,19(8):92-104.
[10]唐柯,倪高玉,李记明,等.辅色素对葡萄酒单体花色苷及颜色的影响[J].食品与发酵工业,2019,45(22):54-59.
[11] BOULTON R.The copigmentation of anthocyanins and its role in the color of red wine:a critical review[J].Am J Enol Viticult,2001,52(2):67-87.
[12]SCHWARZ M,PICAZO-BACETE J J,WINTERHALTER P,et al.Effect of copigments and grape cultivar on the color of red wines fermented after the addition of copigments[J].J Agr Food Chem,2005, 53(21):8372-8381.
[13]ZHANG X K,HE F,ZHANG B,et al.The effect of pre-fermentative addition of gallic acid and ellagic acid on the red wine color,copigmentation and phenolic profiles during wine aging[J].Food Res Int,2018,106:568-579.
[14]谢太理,管敬喜,杨莹,等.毛葡萄新品系G203的种质特点及酿酒品质的研究[J].中外葡萄与葡萄酒,2015(1):32-35.
[15]成果,黄羽,杨莹,等.‘桂葡6号’葡萄酒花色苷组分HPLC-MS分析[J].食品科学,2018,39(10):269-275.
[16]成果,周思泓,黄羽,等.‘桂葡6号’葡萄花色苷组成特点与基因表达规律解析[J].植物生理学报,2017,53(1):103-114.
[17]余欢,张劲,周咏梅,等.不同叶幕夹角对不同瓶储期桂葡6号葡萄酒花色苷组成及含量的影响[J].南方农业学报,2020,51(2):394-403.
[18]余欢,谢太理,张劲,等.避雨栽培对“桂葡6号”葡萄酒花色苷组成及含量的影响[J].西南农业学报,2019,32(2):278-285.
[19]BLANCO-VEGA D,GÓMEZ-ALONSO S,HERMOSÍN-GUTIN C O I.Identification,content and distribution of anthocyanins and low molecular weight anthocyanin-derived pigments in Spanish commercial red wines[J].Food Chem,2014,158:449-458.
[20]王华.葡萄酒分析检验[M].北京:中国农业出版社,2011:2.
[21]ZHANG B,HE F,ZHOU P P,et al.Copigmentation between malvidin-3-O-glucoside and hydroxycinnamic acids in red wine model solutions:Investigations with experimental and theoretical methods[J].Food Res Int,2015,78:313-320.
[22]成果.微环境调控“赤霞珠”葡萄果实花色苷代谢的研究[D].杨凌:西北农林科技大学,2015.
[23]何建军.影响酿酒葡萄果实中花色苷结构修饰的因素分析[D].北京:中国农业大学,2010.
[24]JACKSON R S.Wine Science: Principle and Applications[M].USA:Academic Press,2008:287-295.
[25]GONZALEZ-NEVES G,FRANCO J,BARREIRO L,et al.Varietal differentiation of Tannat,Cabernet-Sauvignon and Merlot grapes and wines according to their anthocyanic composition[J].Eur Food Res Technol,2007,225(1):111-117.
[26]MORI K,GOTO-YAMAMOTO N,KITAYAMA M,et al.Loss of anthocyanins in red-wine grape under high temperature[J].J Exp Bot,2007,58(8):1935-1945.
[27]苗丽平,赵新节,韩爱芹,等.红葡萄酒中花色苷的影响因素[J].酿酒科技,2016(2):40-46.
[28]曹鹏,张波,张欣珂,等.陈酿前添加咖啡酸对干红葡萄酒颜色品质及多酚构成的影响[J].中国食品学报,2019,19(7):153-160.
[29]王晓月,张珊珊,张欣珂,等.发酵前添加黄酮醇类辅色素对‘赤霞珠’干红葡萄酒颜色品质及多酚组成的影响[J].食品科学,2020,41(18):188-195.
[30]DE FREITAS V A P,FERNANDES A,OLIVEIRA J,et al.A review of the current knowledge of red wine colour[J].Oeno One,2017,51(1):1604.
[31]MATSUYAMA S,TANZAWA F,KOBAYASHI H,et al.Leaf removal accelerated accumulation of delphinidin-based anthocyaninsin 'Muscat Bailey A'[Vitis×labruscana (Bailey) and Vitis vinifera (Muscat Hamburg)]grape skin[J].J Jpn Soc Hortic Sci,2014,83(1):17-22.
[32]姜寿梅.西拉葡萄成熟及葡萄酒发酵过程中酚类物质研究[D].北京:中国农业大学,2008.