“鲊”是指将面粉或米粉混以瓜果、蔬菜、鱼肉及食盐腌制而成的发酵食品,发源至今已有2 000多年历史[1]。作为“鲊”的一种,鲊广椒是以二荆条辣椒(Capsicum annuum L.)和玉米粉为原料,辅以食盐、土豆丝或芋头丝等辅料,置于陶坛中密封发酵而成[2]。乳酸菌是鲊广椒发酵过程中的重要菌群,赋予了鲊广椒酸香可口的特点[3],ZHANG Z D等[4]相继从鲊广椒中分离出了4个乳酸菌新种,分别为鲊广椒伴生乳杆菌(Companilactobacillus zhachilii)HBUAS52074T、恩施促生乳杆菌(Lactobacillus enshiensis)HBUAS57009T[5]、土家促生乳杆菌(Levilactobacillus tujiae)HBUAS51241T[6]和安琪嗜戊糖乳杆菌[6](Secundilactobacillus angelii)HBUAS 51383T,表明鲊广椒中蕴含了丰富而独特的乳酸菌资源。
重庆市东部区地处武陵山区,毗邻鄂湘黔三省,属亚热带季风性湿润气候[7],生态多样性较高,加之当地少数民族众多且居民具有食用鲊广椒的习俗,因而该地区鲊广椒中可能蕴含了丰富的乳酸菌资源。近年来,Illumina MiSeq 高通量测序技术突破了传统微生物纯培养方法的限制[8],在鲊广椒微生物多样性解析方面亦有了一定的应用,如GUO Z等[9]利用该技术发现伴生乳杆菌属(Companilactobacillus)、乳植物杆菌属(Lactiplantibacillus)和棒状杆菌属(Corynebacterium)是湖南怀化市和贵州铜仁市两个地区鲊广椒中的核心优势细菌属,且不同地区的鲊广椒其细菌多样性存在一定的差异。重庆东部地区亦有食用鲊广椒的习俗,但民间认为鲊广椒起源于重庆市中东部地区,因而开展重庆东部地区鲊广椒源乳酸菌菌株的挖掘工作,同时对其鲊广椒细菌菌群多样性进行解析,对全面剖析鲊广椒这一地方特色发酵食品的微生物类群具有积极的意义。
本研究从重庆东部的石柱县、云阳县、彭水县、万州区和黔江区共采集鲊广椒样品51份,使用传统微生物纯培养技术对其蕴含的乳酸菌进行了分离鉴定,使用Illumina MiSeq高通量测序技术对其细菌菌群多样性进行了解析,以期为鲊广椒中乳酸菌资源的挖掘提供菌株支持,为鲊广椒的产业化推动提供数据支撑。
1 材料与方法
1.1 材料与试剂
鲊广椒:采集自重庆东部5个地区的51份样品,均为农户使用当地原材料自制而成,样品信息概述见表1;MRS培养基、碳酸钙(分析纯):国药集团化学试剂有限公司;基因组提取试剂盒:德国QIAGEN公司;rTaq酶、10×Buffer、脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP):北京全式金生物技术有限公司;高通量测序配套试剂:美国Illumina公司。
表1 样品采样地及编号
Table 1 Sampling place and code of samples

采样地点 样品编号 样品数目/个 地理位置 原料 发酵时间/d石柱县万州区云阳县彭水县黔江区SZ1~SZ23 WZ1~WZ13 YY1~YY9 PS1~PS4 QJ1~QJ2 23 13 9 4 2 E 107°59′~108°34′;N 29°39′~30°33′E 107°55′~108°53′;N 30°24′~25-31°14′E 108°35′~109°14′;N 30°35′~31°26′E 28°57′~29°51′;N 107°48′~108°36′E 108°28′~108°56′;N 29°04′~29°52′二荆条辣椒、玉米粉、土豆二荆条辣椒、玉米粉二荆条辣椒、玉米粉二荆条辣椒、玉米粉二荆条辣椒、玉米粉30~40 30~40 30~40 20~30 20~30
1.2 仪器与设备
DG250厌氧工作站:英国DWS公司;LRH-150生化培养箱:上海一恒科学仪器有限公司;ECLIPSE Ci生物显微镜:日本Nikon公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司;PE300高通量测序平台:美国Illumina公司;R920机架式服务器:美国DELL公司。
1.3 方法
1.3.1 鲊广椒中乳酸菌菌株的分离纯化
准确称取10 g鲊广椒,加入装有90 mL生理盐水的锥形瓶内,37℃振荡30min,使其充分混匀制成10-1梯度,依次进行10倍梯度稀释,取10-4、10-5和10-6稀释液进行涂布,将涂布后的培养皿置于厌氧工作站(含80%N2、10%H2和10%CO2),30 ℃培养48 h[10]。挑选具有溶钙圈的单菌落,进行三区域划线纯化,将革兰氏染色为阳性,过氧化氢接触酶为阴性,镜检结果合格的菌株,使用30%甘油保存于-80 ℃超低温冰箱备用。
1.3.2 鲊广椒中乳酸菌菌株的鉴定
采用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bbromide,CTAB)法进行分离菌株DNA的提取,将检测合格的DNA产物进行PCR扩增和连接转化。将琼脂糖电泳检测合格的克隆子送往上海桑尼生物科技有限公司进行测序,返回序列拼接后于美国国立生物技术信息中心(national center for biotechnology information,NCBI)网站进行比对,并进行系统发育树的构建。
1.3.3 鲊广椒中微生物宏基因组DNA提取及Illumina MiSeq测序
按照每个地区样品数不少于2个不多于6个的原则,从51个鲊广椒样品中累计选取24个样品进行Illumina MiSeq测序,其中石柱县、万州区和云阳县各选取6个,编号分别为SZ1~SZ6、WZ1~WZ6和YY1~YY6,彭水县4个,编号为PS1~PS4,黔江区2个,编号为QJ1~QJ2。
准确称取2.0 g鲊广椒样品,按照基因组提取试剂盒说明书内容进行DNA的提取。参照李洁等[11]的扩增体系使用通用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对检测合格的样品DNA进行扩增,将扩增成功的PCR产物送至上海美吉生物医药有限公司进行高通量测序。
1.3.4 生物信息学分析
使用QIIME(QuantitativeInsightsIntoMicrobialEcology,v1.9.1)平台对下机后的序列进行质量控制[12],按照97%的相似度进行操作分类单元(operational taxonomic units,OTU)矩阵划分;使用UCHIME去除嵌合体后[13],选取代表性序列通过核糖体数据库项目(ribosomal database project,RDP)[14]、GREENGENE[15]和SILVA数据库[16]进行物种的注释,进而对其分类学地位进行确定。
1.3.5 数据分析
使用MEGA 7.0的和R(v4.1.3)软件对乳酸菌分离株的系统发育树进行构建;使用Origin 2018软件对平均相对丰度大于1.0%细菌门和细菌属的堆积图进行绘制。
2 结果与分析
2.1 鲊广椒样品乳酸菌的分离、鉴定及统计
通过纯培养技术,51个鲊广椒样品共分离纯化得到122株乳酸菌,经同源性比对随机挑选同一种的各一株菌作为代表系列与模式菌株序列利用MEGA7.0和R软件进行系统发育树的构建,结果见图1。
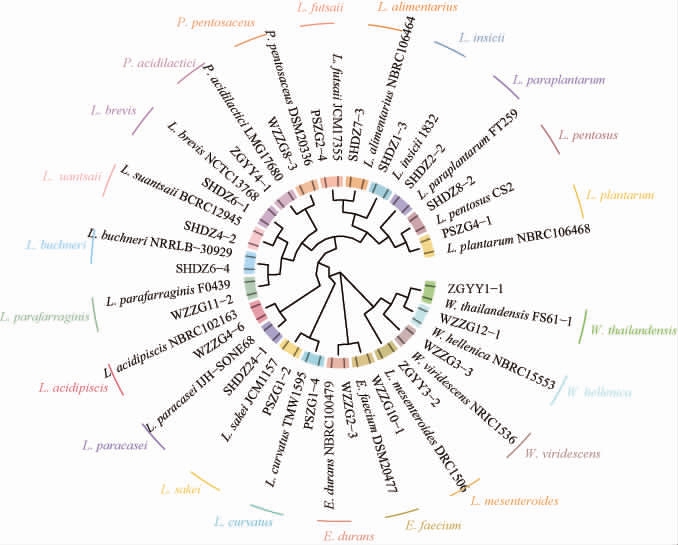
图1 基于16S rRNA基因序列的部分乳酸菌分离株系统发育树
Fig.1 Phylogenetic tree of some lactic acid bacteria isolates based on 16S rRNA gene sequence
由图1可知,所有乳酸菌归属于5个属下的22个种,分别为隶属于乳酸杆菌属(Lactobacillus)的戊糖乳杆菌(L. pentosus)、消化乳杆菌(L. alimentarius)、植物乳秆菌(L.plantarum)、酸鱼乳杆菌(L.acidipiscis)、类植物乳杆菌(L. paraplantarum)、苏氏乳杆菌(L. suantsaii)、副干酪乳杆菌(L. paracasei)、清酒乳杆菌(L. sakei)、弯曲乳杆菌(L.curvatus)、福菜乳杆菌(L.futsaii)、肉糜乳杆菌(L.insicii)、短乳杆菌(L.brevis)、布氏乳杆菌(L.buchneri)和类谷糠乳杆菌(L. parafarraginis)共14个种,隶属于魏斯氏菌属(Weissella)的绿色魏氏菌(W.viridescens)、赫伦魏斯氏菌(W. hellenica)和泰兰氏魏氏菌(W. thailandensis)共3个种,隶属于片球菌属(Pediococcus)的戊糖片球菌(P.pentosaceus)和乳酸片球菌(P.acidilactici)共2个种,隶属于肠球菌属(Enterococcus)的耐久肠球菌(E.durans)和屎肠球菌(E.faecium)共2个种,隶属于明串珠菌属(Leuconostoc)的肠膜明串珠菌(L.mesenteroides)共1个种。基于纯培养技术,对鲊广椒乳酸菌进行分离鉴定,其多样性分析见表2。
表2 基于纯培养技术鲊广椒中乳酸菌多样性分析
Table 2 Diversity analysis of lactic acid bacteria in zha-chili samples by pure culture technology
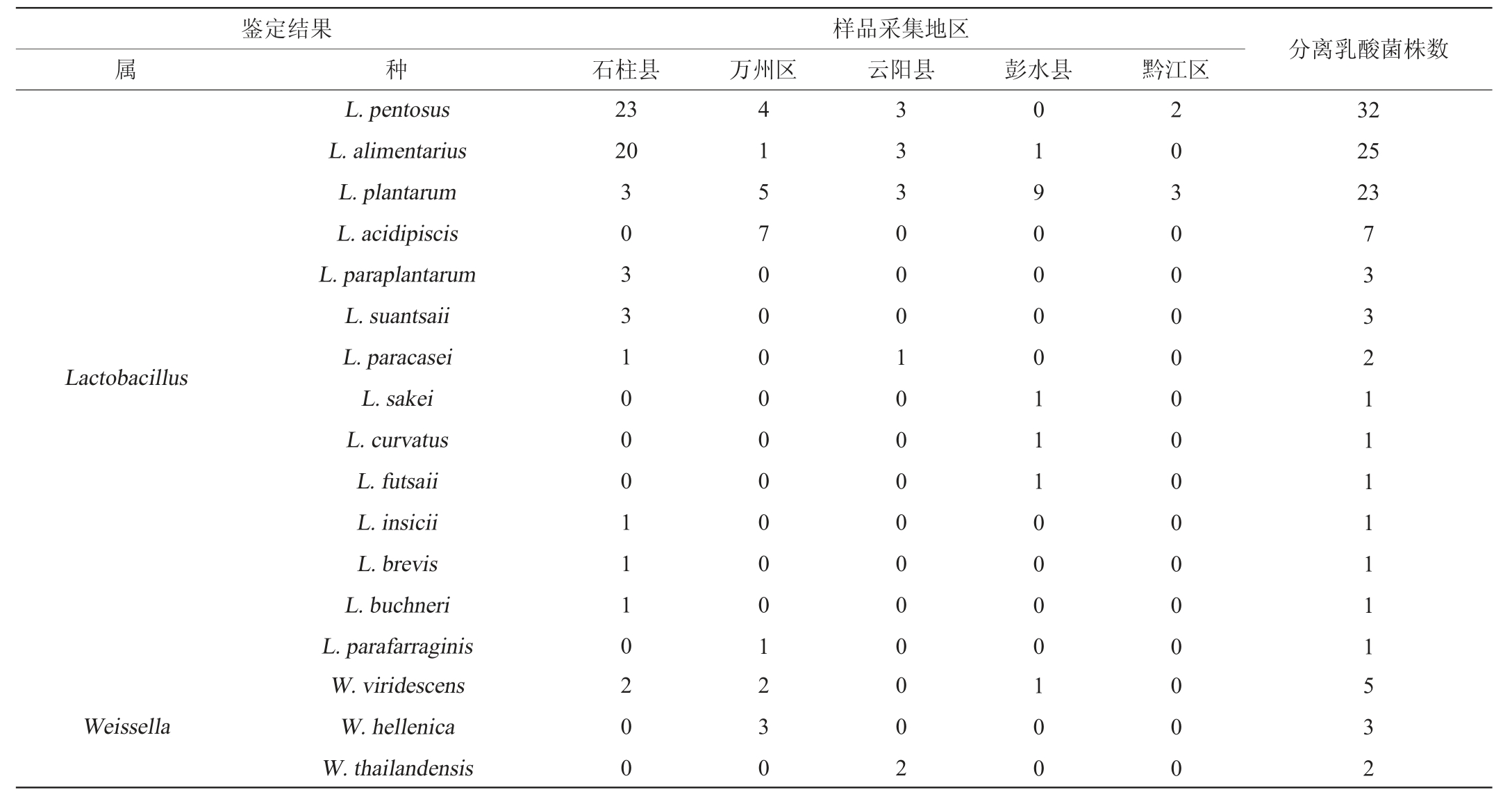
鉴定结果属种样品采集地区石柱县 万州区 云阳县 彭水县 黔江区分离乳酸菌株数Lactobacillus Weissella L.pentosus L.alimentarius L.plantarum L.acidipiscis L.paraplantarum L.suantsaii L.paracasei L.sakei L.curvatus L.futsaii L.insicii L.brevis L.buchneri L.parafarraginis W.viridescens W.hellenica W.thailandensis 23 20 3 0 3 3 1 0 0 0 1 1 1 02 0 0 4 1 5 7 0 0 0 0 0 0 0 0 0 12 3 0 3 3 3 0 0 0 1 0 0 0 0 0 0 00 0 2 0 1 9 0 0 0 0 1 1 1 0 0 0 01 0 0 2 0 3 0 0 0 0 0 0 0 0 0 0 00 0 0 32 25 23 7 3 3 2 1 1 1 1 1 1 15 3 2
续表
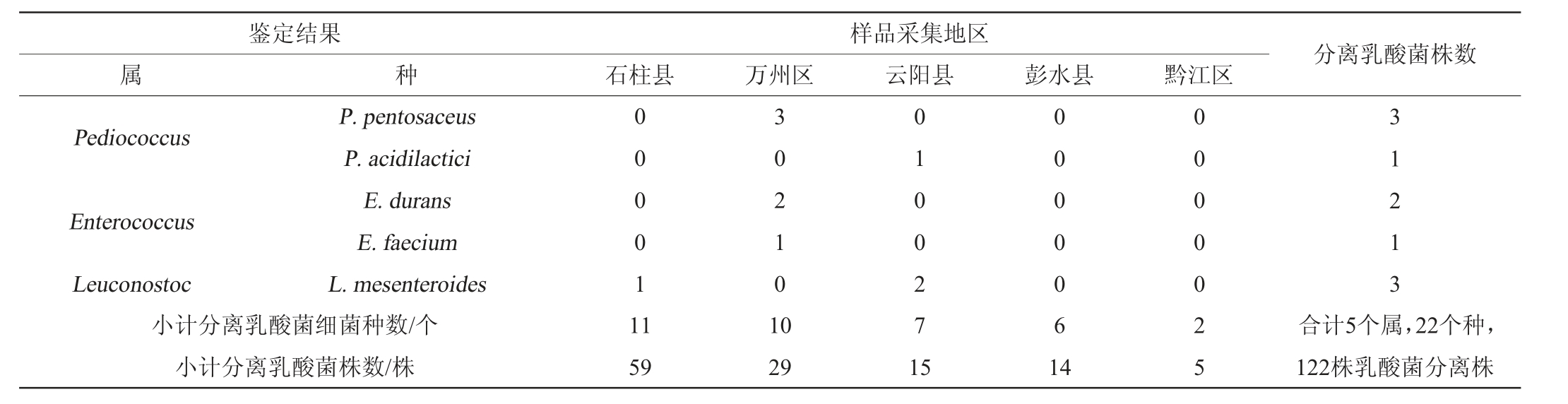
样品采集地区石柱县 万州区 云阳县 彭水县 黔江区Pediococcus鉴定结果属种P.pentosaceus P.acidilactici E.durans E.faecium L.mesenteroides Enterococcus Leuconostoc小计分离乳酸菌细菌种数/个小计分离乳酸菌株数/株0 0 0 0 1 1 1 3 0 2 1 0 1 0 59 29 0 1 0 0 2 7 1 5 0 0 0 0 0 6 1 4 0 0 0 0 0 2 5分离乳酸菌株数3 1 2 13合计5个属,22个种,122株乳酸菌分离株
由表2可知,隶属于乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、肠球菌属(Enterococcus)和明串珠菌属(Leuconostoc)的菌株共分离出102株、10株、4株、3株和3株,分别占总分离株的83.61%、8.20%、3.27%、2.46%和2.46%。在分离到的102株乳酸杆菌菌株中,共分离出戊糖乳杆菌(L.pentosus)、消化乳杆菌(L.alimentarius)和植物乳杆菌(L.plantarum)32株、25株和23株,分别占乳酸杆菌分离株的31.37%、24.51%和22.55%,占乳酸菌总分离株的26.23%、20.49%和18.85%。由此可见,重庆东部地区鲊广椒中乳酸菌类群以乳酸杆菌属(Lactobacillus)为主,且L.pentosus、L.alimentarius和L.plantarum为其主要乳酸杆菌类群。本研究发现L.pentosus是重庆东北地区鲊广椒中的优势乳酸菌之一,而席啦等[17-18]研究发现,湖北省宜昌市秭归县和荆州市洪湖市等地区鲊广椒中的优势乳酸菌为L.plantarum,且均未分离出L.pentosus,与本研究存在一定差异。由此可见,不同地区的鲊广椒其乳酸菌类群存在较大的差异,因而从不同地区鲊广椒中收集和挖掘乳酸菌资源是极为必要的。
2.2 基于MiSeq测序技术鲊广椒细菌群落组成分析
为了更好的对重庆东部地区鲊广椒细菌菌群多样性进行解析,本研究在对51个鲊广椒样品中乳酸菌进行分离鉴定的基础上,按照每个地区样品数不少于2个不多于6个的原则,进一步选取了石柱县6个(SZ1~SZ6)、万州区6个(WZ1~WZ6)、云阳县6个(YY1~YY6)、彭水县4个(PS1~PS4)和黔江区2个(QJ1~QJ2)共计24个鲊广椒样品进行高通量测序。结果表明,24个样品测序共产出741 039条高质量序列,划分为14 857个OTU,归属于14个门,39个纲,67个目,138个科和301个属。进一步对重庆东部地区榨广椒细菌基于门和属水平的组成进行分析。
2.2.1 基于门水平鲊广椒样品细菌群落组成分析
在24个鲊广椒样品中平均相对含量大于1.0%的细菌门见图2。
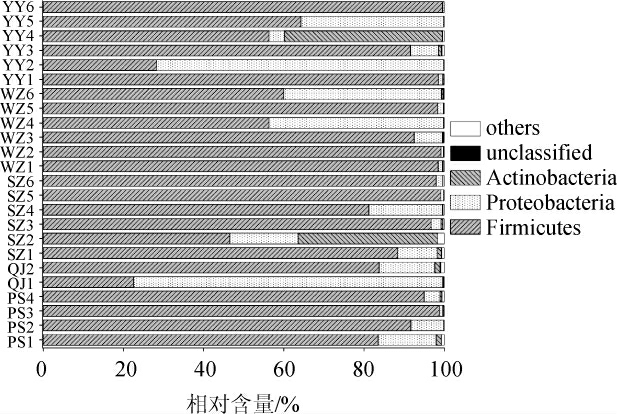
图2 基于门水平鲊广椒中细菌菌群多样性分析结果
Fig.2 Analysis results of bacterial community diversity in zha-chili samples at phylum level
由图2可知,重庆东部地区鲊广椒中平均相对含量大于1.0%的细菌门有3个,分别为厚壁菌门(Firmicutes)(80.36%)、变形菌门(Proteobacteria)(15.88%)和放线菌门(Actinobacteria)(3.38%)。CAI W C等[19]对湖南省湘西土家族苗族自治州的鲊广椒细菌多样性进行了解析,发现其优势细菌门亦为厚壁菌门、变形菌门和放线菌门,平均相对含量分别为81.14%、15.47%和2.99%,与本研究结果一致。由图2亦可知,虽然厚壁菌门和放线菌门在各样品中均存在,但其在各样品中的含量存在一定的差异,如厚壁菌门在PS3等10个样品中相对含量高达90%,但其在样品QJ1和YY2中的相对含量均低于30%,放线菌门在样品QJ1和YY2中的相对含量高达70%以上,而在PS3、SZ5、WZ2和YY6等样品中相对含量均小于1.0%。
2.2.2 基于属水平鲊广椒样品细菌群落组成分析
在24 个鲊广椒样品中平均相对含量大于1.0%的细菌属见图3。
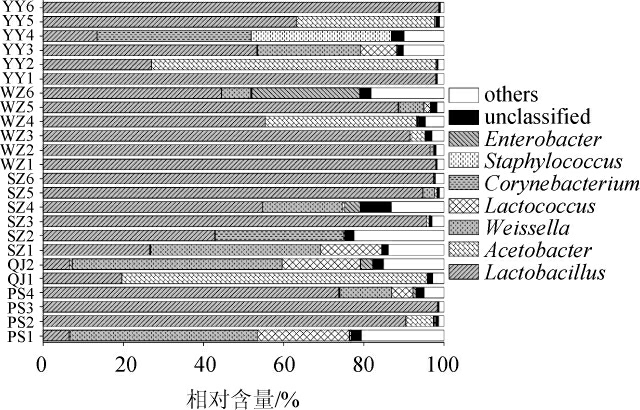
图3 基于属水平鲊广椒中细菌菌群多样性分析结果
Fig.3 Analysis results of bacterial community diversity in zha-chili samples at genus level
由图3可知,重庆东部地区鲊广椒中平均相对含量大于1.0%的细菌属有7个,分别为乳酸杆菌属(Lactobacillus)(63.96%)、醋酸杆菌属(Acetobacter)(9.70%)、魏斯氏菌属(Weissella)(9.16%)、乳球菌属(Lactococcus)(3.15%)、棒杆菌属(Corynebacterium)(2.96%)、葡萄球菌属(Staphylococcus)(1.50%)和肠杆菌属(Enterobacter)(1.50%)。CAI W C等[20]对湖北和湖南地区鲊广椒细菌菌群多样性进行解析,结果发现乳酸杆菌属平均相对含量为74.17%,为样品中含量最多的细菌,这与本研究结果一致,而其研究发现片球菌属(Pediococcus)在样品中的相对含量亦高达2.93%,与本研究存在一定的差异,究其原因可能是由于地域环境、生产工艺或原料存在差异导致的。乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和乳球菌属(Lactococcus)等乳酸菌广泛存在于泡菜[21]和酸奶[22]中,在食品的发酵过程中起着重要的作用,亦对成品的品质产生重要影响。有研究表明,乳酸杆菌属具有耐酸性较强的特点,能够代谢碳水化合物产乳酸,可抑制其他杂菌的生长,从而起到了防腐的效果[23];魏斯氏菌属可以代谢产生纤维素,并且在发酵过程中会产生部分有机酸和酯类,提高产品风味[24];乳球菌属中的乳酸乳球菌(L.lactis)是干酪常用的发酵剂,能够将乳糖转化产生乳酸,具有促进蛋白质水解等作用,从而对乳制品风味产生重要影响[25]。值得关注的是,隶属于棒杆菌属(Corynebacterium)[26]和葡萄球菌属(Staphylococcus)[27]的部分菌种为条件致病菌,因而在后续研究中筛选具有鲊广椒优良发酵特性的乳酸菌并实现产品的乳酸菌纯种发酵,对提升鲊广椒的食用安全性具有积极意义。由图3亦可知,虽然Lactobacillus和Weissella在各样品中均存在,但其在各样品中的含量亦存在一定的差异,Lactobacillus在YY6等10个样品中相对含量均>90%,但其在YY2等6个样品中的相对含量均<30%,Weissella在样品QJ2中的相对含量高达52.36%,而在WZ2等10个样品中相对含量均<1.0%。值得一提的是,其他5个平均相对含量>1.0%的细菌属并不存在于所有样品中,这也进一步说明了重庆东部地区鲊广椒细菌类群构成存在较大差异。
由此可见,重庆东部地区鲊广椒中蕴含了丰富的乳酸菌资源,其乳酸菌类群主要以Lactobacillus、Weissella和Lactococcus为主。
3 结论
本研究采用纯培养和Illumina MiSeq高通量测序技术相结合的方法对重庆东部地区鲊广椒中乳酸菌进行了分离鉴定,同时对其细菌菌群多样性进行解析。纯培养结果发现,该地区鲊广椒中可培养乳酸菌以戊糖乳杆菌(L.pentosus)、消化乳杆菌(L.alimentarius)和植物乳杆菌(L.plantarum)为主,3类乳酸杆菌分离株累计占总分离株总数的65.57%。高通量测序结果表明,平均相对含量>1.0%细菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),平均相对含量>1.0%细菌属为乳酸杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、棒杆菌属(Corynebacterium)、葡萄球菌属(Staphylococcus)和肠杆菌属(Enterobacter),且乳酸杆菌属(Lactobacillus)的平均相对含量为63.96%。
[1]冉春霞,陈光静,邓惠玲,等.渝东南地区土家特色酸鲊肉纯种发酵前期发酵条件优化[J].肉类研究,2019,33(10):29-35.
[2]席啦,向凡舒,郭壮,等.秭归地区鲊广椒中乳酸菌及细菌多样性研究[J].中国酿造,2021,40(11):122-126.
[3]尹小庆,汤艳燕,阚建全,等.两种鲊辣椒发酵过程中香气特征及其差异分析[J].食品与发酵工业,2019,45(16):266-274.
[4]ZHANG Z D,HOU Q C,WANG Y R,et al.Lactobacillus zhachilii sp.nov.,a lactic acid bacterium isolated from Zha-Chili[J].Int J Syst Evol Micr,2019,69(8):2196-2201.
[5]ZHANG Z D,WANG Y R,HOU Q C,et al.Lactobacillus enshiensis sp.nov.,a novel arsenic-resistant bacterium[J].Int J Syst Evol Micr,2020,70(4):2580-2587.
[6] ZHANG Z D, WANG Y R, GUO Z.Characterization of two novel pentose-fermenting and GABA-producing species:Levilactobacillus tujiorum sp.nov.and Secundilactobacillus angelensis sp.nov.isolated from a solidstate fermented zha-chili[J].Syst Appl Microbiol,2022,45(5):126344.
[7]GAO J,BIAN H Y,ZHU C J,et al.The response of key ecosystem services to land use and climate change in Chongqing:time,space,and altitude[J].J Geogr Sci,2022,32(2):317-332.
[8]MA W R,GENG X J,JIA F C,et al.Investigation of microbial composition and functional characterization of Zangqu using high throughput sequencing[J].LWT-Food Sci Technol,2021,136(8):110342.
[9]GUO Z,WANG Y R,ZHANG Z D,et al.Evaluating the flavor and divergent bacterial communities in corn-based zha-chili[J].Food Biosci,2022,46:101563.
[10] PENG C, SUN W T, DONG X, et al.Isolation, identification and utilization of lactic acid bacteria from silage in a warm and humid climate area[J].Sci Rep,2021,11(1):1-9.
[11]李洁,崔霖芸,陈芳勇,等.凯里地区辣椒酸细菌群落多样性及其乳酸菌分离鉴定[J].中国酿造,2021,40(11):98-103.
[12]ALMEIDA A,MITCHELL A L,TARKOWSKA A,et al.Benchmarking taxonomic assignments based on 16S rRNA gene profiling of the microbiota from commonly sampled environments[J].Gigascience, 2018, 7(5):54.
[13]SMITS S A,LEACH J,SONNENBURG E D,et al.Seasonal cycling in the gut microbiome of the Hadza hunter-gatherers of Tanzania[J].Science,2017,357(6353):802-806.
[14]COLE J R,WANG Q,FISH J A,et al.Ribosomal database project:data and tools for high throughput rRNA analysis[J].Nucl Acids Res,2014,42(1):633-642.
[15]XUE Z Y,KABLE M E,MARCO M L.Impact of DNA sequencing and analysis methods on 16S rRNA gene bacterial community analysis of dairy products[J].Msphere,2018,3(5):410-418.
[16]SANTOS M F,SOUZA I G B,GOMES S O,et al.Isolation and characterization of microsatellite markers in the spiny lobster,Panulirus echinatus Smith,1869(Decapoda:Palinuridae)by Illumina MiSeq sequencing[J].J Genet,2018,97(1):25-30.
[17]席啦,向凡舒,张彦,等.天门地区鲊广椒中细菌群落结构及乳酸菌类群研究[J].食品与发酵工业,2022,48(17):122-128.
[18]李娜,张苗苗,舒娜,等.咸丰和当阳地区鲊广椒细菌群落结构差异性研究[J].中国酿造,2020,39(10):48-53.
[19] CAI W C,WANG Y R,HOU Q C, et al.Rice varieties affect bacterial diversity, flavor, and metabolites of zha-chili[J].Food Res Int, 2021,147:110556.
[20]CAI W C,TANG F X,WANG Y R,et al.Bacterial diversity and flavor profile of Zha-Chili,a traditional fermented food in China[J].Food Res Int,2021,141:110112.
[21]汪冬冬,唐垚,伍亚龙,等.泡菜细菌多样性和风味成分研究进展[J].食品与发酵工业,2021,47(21):296-302.
[22]朱潇,梁琪,王湘竹,等.基于Illumina MiSeq高通量技术比较甘肃藏区传统牦牛发酵乳制品细菌菌群多样性[J].中国食品学报,2021,21(4):336-344.
[23]高庆超,常应九,马蓉,等.黑果枸杞酵素自然发酵过程中微生物群落的动态变化[J].食品与发酵工业,2019,45(13):126-133.
[24]郭倩倩,卢彪.晴隆酸菜发酵过程中微生物菌群多样性动态分析[J].中国酿造,2020,39(8):86-91.
[25]赵尘培,姜琳琳,张建龙,等.MLST在乳酸菌鉴定及其多样性分析中的应用[J].食品研究与开发,2021,42(10):218-224.
[26]SILVA-SANTANA G,SILVA C M F,OLIVELLA J G B,et al.Worldwide survey of Corynebacterium striatum increasingly associated with human invasive infections, nosocomial outbreak, and antimicrobial multidrugresistance,1976-2020[J].Arch Microbiol,2021,203(5):1863-1880.
[27] MORK R L, HOGAN P G, MUENKS C E, et al.Longitudinal, strainspecific Staphylococcus aureus introduction and transmission events in households of children with community-associated meticillin-resistant S aureus skin and soft tissue infection: a prospective cohort study[J].Lancet Infect Dis,2020,20(2):188-198.