传统中医理论认为,脾是包含消化系统、免疫系统、循环系统在内的多器官集合,而非西医解剖学中所讲的脾脏[1]。脾阳虚多为饮食不节、情志失调、劳倦过度等因素导致的脾阳虚衰,使脾失去温运,寒邪凝聚于内所表现出大便糖泄、畏寒肢冷、食欲不振等虚弱证候[2]。脾阳虚证形成过程缓慢,治疗恢复也难以一蹴而就,因此选择一种安全有效的药物及剂型尤为重要。酒与医素有不解之缘,繁体“医”字从“酉”,酉者酒也。中药酒剂,也称药酒,是中药的传统剂型,使用历史悠久。《黄帝内经》有“汤液醪醴论篇”,专门讨论用药之道,“醪醴”即为药酒[3]。药酒种类繁多,《本草纲目》按功效将药酒分为三类,分别为补益药酒、驱邪药酒和预防药酒。其中,补益类药酒具有营养保健的功能,可长期食用,其在治疗脾阳虚等慢性病方面具有优势[4]。
茯苓为多孔菌科真菌茯苓(Poria cocos(Schw)Wolf)的干燥菌核,是我国药食同源的传统中药材,享有“十方九茯苓”和“药膳白银”的美誉,其味甘、淡,性平,具有利水渗湿、健脾、宁心的功效[5]。研究表明,茯苓总三萜、茯苓多糖等茯苓中的不同部位均有较好的健脾作用[6]。罗心遥[7]研究发现,茯苓水提液可以通过上调脾虚大鼠血清中的总蛋白(total protein,TP)、胃动素(motilin,MTL)、胃泌素(gastrin,GAS)水平,下调血管活性肠肽(vasoactive intestinal peptide,VIP)、胃组织5-羟色胺(5-hydroxytryptamine,5-HT)水平,保护脾虚造成的大鼠胃肠损伤。张丹丹等[8]通过代谢组学与肠道菌群相结合的技术探讨茯苓水提液的健脾机制,结果表明,其可能与茯苓水提液能够调节脾虚大鼠的肠道菌群,调控精氨酸(arginine,Arg)-脯氨酸(proline,Pro)代谢、烟酸(nicotinic acid,NA)-烟酰胺(nicotinamide,NIC)代谢通路有关。黄酒味苦、甘、辛,具有补益、除湿等功效,能够作为药引用于寒湿攻脾所至胃肠不适的治疗[9]。茯苓入酒的历史悠久,《太平圣惠方》、《饮膳正要》、《本草纲目》等医学典籍中均有茯苓酒的记载。进入现代,茯苓酒也是茯苓产品研发的热点,多种茯苓酒类产品不断涌出,如薏米茯苓酒[10]、茯苓糯米酒[11]、茯苓菌丝发酵酒[12]等,然而目前研究集中于发酵工艺的优化和功能性成分的测定,尚缺少茯苓酒药效作用的研究报道。
本研究将无特定病原体动物(specificpathogenfree,SPF)级SD大鼠分为对照组和模型组,采用饮食不节、疲倦过度、苦寒泻下三因素建立大鼠脾阳虚模型,将造模成功的大鼠分为模型组、茯苓浸渍酒组及传统茯苓酒低、中、高剂量组,比较大鼠体质量、肛温,并进行一般行为学观察,考察血清中D-木糖、胃泌素(GAS)含量、白介素-6(interleukin-6,IL-6)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、干扰素-γ(interferon-γ,IFN-γ)、碱性磷酸酶(alkaline phosphatase,ALP)和丙氨酸转氨酶(alanine aminotransferase,ALT)水平及脾脏病理变化。探讨传统茯苓酒对脾阳虚大鼠的健脾作用,旨在丰富保健药酒种类,提高茯苓附加值,开发健脾和胃产品,为药食同源中药茯苓的开发和利用拓宽思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黍米:十月稻田农业科技有限公司;茯苓:青岛天成中药饮片有限公司;黄酒酵母:安琪酵母股份有限公司;大黄:青岛天成中药饮片有限公司;42%vol蒸馏白酒:北京红星股份有限公司。
8周龄无特定病原体(specific pathogen free,SPF)级SD雄性大鼠50只,体质量180~220 g,由济南朋悦实验动物繁育有限公司提供,实验动物生产许可证号:SCXK(鲁)20190003;由山东中医药大学动物实验中心常规饲养,许可证:SYAK(鲁)20170022,饲养条件为温度20~26 ℃,湿度40%~70%,昼夜交替。
1.1.2 试剂
水合氯醛:国药集团化学试剂有限公司;D-木糖试剂盒:南京建成生物工程研究所;大鼠胃泌素(GAS)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒:江苏晶美生物科技有限公司;大鼠白介素-6(IL-6)、单核细胞趋化蛋白-1(MCP-1)、干扰素-γ(INF-γ)酶联免疫吸附测定(ELISA)试剂盒:上海酶联生物科技有限公司;碱性磷酸酶(ALP)检测试剂盒、丙氨酸转氨酶(ALT)检测试剂盒:山东博科生物产业有限公司;多聚甲醛固定液:武汉塞维尔生物科技有限公司。
1.2 仪器与设备
Specctra Max M5酶标仪:美国Molecular Devices公司;YP6001N电子天平:上海舜宇恒平科学仪器有限公司;DW-86L626医用低温保存箱:青岛海尔生物医疗股份有限公司;BK-280全自动生化分析仪:山东博科生物产业有限公司;CR21N高速冷冻离心机:德国Eppendorf公司;FT3400动物体温计:南京卡尔文生物科技有限公司;DK-S16电热恒温水浴锅:中仪国科(北京)科技有限公司;UV-2700紫外-可见分光光度计:日本岛津实验器材有限公司;PANNORAMIC DESK全景切片扫描仪:匈牙利3DHISTECH公司。
1.3 方法
1.3.1 传统茯苓酒的加工工艺流程及操作要点[13]

操作要点:
原料的筛选:筛选出颗粒饱满、大小均匀、颜色鲜黄的黍米和经专业人员鉴定为正品的茯苓药材。
原料的预处理:用中药材粉碎机将茯苓粉碎为粗粉(全部通过24目筛,混有通过65目筛的粉末不超过40%),获得茯苓粗粉,待用。黍米经清洗后,于室温条件下浸泡24 h。浸渍完毕的黍米缓慢加入100 ℃热水烫至60 ℃,此时搅拌1次,10 min后再搅拌1次,放置摊晾,待温度降至40 ℃后加清水至浸没黍米,继续浸渍24 h。
煮糜:锅中加入原料2倍质量的清水,加热煮沸,将经过预处理的1 000 g黍米与150 g茯苓粗粉于锅中加热煮糜,先武火加热约10 min至锅内黍米吸水变粘,后改为文火加热约1 h至黍米中的淀粉彻底糊化、产生独特的焦香味[14]。
糖化:煮糜完毕后,摊晾至60 ℃,加入原料质量8%的麦曲,继续于60 ℃糖化40 min。
发酵:糖化完毕后,糖化液冷水浴降温至28 ℃,加入原料质量0.2%的活化酵母(黄酒酵母加入至10倍质量的2%葡萄糖溶液中,于35 ℃保持30 min活化),搅拌均匀后装坛发酵7 d。
离心、过滤:发酵完成的醪液4 000 r/min离心20 min,取上清液过滤,得滤液。
杀菌:杀菌又称煎酒,是制备传统茯苓酒的最后一道工序,将滤液于80 ℃中灭菌30 min,即得到传统茯苓酒成品。
1.3.2 茯苓浸渍酒的制备
按传统茯苓酒成品酒中茯苓占比(茯苓和黍米的比例为1.5∶10),将150 g茯苓粗粉于1 000 mL 42%vol蒸馏白酒中浸渍7 d得茯苓浸渍酒。
1.3.3 大黄水煎液的制备
称取适量大黄饮片于圆底烧瓶中,加8倍质量水浸泡30 min,100 ℃加热煮沸30 min,纱布过滤,药液另器保存,药渣继续加4倍质量水煎煮20 min,纱布过滤,合并两次大黄煎煮液,加热浓缩至其质量浓度为1 g/mL。
1.3.4 分组、造模及给药
分组、造模:50只适应性饲养1周的雄性SD大鼠按体质量随机分为2组,对照组6只,剩余44只为脾阳虚造模组。采用饮食不节、苦寒泻下、疲倦过度三因素相结合的方法建立大鼠脾阳虚模型[15-16]。造模过程中,大鼠单日禁食,双日给粮,自由饮水。同时造模大鼠每日上午按10 mL/kg灌胃大黄水煎液,下午置于(55×40×33)cm3的塑料箱中负重游泳至力竭(即大鼠四肢明显失调,鼻尖没入水下5 s,连续3次),每日造模持续15 d。造模完成后,将脾阳虚模型复制成功的大鼠根据体质量分为5组:模型组、茯苓浸渍酒组、传统茯苓酒低、中、高剂量组。
给药:根据2022版《中国居民膳食指南》中建议的成年人每日酒精摄入量不应超过15 g,成人以60 kg计,设定成人每日饮用传统茯苓酒100 mL为宜[17]。动物分组后,设传统茯苓酒低、中、高剂量组分别为5 mL/kg体质量、10 mL/kg体质量和20 mL/kg体质量(分别相当于人体推荐摄入量的3倍、6倍、12倍),由于大鼠最大灌胃量不宜超过10 mL/kg体质量,为达到最佳灌胃效果,将传统茯苓酒经旋转蒸发仪浓缩2.5倍后,再用酒基调制成原浓度(最终酒精度均为12%vol),即分别按浓缩后的2 mL/kg体质量、4 mL/kg体质量和8 mL/kg体质量灌胃;茯苓浸渍酒组浓缩相同倍数后用酒基调制回原浓度(最终酒精度为42%vol),并按浓缩后的8 mL/kg体质量灌胃;对照组与模型组均按8 mL/kg体质量灌胃蒸馏水。给药过程中除对照组外,其余大鼠上午继续按10 mL/kg体质量灌胃大黄水煎液,隔日1次,连续21 d,对照组给予等体积蒸馏水。
1.3.5 大鼠体质量、肛温及行为学观察
观察模型建立前后大鼠体质量与肛温变化,观察大鼠的一般体征以及药物干预过程中各组大鼠体质量变化(每3 d记录一次大鼠体质量),观察每只大鼠的精神状态、运动状况、毛发光泽、大便形状等体征[18]。
1.3.6 样品采集
给药第21天后各组大鼠禁食不禁水12 h。次日早上称每组大鼠体质量,并按10 mL/kg灌胃5%D-木糖溶液。灌胃1 h后,用水合氯醛麻醉大鼠,腹主动脉取血,室温静置后,3 000 r/min、4 ℃离心15 min,分离血清存于-80 ℃冰箱备用。
1.3.7 血清中相关生化指标测定
采用比色法,参照试剂盒说明书上操作步骤测定大鼠血清中D-木糖水平。采用ELISA法,分别参照试剂盒说明书上操作步骤测定大鼠血清中GAS、IFN-γ、IL6、MCP-1水平。采用全自动生化分析仪检测大鼠血清中ALP、ALT水平。
1.3.8 脾脏组织病理学观察
取大鼠相同部位的脾脏组织于4%多聚甲醛中固定48 h,石蜡包埋,切片并进行苏木精-伊红染色法(hematoxylineosin staining,HE)染色,观察大鼠脾脏组织。
1.3.9 统计学方法
使用Graphpad Prism 9.0软件进行统计学分析。结果以“平均值±标准差”表示,P<0.05或P<0.01有统计学意义,多组间比较采用单因素方差分析。
2 结果与分析
2.1 大鼠造模前后体质量、肛温及行为学考察
大鼠造模前后体质量及肛温检测结果见表1。由表1可知,对照组大鼠的体质量较造模前增加35.00%,造模组大鼠的体质量较造模前下降26.21%,造模后两组大鼠的体质量差异具备统计学意义(P<0.05)。对照组大鼠的肛温造模前后变化不明显,均稳定在37.50 ℃左右,造模组大鼠的肛温较造模前下降6.31%,造模后两组大鼠的肛温差异显著(P<0.05)。在行为学考察中,对照组大鼠反应灵敏,毛发顺滑,饮食正常,精神状态良好,造模组大鼠出现双眼无神,消瘦懒动,毛发稀疏,弓背眯眼,尾巴细瘦,大便溏泄等症状[19]。综上,表明脾阳虚大鼠模型建立成功。
表1 大鼠造模前后体质量检测结果
Table 1 Detection results of body mass of rats before and after modeling
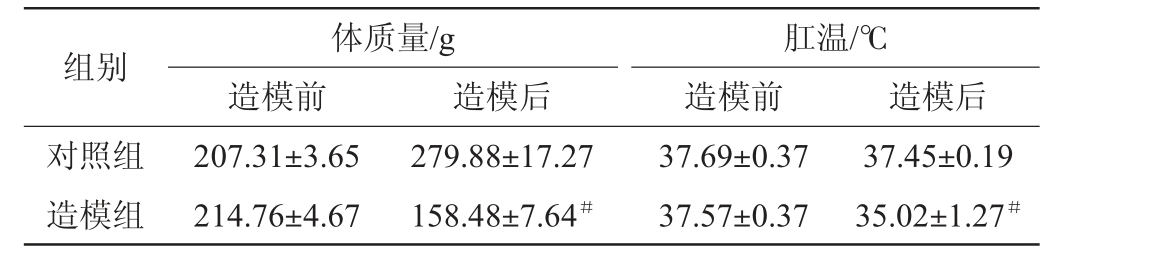
注:“#”表示同行比较差异显著(P<0.05)。下同。
组别对照组造模组体质量/g造模前造模后207.31±3.65 214.76±4.67肛温/℃造模前 造模后279.88±17.27 158.48±7.64#37.69±0.37 37.57±0.37 37.45±0.19 35.02±1.27#
2.2 给药过程中各组大鼠体质量变化
将造模完成的脾阳虚大鼠按体质量分组后进行给药,给药过程中各组大鼠体质量变化见图1。
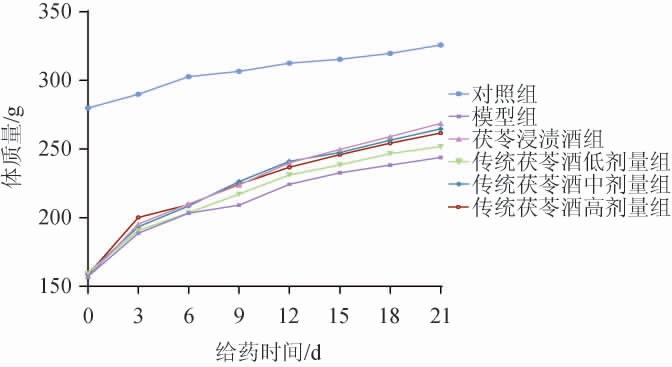
图1 给药过程中各组大鼠体质量变化
Fig.1 Changes of body mass of rats in each group during administration
由图1可知,药物干预后,各组大鼠精神状态有所好转,随着给药时间的延长,各组大鼠毛发干枯、扎堆蜷缩、大便溏稀等症状减轻,灵敏度及活动度趋向正常。给药过程中,模型组大鼠体质量增长较慢。与模型组相比,末次给药时传统茯苓酒中、高剂量组与茯苓浸渍酒组体质量分别增长8.56%、7.29%、10.16%。但茯苓浸渍酒组大鼠随体质量的增加,体态逐渐臃肿,以颈部和腹部最为明显,且偶见后腿肿胀现象,猜测与长期摄入大量酒精,致五脏阳以竭,使蒸化阴液受阻,水邪充斥肌肤引发水肿有关[20],而传统茯苓酒组大鼠体型正常。
2.3 大鼠血清中D-木糖及GAS含量检测结果
D-木糖经口服进入机体后,由小肠吸收入血,是反映肠道吸收能力的重要指标。研究表明,多数脾虚证患者D-木糖吸收率明显降低[21]。GAS是一种可以刺激胃酸及胃蛋白酶分泌的肠道激素,其分泌失调会引发胃肠道功能紊乱[22],目前学术界对GAS含量与脾虚证的关系研究存在一定争议,有学者认为,脾虚证大鼠血清GAS水平有所降低[23];亦有学者认为慢性胃炎属脾阳虚证会造成GAS分泌增多[24]。大鼠血清中D-木糖及GAS含量的检测结果见表2。
表2 大鼠消化吸收功能指标检测结果
Table 2 Detection results of digestion and absorption function indexes of rats
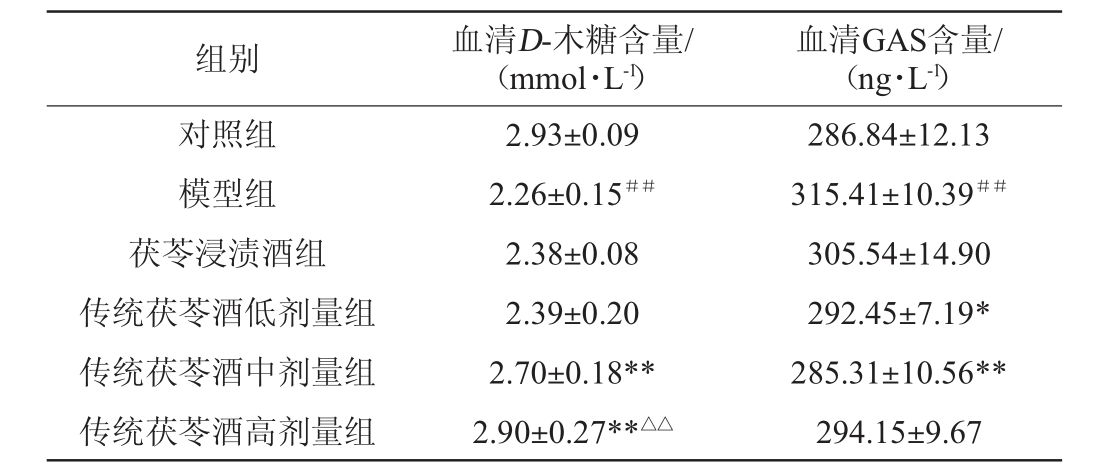
注:“#”表示与对照组比较差异显著(P<0.05),“##”表示与对照组比较差异极显著(P<0.01);“*”表示与模型组比较差异显著(P<0.05),“**”表示与模型组比较差异极显著(P<0.01);“△”表示与茯苓浸渍酒组比较差异显著(P<0.05),“△△”表示与茯苓浸渍酒组比较差异极显著(P<0.01)。下同。
组别 血清D-木糖含量/(mmol·L-1)血清GAS含量/(ng·L-1)对照组模型组茯苓浸渍酒组传统茯苓酒低剂量组传统茯苓酒中剂量组传统茯苓酒高剂量组2.93±0.09 2.26±0.15##2.38±0.08 2.39±0.20 2.70±0.18**2.90±0.27**△△286.84±12.13 315.41±10.39##305.54±14.90 292.45±7.19*285.31±10.56**294.15±9.67
由表2可知,大鼠口服D-木糖溶液1 h后,与对照组相比,模型组大鼠血清D-木糖含量极显著降低(P<0.01),血清GAS含量极显著升高(P<0.01),表明模型组大鼠胃肠消化功能受损。与模型组相比,传统茯苓酒中、高剂量组血清D-木糖含量分别极显著升高19.47%、28.32%(P<0.01)。传统茯苓酒低、中剂量组血清GAS含量分别显著降低7.28%(P<0.05)、极显著降低9.54%(P<0.01)。表明饮用不同剂量的传统茯苓酒能够不同程度改善脾阳虚导致的胃肠功能紊乱,提高机体消化吸收能力。
2.4 大鼠血清中IL-6、MCP-1、IFN-γ含量检测结果
脾脏是人体最大的免疫器官,脾阳虚会造成机体免疫功能紊乱。IL-6是由Th2分泌的一种多功能细胞因子,具有免疫监视的功能,当疾病发生时其能活化浆细胞,引发炎症反应[25]。IFN-γ为Th1细胞分泌的一种特征性细胞因子,用于介导细胞免疫[26]。MCP-1是趋化性细胞因子亚家族成员之一,Th1/Th2失衡会引起的MCP-1表达异常[27]。大鼠血清中IL-6、MCP-1、IFN-γ含量检测结果见表3。
表3 大鼠血清中IL-6、MCP-1及IFN-γ含量检测结果
Table 3 Detection results of IL-6、MCP-1, and IFN-γ contents in serum of rats
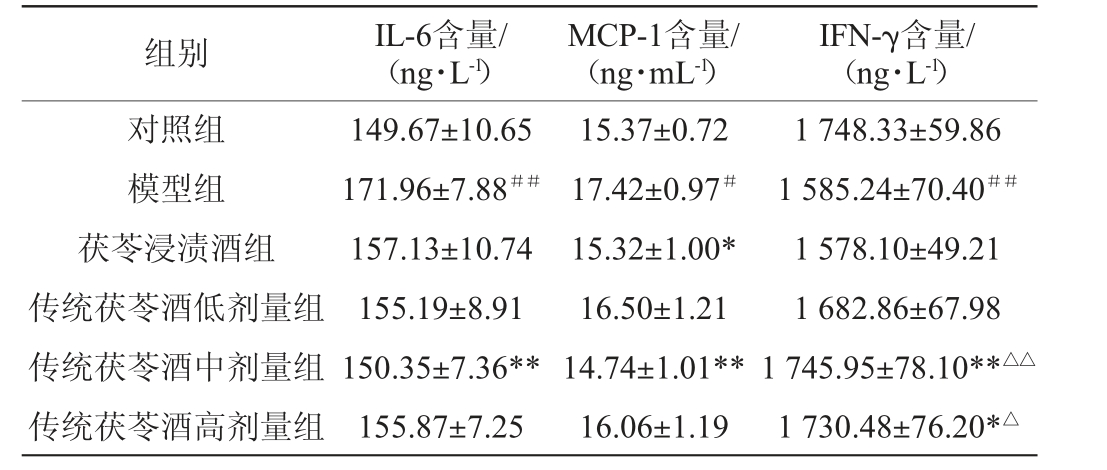
组别 IL-6含量/(ng·L-1)MCP-1含量/(ng·mL-1)IFN-γ含量/(ng·L-1)对照组模型组茯苓浸渍酒组传统茯苓酒低剂量组传统茯苓酒中剂量组传统茯苓酒高剂量组149.67±10.65 171.96±7.88##157.13±10.74 155.19±8.91 150.35±7.36**155.87±7.25 15.37±0.72 17.42±0.97#15.32±1.00*16.50±1.21 14.74±1.01**16.06±1.19 1 748.33±59.86 1 585.24±70.40##1 578.10±49.21 1 682.86±67.98 1 745.95±78.10**△△1 730.48±76.20*△
由表3可知,与对照组相比,模型组大鼠血清IL-6、MCP-1含量分别极显著(P<0.01)、显著升高(P<0.05)、IFN-γ含量极显著降低(P<0.01),表明模型组大鼠免疫功能失调。与模型组相比,传统茯苓酒中剂量组大鼠血清IL-6含量极显著降低12.57%(P<0.01),茯苓浸渍酒组与传统茯苓酒中剂量组MCP-1含量分别显著降低12.06%(P<0.05)、极显著降低15.38%(P<0.01),传统茯苓酒中、高剂量组IFN-γ含量分别极显著升高10.14%(P<0.01)、显著升高9.16%(P<0.05)。与茯苓浸渍酒组相比,传统茯苓酒组大鼠血清中IL-6及MCP-1含量差异不显著,传统茯苓酒中、高剂量组大鼠血清中IFN-γ含量分别极显著增加10.64%(P<0.01)、显著增加9.66%(P<0.05),可见茯苓浸渍酒虽能在一定程度上缓解脾阳虚造成的免疫紊乱,但疗效不及传统茯苓酒。综合来看,中剂量传统茯苓酒对维持机体内环境稳定有保护作用。
2.5 大鼠血清中ALP、ALT含量检测结果
国家药典规定国药准字药酒为蒸馏酒提取制成的澄清液体制剂[28],但高度蒸馏酒导致的安全性问题却严重制约着其在临床的应用。过量饮酒后,酒精及其中间代谢物进入机体,80%~90%在肝内代谢,会导致肝细胞脂质过氧化,改变细胞膜的通透性,影响肝脏微循环,造成肝细胞的变性坏死[29],因此检测药酒是否会导致肝脏毒性也是评价其临床安全的重要指标。大鼠血清中ALP、ALT含量检测结果见表4。
表4 大鼠血清中碱性磷酸酶(ALP)、丙氨酸转氨酶(ALT)含量检测结果
Table 4 Detection results of alkaline phosphatase (ALP) and alanine aminotransferase (ALT) contents in serum of rats
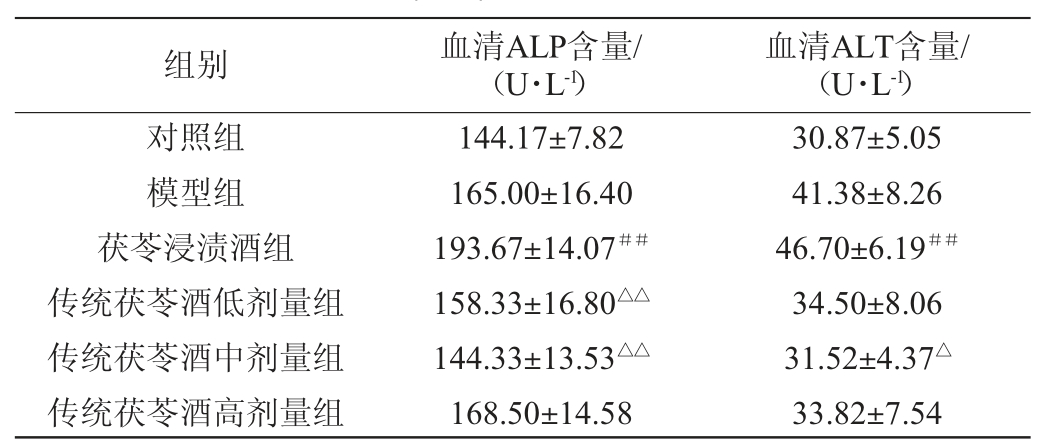
组别 血清ALP含量/(U·L-1)血清ALT含量/(U·L-1)对照组模型组茯苓浸渍酒组传统茯苓酒低剂量组传统茯苓酒中剂量组传统茯苓酒高剂量组144.17±7.82 165.00±16.40 193.67±14.07##158.33±16.80△△144.33±13.53△△168.50±14.58 30.87±5.05 41.38±8.26 46.70±6.19##34.50±8.06 31.52±4.37△33.82±7.54
血清ALP、ALT异常表达是肝脏损伤的早期标志[30]。由表4可知,与对照组相比,模型组大鼠血清ALP、ALT水平有所升高,虽然不具备统计学差异,但也从侧面证明了“内伤脾胃,百病由生”的观点;茯苓浸渍酒组大鼠血清ALP、ALT水平分别极显著增加34.33%、51.28%(P<0.01),表明由高度蒸馏酒制得的茯苓浸渍酒有明显的肝脏毒性。与茯苓浸渍酒组相比,传统茯苓酒低、中剂量组大鼠血清ALP含量分别极显著降低18.25%、25.48%(P<0.01),传统茯苓酒中剂量组血清ALT含量显著降低32.51%(P<0.05),说明传统茯苓酒对肝脏损伤较小。已有研究表明,茯苓多糖具有较好的保肝作用,能够抑制细胞色素P450 2E1(cytochrome P450 2E1,CYP2E1)/活性氧(reactive oxygen species,ROS)/丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路诱导的肝细胞凋亡和Toll样受体4(tolllike receptor 4,TLR4)/核转录因子κB(nuclear factors-κB,NF-κB)信号通路诱导的肝脏炎症,显著改善酒精性肝损伤[31]。因此,猜测传统茯苓酒较低的肝脏毒性,除了其为低醇制剂这个因素外,可能也与茯苓多糖的保肝作用有关。
2.6 大鼠脾脏组织病理学观察
大鼠的脾脏组织病理学观察结果见图2。由图2可知,对照组大鼠脾脏切片白髓结构清晰,数量丰富,红髓与白髓分界清楚。与对照组相比,模型组大鼠脾脏组织可见大量的白髓萎缩,体积减小,白髓内淋巴细胞数量减少,排列疏松,红髓与白髓分界模糊。茯苓浸渍酒组大鼠脾脏组织白髓结构清晰,淋巴细胞排列趋于紧密,但生发中心数目少于传统茯苓酒组。传统茯苓酒低剂量组大鼠脾脏组织白髓结构趋向清晰,淋巴细胞数量有所增加,但红髓和白髓界限较模糊。传统茯苓酒中、高剂量组大鼠脾脏组织中红髓和白髓界限更明确,淋巴细胞增多且排列紧密有序,接近于对照组。说明传统茯苓酒能够显著提升脾阳虚大鼠的脾脏恢复能力。
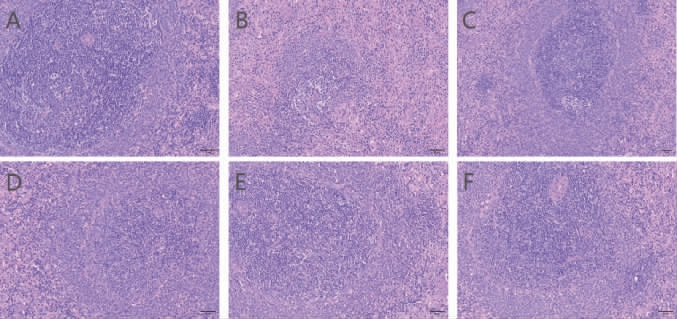
图2 大鼠脾脏组织病理学观察结果(×200)
Fig.2 Histopathological observation results of spleen in rats(×200)
A:对照组;B:模型组;C:茯苓浸渍酒组;D:传统茯苓酒低剂量组;E:传统茯苓酒中剂量组;F:传统茯苓酒高剂量组。
3 结论
本研究表明,传统茯苓酒中剂量能够促进脾阳虚大鼠体质量增长,改善脾脏病变程度,极显著升高脾阳虚大鼠血清D-木糖含量(P<0.01)和血清IFN-γ含量(P<0.01),极显著降低大鼠血清GAS、IL-6和MCP-1含量(P<0.01)。与茯苓浸渍酒组相比,传统茯苓酒中剂量组大鼠血清中ALP和ALT含量分别极显著降低25.48%(P<0.01)、显著降低32.51%(P<0.05),说明适量的传统茯苓酒饮用安全,能改善脾阳虚造成的胃肠道紊乱,调节机体免疫。
[1]马天驰,王彩霞,于漫.论《景岳全书》调脾胃养生思想[J].中华中医药学刊,2016,34(6):1313-1316.
[2]孙伟越,袁琛皓,董广通,等.脾阳虚动物模型的生物学标志研究[J].中国药房,2014,25(47):4502-4503.
[3]温桂花,李艳,范玲玲,等.中国药典药酒方中的药用植物[J].中药材,2020,43(11):2657-2662.
[4]刘志萍,辛宁,于长江,等.中药药酒的控制技术及临床应用研究进展[J].中国民族民间医药,2015,24(19):19-21.
[5]国家药典委员会.中华人民共和国药典.一部[M].北京:中国医药科技出版社,2020:251.
[6]涂仪军.茯苓不同提取部位健脾药效作用及机制研究[D].武汉:湖北中医药大学,2020.
[7]罗心遥.基于谱效关系的茯苓健脾药效物质基础研究[D].武汉:湖北中医药大学,2020.
[8]张丹丹,叶晓川.基于肠道菌群和代谢组学探讨茯苓水提物健脾的作用机制[J].中华中医药杂志,2021,36(7):3994-4001.
[9]胡超凡,阮晖,金建江,等.黄酒健康功效及相关生物活性物质研究进展[J].中国酿造,2021,40(7):7-11.
[10]杨祖滔,吴天祥,汤庆莉,等.薏米茯苓黄酒中功能性成分的测定[J].酿酒科技,2017(12):122-129.
[11]曹敬华,史路路,蔡凤娇,等.茯苓养生黄酒酿造工艺研究[J].酿酒,2014,41(3):68-72.
[12]宋桂庆.干型半干型茯苓酒发酵工艺研究及相关检测[D].保定:河北大学,2008.
[13]侯林,王晓晴,周芹芹.一种茯苓醪酒制备工艺:CN202211217881.3[P].2022-12-27.
[14]胡普信,寿泉洪,孟中法,等.黄酒工艺技术[M].北京:中国轻工业出版社,2014:83.
[15]牛江涛,曹瑞,边甜甜,等.红芪与炙红芪补中益气作用对比及成分差异分析[J].中草药,2019,50(13):3107-3112.
[16]游宇,罗林,陈哲杰,等.生脉饮多糖提取工艺优化及对脾虚模型大鼠肠道功能调节作用的研究[J].中国药房,2019,30(4):493-498.
[17]秦文,王丽媛,杨倬,等.黄酒对高脂血症模型大鼠血脂及肠道菌群的影响[J].中国酿造,2019,38(4):65-69.
[18]周静,王静,孙宝国,等.糯米对脾虚证模型大鼠的影响[J].食品工业科技,2013,34(6):360-362,400.
[19]孙伟越,袁琛皓,董广通,等.脾阳虚动物模型的生物学标志研究[J].中国药房,2014,25(47):4502-4503.
[20]吴振.浅论“酒伤”发病规律[J].山东中医药大学学报,2015,39(5):408-409.
[21]张育贵,张淑娟,牛江涛,等.炙黄芪和炙红芪干预脾气虚大鼠的药效比较研究[J].中国中药杂志,2021,46(21):5641-5649.
[22]ZENG Q,OU L,WANG W,et al.Gastrin,cholecystokinin,signaling,and biological activities in cellular processes[J].Front Endocrinol, 2020,11:112.
[23]刘梅洁,李鸿泓,赵宏艳,等.脾虚、肾虚及脾肾两虚证大鼠外周血中OPG、RANKL、VIP、MTL及GAS不同表达特点[J].中华中医药杂志,2015,30(10):3466-3469.
[24]胡琳琳,高云芳,何志仙.三种脾虚证模型小鼠消化吸收功能改变的比较研究[J].中国中西医结合杂志,2005(9):813-816.
[25]CHEN Y F,ZHANG J J,QU C,et al. Inonotus obliquus polysaccharide ameliorates dextran sulphate sodium induced colitis involving modulation of Th1/Th2 and Th17/Treg balance[J].Artif Cell, Nanomed B,2019,47(1):757-766.
[26]UYEDA M J,FREEBORN R A,CIENIEWICZ B,et al.BHLHE40 regulates IL-10 and IFN-γ production in T cells but does not interfere with human type 1 regulatory T cell differentiation[J].Front Immunol,2021,12:683680.
[27]杨攀玉,曲婷,曾莉,等.外周血TBNK淋巴细胞亚群和血清Th1/Th2细胞因子与不明原因复发性流产的相关性研究[J].中国免疫学杂志,2021,37(6):729-736.
[28]罗兴洪.药酒的历史沿革与发展现状[J].中国食品药品监管,2018(5):73-80.
[29]PATEL R.Wilson disease:a diagnostic challenge in a patient with alcoholic liver disease[J].BMJ Case Reports,2019,12(10):e232449.
[30]宋培放,潘秋莎,杨凌.药物性肝损伤生物标志物[J].世界中医药,2020,15(23):3553-3560.
[31] JIANG Y H, WANG L, CHEN W D, et al. Poria cocos polysaccharide prevents alcohol-induced hepatic injury and inflammation by repressing oxidative stress and gut leakiness[J].Front Nutr,2022,9:963598.