金黄色葡萄球菌(Staphylococcus aureus),隶属于葡萄球菌属(Staphylococcus),普遍存在于空气、食物、污水等环境中[1]。金黄色葡萄球菌及其肠毒素是造成细菌性食物中毒的最常见原因之一,在动物养殖、食品生产加工和食品监管方面均存在隐患。因此,快速准确地检测金黄色葡萄球菌是确保食品安全和保护人类免受食源性疾病侵害的关键因素。基于传统培养的检测方法是食源性致病菌检测的金标准,但费时又费力。聚合酶链式反应(polymerase chain reaction,PCR)是基于核酸键比对的检测技术,提高了灵敏度和特异性,但PCR需要热循环扩增仪器和复杂的扩增程序,无法满足现场快速检测的需求。核酸等温扩增技术是PCR的替代方案,等温扩增是一种使用简单的温度控制器扩增核苷酸链的技术,允许核酸扩增在单一的恒定温度下进行,无需热循环仪,具有检测效率高,检测速度快,设备简单等优势,在现场快速检测方面的适用性高,可有效应用于食源性致病菌的检测[2-3]。
目前,检测金黄色葡萄球菌的核酸等温扩增检测技术有环介导等温扩增(loop mediated isothermal amplification,LAMP)、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)、重组酶介导扩增(recombinase aided amplification,RAA)、滚环扩增(rolling circle amplification,RCA)等。此外,国家也发布了金黄色葡萄球菌等温扩增检测的标准,如SN/T 2754.1—2011《出口食品中致病菌环介导恒温扩增(LAMP)检测方法第1部分:金黄色葡萄球菌》[4]等。金黄色葡萄球菌现场快速检测技术仍存在灵敏度低、检测时间长等问题,无法满足食品安全监督管理和食品产品质量控制的需要。
因此,为了适应食品安全监管的新形势,提升食品安全监管的技术水平,本文阐述了常见的核酸等温扩增技术中的环介导等温扩增(LAMP)、滚环扩增(RCA)、重组酶聚合酶扩增(RPA)、重组酶介导扩增(RAA)的原理及优缺点,主要阐述了核酸等温扩增技术技术在金黄色葡萄球菌检测上的应用,并总结了其目标产物检测技术,以期为金黄色葡萄球菌等温扩增快速检测技术开发提供理论支持。
1 核酸等温扩增技术的原理及优缺点
1.1 核酸等温扩增技术的原理
LAMP是一种通过使用具有高置换链活性的脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶和一组专门设计的引物扩增目标DNA链的分子生物学检测方法。首先,将正向内引物(forward inner primer,FIP)杂交到靶DNA的F2c区域,并合成互补链,接下来,在外引物F3杂交到F3c区后开始链置换。然后释放互补链并用作向后内引物。接下来,将后向内引物(backward inward primer,BIP)杂交,并开始链合成。随后,使用B3引物完全合成互补的DNA链,并产生哑铃形或茎环DNA用于LAMP循环扩增[5]。
RCA是一种等温扩增反应,由在37 ℃下具有链置换活性的DNA聚合酶催化完成。独特的寡核苷酸挂锁探针(padlock probe,PLP)与靶序列杂交,在DNA连接酶作用下合成环状模板。特异引物与环状模板对齐后,在DNA聚合酶的作用沿环延伸,并且先前生成的延伸链不断被替换。最终产生数百至数千个重复的长单链DNA产物,包括单引物扩增RCA(single-primer RCA)、多引物扩增RCA(multiple-primer RCA)和指数扩增RCA(exponential RCA)[6-7]。另外,在RCA基础上开发了一种跨越式滚环扩增(saltatory rolling circle amplification,SRCA),实现了非闭环DNA模板扩增,且无需形成环状结构[8]。
RPA是由加载因子(T4 UvsY)、重组酶(T4 UvsX)、聚合酶(Bsu)和单链结合蛋白(T4 gp32)以及两条特异性的上下游引物参与的一种等温扩增反应。首先,T4 UvsX重组酶在T4 UvsY蛋白的帮助下与寡核苷酸引物结合,形成重组酶-引物复合物,然后这些复合物与目标dsDNA的同源序列杂交,并在同源位点启动链侵袭。解链的DNA链通过单链结合蛋白(T4 gp32)稳定,具有链置换活性的DNA聚合酶(Bsu)结合到引物的3'端,并且在脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)存在下进行引物延伸,并实现DNA产物的指数放大[9],RPA已由TwistDx商业化[10]。
RAA与RPA具有相似的原理,区别是其重组酶UvsX来自于大肠杆菌(Escherichia coli),而RPA是噬菌体重组酶。RAA是由江苏奇天公司研发,并进行了商业化生产[11]。
1.2 不同核酸等温扩增技术的比较及优缺点
核酸等温扩增的显著优势是能够使用简单的热控制仪器扩增核酸,且操作简单,不需要专业的人员即可操作[12]。不同核酸等温扩增技术的比较见表1。
表1 不同核酸等温扩增技术的比较
Table 1 Comparison of different nucleic acid isothermal amplification technology

类型 LAMP RCA RPA RAA扩增前处理扩增类型扩增温度/℃聚合酶目标基因长度引物数量总反应时间/min扩增后步骤靶标dsDNA需95 ℃解链指数扩增60~65 BstDNA聚合酶<300 bp 4~6<60 80 ℃加热靶标dsDNA需95 ℃解链;在37~95 ℃下PLP和靶基因连接线性和指数扩增37~65 phi29 DNA聚合酶<1 700 bp 1~2引物和PLP<150 60 ℃加热/指数扩增37~40 Bsu DNA聚合酶<500 bp 2 20~40//指数扩增37~40 Bsu DNA聚合酶<500 bp 2 20~40/
由表1可知,4种核酸等温扩增技术的反应温度范围为37~65 ℃,越高的温度对设备的要求就越高,RPA和RAA的反应温度为37~40 ℃,更接近室温环境。除此之外,LAMP和RCA扩增反应前还需要95 ℃的条件进行双链DNA(double strand DNA,dsDNA)解链为单链DNA(single strand DNA,ssDNA),且在扩增反应的最后还需80 ℃和60 ℃条件下扩增以提高检测的灵敏度。而RPA和RAA可以直接作用于dsDNA,不需要额外的加热步骤[7]。对于扩增类型而言,4种等温扩增技术都可实现指数扩增。对于聚合酶而言,3种DNA聚合酶都具有链置换活性和5'→3'聚合酶活性,而phi29 DNA聚合酶可连续合成长片段的DNA,RAA采用的来源于细菌和真菌的DNA聚合酶相较于RPA具有更高的活性[13]。对于反应时间而言,RPA和RAA的反应时间最短,可实现靶基因的快速检测,有利于开发食源性致病菌的快速检测。对于目标基因长度,RCA能够扩增的片段最长。对于引物数量而言,LAMP需要4~6个引物,引物设计复杂,容易引起非特异性扩增。
LAMP具有出色的特异性和扩增速率,但其主要缺点是靶DNA长度的限制和扩增子的复杂结构。LAMP的最佳靶标长度<300 bps,因此设计引物时不建议扩增>500 bps的靶DNA[14]。RPA的主要缺点是设计引物的难度很高,由于RPA在相对较低的温度下工作,因此较长的引物形成的二级结构不会变性,但这可能导致扩增失败,因此建议使用30~45个碱基对范围内的引物[15]。RPA的第二个缺点是它对目标序列选择的限制。尽管RPA能够扩增高达1.5 kb的长序列,但它更适合80~400 bps的短序列,最好为100~200 bps[16],另外RPA和RAA还支持多重扩增反应,适合开发多种食源性致病菌的同时检测[17]。RCA由于使用PLP扩增线性靶标DNA会导致测定的特异性更高,且存在非特异性扩增和引物设计的复杂问题[3]。此外,RAA试剂的成本要较RPA的试剂成本低,也是开发金黄色葡萄球菌的快速检测技术的一大优势。
2 核酸等温扩增技术技术在金黄色葡萄球菌检测上的应用
采用核酸等温扩增技术检测金黄色葡萄球菌的流程如下:
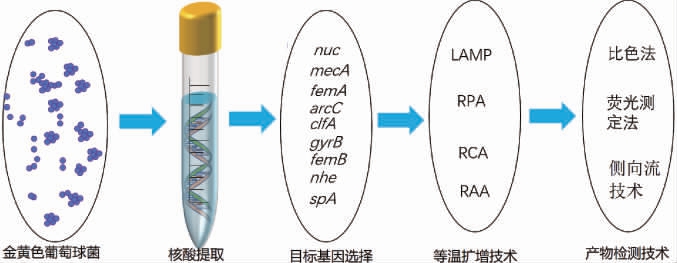
2.1 金黄色葡萄球菌核酸等温扩增检测限
核酸等温扩增技术在金黄色葡萄球菌检测上得到广泛应用,基于等温扩增技术检测金黄色葡萄球菌的相关研究进展见表2。
表2 核酸等温扩增技术在金黄色葡萄球菌检测上的应用
Table 2 Application of nucleic acid isothermal amplification technology in Staphylococcus aureus detection
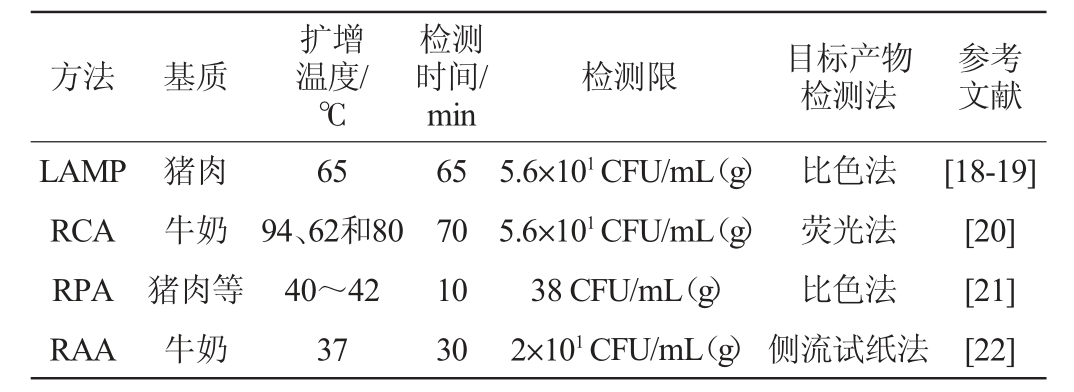
注:检测限基于金黄色葡萄球菌细胞浓度。
方法 基质扩增温度/℃检测时间/min检测限 目标产物检测法参考文献LAMP RCA RPA RAA猪肉牛奶猪肉等牛奶65 94、62和80 40~42 37 65 70 10 30 5.6×101 CFU/mL(g)5.6×101 CFU/mL(g)38 CFU/mL(g)2×101 CFU/mL(g)比色法荧光法比色法侧流试纸法[18-19][20][21][22]
由表2可知,灵敏度越高,能从样品检测到金黄色葡萄球菌的可能性就越高;检测限越低,越能真实反应样品中污染的金黄色葡萄球菌。LAMP、RCA、RPA和RAA的检测灵敏度均能达到100 CFU/mL(g),但SOWMYA N等[23]建立的金黄色葡萄球菌LAMP方法,只能检测牛奶、甘蔗汁和米饭中低至100 CFU/mL(g)的金黄色葡萄球菌,SHEET O H等[24]开发的基于基因nuc的LAMP检测方法,仅能检测牛奶中低至9×102 CFU/mL的金黄色葡萄球菌,HASSAN M等[25]开发了基于femA和arcC基因检测金黄色葡萄球菌的LAMP方法,可检测到食品中100 CFU/mL(g)的金黄色葡萄球菌。WANG Y T等[26]建立了免疫磁分离-RCA检测金黄色葡萄球菌的方法,可检测果汁中低至3.3×102 CFU/mL的金黄色葡萄球菌。LI Y N等[27]描述了用于测定金黄色葡萄球菌DNA的比色微孔板法,金黄色葡萄球菌目标序列的检测限为1.2 pmol/L的基因组,并验证了该方法在食品样品中的应用潜力。YANG Q等[20]建立了一种SRCA方法来检测牛奶中的金黄色葡萄球菌,其荧光检测方法的检测限为56 CFU/mL,与传统的PCR方法相比,SRCA测定的灵敏度至少提高了100倍,但该方法需要94 ℃预变性3 min,80 ℃孵育5 min,增加了检测成本。
CHENG R等[28]采用一种基于免疫磁珠和RPA结合的免疫磁分离法检测牛奶和猪肉中的金黄色葡萄球菌菌株,在人工污染样品中的检测灵敏度为5.1×101 CFU/mL。HU J Q等[29]建立的基于RPA和聚合物絮凝沉降的新型检测方法,人工污染食品样品中金黄色葡萄球菌的检测限为38 CFU/mL(g)。王雨[30]建立了一种基于RPA-侧向流动试纸条(lateral flow dipstick,LFD)的快速、可视化检测系统,可以对沙门氏菌和金黄色葡萄球菌两种重要的食源性致病菌实现高灵敏性、强特异性的快速有效检测,在加入金黄色葡萄球菌的肉、海鲜、蔬菜、牛奶、鸡蛋等食品基质中金黄色葡萄球菌的检测灵敏度为20 CFU/mL(g)。后来旺等[31]开发的RAA-侧流层析试纸方法,灵敏度分析结果表明金黄色葡萄球菌的检出限为1.83×102 CFU/mL。QIAN J J等[22]建立了检测金黄色葡萄球菌的RAA-LFD技术,人工污染酱油、豆汁、果奶和牛奶样品的检测限为2×101 CFU/mL。
同种等温扩增技术基于不同的样品基质,其检测限也存在差异,如XIONG J等[32]开发的可视闭管LAMP方法,仅能检测到干鱼制品中3×103 CFU/g的金黄色葡萄球菌,HU J Q等[29]建立的RPA方法可以检测到牛奶、虾、鱼、剩米饭中低至3.8 CFU/mL(g)的金黄色葡萄球菌,而在猪肉、奶酪和鸡蛋中的检测灵敏为38 CFU/g。分析其原因,可能是由于不同样品存在的抑制剂不同,也可能是样品基质本身的成分对等温扩增反应存在干扰,如奶酪和鸡蛋的高黏稠度降低了DNA的提取效率,高脂肪高蛋白质干扰了等温扩增反应的进程等。因此,应针对不同的样品基质考虑等温扩增反应种类并研究其检测的灵敏度。
2.2 核酸等温扩增技术检测金黄色葡萄球菌的目标基因
金黄色葡萄球菌检测常用基因见表3。
表3 金黄色葡萄球菌检测常用基因
Table 3 Common genes for Staphylococcus aureus detection

序号 目标基因 基因解释1 2 3 4 5 6 8 9 1 0 11 12 nuc mecA arcC femA gyrB特异性靶基因femB spA clfA sed coa编码耐热核酸酶的基因编码产生青霉素结合蛋白PBP2a的结构基因编码氨基甲酸酯激酶的基因辅助耐药基因,所编码蛋白与细胞壁肽聚糖五甘氨酸桥合成有关编码DNA促旋酶中B亚单位蛋白的基因编码假定膜蛋白的基因辅助耐药基因,参与细胞壁五甘氨酸侧链和肽间桥形成编码金黄色葡萄球菌蛋白A的基因编码金黄色葡萄球菌凝聚因子A的基因编码金黄色葡萄球菌肠毒素D的基因编码金黄色葡萄球菌辅酶A的基因
由表3可知,检测金黄色葡萄球菌常用的靶基因主要有nuc、femA、mecA、arcC、gyrB等。nuc基因是编码金黄色葡萄球菌细胞外热稳定核酸酶(thermostable nuclease,TNase)蛋白的物种特异性基因,在不同菌株之间具有较高的保守性,是检测金黄色葡萄球菌应用最广的目标基因[33-34]。femA为金黄色葡萄球菌特异性基因,是耐药基因的辅助基因,其所编码蛋白与细胞壁肽聚糖五甘氨酸桥合成有关,已被用作鉴定金黄色葡萄球菌的分子标记,在系统发育上也是保守的,葡萄球菌之间的差异低于20%[30];mecA编码青霉素结合蛋白2a基因,是耐甲氧西林金黄色葡萄球菌的特异性基因,常与nuc基因结合检测金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌;arcC为编码氨基甲酸酯激酶的基因,是金黄色葡萄球菌七个管家基因之一,对金黄色葡萄球菌具有特异性;gyrB编码DNA促旋酶中B亚单位蛋白的基因。
金黄色葡萄球菌的目标基因越保守,其检测准确度就越高,越能同其他细菌区分开。此外,选择其他方法确定金黄色葡萄球菌靶基因也有相关研究报道,如WU C等[35]通过对国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中金黄色葡萄球菌基因组序列和NCBI的非冗余核酸数据库下载到本地服务器,通过本地基于局部比对搜索工具(basic local alignment search tool,BLAST)和在线比对筛选金黄色葡萄球菌的潜在特异性基因,并满足种间特异性和种内普遍性的标准,建立了特异性的LAMP检测方法,检测限为4×102 CFU/mL,对金黄色葡萄球菌的特异性为100%,与传统的PCR相比,LAMP将检测限降低了220倍。
3 目标产物检测技术
3.1 比色法
比色法是借助反应体系中的特殊成分(如MnCl2),加入特定的比色显色试剂(金属敏感染料和pH敏感染料)生成定性的颜色结果[36]。显色试剂一般有甲酚红(由红色到黄色)、羟基萘酚蓝(深蓝色到蓝色)和骨钙黄素(深黄色到黄色),以及孔雀石绿(深蓝色到浅蓝色)和无色结晶紫等[37]。CHEN X等[38]采用孔雀石绿作为比色剂,阳性结果会由无色变为绿色,开发了耐甲氧西林金黄色葡萄球菌的LAMP比色检测方法,检测限为100 fg的基因组DNA。此外,还可以通过观察沉淀物来辨别检测结果,HU J Q等[29]提出了一种基于RPA和聚合物絮凝沉降的新型检测方法,0.2 g/mL PEG8 000与0.5 moL NaCl溶液混匀后,与RPA产物1∶1混匀,加入10 μL免疫磁珠结合目标产物进行磁分离洗涤,乙酸钠缓冲液作用下产生絮凝沉降,目视可检测低至1.3×10-5 ng的金黄色葡萄球菌基因。XIONG J等[32]以5种pH敏感指示剂进行目视评估,比较溴百里酚蓝、酚红、甲酚红、中性红和羟基萘酚蓝的灵敏度和特异性,最终选择甲酚红建立了基于pH敏感指示剂的闭管LAMP检测方法,可检测5.4 copy/μL金黄色葡萄球菌基因产物。
采用比色法检测,无需任何复杂的检测仪器或训练有素的人员即可完成,特别适用于资源有限环境下金黄色葡萄球菌的现场检测。但比色法也存在一些缺点,在复杂的生物样品中很难看到产生的颜色,需要一双“有经验的眼睛”来解释颜色变化[39];另外还存在靶基因特异性弱,假阳性结果等问题。因此,为提高检测结果的准确性,会将比色法与纸芯片、智能化平台[40]结合,以实现检测结果的定量分析。
3.2 荧光测定
荧光测定是实时监测扩增的直接方案,通过加入与DNA相结合的荧光染料指示扩增反应,常用的荧光染料有溴化乙 锭、PicoGreen、SYBR Green I、GelRed 和GelGreen 等。SYBR Green I与dsDNA结合时,用紫外线照射时会发出绿色荧光[24,28]。王芳等[41]将扩增产物DNA与[Ru(bpy)2(dppz)]2+结合后产生的强烈红色荧光信号判定结果,SU J Y等[42]以SYBR Green指示染料建立了金黄色葡萄球菌的orfXLAMP检测方法,具有很高的特异性和灵敏度。KHOSRAVI A D等[43]采用SYBR Green I评估金黄色葡萄球菌的LAMP扩增产物,在紫外线下将橙色变为绿色,与PCR结果100%一致。FAN X R等[21]通过SYBR Green I结合重组酶聚合酶扩增,建立了金黄色葡萄球菌的快速、视觉和无设备的即时检测方法。荧光测定可以实现肉眼观察,也可以使用成本低的便携式荧光阅读器进行检测,从而实现检测的定性和定量分析,司晓雪[44]建立了一种基于3,3',5,5'-四甲基联苯胺-辣根过氧化物酶-过氧化氢显色体系的金黄色葡萄球菌快速可视化检测方法,具有良好的特异性和稳定性。然而,荧光染料存在扩增抑制问题,如SYBR Green I可显著抑制扩增反应。为了降低其抑制效应,可采用闭管方式[23]或者蜡封管方式[10],也可选择旋转管方式[45]。
3.3 侧向流技术
侧向流测定(lateral flow assay,LFA)技术是通过肉眼观察测试线的颜色变化来进行检测的一种分析技术,基于金纳米颗粒(Au Nanoparticles,AuNPs)积累引起的颜色变化进行判断,用于现场检测和量化目标物质,将待测样品添加到独立设备上,几分钟内即可获得结果[46-47]。侧向流技术与不同的载体结合(如试纸条、传感设备)可建立不同侧向流测定技术。侧向流测定技术结构示意图见图1。由图1可知,LFA的典型结构包括多孔膜、样品垫、接合垫和吸收垫,分为样品区、检测区和控制区。LFA具有研发生产成本低、易于使用的特点,是快速检测最佳选择之一。将等温扩增方法与LFA相结合,可以确保在非实验室条件下具有超高的测试灵敏度,并降低了对设备的要求[48]。LFA通过与LAMP、RPA、RAA结合使用检测金黄色葡萄球菌,展示了检测系统的高灵敏度、便捷性。WANG Y L等[49]将RPA与LFA技术结果开发了检测金黄色葡萄球菌的IMS-RPA-LF方法,能够检测牛奶样品中低至40 CFU/mL的金黄色葡萄球菌。后来旺等[31]建立了RAA-LFA检测金黄色葡萄球菌的方法,具有特异性强、灵敏度高等特点。但LFA仍然存在一定的不足,如可能存在样品污染,对环境控制力弱、检测结果的准确度等问题。
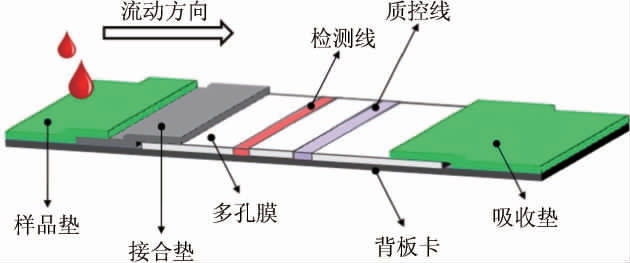
图1 侧向流试纸条结构示意图
Fig.1 Schematic diagram of lateral flow test strip structure
另外,随着新型纳米材料的开发和研发技术的提高,设计了基于纳米颗粒的侧向流生物传感器(lateral flow biosensor,LFB),原理与LFA相似,LFB采用的塑料盒固定封装,由吸收垫、硝酸纤维素膜、样品垫和共轭垫有序地组装在背卡或设备上[34]。CHEN X等[38]建立了基于纳米颗粒的侧向流生物传感器(LAMP-LFB),用于检测所有金黄色葡萄球菌,特异性为100%。LFB提供了更多的可视化,不需要特殊的仪器、控制器和过程,成为分析产物的优选方法[34]。
4 结论
核酸等温扩增技术作为近十多年来兴起的新技术,具有设备简单、反应速度快、灵敏度高等优点,已经成为食源性致病菌检测的研究热点。金黄色葡萄球菌作为全球大多数国家的食品安全法定检测项目,开发了大量的金黄色葡萄球菌等温扩增技术,在保障食品安全和控制食源性疾病方面均发挥了巨大作用。
本文通过介绍LAMP、RPA/RAA、RCA技术的反应机制,比较了几种等温扩增技术的优势和劣势,为后续等温扩增技术的选择提供了参考。同时,从金黄色葡萄球菌等温扩增检测方法的检测限、目标基因和目标产物检测技术方面阐述了金黄色葡萄球菌等温扩增技术的研究进展。其中,RPA、RAA反应具有需求温度低,检测时间短,可同时检测多种病原体等优势,适合开发快速检测技术。比色法、荧光测定法和侧向流技术都属于视觉检测技术,通过肉眼观察即可判断结果,在设备便捷、检测时间等方面具有一定的优势。本文为开发金黄色葡萄球菌等温扩增检测方法提供理论支持,为研发金黄色葡萄球菌的即时检测设备奠定基础。
[1]徐文娟.常见的几种金黄色葡萄球菌快速检测技术[J].现代食品,2021,20:105-107.
[2] LI X, ZHANG X L, SHI X L, et al.Review in isothermal amplification technology in food microbiological detection[J].Food Sci Biotechnol,2022,31:1501-1511.
[3]CAO S Y,TANG X C,CHEN T S,et al.Types and applications of nicking enzyme-combined isothermal amplification[J].Int J Mol Sci,2022,23(9):4620.
[4]中华人民共和国国家质量监督检验检疫总局.SN/T 2754.1—2011出口食品中致病菌环介导恒温扩增(LAMP)检测方法第1部分:金黄色葡萄球菌[S].北京:中国标准出版社,2011.
[5]GLÖKLER J,LIM T S,IDA J,et al.Isothermal amplifications-a comprehensive review on current methods[J].Crit Rev Biochem Mol Biol,2021,56(6):543-586.
[6]ASADI R,MOLLASALEHI H.The mechanism and improvements to the isothermal amplification of nucleic acids,at a glance[J].Anal Biochem,2021,631:114260.
[7]LEONARDO S,TOLDRÀ A,CAMPÀS M.Biosensors based on isothermal DNA amplification for bacterial detection in food safety and environmental monitoring[J].Sensors,2021,21(2):602.
[8]张蕴哲,苑宁,李靳影,等.可视化跨越式滚环等温扩增技术检测食品中沙门氏菌[J].中国食品学报,2020,20(9):304-311.
[9] PIEPENBURG O, WILLIAMS C H, STEMPLE D L, et al.DNA detection using recombination proteins[J].PLoS Biol,2006,4(7):e204.
[10] PUMFORD E A,LU J,SPACZAI I, et al.Developments in integrating nucleic acid isothermal amplification and detection systems for pointof-care diagnostics[J].Biosens Bioelectron,2020,170:112674.
[11] SHEN X X,QIU F Z,SHEN L P,et al.A rapid and sensitive recombinase aided amplification assay to detect hepatitis B virus without DNA extraction[J].BMC Infect Dis,2019,19(1):229.
[12] BOONBANJONG P, TREERATTRAKOON K, WAIWINYA W, et al.Isothermal amplification technology for disease diagnosis[J].Biosensors,2022,12(9):677.
[13]王帅,杨艳歌,吴占文,等.RPA、RAA及ERA技术在食源性致病菌快速检测中的研究进展[J/OL].食品科学:1-11[2023-04-19].http://kns.cnki.net/kcms/detail/11.2206.TS.20220819.0859.012.html.
[14]WANG J W,JIANG H,PAN L M,et al.Rapid on-site nucleic acid testing:On-chip sample preparation,amplification,and detection,and their integration into all-in-one systems[J].Front Bioeng Biotechnol,2023,11:1020430.
[15]LOBATO I M,O'SULLIVAN C K.Recombinase polymerase amplification:Basics,applications and recent advances[J].Trends Analyt Chem,2018,98:19-35.
[16] HIGGINS M, RAVENHALL M, WARD D, et al.PrimedRPA: primer design for recombinase polymerase amplification assays[J].Bioinformatics,2019,35(4):682-684.
[17]MUNAWAR M A.Critical insight into recombinase polymerase amplification technology[J].Expert Rev Mol Diagn,2022,22(7):725-737.
[18]WU C,ZENG Y Y,HE Y.Rapid visualization and detection of Staphylococcus aureus based on loop-mediated isothermal amplification[J].World J Microbiol Biotechnol,2021,37:209.
[19]邹作成,王西,刘雪兰,等.基于nuc基因的环介导等温核酸扩增(LAMP)可视化技术检测食源性金黄色葡萄球菌[J/OL].中国动物传染病学报,2023:1-7[2023-04-19].DOI:10.19958/j.cnki.cn31-2031/s.20210629.009.
[20]YANG Q,ZHANG Y Z,LI S,et al.Saltatory rolling circle amplification for sensitive visual detection of Staphylococcus aureus in milk[J].J Dairy Sci,2019,102(11):9702-9710.
[21] FAN X R, HAN F T, ZHAO B N, et al.Rapid, visual, and equipmentfree point-of-care testing for Staphylococcus aureus by direct recombinase polymerase amplification with SYBR GreenI[J].Acta Bioch Bioph Sin,2021,53(9):1250-1253.
[22]QIAN J J,HUANG D,NI D S,et al.A portable CRISPR Cas12a based lateral flow platform for sensitive detection of Staphylococcus aureus with double insurance[J].Food Control,2022,132:108485.
[23] SOWMYA N,THAKUR M S, MANONMANI H K.Rapid and simple DNA extraction method for the detection of enterotoxigenic Staphylococcus aureus directly from food samples:comparison of PCR and LAMP methods[J].J Appl Microbiol,2012,113(1):106-113.
[24] SHEET O H, GRABOWSKI N T, KLEIN G, et al.Development and validation of a loop mediated isothermal amplification(LAMP)assay for the detection of Staphylococcus aureus in bovine mastitis milk samples[J].Mol Cell Probes,2016,30(5):320-325.
[25] HASSAN M, VITTAL R, RAJ J M, et al.Loop-mediated isothermal amplification (LAMP): a sensitive molecular tool for detection of Staphylococcus aureus in meat and dairy product[J].Braz J Microbiol,2022,53:341-347.
[26] WANG Y T,WANG Z Z, ZHAN Z X, et al.Fluorescence detection of Staphylococcus aureus using vancomycin functionalized magnetic beads combined with rolling circle amplification in fruit juice[J].Anal Chim Acta,2022,1189:339213.
[27]LI Y N,WANG J Y,WANG S,et al.Rolling circle amplification based colorimetric determination of Staphylococcus aureus[J].Mikrochim Acta,2020,187:119.
[28] CHENG R, LI L, ZHEN S H, et al.Rapid detection of Staphylococcus aureus in milk and pork via immunomagnetic separation and recombinase polymerase amplification[J].Microbiol Spectr,2023,11(2):e0224922.
[29]HU J Q,WANG Y,DING H M,et al.Recombinase polymerase amplification with polymer flocculation sedimentation for rapid detection of Staphylococcus aureus in food samples[J].Int J Food Microbiol,2020,331:108691.
[30]王雨.基于RPA-LFD的沙门氏菌和金黄色葡萄球菌可视化快速检测方法研究[D].长春:吉林大学,2022.
[31]后来旺,李达容,邓波,等.金黄色葡萄球菌RAA-LFD快速检测方法的建立与应用[J].食品科学,2022,43(4):331-339.
[32] XIONG J, HUANG B, XU J S, et al.A closed-tube loop-mediated isothermal amplification assay for the visual detection of Staphylococcus aureus[J].Appl Biochem Biotechnol,2020,191:201-211.
[33]张小雨,王雯雯,马臣杰,等.金黄色葡萄球菌LAMP检测方法的建立及应用[J].农业生物技术学报,2021,29(9):1845-1854.
[34]冯瑜菲,袁超文.基于可视化聚合酶交联螺旋反应快速检测金黄色葡萄球菌方法的建立[J].中国预防兽医学报,2022,44(7):737-742.
[35]WU C,ZENG Y Y,HE Y.Rapid visualization and detection of Staphylococcus aureus based on loop-mediated isothermal amplification[J].World J Microbiol Biotechnol,2021,37:209.
[36]WANG J,LI H G,LI T T,et al.Determination of bacterial DNA based on catalytic oxidation of cysteine by G-quadruplex DNAzyme generated from asymmetric PCR: Application to the colorimetric detection of Staphylococcus aureus[J].Mikrochim Acta,2018,185:410.
[37] TANNER N A,ZHANG Y H,EVANS T C.Visual detection of isothermal nucleic acid amplification using pH-sensitive dyes[J].Biotechniques,2015,58(2):59-68.
[38] CHEN X, MA K, YI X, et al.The rapid and visual detection of methicillin-susceptible and methicillin-resistant Staphylococcus aureus using multiplex loop-mediated isothermal amplification linked to a nanoparticle-based lateral flow biosensor[J].Antimicrob Resist Infect Control,2020,9:111.
[39]ISLAM M M,KOIRLA D.Toward a next-generation diagnostic tool:A review on emerging isothermal nucleic acid amplification techniques for the detection of SARS-CoV-2 and other infectious viruses[J].Anal Chim Acta,2022,1209:339338.
[40] NGUYEN H Q, NGUYEN V D, VAN NGUYEN H, et al.Quantification of colorimetric isothermal amplification on the smartphone and its open-source app for point-of-care pathogen detection[J].Sci Rep,2020,10:15123.
[41]王芳,董菁,李艳妮,等.基于核酸分子光开关的闭管可视化环介导等温扩增检测方法[J].分析测试学报,2022,41(4):646-651.
[42]SU J Y,LIU X C,CUI H M,et al.Rapid and simple detection of methicillin-resistance Staphylococcus aureus by orfX loop-mediated isothermal amplification assay[J].BMC Biotechnol,2014,14:8.
[43]KHOSRAVI A D,KHOSHNOOD S,MONTAZERI E A,et al.The application of the loop-mediated isothermal amplification method for rapid detection of methicillin-resistant Staphylococcus aureus[J].New Microbes New Infect,2022,45:100960.
[44]司晓雪.金黄色葡萄球菌可视化检测方法的建立与评价[D].长春:吉林大学,2020.
[45]DIXIT K K,VERMA S,SINGH O P,et al.Validation of SYBR green I based closed tube loop mediated isothermal amplification(LAMP)assay and simplified direct-blood-lysis (DBL)-LAMP assay for diagnosis of visceral leishmaniasis (VL)[J].PLoS Negl Trop Dis, 2018, 12(11):e0006922.
[46]KOCZULA K M,GALLOTTA A.Lateral flow assays[J].Essays Biochem,2016,60(1):111-120.
[47]DI NARDO F,CHIARLLO M,CAVALERA S,et al.Ten years of lateral flow immunoassay technique applications:trends,challenges and future perspectives[J].Sensors,2021,21(15):5185.
[48]ZHENG C J,WANG K,ZHENG W,et al.Rapid developments in lateral flow immunoassay for nucleic acid detection[J].Analyst, 2021, 146:1514-1528.
[49]WANG Y L,ZHANG X,WANG Q,et al.Rapid and visual detection of Staphylococcus aureus in milk using a recombinase polymerase amplification-lateral flow assay combined with immunomagnetic separation[J].J Appl Microbiol,2022,133(6):3741-3754.