结冷胶是一种由少动鞘氨醇单胞菌(Sphingomonas paucimobilis)代谢产生的胞外可溶性杂多糖,其分子结构是由D-葡萄糖醛酸、D-葡萄糖和L-鼠李糖按1∶2∶1的重复结构单元组成,在葡萄糖残基上通常连接有乙酰基和甘油酰基[1-3]。因其具有较好的流变性和凝胶特性,易于生物降解且安全无毒性等特点[4-6],在食品、日化、医药等工业领域作为增稠剂、乳化剂和稳定剂被广泛应用[7-9]。市售结冷胶产品根据其分子结构中乙酰基含量的不同可分为高酰基结冷胶和低酰基结冷胶[10-11]。天然的结冷胶均为高酰基结冷胶,其凝胶温度高,杂质分离困难[12-14];商品化结冷胶产品主要是低酰基结冷胶,低酰基结冷胶凝胶温度低,杂质分离相对容易,凝胶强度高,应用领域广泛[15-19]。
低酰基结冷胶一般是利用高酰基结冷胶在碱性环境下加热脱酰基获得[20],生产工艺复杂,能耗高,生产成本高,而通过改造生产菌直接生产低酰基结冷胶的报道还较少。因此,本研究以少动鞘氨醇单胞菌ATCC31461为出发菌株,利用RedET同源重组技术[21]敲除其乙酰基转移酶基因nat,构建直接合成低酰基结冷胶的乙酰基缺陷型重组菌株,并以低酰基结冷胶产率为响应值,采用单因素试验及响应面试验对其发酵培养基组成进行优化,为后续研究开发低酰基结冷胶直接发酵生产工艺及工业化生产技术奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和引物
少动鞘氨醇单胞菌(Sphingomonas paucimobilis)ATCC31461、大肠杆菌(Escherichia coli)TransT1、pBBR1-kan-Ptac-firefly质粒、庆大霉素-SacB(蔗糖致死基因)组件:本实验室;本研究所用引物见表1。
表1 本研究所用引物
Table 1 Primers used in the study
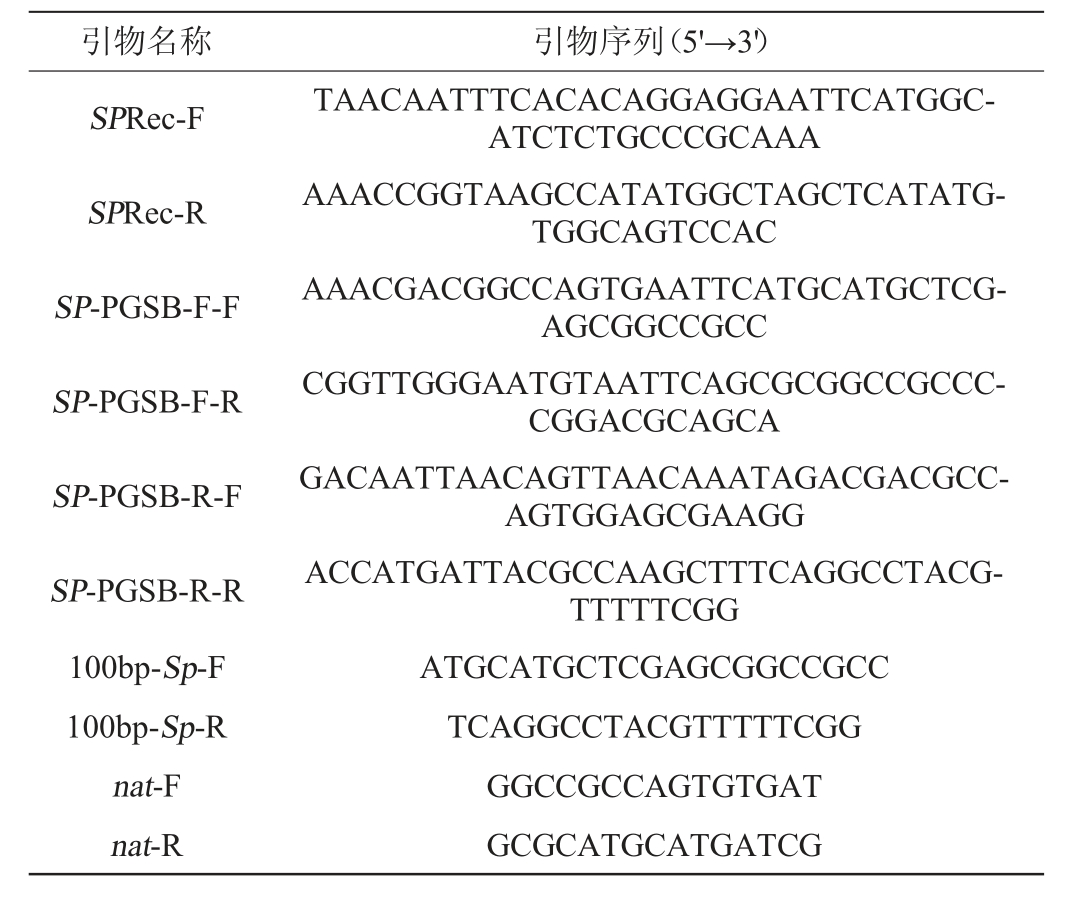
引物名称 引物序列(5'→3')SPRec-F SPRec-R SP-PGSB-F-F SP-PGSB-F-R SP-PGSB-R-F SP-PGSB-R-R 100bp-Sp-F 100bp-Sp-R nat-F nat-R TAACAATTTCACACAGGAGGAATTCATGGCATCTCTGCCCGCAAA AAACCGGTAAGCCATATGGCTAGCTCATATGTGGCAGTCCAC AAACGACGGCCAGTGAATTCATGCATGCTCGAGCGGCCGCC CGGTTGGGAATGTAATTCAGCGCGGCCGCCCCGGACGCAGCA GACAATTAACAGTTAACAAATAGACGACGCCAGTGGAGCGAAGG ACCATGATTACGCCAAGCTTTCAGGCCTACGTTTTTCGG ATGCATGCTCGAGCGGCCGCC TCAGGCCTACGTTTTTCGG GGCCGCCAGTGTGAT GCGCATGCATGATCG
1.1.2 试剂
蔗糖、NaCl、无水乙醇(均为分析纯):国药集团化学试剂有限公司;体积分数95%乙醇:天津市富宇精细化工有限公司;酵母提取物、蛋白胨、酵母膏、牛肉膏(均为生化试剂):北京奥博星生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、琼脂糖凝胶回收试剂盒、质粒小提试剂盒:天根生化科技(北京)有限公司;Fastpfu DNA Polymerase:北京全式金生物技术股份有限公司;庆大霉素、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG):上海阿拉丁生化科技股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
LB固体培养基[22]:酵母粉5.0 g/L,蛋白胨10.0 g/L,NaCl 10.0 g/L,琼脂20 g/L,液体培养基中不添加琼脂。
固体培养基:蔗糖10.0 g/L,酵母膏3.0 g/L,蛋白胨5.0 g/L,牛肉膏2.0 g/L,NaCl 5.0 g/L,琼脂粉15.0 g/L,pH 7.0。
种子培养基:蔗糖10.0 g/L,酵母膏1.0 g/L,碱解黄豆粉4.0g/L,K2HPO40.5g/L,KH2PO40.5g/L,MgSO40.5g/L,pH7.0。
初始发酵培养基:蔗糖30.0 g/L,碱解豆粕6.0 g/L,K2HPO4 1.0 g/L,KH2PO4 1.5 g/L,MgSO4 1.0 g/L,pH 7.0。
以上培养基灭菌条件均为121 ℃高压灭菌20 min。
1.2 仪器与设备
T960聚合酶链式反应(polymerase chain reaction,PCR)仪:耶拿分析仪器(北京)有限股份公司;TU-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;5804R冷冻离心机:德国艾本德公司;MicroPulser电穿孔仪:美国伯乐公司;DV-2T旋转黏度计:美国博勒飞公司;1260 Infinity II高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株的构建
RedET同源重组操作系统的构建:在美国国立生物技术信息中心(national center for biotechnology information,NCBI)通过基本局部比对搜索工具(basic local alignment search tool,BLAST)分析少动鞘氨醇单胞菌基因组,在Sphingomonas paucimobilis LH128中找到具有重组功能的蛋白SpRecET,其类似RedET的操纵子,包含一个与RecT功能相当的RecT蛋白LH128_00075,一个与RecE功能相当的噬菌体核酸内切酶LH128_00080。委托金斯瑞生物科技公司合成质粒pUC57-SpRecET。通过限制性内切酶EcoR1和Nhe1对质粒pUC57-SpRecET和pBBR1-kan-Ptac-firefly进行双酶切,采用琼脂糖凝胶回收获得同源重组酶基因SpRecET片段和线性质粒片段。采用T5 DNA连接酶进行连接,并通过化学转化法导入大肠杆菌TransT1中,构建重组酶表达质粒pBBR1-kan-Ptac-SpRecET。在含50 μg/mL卡那霉素抗性的LB平板上,挑取单克隆提取质粒进行PCR验证。提取重组酶表达质粒pBBR1-kan-Ptac-SpRecET,通过电击转化法将其导入出发菌株少动鞘氨醇单胞菌ATCC31461中,构建含重组酶表达质粒pBBR1-kan-Ptac-SpRecET的少动鞘氨醇单胞菌RedET同源重组操作系统,在含50 μg/mL卡那霉素抗性的固体培养基平板上,挑取单克隆并提取质粒进行PCR验证。
乙酰基转移酶基因敲除组件的构建:以少动鞘氨醇单胞菌ATCC31461基因组为模板,分别以SP-PGSB-F-F/SPPGSB-F-R、SP-PGSB-R-F/SP-PGSB-R-R为引物,PCR扩增获得乙酰转移酶基因nat上游100 bp和下游100 bp的同源片段。将上游100 bp和下游100 bp的同源片段、庆大霉素-SacB组件和pUC57载体用T5 DNA连接酶进行连接,并通过化学转化法导入大肠杆菌TransT1中,构建含△nat-PGSB组件(含乙酰基转移酶基因上游100 bp和下游100 bp的同源片段、庆大霉素-SacB组件的基因片段)的pUC57-△nat-PGSB质粒。在含50 μg/mL庆大霉素抗性的LB平板上,挑取单克隆并提取质粒进行PCR验证。以pUC57-△nat-PGSB质粒为模板,100bp-Sp-F和100bp-Sp-R为引物进行PCR扩增,获得带有乙酰基转移酶基因上、下游100 bp同源臂的线性片段△nat-PGSB组件,通过琼脂糖凝胶回收后得到△nat-PGSB组件。
产低酰基结冷胶少动鞘氨醇单胞菌重组菌株的构建:采用100 mmol/L的IPTG诱导含pBBR1-kan-Ptac-SpRecET质粒的少动鞘氨醇单胞菌进行重组酶表达,通过电击转化法将△nat-PGSB组件导入诱导后的少动鞘氨醇单胞菌中,涂布于含有50 μg/mL庆大霉素抗性的固体培养基平板上,28 ℃条件下培养3 d,挑取转化子,PCR验证获得敲除乙酰基转移酶基因的重组菌株。
1.3.2 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株的发酵
取保存于-80 ℃装有产低酰基结冷胶少动鞘氨醇单胞菌重组菌株的甘油管,用接种环取菌液划线于含50 μg/mL庆大霉素的斜面固体培养基中,在培养箱中28 ℃培养24 h。从斜面刮取一环菌体接种于种子培养基中,装液量为100 mL/500 mL,28 ℃、300 r/min培养16 h。将培养好的种子液以10%(V/V)的接种量接种于初始发酵培养基中,28 ℃、300 r/min条件下发酵72 h,测定乙酰基含量、产胶率及发酵液表观黏度。
1.3.3 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株生长曲线的绘制
将培养好的种子液以10%(V/V)的接种量接种于初始发酵培养基中,28 ℃、300 r/min条件下培养,每4 h取样测定OD600nm值。以培养时间(X)为横坐标,OD600nm值(Y)为纵坐标,绘制生长曲线。
1.3.4 产低酰基结冷胶少动鞘氨醇单胞菌发酵培养基优化单因素试验
固定发酵条件为接种量10%(V/V),发酵温度28 ℃,转速300 r/min,发酵时间72 h。在初始发酵培养基(对照)的基础上,分别考察碳源种类(可溶性淀粉、果糖、蔗糖、葡萄糖、乳糖)及添加量(30.0 g/L、40.0 g/L、50.0 g/L、60.0 g/L、70.0 g/L)、氮源种类(豆粉、豆粕、玉米浆、酵母膏、酵母粉、酵母蛋白胨、鱼蛋白胨)及添加量(4.0 g/L、6.0 g/L、8.0 g/L、10.0 g/L、12.0 g/L)、K2HPO4添加量(2.0 g/L、3.0 g/L、4.0 g/L、5.0 g/L、6.0 g/L)、KH2PO4添加量(1.0 g/L、2.0 g/L、3.0 g/L、4.0 g/L、5.0 g/L、6.0 g/L)及MgSO4添加量(0、0.3 g/L、0.6 g/L、0.9 g/L、1.2 g/L)对产低酰基结冷胶少动鞘氨醇单胞菌重组菌株发酵液表观黏度和产胶率的影响。
1.3.5 产低酰基结冷胶少动鞘氨醇单胞菌发酵培养基优化响应面试验
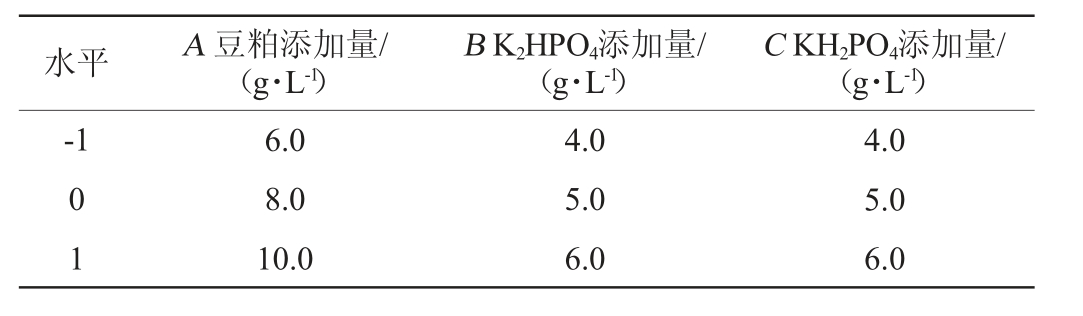
在单因素试验基础上,选择对产低酰基结冷胶少动鞘氨醇单胞菌重组菌株发酵液表观黏度和产胶率影响显著的3个因素豆粕添加量(A)、K2HPO4添加量(B)和KH2PO4添加量(C)作为考察指标,以产胶率(Y)为响应值,采用Design-Expert 12.0.3设计3因素3水平的中心组合设计(Box-Behnken Design,BBD)试验,Box-Behnken试验因素与水平见表2。
表2 Box-Behnken试验设计因素及水平
Table 2 Factors and levels of Box-Behnken experiment design
水平 A 豆粕添加量/(g·L-1)C KH2PO4添加量/(g·L-1)-1 B K2HPO4添加量/(g·L-1)0 1 6.0 8.0 10.0 4.0 5.0 6.0 4.0 5.0 6.0
1.3.6 分析检测
乙酰基含量的测定:参考文献[23]采用HPLC法测定乙酰基含量。
发酵液表观黏度测定:使用Brookfield DV-2T型旋转黏度计测定发酵液表观黏度[24]。
产胶率测定[24]:准确称取发酵液50.0 g,加入2~3倍体积分数95%的乙醇沉淀结冷胶,所得结冷胶沉淀经体积分数95%的乙醇洗涤1~2次,干燥至恒质量后称质量,计算产胶率,其计算公式如下:
1.3.7 数据处理
所有试验重复进行3次,结果以“平均值±标准差”表示;采用SPSS 19.0进行数据分析;采用Design-Expert 12.0.3设计响应面试验;利用Origin 2021作图。
2 结果与分析
2.1 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株的构建
以nat-F/nat-R、100bp-Sp-F/100bp-Sp-R为引物,分别对10株转化子(编号1~10)进行PCR验证,结果见图1。由图1可知,转化子1~3、5~7、9、10的PCR扩增结果中没有nat基因,只有△nat-PGSB,表明成功敲除了乙酰基转移酶基因,选取其中一株成功敲除乙酰基转移酶基因的少动鞘氨醇单胞菌转化子,编号为LY126。
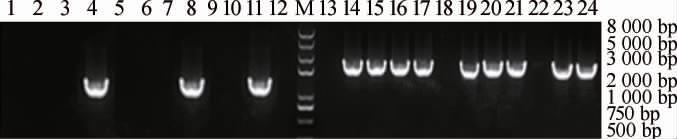
图1 乙酰基转移酶缺失转化子的PCR验证结果
Fig.1 PCR validation results of acetyltransferase-deficient transformers
1~10、15~24:转化子PCR验证结果(1~10:是转化子编号1~10 nat基因验证结果;15~24:是转化子编号1~10 △nat-PGSB验证结果);
11、14:阳性对照(11:出发菌株、14:△nat-PGSB组件);12、13:阴性
对照(模板是水);M:DL 5000 DNA Marker。
2.2 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株LY126的发酵
出发菌株ATCC31461与产低酰基结冷胶少动鞘氨醇单胞菌重组菌株LY126的乙酰基含量、产胶率及发酵液表观黏度见图2。由图2可知,重组菌株LY126所产结冷胶乙酰基含量为1.66%、发酵液表观黏度为7 520 mPa·s,较出发菌株ATCC31461分别降低32.79%、36.59%(P<0.05),产胶率为1.53%,较出发菌株ATCC31461提高8.51%(P<0.05)。综上可知,敲除乙酰基转移酶后,重组菌株LY126可直接合成低酰基结冷胶,且发酵液表观黏度显著降低,发酵液中溶氧水平提高,进而提高了结冷胶合成效率并有效降低了发酵过程能耗,可以有效的降低结冷胶生产成本。
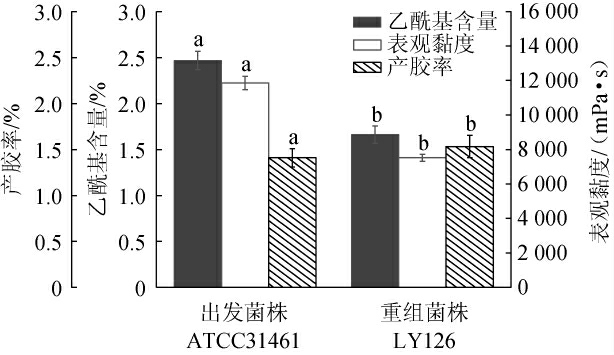
图2 出发菌株ATCC31461及重组菌株LY126的乙酰基含量、产胶率及发酵液表观黏度测定结果
Fig.2 Determination results of acetyl content, low-acyl gellan gum yield and fermentation broth apparent viscosity of starting strain ATCC31461 and recombinant strain LY126
不同字母表示菌株间差异显著(P<0.05)。下同。
2.3 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株LY126的生长曲线
为了研究乙酰基转移酶敲除后对菌株生长的影响,测定出发菌株ATCC31461及重组菌株LY126的生长曲线,结果见图3。由图3可知,发酵过程中,重组菌株LY126的OD600nm值略低于出发菌株ATCC31461,但两菌株的生长情况一致,均在培养4 h后进入对数生长期,20 h后达到稳定期,重组菌株LY126的最大OD600nm值为10.2。有研究发现[25],对数中后期菌体具有较高的活力,因此,选择在菌株生长至对数中后期转种培养,即16 h作为重组菌株LY126培养周期,此时重组菌株LY126的OD600nm值为7.4。

图3 出发菌株ATCC31461及重组菌株LY126的生长曲线
Fig.3 Growth curves of starting strain ATCC31461 and recombinant strain LY126
2.4 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株LY126发酵培养基优化单因素试验
2.4.1 碳源种类的确定
在培养基中添加碳源可为细胞生命活动提供能量,同时可为产物的合成提供碳骨架[26]。不同碳源对重组菌株LY126发酵合成低酰基结冷胶的影响见图4。由图4可知,当葡萄糖作为唯一碳源时,发酵液的表观黏度和产胶率均最高,分别为8 500.0 mPa·s和1.70%;其次是蔗糖,表观黏度和产胶率分别是7 520.0 mPa·s和1.57%;可溶性淀粉作为唯一碳源时,表观黏度和产胶率最低,分别为90 mPa·s和0.82%。因此,确定重组菌株LY126的最佳碳源为葡萄糖。
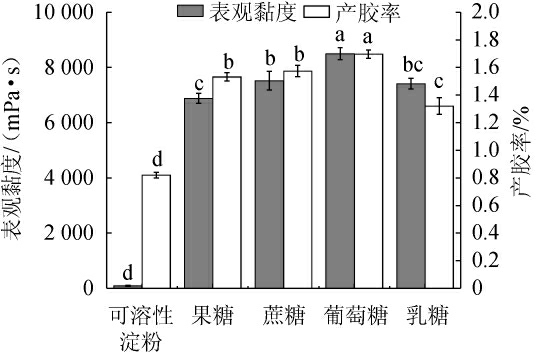
图4 碳源种类对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.4 Effect of carbon source species on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.4.2 葡萄糖添加量的确定
不同葡萄糖添加量对重组菌株LY126发酵合成低酰基结冷胶的影响见图5。由图5可知,当葡萄糖添加量为30.0~50.0 g/L时,发酵液的表观黏度和产胶率随着葡萄糖添加量的提高而增加;当葡萄糖添加量为50.0 g/L时,发酵液的表观黏度及产胶率达到最高,分别为9 920 mPa·s和1.76%;当葡萄糖添加量为50.0~70.0 g/L时,发酵液表观黏度和产胶率随着葡萄糖添加量的上升而略有降低,碳源添加量的变化对产胶率影响相对稳定。因此,确定葡萄糖最佳添加量为50.0 g/L。
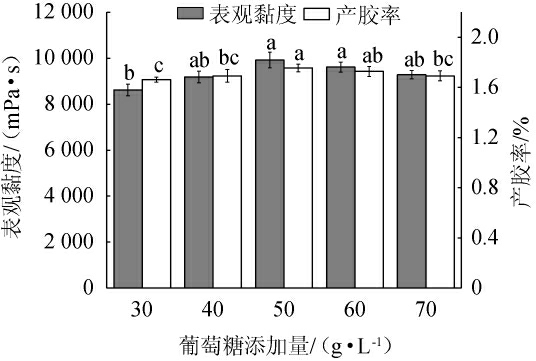
图5 葡萄糖添加量对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.5 Effect of glucose addition on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.4.3 氮源种类的确定
在培养基中添加氮源不仅能够加快结冷胶生产菌株的生长,还可促进结冷胶生产菌株合成结冷胶[27]。不同氮源对重组菌株LY126发酵合成低酰基结冷胶的影响见图6。由图6可知,以豆粕作为氮源时,发酵液的表观黏度和产胶率均最高,分别为7 660.0 mPa·s和1.56%;其次是玉米浆,表观黏度及产胶率分别为7 370.0 mPa·s和1.44%;酵母蛋白胨和鱼蛋白胨作为氮源时的表观黏度和产胶率都比较低。因此,选择豆粕作为最优氮源。
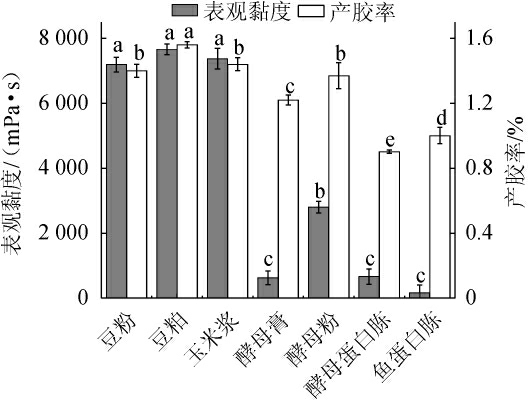
图6 氮源种类对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.6 Effect of nitrogen source type on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.4.4 豆粕添加量的确定
不同豆粕添加量对重组菌株LY126发酵合成低酰基结冷胶的影响见图7。由图7可知,当豆粕添加量为4.0~8.0 g/L时,发酵液的表观黏度和产胶率随着豆粕添加量的提高而增加;当豆粕添加量为8.0 g/L时,发酵液的表观黏度及产胶率均达到最高,分别为8 830.0 mPa·s和1.67%;当豆粕添加量为8.0~12.0 g/L时,发酵液表观黏度和产胶率随着豆粕添加量的上升而略有降低。分析原因可能是豆粕的增加提高了菌株对豆粕的利用率,促进了结冷胶的合成;但豆粕添加量过高促进了发酵过程中菌株的快速生长,反而抑制了结冷胶的合成。因此,确定豆粕的最佳添加量为8 g/L。
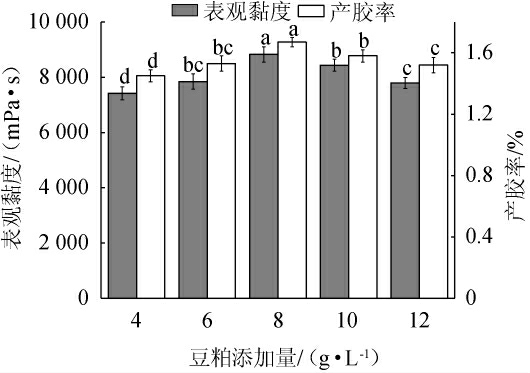
图7 豆粕添加量对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.7 Effect of soybean meal addition on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.4.5 K2HPO4添加量的确定
不同K2HPO4添加量对重组菌株LY126发酵合成低酰基结冷胶的影响见图8。由图8可知,当K2HPO4添加量为1.0~5.0 g/L时,发酵液的表观黏度和产胶率随着K2HPO4添加量的增加而升高;当K2HPO4添加量为5.0 g/L时,发酵液的表观黏度和产胶率均达到最高,分别为9 250.0 mPa·s和1.74%;当K2HPO4添加量>5.0 g/L后,发酵液的表观黏度和产胶率随着K2HPO4添加量的增加而略有降低。因此,确定K2HPO4的最佳添加量为5 g/L。
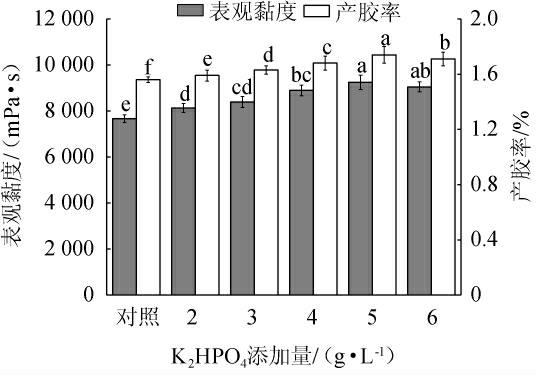
图8 K2HPO4添加量对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.8 Effect of K2HPO4 addition on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.4.6 KH2PO4添加量的确定
不同KH2PO4添加量对重组菌株LY126发酵合成低酰基结冷胶的影响见图9。由图9可知,当KH2PO4添加量为1.0~5.0 g/L时,发酵液的表观黏度和产胶率随着KH2PO4添加量的增加而提高;当KH2PO4添加量为5.0 g/L时,发酵液的表观黏度和产胶率均达到最高,分别为9 290.0 mPa·s和1.76%;当KH2PO4添加量为5.0~6.0 g/L,发酵液的表观黏度和产胶率随着KH2PO4添加量的增加而略有降低。因此,确定KH2PO4的最佳添加量为5.0 g/L。
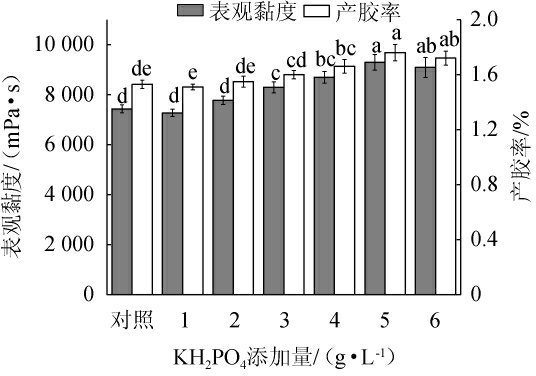
图9 KH2PO4添加量对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.9 Effect of KH2PO4 addition on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.4.7 MgSO4添加量的确定
不同MgSO4添加量对重组菌株LY126发酵合成低酰基结冷胶的影响见图10。由图10可知,当MgSO4添加量为0~1.2 g/L时,发酵液的表观黏度和产胶率随着MgSO4添加量的增加而提高;当MgSO4添加量为0.9 g/L时,发酵液的表观黏度和产胶率均达到最高,分别为7 480.0 mPa·s和1.56%;当MgSO4添加量>0.9 g/L时,发酵液的表观黏度和产胶率均下降。因此,确定MgSO4的最佳添加量为0.9 g/L。
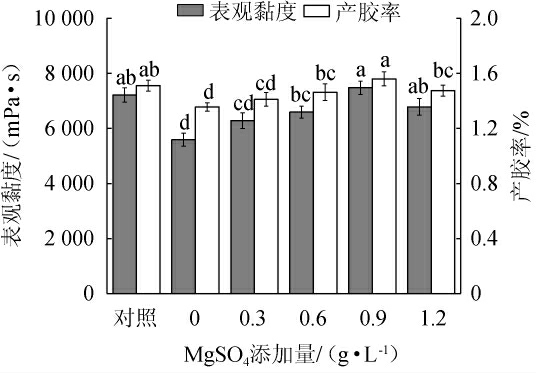
图10 MgSO4添加量对重组菌株LY126发酵合成低酰基结冷胶的影响
Fig.10 Effect of MgSO4 addition on the synthesis of low-acyl gellan gum by recombinant strain LY126 fermentation
2.5 产低酰基结冷胶少动鞘氨醇单胞菌重组菌株LY126发酵培养基优化响应面试验
在单因素试验的基础上,选择对产低酰基结冷胶少动鞘氨醇单胞菌重组菌株发酵液表观黏度和产胶率影响显著的3个因素豆粕添加量(A)、K2HPO4添加量(B)和KH2PO4添加量(C)作为考察指标,以产胶率(Y)为响应值,采用Design-Expert 12.0.3软件设计BBD试验,试验设计及结果见表3,方差分析见表4。
表3 Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken experiments
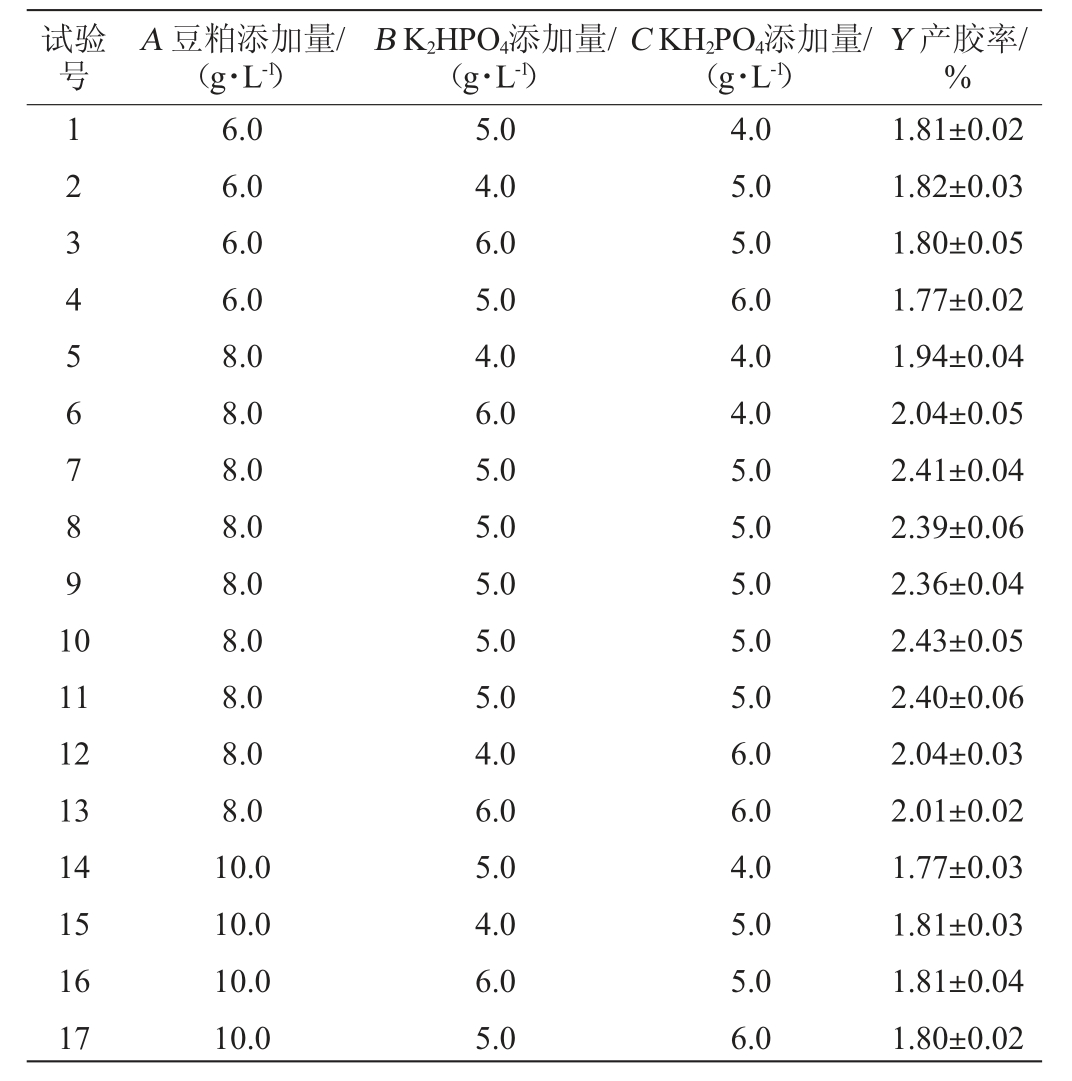
试验号A 豆粕添加量/(g·L-1)B K2HPO4添加量/(g·L-1)C KH2PO4添加量/(g·L-1)Y 产胶率/%1234567891 0 11 12 13 14 15 16 17 6.0 6.0 6.0 6.0 8.0 8.0 8.0 8.0 8.0 8.0 8.0 8.0 8.0 10.0 10.0 10.0 10.0 5.0 4.0 6.0 5.0 4.0 6.0 5.0 5.0 5.0 5.0 5.0 4.0 6.0 5.0 4.0 6.0 5.0 4.0 5.0 5.0 6.0 4.0 4.0 5.0 5.0 5.0 5.0 5.0 6.0 6.0 4.0 5.0 5.0 6.0 1.81±0.02 1.82±0.03 1.80±0.05 1.77±0.02 1.94±0.04 2.04±0.05 2.41±0.04 2.39±0.06 2.36±0.04 2.43±0.05 2.40±0.06 2.04±0.03 2.01±0.02 1.77±0.03 1.81±0.03 1.81±0.04 1.80±0.02
表4 回归模型的方差分析
Table 4 Variance analysis of regression mode
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
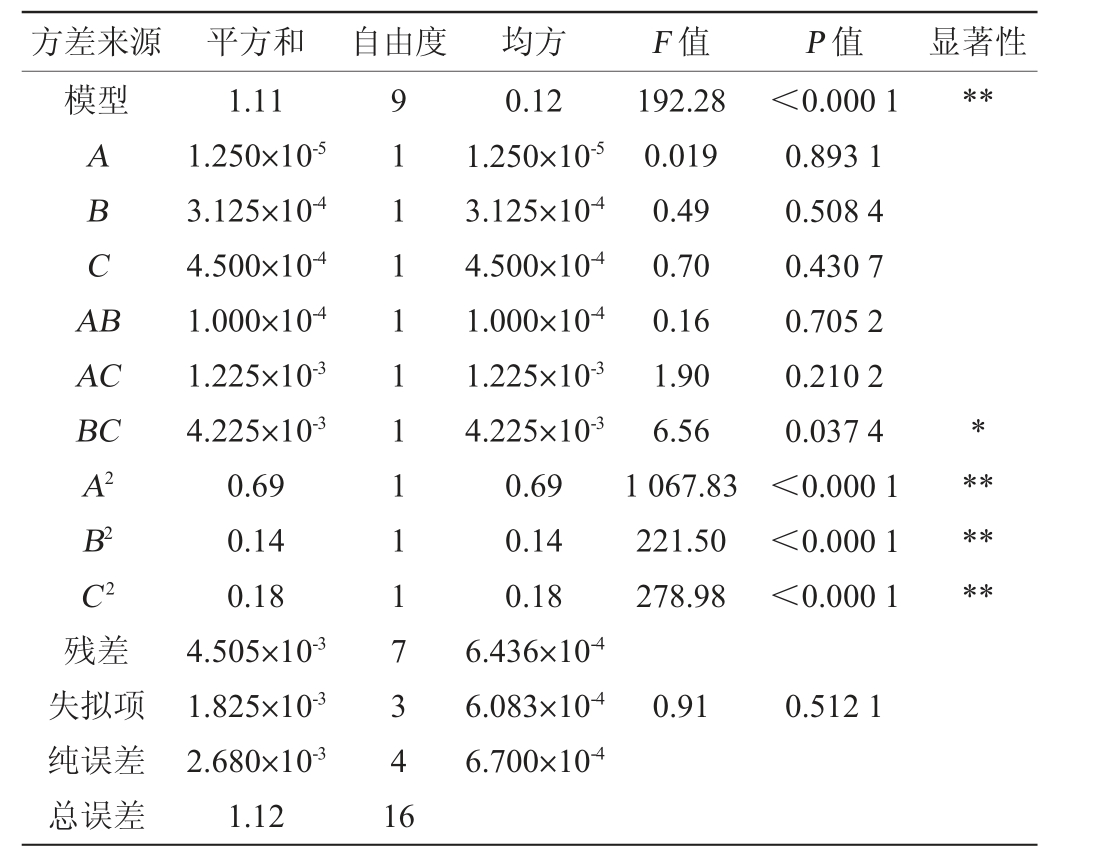
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**ABCA B AC BC A2 B2 C2残差失拟项纯误差总误差1.11 1.250×10-5 3.125×10-4 4.500×10-4 1.000×10-4 1.225×10-3 4.225×10-3 0.69 0.14 0.18 4.505×10-3 1.825×10-3 2.680×10-3 1.12 91111111117341 6 0.12 1.250×10-5 3.125×10-4 4.500×10-4 1.000×10-4 1.225×10-3 4.225×10-3 0.69 0.14 0.18 6.436×10-4 6.083×10-4 6.700×10-4 192.28 0.019 0.49 0.70 0.16 1.90 6.56 1 067.83 221.50 278.98<0.000 1 0.893 1 0.508 4 0.430 7 0.705 2 0.210 2 0.037 4<0.000 1<0.000 1<0.000 1*******0.91 0.512 1
采用Design-Expert 12.0.3对表3试验数据进行多元二次回归拟合,得到产胶率的二次多元回归方程:
Y=2.40-1.25×10-3A+6.25×10-3B+7.50×10-3C+5.00×10-3AB+0.018AC-0.033BC-0.4A2-0.18B2-0.21C2
由表4可知,模型的P值<0.000 1,极显著,失拟项P值>0.05,不显著,说明回归模型与数据之间的拟合度较好。模型的决定系数R2=0.996 0,表明该模型能解析99.60%的响应变化,存在0.40%的总变异,说明该模型的拟合度良好,试验误差也比较小。调整决定系数R2Adj=0.990 8,说明该模型响应值的变化有99.08%来源于所选的因素。响应值Y的变异系数(variable coefficient,CV)=1.25%<5%,说明该试验的重复性较好,具有一定可行性。由表5亦可知,交互项BC对结果影响显著(P<0.05),二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。为直观表示各因素间交互作用对产胶率的影响,绘制各因素间交互作用对产胶率影响的响应面及等高线,结果见图11。
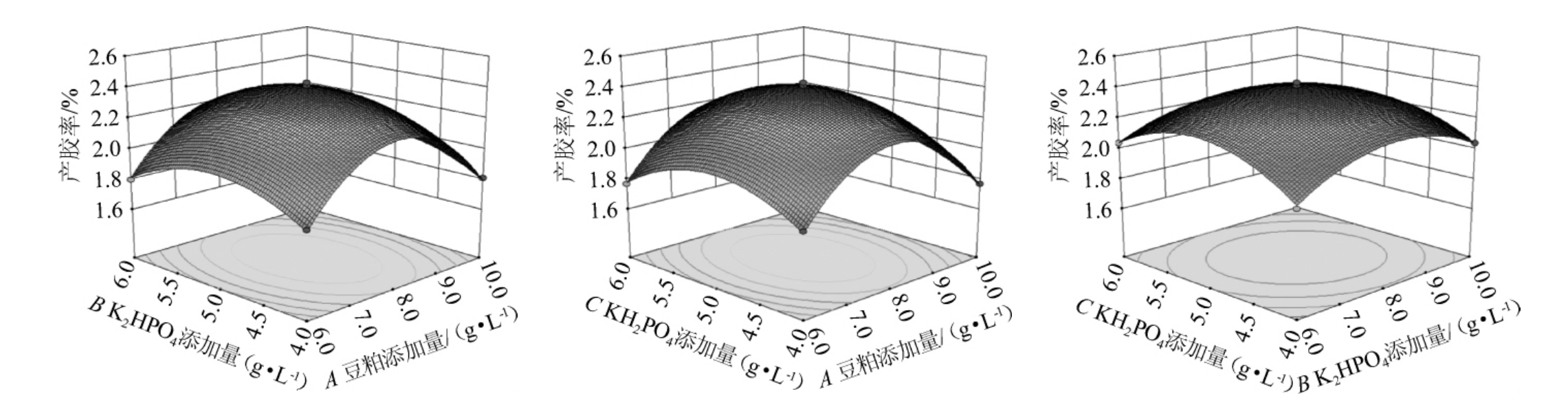
图11 各因素间交互作用对产胶率影响的响应面及等高线图
Fig.11 Response surface plots and contour lines of effect of interaction between each factors on low-acyl gellan gum yield
响应面曲面图弧度变化越陡峭,等高线越密集,说明两个因素之间的相互作用越显著。由图11可知,响应面均呈凸形,等高线呈椭圆形,说明各因素间交互作用对产胶率具有一定的影响。
采用Design-Expert 12.0.3对回归方程进行求解,得到重组菌株LY126产低酰基结冷胶的最优发酵培养基为:豆粕添加量为8.00 g/L、K2HPO4添加量为5.02 g/L、KH2PO4添加量为5.02 g/L,在此条件下,产胶率理论值为2.40%。为便于实际操作,将最优发酵培养基调整为:葡萄糖添加量为50.00 g/L、豆粕添加量为8.00 g/L、K2HPO4添加量为5.00 g/L、KH2PO4添加量为5.00 g/L、MgSO4添加量为0.90 g/L,在此条件下进行5次验证试验,得到平均产胶率为(2.38±0.05)%,其与理论值接近,说明模型和实际情况拟合程度高,证明该模型可行,与优化前比较,产胶率提高了55.40%。
3 结论
本研究基于现有高酰基结冷胶生产菌Sphingomonas paucimobilis ATCC31461为出发菌株,采用RedET同源重组技术构建低酰基结冷胶生产菌株少动鞘氨醇单胞菌重组菌株LY126,其可直接生物合成低酰基结冷胶。与出发菌株ATCC31461相比,重组菌株LY126的乙酰基含量降低32.79%,产胶率提高8.65%。通过单因素与响应面试验优化得到重组菌株LY126产低酰基结冷胶的最优发酵培养基为葡萄糖添加量50.00 g/L、豆粕添加量8.00 g/L、K2HPO4添加量5.00 g/L、KH2PO4添加量5.00 g/L、MgSO4添加量0.90 g/L,在此条件下,低酰基结冷胶的产率为2.38%,比优化前(1.53%)提高55.40%,与当前结冷胶生产技术比较生产过程能耗大幅度降低,可有效降低低酰基结冷胶的生产成本,对实现低酰基结冷胶直接发酵生产具有重要指导意义。
[1]段飞扬,王力,詹晓北,等.结冷胶裂解酶在毕赤酵母中的异源表达及其性质和应用[J].食品与发酵工业,2022,48(9):1-7.
[2] SCHMID J, SPERL N, SIEBER V.A comparison of genes involved in sphingan biosynthesis brought up to date[J].Appl Microbiol Biot,2014,98(18):7719-7733.
[3] PRAJAPATI V D, JANI G K, ZALA B S, et al.An insight into the emerging exopolysaccharide gellan gum as a novel polymer[J].Carbohyd Polym,2013,93(2):670-678.
[4] AGNELLO S, GASPERINI L, MANO J F, et al.Synthesis, mechanical and thermal rheological properties of new gellan gum derivatives[J].Int J Biol Macromol,2017,98(2):646-653.
[5]BAJAJ I,SURVASE S,SAUDAGAR P,et al.Gellan gum:Fermentative production, downstream processing and applications[J].Food Technol Biotech,2007,45(4):341-354.
[6] GUO N, ZHU G L, CHEN D, et al.Preparation and characterization of gellan gum-guar gum blend films incorporated with nisin[J].J Food Sci,2020,85(6):1799-1804.
[7]GRAHAM S,MARINA P F,BLENCOWE A.Thermoresponsive polysaccharides and their thermoreversible physical hydrogel networks[J].Carbohyd Polym,2019,207(6):143-159.
[8]OGAWA E,TAKAHASHI R,YAJIMA H,et al.Effects of molar mass on the coil to helix transition of sodium-type gellan gums in aqueous solutions[J].Food Hydrocolloid,2005,20(2):378-385.
[9] 陈青,程红梅,周涛涛,等.不同超声条件下结冷胶酸性凝胶的凝胶特性研究[J].农业机械学报,2021,52(10):402-408.
[10]杭琳悦.高酰基结冷胶、k-卡拉胶对低脂乳化,肠品质改良及热诱导凝胶机理研究[D].杭州:浙江工商大学,2022.
[11]孟岳成,李朱承,徐雪姣,等.高、低酰基结冷胶的乳化活性及稳定性[J].中国食品学报,2021,21(3):210-216.
[12]芮金红.结冷胶生产菌株代谢工程改造[D].呼和浩特:内蒙古大学,2019.
[13]李朱承.高酰基结冷胶悬浮指标的测定方法研究及应用[D].杭州:浙江工商大学,2020.
[14]汪振法,包鑫,董爽,等.高酰基结冷胶在常温乳酸菌饮料中的应用研究[J].发酵科技通讯,2018,47(2):100-104.
[15]陈青,周涛涛,程红梅,等.低酰基/高酰基复合酸性结冷胶凝胶的凝胶特性研究[J].农业机械学报,2020,51(6):360-365.
[16]刘三宝,郭娜,朱桂兰,等.低酰基结冷胶-瓜尔豆胶复配体系的凝胶特性与流变特性研究[J].农产品加工,2019,486(16):6-9.
[17]李荣.低酰基结冷胶流体凝胶的制备及其流变特性研究[D].杭州:浙江工商大学,2019.
[18]赵越,胡佳麒,刘冠辰,等.高酰基结冷胶对羧甲基纤维素钠溶液流变特性的影响及其在常温饮用型酸奶中的应用[J].饮料工业,2022,25(5):13-20.
[19]崔亥迪.大蒜多糖对低酰结冷胶的改良作用及应用[D].泰安:山东农业大学,2021.
[20]MAO R,TANG J,SWANSON B G.Texture properties of high and low acyl mixed gellan gels[J].Carbohyd Polym,2000,41(4):331-338.
[21] WANG X, ZHENG D, LIANG R.An efficient electro-competent cells generation method of Xanthomonas campestris pv.campestris:its application for plasmid transformation and gene replacement[J].Adv Microbiol,2016,6(2):79-87.
[22]刘玉杰,邵文泰,张浩,等.活的非可培养状态细菌的培养和复苏条件的研究[J].食品安全质量检测学报,2022,13(24):8144-8151.
[23]YUAN S,LIANG J,ZHANG Y,et al.Evidence from thermal aging indicating that the synergistic effect of glyoxal and sodium sulfite improved the thermal stability of conformational modified xanthan gum[J].Polymers,2022,14(2):243-249.
[24]袁淏.高酰基结冷胶的开发与生产技术研究[D].郑州:河南工业大学,2017.
[25]王亚珍.少动鞘氨醇单胞菌高产结冷胶菌株的选育及其生物合成机理研究[D].镇江:江苏大学,2021.
[26]陈亚敏.结冷胶发酵生产工艺技术优化研究[D].杭州:浙江大学,2011.
[27]徐力.结冷胶生产菌株选育及发酵优化[D].杭州:浙江工业大学,2015.