沃柑为“坦普尔”橘橙和“丹西”红橘的杂交种,原产于以色列,后于韩国引种到我国[1],广泛种植于广西等地。沃柑是典型的非呼吸跃变型果实,在采摘时已经接近成熟,所以在采后储藏及运输过程中易发生腐烂[2],每年在采后运输期间造成的损失占总产量的20%~40%[3-4],严重时甚至可以达到50%[5],给果农造成了严重的经济损失。其中由意大利青霉(Penicillium italicum)引起的青霉病和由指状青霉(Penicillium digitatum)引起的绿霉病又是柑橘采后最主要的病害,占总损失量的90%[6]。除此之外,橘青霉(Penicillium citrinum)和扩展青霉(Penicillium expansum)也是导致柑橘采后腐烂的青霉菌[7]。
由于长期使用同一种化学保鲜杀菌剂会使病原菌产生一定的抗药性,对环境安全没有保障,随着人们对于食品安全和生态保护意识的增加,生物防控保鲜剂逐步成为研究热点[8-11]。研究表明,拮抗细菌经过代谢可以产生拮抗细菌或真菌的物质[12],从而达到降低沃柑采后病害的发生率。贝莱斯芽孢杆菌(Bacillus velezensis)是一种能够产生抗逆性芽孢的好氧或兼性好氧型革兰氏阳性菌[13],具有良好的抑菌性,可以分泌多种抑菌物质,从而达到抑制病原菌的作用,主要包括:伊枯草菌素(Iturins)[14]、丰原素(Fengycins)[15]以及表面活性素(Surfactins)[16]等脂肽类抗生素[17];蛋白酶、几丁质酶和β-葡聚糖酶等蛋白类抗菌物质[18]以及地非西丁(Difficidin)[19]、大环内酯类抗生素(Macro lactin)[20]等聚酮类化合物。ARREBOLA E等[21]在柑橘果实表面发现了一株解淀粉芽孢杆菌(Bacillus amyloliquefaciens),对柑桔黑腐病菌(Alternariacitri)、胶孢炭疽菌(Colletotrichum gloeosporioides)、皮壳青霉(Penicillium crustosum)等7种柑橘采后病害的致病真菌具有明显的抑制作用,且在其代谢产物中,脂肽类的伊枯草菌素家族对抑制柑橘采后真菌性病害起至关重要的作用。孙平平等[22]研究证明贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌具有良好的抑制作用,活体抑制率可达92.88%及77.47%。鲁晏宏[23]从香梨树叶片和枝条内分离出一株内生贝莱斯芽孢杆菌NY2,可以有效抑制香梨采后青霉病。在国际上,枯草芽孢杆菌(Bacillus subtilis)及部分贝莱斯芽孢杆菌(Bacillus velezensis)已经作为生物防控保鲜剂面世了,被广泛用于防治白粉病、灰霉菌、棉花枯萎病和苹果腐烂病等植物病害[24-26]。
本课题组前期从沃柑表皮筛选到一株能够有效抑制沃柑采后腐烂致病菌青霉(Penicillium sp.)的贝莱斯芽孢杆菌wr8,通过单因素试验与响应面分析法对贝莱斯芽孢杆菌(Bacillus velezensis)wr8高产抑菌物质的发酵条件进行优化,以期提高菌株wr8的抑菌活性,有效预防由青霉侵染造成的沃柑采后腐烂现象,为研究开发新型生物防腐剂提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
青霉(Penicillium sp.):由本实验室分离保藏。
贝莱斯芽孢杆菌(Bacillus velezensis)wr8:由本实验室分离自沃柑果实,现保藏于广东省微生物菌种保藏中心(Guangdong Microbial Culture Collection Center,GDMCC)。
1.1.2 实验试剂
胰蛋白胨、酵母粉(均为生化试剂):赛默飞世尔科技公司;氯化钠(分析纯):天津市北辰方正试剂厂;琼脂粉(生化试剂)、L-谷氨酸、L-精氨酸(均为分析纯):北京索莱宝科技有限公司;尿素、氯化钙、氯化钾(均为分析纯):国药集团化学试剂有限公司;牛肉膏(生化试剂):北京奥博星生物技术有限责任公司;硫酸铵、氢氧化钠(均为分析纯):天津欧博凯化工有限公司;氯化锰(分析纯):天津市永大化学试剂有限公司;氯化镁(分析纯):天津市大茂化学试剂厂;盐酸(分析纯):成都市科隆化学品有限公司。
1.1.3 培养基
LB培养基:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,氯化钠10.0 g/L,pH值调至7.0,121 ℃灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸出粉6.0 g/L,葡萄糖20.0 g/L,琼脂20.0 g/L,pH值调至5.5±0.2,121 ℃灭菌20 min。
马铃薯葡萄糖软琼脂培养基:马铃薯浸出粉6.0 g/L,葡萄糖20.0g/L,琼脂粉8.0 g/L,121 ℃灭菌20 min。
1.2 仪器与设备
SQP电子天平、PB-10酸度计:赛多利斯科学仪器(北京)有限公司;SW-CJ-1FD超净工作台:南京菲奇工贸有限公司;YM50 50 L立式压力蒸汽灭菌锅:上海高致精密仪器有限公司;MIKRO 220R高速冷冻离心机:德国Hettich科学仪器有限公司;MIN QUAN MQD-B3R全温三层组合式振荡培养箱:上海旻泉仪器有限公司;PQX-160人工气候箱:上海精其仪器有限公司。
1.3 方法
1.3.1 种子液的制备
挑取贝莱斯芽孢杆菌wr8单菌落于装液量为150 mL/250 mL LB培养基中,37 ℃、220 r/min振荡培养7.0 h作为种子液。
1.3.2 发酵上清液的制备
将种子液以2.0%的接种量接入装有150 mL LB培养基的250 mL三角瓶中,37 ℃、220 r/min振荡培养24 h,发酵液12 000 r/min离心5 min,取上清过0.22 μm无菌滤膜备用。
1.3.3 抑菌活性的测定
以青霉为指示菌,使用抑菌圈法测定发酵液的抑菌活性,活性大小以抑菌圈直径(mm)表示。指示菌平板的下层为PDA培养基,上层为一薄层混有青霉孢子的PDA软琼脂培养基,用1 mL无菌吸头打孔(直径9 mm),取100 μL无菌上清液于孔中,以LB培养基作空白对照,待液体吹干后,30 ℃倒置培养48 h,采用十字交叉法测量抑菌圈直径,取平均值,每个处理做3组平行。
1.3.4 菌株wr8发酵条件优化单因素试验
在初始LB培养基基础上分别考察种龄(5 h、6 h、7 h、8 h、9 h),装液量(100 mL/250 mL、125 mL/250 mL、150 mL/250 mL、175 mL/250 mL、200 mL/250 mL),接种量(0.5%、1.0%、1.5%、2.0%、2.5%),培养基初始pH值(6.0、6.5、7.0、7.5、8.0),氮源种类(10.0 g/L硫酸铵、尿素、牛肉膏、精氨酸、谷氨酸),最佳氮源添加量(5.0 g/L、10.0 g/L、15.0 g/L、20.0 g/L、25.0 g/L),无机盐种类(10.0 g/L氯化钠、氯化镁、氯化钾、氯化钙、氯化锰),无机盐添加量(5.0 g/L、10.0 g/L、15.0 g/L)对贝莱斯芽孢杆菌wr8对青霉的抑菌圈的影响。
1.3.5 菌株wr8发酵条件优化Plackett-Burman(PB)试验
PB试验可以通过少量试验从多个因素中快速选出影响较显著的几个因素,故对种龄、装液量、接种量、初始pH值、牛肉膏添加量、氯化钾添加量6个因素均选取2个水平,以菌株wr8对青霉产生的抑菌圈直径作为响应值筛选影响显著的因素。PB试验设计因素与水平见表1。
表1 菌株wr8发酵条件优化PB试验设计因素与水平
Table 1 Factors and levels of PB experiments for fermentation conditions optimization of strain wr8
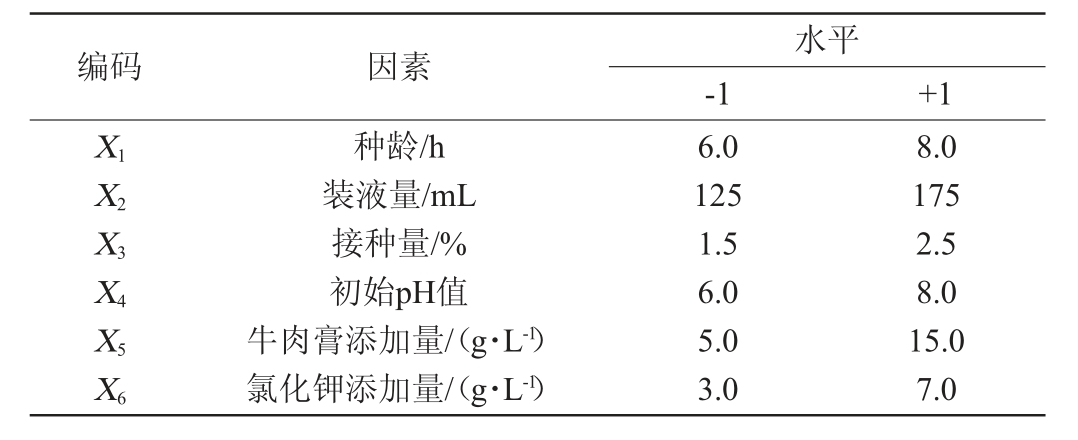
编码 因素水平-1 +1 X1X2X3X4X5X6种龄/h装液量/mL接种量/%初始pH值牛肉膏添加量/(g·L-1)氯化钾添加量/(g·L-1)6.0 125 1.5 6.0 5.0 3.0 8.0 175 2.5 8.0 15.0 7.0
1.3.6 菌株wr8发酵条件优化最陡爬坡试验
根据PB试验对筛选出来的显著性因子,结合各因子的效应系数及实际情况对变化方向和步长进行设计,并按正负效应选择高低水平进行最陡爬坡试验,确定Box-Behnken试验的起始中心点。
1.3.7 菌株wr8发酵条件优化Box-Behnken(BB)试验设计
在PB及最陡爬坡试验基础上,采用统计软件Design Expert 12,按照BB中心组和试验设计原理,以装液量(A)、接种量(B)、牛肉膏添加量(C)为自变量,以抑菌圈直径(Y)为响应值,进行3因素3水平响应面分析试验。BB试验设计因素与水平见表2。
表2 菌株wr8发酵条件优化BB试验因素与水平
Table 2 Factors and levels of BB experiments for fermentation conditions optimization of strain wr8
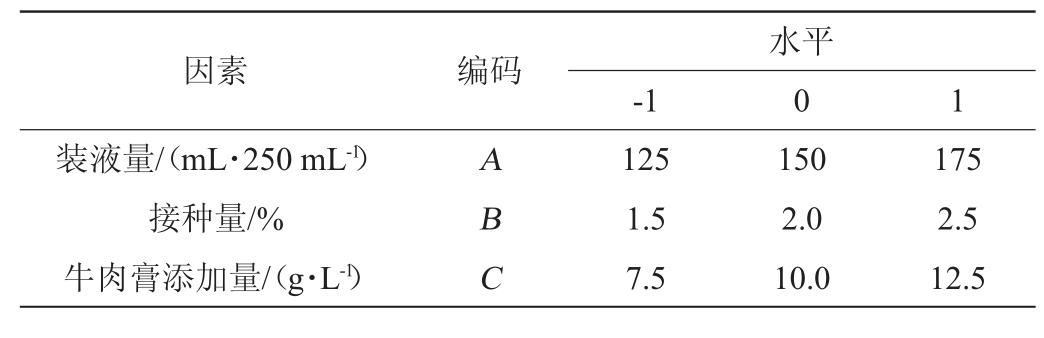
因素 编码装液量/(mL·250 mL-1)接种量/%牛肉膏添加量/(g·L-1)-1水平0 1 ABC 125 1.5 7.5 150 2.0 10.0 175 2.5 12.5
1.3.8 数据处理
采用Excel 2016及Design Expert 12软件对数据进行分析处理。
2 结果与分析
2.1 菌株wr8发酵条件优化单因素试验
各培养条件对贝莱斯芽孢杆菌wr8对青霉产生的抑菌圈的影响见图1。

图1 各培养条件对菌株wr8抑菌效果的影响
Fig.1 Effect of culture conditions on antifungal effect of strain wr8
由图1可知,在LB初始培养基基础上选择种龄7 h,装液量150 mL/250 mL,接种量2.0%,培养基初始pH值6.5,氮源10.0 g/L牛肉膏,无机盐5.0 g/L氯化钾为适宜培养条件。
2.2 Plackett-Burman试验筛选显著因子
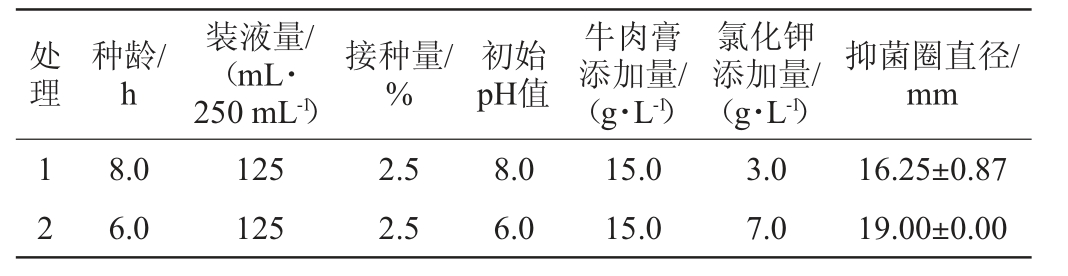
根据单因素试验共设计12组试验,每组试验重复3次,试验结果见表3。各因素之间的水平及效应评价见表4。采用Design Expert 12软件对表3数据进行拟合,得到拟合二阶回归方程:Y=17.10-0.272 0X1-0.791 7X2+0.631 9X3-0.590 3X4-0.5926X5+0.1678X6+1.2X1X2+0.816 0X2X6,由表4可知,该模型决定系数R2=0.978 9,校正决定系数R2Adj=0.922 5,表明该模型的相关性,重复性均较好,因素水平设计合理;P值0.019 4<0.05,表明该模型影响显著。各因素对菌株wr8抑菌效果的影响显著性大小顺序为装液量>接种量>牛肉膏添加量>初始pH值>种龄>氯化钾添加量,故确定在初始pH值为6.5,种龄7.0 h,添加5.0 g/L氯化钾时对影响菌株wr8抑菌效果较显著的前3个因素装液量、牛肉膏添加量及接种量进行优化。
表3 菌株wr8发酵条件优化PB试验设计及结果
Table 3 Design and results of PB experiments for fermentation conditions optimization of strain wr8
?
续表

处理种龄/h装液量/(mL·250 mL-1)接种量/%初始pH值牛肉膏添加量/(g·L-1)氯化钾添加量/(g·L-1)抑菌圈直径/mm 3 4 5 6 7 8 9 1 0 11 12 6.0 6.0 8.0 8.0 6.0 6.0 8.0 8.0 6.0 8.0 125 175 175 125 125 175 125 175 175 175 1.5 2.5 1.5 2.5 1.5 1.5 1.5 1.5 2.5 2.5 8.0 6.0 6.0 8.0 6.0 8.0 6.0 8.0 8.0 6.0 5.0 15.0 5.0 5.0 5.0 15.0 15.0 15.0 5.0 5.0 7.0 7.0 7.0 7.0 3.0 3.0 3.0 7.0 3.0 3.0 18.25±0.87 17.33±0.72 18.17±1.84 16.58±0.76 20.75±0.43 12.50±0.00 16.50±1.00 16.67±0.88 14.75±0.00 18.42±2.96
表4 PB试验主效应分析
Table 4 Main effect analysis of PB experiments design
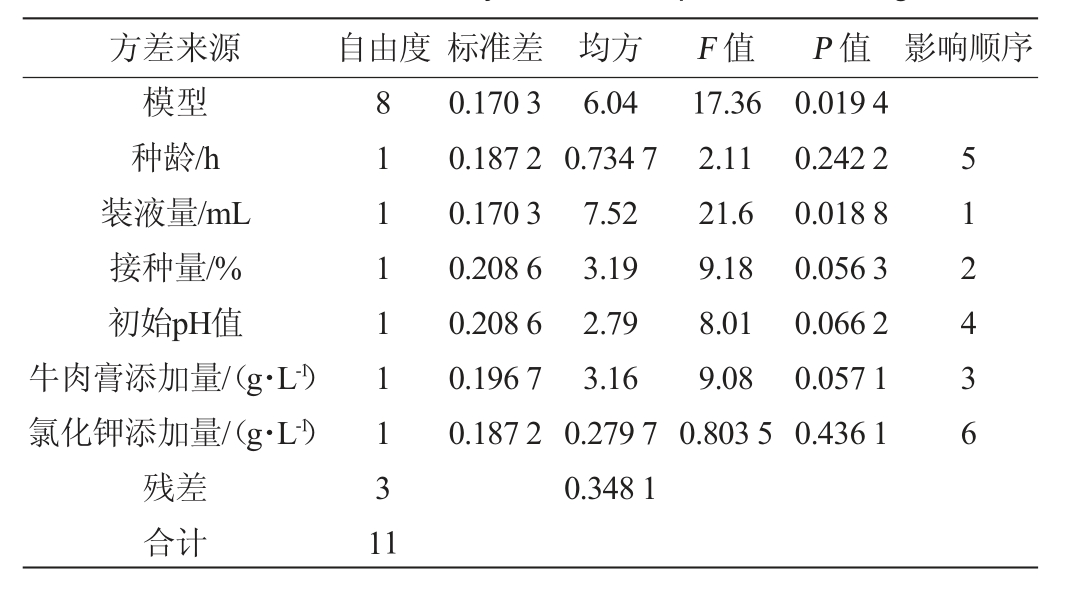
方差来源 自由度 标准差 均方 F 值 P 值 影响顺序模型种龄/h装液量/mL接种量/%初始pH值牛肉膏添加量/(g·L-1)氯化钾添加量/(g·L-1)残差合计811111131 1 0.170 3 0.187 2 0.170 3 0.208 6 0.208 6 0.196 7 0.187 2 6.04 0.734 7 7.52 3.19 2.79 3.16 0.279 7 0.348 1 17.36 2.11 21.6 9.18 8.01 9.08 0.803 5 0.019 4 0.242 2 0.018 8 0.056 3 0.066 2 0.057 1 0.436 1 512436
2.3 最陡爬坡试验
在PB试验基础上进行最陡爬坡试验。装液量、接种量以及牛肉膏添加量是3个较显著的影响因子,根据PB试验结果设计这3个影响因子的变化方向和步长,装液量以每次降低25 mL/250 mL、接种量增加0.5%、牛肉膏添加量降低2.5 g/L为步长,每组处理重复3次,最陡爬坡试验设计和结果见表5。
表5 菌株wr8发酵条件优化最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent tests for fermentation conditions optimization of strain wr8
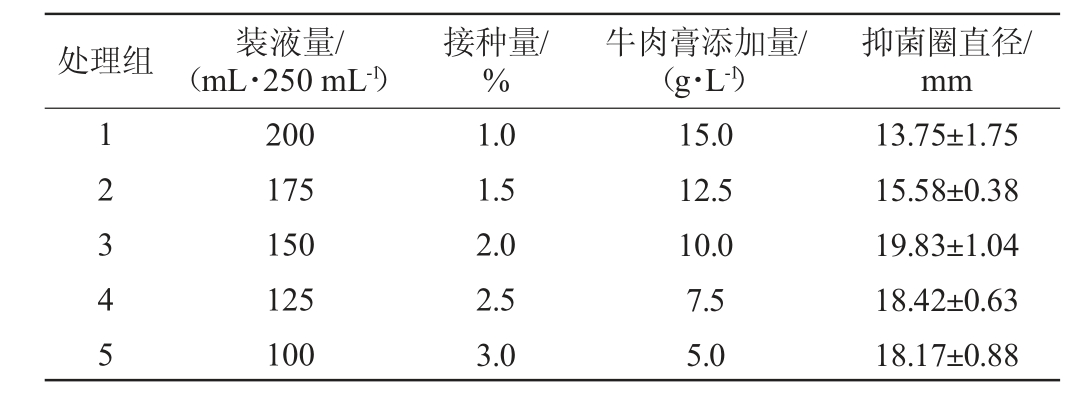
处理组 装液量/(mL·250 mL-1)接种量/%牛肉膏添加量/(g·L-1)抑菌圈直径/mm 12345 200 175 150 125 100 1.0 1.5 2.0 2.5 3.0 15.0 12.5 10.0 7.5 5.0 13.75±1.75 15.58±0.38 19.83±1.04 18.42±0.63 18.17±0.88
由表5可知,第三组处理即装液量为150/250 mL、接种量为2.0%、牛肉膏添加量为10.0 g/L时,菌株wr8产生的抑菌圈直径最大,为(19.83±1.04)mm,故选择该组试验条件作为响应面试验的中心点。
2.4 Box-Behnken试验结果与响应面分析
2.4.1 响应面试验设计与结果
通过前期试验,以150 mL/250 mL装液量、2.0%接种量及10.0 g/L牛肉膏添加量为中心点进行BB试验设计,结果见表6,方差分析见表7。
表6 菌株wr8发酵条件优化BB试验设计与结果
Table 6 Design and results of BB experiments for fermentation conditions optimization of strain wr8

试验号 A 装液量/(mL·250 mL-1)B 接种量/%C 牛肉膏添加量/(g·L-1)Y 抑菌圈直径/mm 1234567891 0 11 12 13 14 15 16 17 125 175 150 125 150 150 175 150 125 150 150 150 150 125 150 175 175 2.0 2.5 1.5 2.5 2.0 2.0 1.5 1.5 2.0 2.0 2.0 2.5 2.0 1.5 2.5 2.0 2.0 12.5 10.0 12.5 10.0 10.0 10.0 10.0 7.5 7.5 10.0 10.0 12.5 10.0 10.0 7.5 12.5 7.5 16.42±0.76 14.83±0.14 16.67±0.63 15.25±0.25 20.33±1.94 20.42±0.80 14.67±0.14 17.00±0.75 16.50±0.50 20.25±1.75 20.50±1.56 17.67±0.88 20.42±0.29 15.25±0.25 17.08±1.51 15.67±0.38 15.92±0.14
表7 回归模型的方差分析
Table 7 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
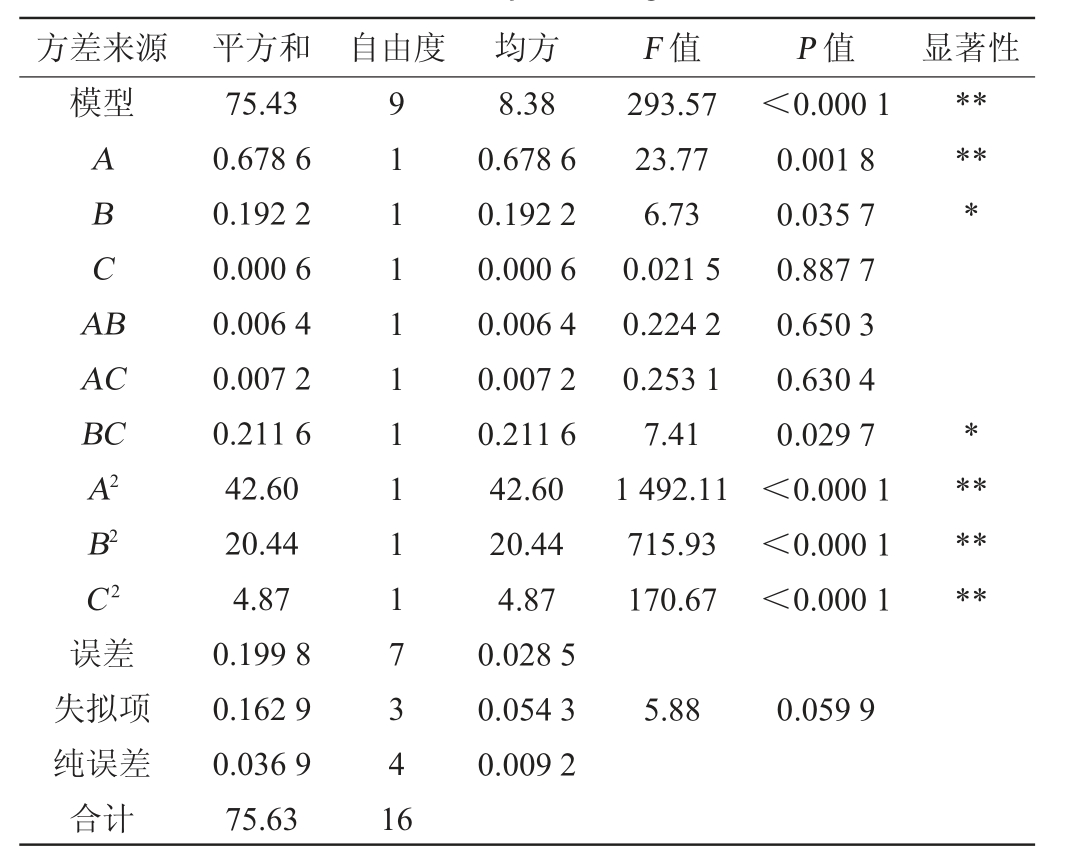
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*****AC BC A2 B2 C2误差失拟项纯误差合计75.43 0.678 6 0.192 2 0.000 6 0.006 4 0.007 2 0.211 6 42.60 20.44 4.87 0.199 8 0.162 9 0.036 9 75.63 91111111117341 6 8.38 0.678 6 0.192 2 0.000 6 0.006 4 0.007 2 0.211 6 42.60 20.44 4.87 0.028 5 0.054 3 0.009 2 293.57 23.77 6.73 0.021 5 0.224 2 0.253 1 7.41 1 492.11 715.93 170.67<0.000 1 0.001 8 0.035 7 0.887 7 0.650 3 0.630 4 0.029 7<0.000 1<0.000 1<0.000 1*******5.88 0.059 9
利用Design Expert 12统计软件对表6结果进行分析,得到3个因素对贝莱斯芽孢杆菌wr8的抑菌圈直径(Y)影响的拟合二次多项方程:Y=20.38-0.291 3A+0.155 0B-0.008 7C+0.040 0AB-0.042 5AC+0.230 0BC-3.18A2-2.20B2-1.08C2。
由表7可知,该回归方程P<0.000 1,说明该模型极显著;失拟项P=0.059 9>0.05,说明失拟不显著,方程回归模型拟合真实水平,选择合理。决定系数R2=0.997 4、校正决定系数R2Adj=0.994 0,说明该回归方程拟合程度高;变异系数为0.974 2、信噪比为45.298 5,说明试验和模型均可靠。根据表中F值可知,各因素对抑菌圈直径的影响程度存在差异,一次项A、二次项A2、B2、C2对菌株wr8的抑菌效果具有极显著影响(P<0.01),一次项B、交互项BC对菌株wr8的抑菌效果具有显著的影响(P<0.05)。
2.4.2 响应面分析
3个因素间交互作用对菌株wr8抑菌效果影响的响应曲面及等高线图见图2。由图2可知,各因素间的交互作用对抑菌圈直径(Y)均呈现出抛物面型关系,先上升后下降,所得到的响应面都存在一个极大值点,其中接种量与牛肉膏添加量之间的交互作用最为明显,装液量与牛肉膏添加量之间的交互作用次之,装液量与接种量之间的交互作用最次。
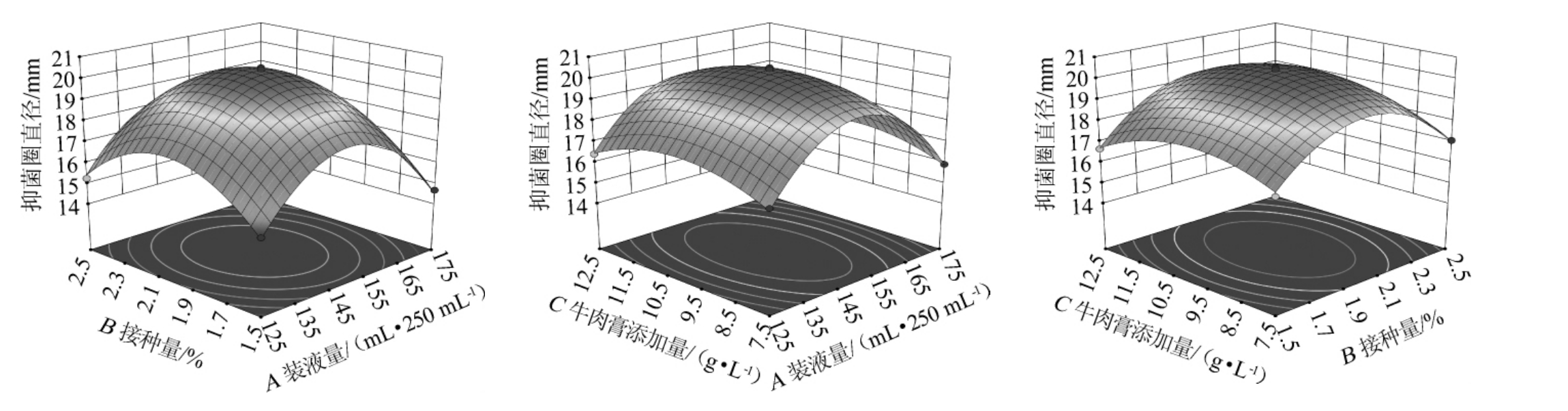
图2 装液量、接种量、牛肉膏添加量间交互作用对菌株wr8抑菌圈直径影响的响应曲面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between loading volume, inoculum and beef extract addition on inhibitory zone diameter of strain wr8
经过响应面优化,根据拟合二阶模型公式得到理论上菌株wr8产抑青霉物质最佳的培养条件:装液量148.748 mL/250 mL、接种量2.057%、牛肉膏添加量9.416 g/L,产生的抑菌圈直径预测值为20.316 mm。为验证其最佳试验条件,并满足实际操作可行性,选择装液量150 mL/250 mL、接种量2.0%、牛肉膏添加量9.5 g/L进行3次重复试验,得到菌株wr8的抑菌圈直径实际值为(20.42±0.14)mm,说明该模型结果可靠,是优化前(12.50±0.87)mm的1.63倍。
3 结论
青霉是造成沃柑采后腐烂的重要病原菌之一,以青霉为指示菌,利用单因素试验及PB试验、最陡爬坡试验和BB试验对其拮抗细菌贝莱斯芽孢杆菌wr8的培养条件进行研究,得到其最优的发酵条件:蛋白胨10.0 g/L、牛肉膏9.5 g/L、酵母粉5.0 g/L、氯化钾5.0 g/L、种龄7.0 h、装液量150/250 mL、接种量2.0%、初始pH值6.5,其中装液量、接种量及牛肉膏添加量为主效应因素,对菌株wr8的抑菌效果影响较显著,优化后菌株wr8对青霉产生的抑菌圈直径为(20.42±0.14)mm,是未优化前(12.50±0.87)mm的1.63倍。综上,贝莱斯芽孢杆菌wr8能够有效抑制青霉,对防治沃柑采后腐烂具有良好的应用前景,为研究开发新型生物防腐剂提供了应用基础。
[1]黄其椿,刘吉敏,何新华,等.晚熟杂柑“沃柑”在广西武鸣的栽培表现初报[J].中国南方果树,2014,43(3):86-88.
[2]王智荣.荧光假单胞菌ZX生物防治采后锦橙青霉病和绿霉病研究[D].重庆:西南大学,2019.
[3]戚雯雯.合掌消抑菌富集物对柑橘绿霉病的抑菌机理及其保鲜效果的研究[D].南昌:江西农业大学,2020.
[4]WURYATMO E,ABLE A J,FORD C M,et al.Effect of volatile citral on the development of blue mould,green mould and sour rot on navel orange[J].Aust Plant Pathol,2014,43(4):403-411.
[5]陈山乔,李丹丹,贾丽娜,等.柑橘内在品质评价及保鲜技术研究进展[J].包装工程,2021,42(7):45-53.
[6]ZHANG Z F,ZHU Z G,MA Z H,et al.A molecular mechanism of azoxystrobin resistance in Penicillium digitatum UV mutants and a PCR-based assay for detection of azoxystrobin-resistant strains in packing-or storehouse isolates[J].Int J Food Microbiol,2009,131(2):157-161.
[7]于新,冯彤,庞杰,等.柑橘采后青霉毒素的研究[J].食品科学,1998,19(11):11-13.
[8]郭娟华,涂起红,陈楚英,等.拮抗微生物防治柑橘采后病害研究进展[J].食品科学,2013,34(23):351-356.
[9]TALIBI I,ASKARNE L,BOUBAKER E H,et al.Antifungal activity of Moroccan medicinal plants against citrus sour rot agent Geotrichum candidum[J].Lett Appl Microbiol,2012,55(2):155-161.
[10]TALIBI I,BOUBAKER H,BOUDYACH E H.Alternative methods for the control of postharvest citrus diseases[J].J Appl Microbiol, 2014,117(1):1-17.
[11]张兰,李节法,陈东奎,等.柑桔采后病害新型生物防控保鲜剂研究进展[J].广西农学报,2016,31(5):59-63.
[12]LUCON C M M,GUZZO S D,JESUS C O,et al.Postharvest harpin or Bacillus thuringiensis treatments suppress citrus black spot in'Valencia'oranges[J].Crop Protect,2010,29(7):766-772.
[13]邱博书.豆酱中具有抗青霉、产风味特性芽孢杆菌菌株的分离筛选[D].沈阳:沈阳农业大学,2019.
[14]RASIYA K T,DENOJ S.Iturin and surfactin from the endophyte Bacillus amyloliquefaciens strain RKEA3 exhibits antagonism against Staphylococcus aureus[J].Biocatal Agr Biotechnol,2021,36:102125.
[15]ZHEN L L,WANG Z Q,TAO W,et al.Isolation and characterization of fengycins produced by Bacillus amyloliquefaciens JFL21 and its broadspectrum antimicrobial potential against multidrug-resistant foodborne pathogens[J].Front Microbiol,2020,11:579621.
[16]CAROLINA R G,ILSON P P,FABIO F M,et al.Surfactin from Bacillus velezensis H2O-1: production and physicochemical characterization for postsalt applications[J].J Surf Deterg,2019,22(3):451-462.
[17]张德锋,高艳侠,王亚军,等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报,2020,47(11):3634-3649.
[18] DHOUIB H, ZOUARI I, ABDALLAH D B, et al.Potential of a novel endophytic Bacillus velezensis in tomato growth promotion and protection against Verticillium wilt disease[J].Biol Control, 2019, 139: 104092-104092.
[19] KAJAL C, KIZHAKKEKALAM K, MINJU J, et al.Difficidin class of polyketide antibiotics from marine macroalga-associated Bacillus as promising antibacterial agents[J].Appl Microbiol Biotechnol,2021,105(16-17):1-14.
[20]CHEN L,WANG X H,LIU Y P.Contribution of macrolactin in Bacillus velezensis CLA178 to the antagonistic activities against Agrobacterium tumefaciens C58[J].Arch Microbiol,2021,203(4):1-10.
[21]ARREBOLA E,JACOBS R,KORSTEN L.Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J].J Appl Microbiol,2010,108(2):386-395.
[22]孙平平,崔建潮,贾晓辉,等.贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J].微生物学报,2018,58(9):1637-1646.
[23]鲁晏宏.梨树内生菌对香梨贮藏品质的影响[D].乌鲁木齐:新疆大学,2021.
[24]SHARMA R R,SINGH D,SINGH R.Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review[J].Biol Control,2009,50(3):205-221.
[25]HYEON N M,SOO P M,GI K H,et al.Biological control of strawberry Fusarium wilt caused by Fusarium oxysporum f.sp.fragariae using Bacillus velezensis BS87 and RK1 formulation[J].J Microbiol Biotechnol,2009,19(5):520-524.
[26]陈龙,吴兴利,闫晓刚,等.贝莱斯芽孢杆菌的分类、次级代谢产物及应用[J].家畜生态学报,2020,41(1):1-8.