黄酒为中国所独有的世界三大发酵古酒之一,以稻米、黍米等为主要原料,经麦曲等糖化发酵剂酿制而成,具有众多保健功效[1]。我国黄酒的品种很多,主要分布在江浙沪区域,但其中以浙江的绍兴酒最具有代表性[2]。
传统绍兴酒酿造过程为开放式发酵,因此环境中的微生物与主要酿造微生物均影响黄酒风味物质的形成[3]。但作为黄酒酿造过程中糖化剂与产香剂的绍兴酒麦曲[4],因富含霉菌、酵母、细菌等多种微生物,且在酿造的不同阶段发挥重要作用[5],故被称为“酒之骨”[6]。绍兴酒企多采用生麦曲投料,绍兴酒麦曲按照麦曲制作工序可分为手工麦曲和机制麦曲[7];按照市域内的地理方位可分为东路和西路[8],以及不属于这两路的中路;按照培养环境可分为开放[9]和封闭(箱式)麦曲[10]。手工和机制麦曲,系草包曲的基础上发展而来,将小麦破碎后开放式生产而得[11],故同属于开放培养绍兴酒麦曲。毛青钟[10]研究开发了黄酒酿造和生麦曲制作自动化控制系统,实现了封闭(箱式)麦曲的生产。受培养环境、制作工序、地理方位等因素的影响,绍兴不同工艺的绍兴酒麦曲品质具有一定差异性,导致黄酒酿造中存在质量不稳定,因此,有必要对绍兴酒麦曲中的微生物群落结构进行分析研究[2]。
目前,关于绍兴酒麦曲的研究主要集中在麦曲工艺的优化[11],以及绍兴酒麦曲不同种类或者用量对黄酒品质的影响[12]等方面,也有利用组学技术研究绍兴酒麦曲中的微生物与代谢物的相关性[13]。随着生物信息学等技术的发展,16S rDNA基因测序等技术被越来越多地应用于样品中较为复杂的微生物菌群分析[14]。如吴树坤等[15]利用高通量测序技术分析四川浓香型大曲微生物群落结构差异,LIU S P等[16]研究绍兴机械化黄酒酿造中的菌群结构,周志立[17]研究绍兴酒麦曲的微生物群落演替等。但关于不同工艺绍兴酒麦曲的微生物多样性分析比较研究还鲜见报道。
本研究采用Illumina Miseq高通量测序技术对6种不同工艺的绍兴酒麦曲微生物菌群多样性进行分析,比较封闭与开放的培养环境因素、手工与机制的制作工序因素、东中西路的市域内地理方位因素对绍兴酒麦曲微生物群落结构的影响,旨在揭示不同工艺绍兴酒麦曲的微生物组成异同,为优化绍兴酒的酿造提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
从绍兴地区东路、中路、西路共收集6种绍兴酒麦曲,分别为东路机制(DLJZ)、东路手工(DLSG)、中路机制(ZLJZ)、中路手工(ZLSG)、西路手工(XLSG)、西路箱式(XLXS14)。除西路箱式为封闭培养外,其余5种麦曲皆为开放培养。6种绍兴酒麦曲的采集时间为2022年10月,所有样品经无菌密封后放入-80 ℃超低温冰箱保藏备用。
1.1.2 试剂
PowerSoilR脱氧核糖核酸(deoxyribo nucleicacid,DNA)IsolationKit:美国MoBIO公司;凝胶回收试剂盒:德国Qiagen公司;聚合酶链式反应(polymerase chain reaction,PCR)样品制备试剂盒:美国illumina公司;高保真PCR混合液:美国NEB公司;Ampure XP磁珠:美国Beckman Coulter公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Illumina Miseq测序仪:美国Illumina公司;Bioanalyzer 2100生物分析仪:美国Agilent公司;NanoDrop2000超微量分光光度计、Qubit@2.0荧光定量仪:美国Thermo Scientific公司;5425 FA型离心机:德国Eppendorf公司;GeneAmpB 9700 PCR仪:美国ABI公司;DYCP-35型凝胶电泳仪:北京六一生物科技有限公司。
1.3 实验方法
1.3.1 绍兴酒麦曲样品微生物基因组DNA提取
采用五点取样法对6种绍兴酒麦曲样品进行取样,称取0.25 g样品,参照PowerSoilR DNA Isolation Kit说明书对样品中微生物基因组DNA进行提取,使用NanoDrop2000测定浓度并检验受蛋白质等污染程度,之后用1%琼脂糖凝胶电泳对DNA的浓度和纯度进行检测。
1.3.2 绍兴酒麦曲样品微生物菌群的Illumina Miseq高通量测序
取适量的基因组DNA为模板,以带有标签Barcode(条码)的341F(5'-ACTCCTACGGGAGGCAGCAG-3')、805R(5'-GGACTACHVGGGTWTCTAAT-3')为引物对细菌菌群的V3-V4区域基因序列进行PCR扩增。以ITS1F(5'-TCCGTAGGTGAACCTGCGG-3')和ITS1R(5'-GCTGCGTTCTTCATCGATGC-3')为引物对真菌ITS区域基因序列进行PCR扩增。PCR扩增体系(50 μL):DNA 10 ng,引物各1 μL,2×高保真PCR混合液25 μL,无核酸酶水定容至50 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共进行35个循环;最后72 ℃延伸5 min[18]。PCR扩增产物用1%琼脂糖凝胶电泳进行纯化回收,纯化后扩增产物委托浙江天科高新技术发展有限公司完成建库和Illumina Miseq高通量测序[19]。
1.3.3 数据处理及分析
使用浙江天科高新技术发展有限公司的分析平台开展生物信息学分析,原始数据使用Uparse软件,根据序列相似度>97%进行操作分类单元(operational taxonomic units,OTUs)聚类,利用核糖体数据库项目(ribosomal database project,RDP)classifier对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为90%。基于OTU聚类分析,使用Qiime软件(Version 1.9.1)对样品Alpha及Beta多样性进行分析。
1.3.4 数据处理
使用SPSS 26.0软件对数据进行分析,结果用“平均值±标准差”表示,组间均数比较采用单因素方差分析。
2 结果与分析
2.1 绍兴酒麦曲样品中细菌菌群多样性分析
2.1.1 细菌菌群稀释曲线分析
稀释曲线是常见的描述组内样品多样性的曲线。稀释曲线可直接反映测序数据量的合理性,并间接反映样品中物种的丰富程度,当曲线趋向平坦时,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种[20]。6种绍兴酒麦曲样品中细菌菌群的稀释曲线见图1。
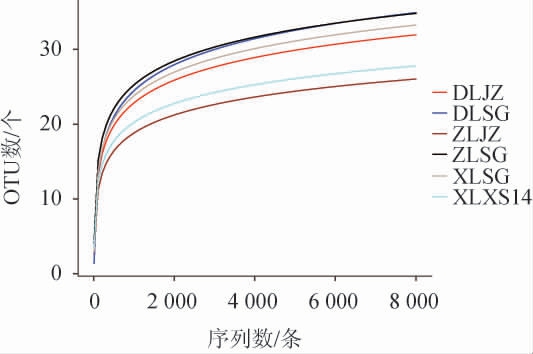
图1 6种绍兴酒麦曲样品中细菌菌群的稀释曲线
Fig.1 Rarefaction curves of bacterial flora in 6 kinds of Shaoxing Huangjiu wheat Qu samples
由图1可知,随着测序深度的增加,OTUs数随之增加,同时稀释曲线趋于平缓,因此,虽随着测序量的增加有可能会发现新的细菌,但样品细菌多样性趋于稳定,说明测序量足够合理[21]。所以,本研究细菌的测序量满足后续的生信分析要求。
2.1.2 细菌菌群测序结果及Alpha多样性分析
Alpha多样性反映特定样本中物种的丰富度和均匀度[22]。覆盖率反应了测序对样本中低丰度物种的覆盖程度[23]。6种绍兴酒麦曲样品细菌菌群测序及Alpha多样性分析结果见表1。由表1可知,所有样本的覆盖率在99.91%~99.95%,说明本次测序覆盖度较好,能够代表所有样品微生物的真实菌群情况。基于97%相似度的OTU数量在34.67~43.67个之间,不同样品间OTU数目不同。ACE指数常用来估计物种总数,其值越大,物种丰富度越高;Shannon指数越大,说明群落多样性越高[24]。由表1亦可知,所有绍兴酒麦曲样品的ACE指数在35.08~51.95之间,Shannon指数在1.26~2.60之间。其中,样品ZLSG的ACE指数最高,样品XLXS14的ACE指数最低,说明中路手工麦曲样品的细菌菌群丰度最高,西路箱式麦曲样品的细菌菌群丰度最低。样品XLXS14的Shannon指数最高,DLSG的Shannon指数最低,说明西路箱式麦曲样品的细菌菌群多样性最高,东路手工麦曲样品的细菌菌群多样性最低。
表1 6种绍兴酒麦曲样品细菌菌群测序及Alpha多样性分析结果
Table 1 Results of bacterial community sequencing and Alpha diversity analysis of 6 kinds of Shaoxing Huangjiu wheat Qu samples
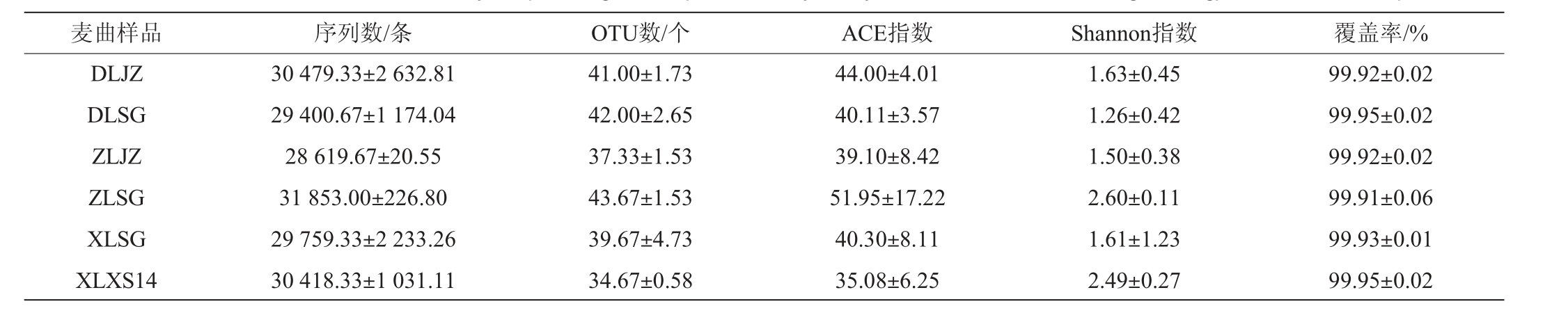
麦曲样品 序列数/条 OTU数/个 ACE指数 Shannon指数 覆盖率/%DLJZ DLSG ZLJZ ZLSG XLSG XLXS14 30 479.33±2 632.81 29 400.67±1 174.04 28 619.67±20.55 31 853.00±226.80 29 759.33±2 233.26 30 418.33±1 031.11 41.00±1.73 42.00±2.65 37.33±1.53 43.67±1.53 39.67±4.73 34.67±0.58 44.00±4.01 40.11±3.57 39.10±8.42 51.95±17.22 40.30±8.11 35.08±6.25 1.63±0.45 1.26±0.42 1.50±0.38 2.60±0.11 1.61±1.23 2.49±0.27 99.92±0.02 99.95±0.02 99.92±0.02 99.91±0.06 99.93±0.01 99.95±0.02
2.1.3 细菌群落组成分析
基于属水平,6种绍兴酒麦曲样品中细菌菌群结构见图2。
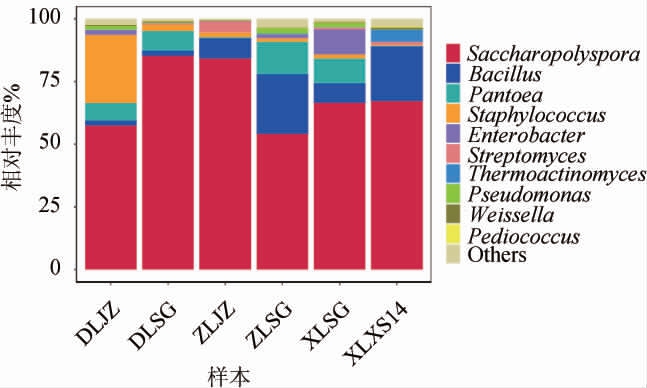
图2 基于属水平6种绍兴酒麦曲样品的细菌菌群结构
Fig.2 Bacterial flora structure of 6 kinds of Shaoxing Huangjiu wheat Qu samples based on genus level
Others表示相对丰度<0.01%的菌属。
由图2可知,从6种绍兴酒麦曲样品中共注释到30个细菌属。在属水平上,东路机制麦曲样品(DLJZ)中的优势细菌属(相对丰度>1%)为糖多孢菌属(Saccharopolyspora)(57.45%)、芽孢杆菌属(Bacillus)(1.92%)、泛生菌属(Pantoea)(7.09%)、葡萄球菌属(Staphylococcus)(27.19%)、肠杆菌属(Enterobacter)(1.83%)和假单胞菌属(Pseudomonas)(1.53%)。东路手工麦曲样品(DLSG)中的优势细菌属为糖多孢菌属(85.24%)、芽孢杆菌属(2.12%)、泛生菌属(7.82%)和葡萄球菌属(2.63%)。中路机制麦曲样品(ZLJZ)中的优势细菌属为糖多孢菌属(84.24%)、芽孢杆菌属(8.05%)、葡萄球菌属(1.88%)和链霉菌属(Streptomyces)(4.53%)。中路手工麦曲样品(ZLSG)中的优势细菌属为糖多孢菌属(54.15%)、芽孢杆菌属(23.78%)、泛生菌属(13.04%)、葡萄球菌属(1.34%)、肠杆菌属(1.35%)和假单胞菌属(2.16%)。西路手工麦曲样品(XLSG)中的优势细菌属为糖多孢菌属(66.61%)、芽孢杆菌属(7.73%)、泛生菌属(9.95%)、葡萄球菌属(1.56%)、肠杆菌属(9.96%)和假单胞菌属(1.63%)。西路箱式麦曲样品(XLXS14)中的优势细菌属为糖多孢菌属(67.26%)、芽孢杆菌属(21.78%)、链霉菌属(1.20%)、高温放线菌属(Thermoactinomyces)(4.81%)。糖多孢菌属和芽孢杆菌属为6种绍兴酒麦曲样品中共有的优势细菌属,平均相对丰度分别为69.16%和10.90%,而高温放线菌属仅在西路箱式麦曲样品中为优势细菌属。
对绍兴酒麦曲的细菌菌群多样性分析发现,在属水平6种绍兴酒麦曲样品之间差异较小,绝对优势细菌属均为糖多孢菌属(Saccharopolyspora),绍兴酒麦曲中稳定的优势细菌群落保证了绍兴酒的发酵稳定性。刘芸雅等[2]通过分析绍兴酒麦曲的细菌群落结构,发现黄酒中的优势细菌属为芽孢杆菌属和糖多孢菌属,与本研究相似但丰度存在差异,可能是因麦曲原料、发酵微环境等因素差异所导致。GUAN Z B等[25]通过PCR-变性梯度凝胶电泳(denaturing gel gradient electrophoresis,DGGE)及高通量测序技术研究发现,麦曲中的糖多孢菌属系优势菌群,这与本研究结果相似,这证明了糖多孢菌属在麦曲中的重要性。另有研究表明,黄酒正常发酵过程中糖多孢菌属的浓度要高于异常发酵液中糖多孢菌属的浓度[26],因为糖多孢菌属参与淀粉、麦芽糖、糊精的降解过程,此外糖多孢菌属可将丁酮二酸转化为天冬氨酸,也可进一步将天冬氨酸转化为苏氨酸或甲硫氨酸[16]。
2.1.4 细菌群落相似性分析
无度量多维标定法(non-metric multidimensional scaling,NMDS)是非线性模型,克服了线性模型(包括主成分分析(principal component analysis,PCA)、主坐标分析(principal coordinates analysis,PCoA))的缺点,更好地反映生态学数据的非线性结构,可通过点与点间的距离反映不同样本间的差异程度[27]。基于OTU对6种绍兴酒麦曲样品细菌群落进行NMDS分析结果见图3。
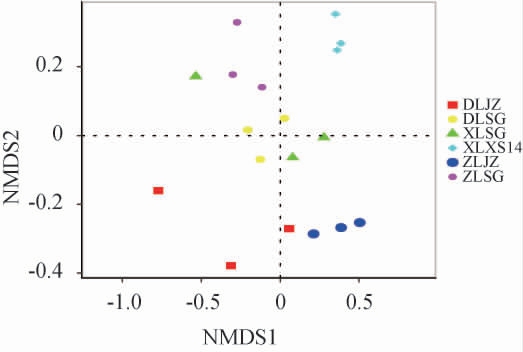
图3 基于操作分类单元的6种绍兴酒麦曲样品细菌群落NMDS分析结果
Fig.3 NMDS analysis results of bacterial community of 6 kinds of Shaoxing Huangjiu wheat Qu samples based on operational taxonomic units
Stress值可以检验NMDS分析结果的优劣[28],由图3可知,基于OTU水平6种绍兴酒麦曲样品细菌菌群NMDS分析的Stress值为0.139,说明分析结果有很好的解释意义。由图3亦可知,R2=0.684 1,P<0.01,说明6种绍兴酒麦曲样品的细菌群落结构有显著差异。样品XLXS14空间分布靠近,表明西路箱式麦曲样品组内微生物组成具有较高的相似性,且独自分布在第一象限,与其他绍兴酒麦曲样品的距离较远,表明西路箱式麦曲样品与其他绍兴酒麦曲样品的细菌群落组成存在较大差异。中路机制麦曲样品(ZLJZ)与中路手工(ZLSG)、东路机制(DLJZ)、东路手工(DLSG)、西路手工(XLSG)麦曲样品的距离较近,表明组间微生物菌群组成相似。结果表明,西路箱式麦曲样品与其他绍兴酒麦曲样品的微生物群落结构存在差异,但其他5种绍兴酒麦曲样品之间的群落结构差异较小,这可能与绍兴酒麦曲的培养环境有关,西路箱式麦曲在润料后进入密闭的培养室内进行保温保湿培养[29],而其他5种绍兴酒麦曲在润料后进行开放培养[17]。周志立[17]认为生麦曲是环境中的微生物与原料中的微生物共同发酵的结果,其研究结果佐证本研究观点。
2.1.5 差异细菌菌群分析
线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)常用于分类学水平物种特征及差异分析[30],6种绍兴酒麦曲样品中差异细菌菌群的LEfSe分析结果见图4。
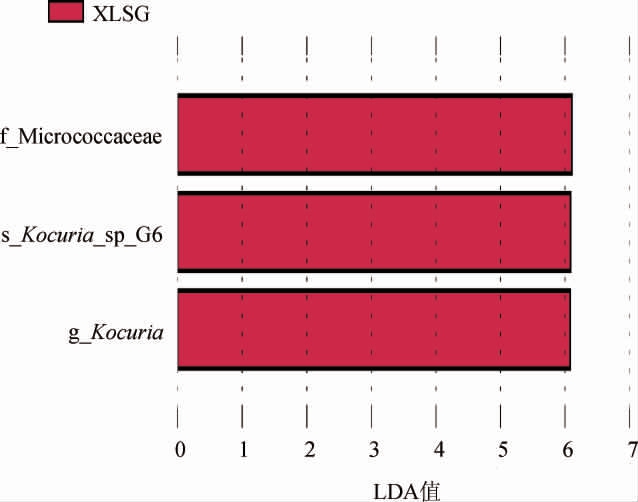
图4 6种绍兴酒麦曲样品中差异细菌菌群的LEfSe分析结果
Fig.4 LEfSe analysis results of different bacterial flora in 6 kinds of Shaoxing Huangjiu wheat Qu samples
由图4可知,从西路手工麦曲样品中共检出3个差异菌群,均为微球菌科(Micrococcaceae)类微生物。西路箱式麦曲样品与其他绍兴酒麦曲样品细菌菌群并不存在明显差异,这与NMDS分析结果存在一定差异,结合细菌群落组成属水平分析结果可知,西路箱式麦曲样品与其他绍兴酒麦曲样品在属水平上的优势菌属相同,仅存在相对丰度的差异。
从细菌菌群的NMDS和LEfSe分析结果可知,6种绍兴酒麦曲样品细菌群落结构差异较小,主要表现为优势菌群相对丰度的差别。由此可见,不同工艺对绍兴酒麦曲细菌菌群结构影响较小。
2.2 绍兴酒麦曲样品中真菌菌群多样性分析
2.2.1 真菌菌群稀释曲线分析
6种绍兴酒麦曲样品中真菌菌群的稀释曲线见图5。
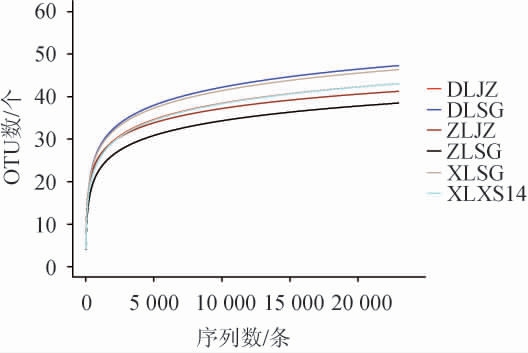
图5 6种绍兴酒麦曲样品中真菌菌群的稀释曲线
Fig.5 Rarefaction curves of fungal flora in 6 kinds of Shaoxing Huangjiu wheat Qu samples
由图5可知,随着测序深度的增加,OTUs数随之增加,同时稀释曲线趋缓,因此,虽随着测序量的增加有可能会发现新的真菌,但样品真菌多样性趋于稳定,说明测序量足够合理。所以,本研究真菌的测序量满足后续的生信分析要求。
2.2.2 真菌菌群测序结果及Alpha多样性分析
6种绍兴酒麦曲样品真菌菌群测序及Alpha多样性分析结果见表2。
表2 6种绍兴酒麦曲样品真菌菌群测序及Alpha多样性分析结果
Table 2 Results of fungal flora sequencing and Alpha diversity analysis of 6 kinds of Shaoxing Huangjiu wheat Qu samples
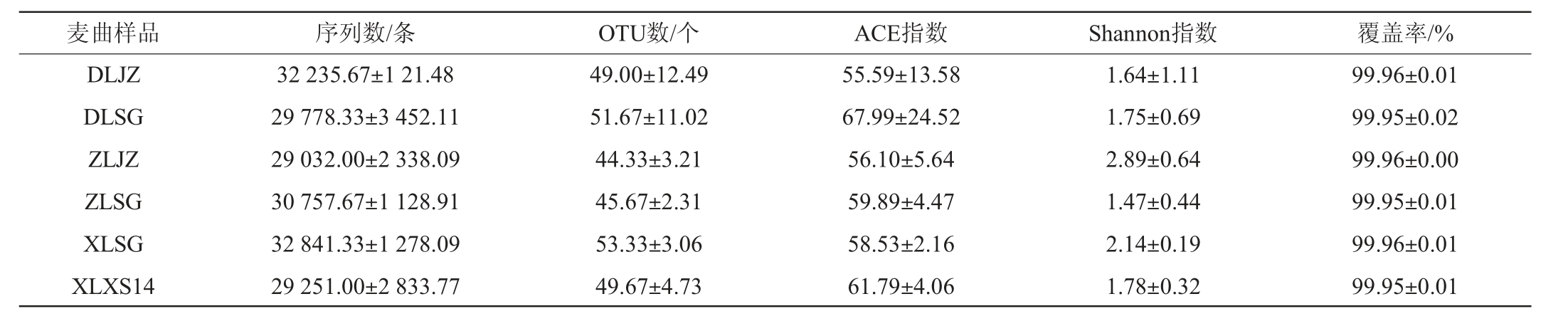
麦曲样品 序列数/条 OTU数/个 ACE指数 Shannon指数 覆盖率/%DLJZ DLSG ZLJZ ZLSG XLSG XLXS14 32 235.67±1 21.48 29 778.33±3 452.11 29 032.00±2 338.09 30 757.67±1 128.91 32 841.33±1 278.09 29 251.00±2 833.77 49.00±12.49 51.67±11.02 44.33±3.21 45.67±2.31 53.33±3.06 49.67±4.73 55.59±13.58 67.99±24.52 56.10±5.64 59.89±4.47 58.53±2.16 61.79±4.06 1.64±1.11 1.75±0.69 2.89±0.64 1.47±0.44 2.14±0.19 1.78±0.32 99.96±0.01 99.95±0.02 99.96±0.00 99.95±0.01 99.96±0.01 99.95±0.01
由表2可知,6种绍兴酒麦曲样品真菌菌群的覆盖率值均>99%,说明本次测序覆盖度较好,能够代表所有样品微生物的真实菌群情况。基于97%相似度OTU数量在44.33~53.33个之间,所有绍兴酒麦曲样品的ACE指数在55.59~67.99之间,Shannon指数在1.47~2.89之间。其中,样品DLSG的ACE指数最高,样品DLJZ的ACE指数最低,说明东路手工麦曲样品的细菌菌群丰度最高,东路机制麦曲样品的细菌菌群丰度最低。样品ZLJZ的Shannon指数最高,ZLSG的Shannon指数最低,说明中路机制麦曲样品的细菌菌群多样性最高,中路手工麦曲样品的细菌菌群多样性最低。
2.2.3 真菌群落组成分析
基于属水平,6种绍兴酒麦曲样品中细菌菌群结构见图6。
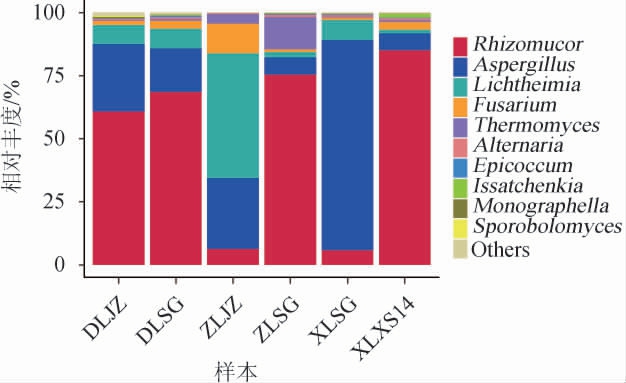
图6 基于属水平6种绍兴酒麦曲样品的真菌菌群结构
Fig.6 Fungal flora structure of 6 kinds of Shaoxing Huangjiu wheat Qu samples based on genus level
Others表示相对丰度<0.01%的菌属。
由图6可知,从6种绍兴酒麦曲样品中共注释到43个真菌属。在属水平上,东路机制麦曲样品(DLJZ)中的优势真菌属(相对丰度>1%)为根毛霉属(Rhizomucor)(60.84%)、曲霉属(Aspergillus)(26.78%)、横梗霉属(Lichtheimia)(7.47%)和镰刀菌属(Fusarium)(1.71%)。东路手工麦曲样品(DLSG)中的优势真菌属为根毛霉属(68.66%)、曲霉属(17.28%)、横梗霉属(7.70%)和镰刀菌属(3.28%)。中路机制麦曲样品(ZLJZ)中的优势真菌属为根毛霉属(6.32%)、曲霉属(28.22%)、横梗霉属(49.42%)、镰刀菌属(11.77%)和嗜热丝孢菌属(3.75%)。中路手工麦曲样品(ZLSG)中的优势真菌属为根毛霉属(75.52%)、曲霉属(6.88%)、横梗霉属(2.00%)、镰刀菌属(1.12%)和嗜热丝孢菌属(12.80%)。西路手工麦曲样品(XLSG)中的优势真菌属为根毛霉属(5.77%)、曲霉属(83.45%)、横梗霉属(7.88%)和镰刀菌属(1.02%)。西路箱式麦曲样品(XLXS14)中的优势真菌属为根毛霉属(85.08%)、曲霉属(6.82%)、横梗霉属(1.47%)、镰刀菌属(2.92%)和Issatchenkia(1.43%)。根毛霉属、曲霉属、横梗霉属和镰刀霉属为6种绍兴酒麦曲样品中的共有优势细菌属,平均相对丰度分别为50.37%、28.32%、12.67%和3.64%,嗜热丝孢菌属为中路机制和中路手工麦曲样品中的优势菌属,而伊萨琴基亚属仅在西路箱式麦曲样品中为优势细菌属。
从真菌属水平分析发现,虽然6种绍兴酒麦曲样品之间存在差异,但根毛霉属和曲霉属是所有样品中相对丰度较高的真菌属,其平均相对丰度之和可达78.69%。麦曲中的根毛霉属(Rhizomucor)和曲霉属(Aspergillus)主要为发酵过程提供丰富的酶系[31],曲霉属(Aspergillus)还可为黄酒发酵中酯类等风味物质的合成提供前体物质[32]。伊萨琴基亚属是西路箱式麦曲中所独有的优势真菌属。XIE G F等[33]通过核糖体基因间隔序列分析(ribosomal intergenic spacer analysis,RISA)等方法分析得到根毛霉属和曲霉属为麦曲中的优势菌群,其结果与本研究结果一致。
2.2.4 真菌群落相似性分析
基于OTU水平6种绍兴酒麦曲样品真菌群落NMDS分析结果见图7。
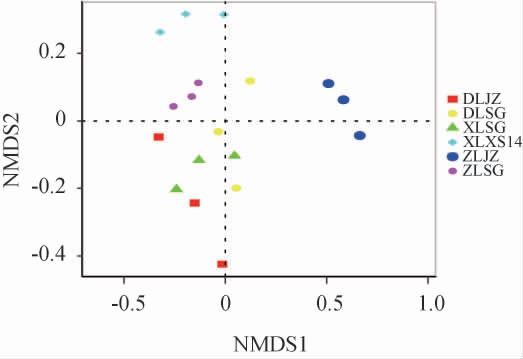
图7 基于操作分类单元水平6种绍兴酒麦曲样品真菌群落NMDS分析结果
Fig.7 NMDS analysis results of fungal community of 6 kinds of Shaoxing Huangjiu wheat Qu samples based on operational taxonomic units level
由图7可知,基于OTU水平6种绍兴酒麦曲样品真菌菌群NMDS分析的Stress值为0.190,说明分析结果有很好的解释意义。由图7亦可知,R2=0.757 8,P<0.01,说明6种绍兴酒麦曲样品的真菌群落结构有显著差异。由图7亦可知,XLXS14样品与其他绍兴酒麦曲样品的距离较远,表明西路箱式麦曲与其他绍兴酒麦曲的真菌群落组成存在较大差异,而其他5种绍兴酒麦曲样品的距离较近,表明组间微生物组成相似。
2.2.5 差异真菌菌群分析
6种绍兴酒麦曲样品中差异真菌菌群的LEfSe分析结果见图8。
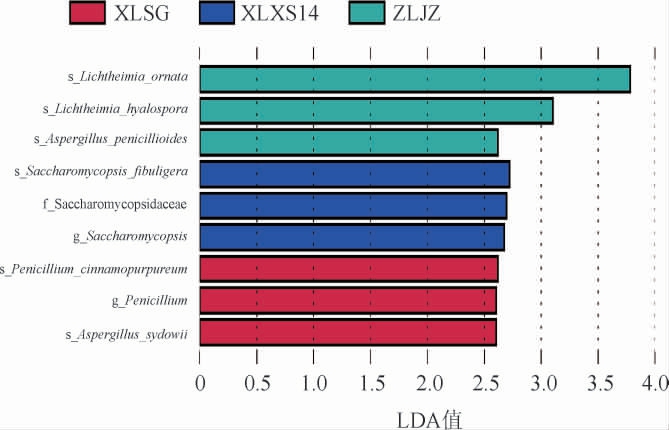
图8 6种绍兴酒麦曲样品中差异真菌菌群的LEfSe分析结果
Fig.8 LEfSe analysis results of differential fungal flora in 6 kinds of Shaoxing Huangjiu wheat Qu samples
由图8可知,西路箱式麦曲样品(XLXS14)中检出的差异菌群为复膜孢酵母科(Saccharomycopsidaceae)、复膜孢酵母属(Saccharomycopsis)、扣囊复膜酵母(Saccharomycopsis fibuligera)微生物。据报道[34],该菌科微生物在酒类发酵过程中能产生淀粉酶、β-葡萄糖苷酶等酶系,降解淀粉转化生成乙醇和有机酸,丰富酯化反应的前体物质种类。
中路机制麦曲和西路手工麦曲也与其他样品存在部分差异,其中中路机制麦曲样品(ZLJZ)的差异菌群是横梗霉属(Lichtheimia)的Lichtheimia ornata 和Lichtheimia hyalospora以及曲霉属(Lichtheimia)的帚状曲霉(Aspergillus penicillioides);西路手工麦曲样品(XLSG)的差异菌群是青霉菌属(Penicillium)及其Penicillium cinnamoupurpureum和曲霉属的聚多曲霉(Aspergillus sydowii)。这与NMDS分析结果相佐证,但上述菌群在样品中相对丰度较低。
从真菌菌群的NMDS和LEfSe分析结果可知,西路箱式麦曲与其他绍兴酒麦曲的真菌群落组成存在较大差异,另5种绍兴酒麦曲样品之间的群落差异较小。由此可见,培养环境是影响真菌菌群组成的主要因素之一。西路手工、中路手工、中路机制、东路手工与东路机制的麦曲样品位点相互交叉,表明手工与机制等麦曲成型工序、绍兴区域内的东路、中路与西路等地理方位对群落结构组成的差异并不明显。
3 结论
本研究采用高通量测序技术对6种不同工艺绍兴酒麦曲样品的微生物群落结构进行分析,结果表明,从6种不同工艺绍兴酒麦曲样品共注释到30个细菌属和43个真菌属。其中共有的优势细菌属为糖多孢菌属(Saccharopolyspora)(69.16%)和芽孢杆菌属(Bacillus)(10.90%);共有的优势真菌属为根毛霉属(Rhizomucor)(50.37%)、曲霉属(Aspergillus)(28.32%)、横梗霉属(Lichtheimia)(12.66%)、镰刀菌属(Fusarium)(3.64%)。高温放线菌属(Thermoactinomyces)(4.81%)和伊萨琴基亚(Issatchenkia)(1.43%)仅在西路箱式麦曲样品中为优势菌属。通过NMDS和LEfSe对不同工艺绍兴酒麦曲样品的细菌和真菌菌群多样性分析发现,西路箱式麦曲与其他5种绍兴酒麦曲的真菌群差异较大,表明封闭与开放培养环境导致绍兴酒麦曲的微生物群落组成存在较大差异。本研究可为优化绍兴酒的酿造提供绍兴酒麦曲微生物群落结构方面的理论依据。
[1]葛松涛,寿泉洪,韩文凤,等.响应面法优化鲜黄酒瓶内发酵工艺[J].食品工业科技,2023,44(2):278-284.
[2]刘芸雅,毛健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1):201-208.
[3]CHEN C,LIU Y,TIAN H X,et al.Metagenomic analysis reveals the impact of JIUYAO microbial diversity on fermentation and the volatile profile of Shaoxing-jiu[J].Food Microbiol,2020,86:103326.
[4] ZHANG K Z, LI Q, WU W C, et al.Wheat Qu and its production technology,microbiota,flavor,and metabolites[J].J Food Sci,2019,84(9):2373-2386.
[5] MO X L,XU Y,FAN W L,et al.Characterization of aroma compounds in Chinese rice wine Qu by solvent-assisted flavor evaporation and headspace solid-phase microextraction[J].J Agr Food Chem, 2010, 58(4): 2462-2469.
[6]谷晓东,刘怡琳,席晓丽,等.基于高通量测序技术对6种黄酒酒曲中微生物多样性的研究[J].食品工业科技,2022,43(16):148-157.
[7]唐鳗秋,夏玙,覃凤阳,等.四川黄酒麦曲发酵过程中理化特性及微生物多样性变化研究[J].食品与发酵工业,2021,47(24):35-40.
[8]吴双涛,潘兴祥.浙江省国家级非物质文化遗产代表性传承人口述史丛书王阿牛卷[M].浙江:浙江摄影出版社,2021:4-5.
[9]周志立,刘双平,徐岳正,等.仿草包曲在黄酒发酵中的应用及其对黄酒风味的影响[J].食品科学技术学报,2021,39(5):135-144.
[10]毛青钟.自动化制生麦曲系统及不同点生麦曲糖化力、液化力的测定[J].江苏调味副食品,2021(1):33-36.
[11]MA D L,LIU S P,LIU H P,et al.Developing an innovative raw wheat Qu inoculated with Saccharopolyspora and its application in Huangjiu[J].J Sci Food Agr,2022,102(15):7301-7312.
[12]张晶,刘双平,周志磊,等.麦曲添加量对黄酒酿造及其风味的影响[J].食品与机械,2020,36(4):56-61.
[13]张波,管政兵,谢广发,等.绍兴黄酒麦曲制曲过程的宏蛋白质组学研究[J].食品与发酵工业,2012,38(1):1-7.
[14]ZHAO X X,WANG Y R,CAI W C,et al.High-throughput sequencingbased analysis of microbial diversity in rice wine koji from different areas[J].Curr Microbiol,2020,77:882-889.
[15]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[16]LIU S P,CHEN Q L,ZOU H J,et al.A metagenomic analysis of the relationship between microorganisms and flavor development in Shaoxing mechanized Huangjiu fermentation mashes[J].Int J Food Microbiol,2019,303:9-18.
[17]周志立.绍兴黄酒生麦曲的微生物群落演替驱动力研究与制曲工艺优化[D].无锡:江南大学,2021.
[18]陈乐乐,王乙伊,汪怡宁,等.浙江地区中温大曲贮存过程细菌群落多样性及功能预测分析[J].中国酿造,2023,42(1):109-114.
[19]RUAN R J,JIANG Z F,WU Y H,et al.High-throughput sequence analysis reveals variation in the relative abundance of components of the bacterial and fungal microbiota in the rhizosphere of Ginkgo biloba[J].Peer J,2019,7:e8051.
[20]杜贞娜,单之初,沈赤,等.传统绍兴黄酒酿造真菌群落与多样性发生机制[J].应用生态学报,2022,33(4):1118-1124.
[21]陆进舟,龙华,黄元敏,等.不同地区黄酒麦曲真菌与细菌多样性比较分析[J].中国食品添加剂,2022,33(10):204-212.
[22]REUTER J A,SPACEK D V,SNYDER M P.High-throughput sequencing technologies[J].Mol Cell,2015,58(4):586-597.
[23]母应春,姜丽,苏伟.应用Illumina高通量测序技术分析3种酒曲中微生物多样性[J].食品科学,2019,40(14):115-122.
[24]LEI Y P,XIAO Y L,LI L F,et al.Impact of tillage practices on soil bacterial diversity and composition under the tobacco-rice rotation in China[J].J Microbiol,2017,55:349-356.
[25] GUAN Z B, ZHANG Z H, CAO Y, et al.Analysis and comparison of bacterial communities in two types of 'wheat Qu', the starter culture of Shaoxing rice wine, using nested PCR-DGGE[J].J I Brewing, 2012,118(1):127-132.
[26]HONG X T,CHEN J,LIU L,et al.Metagenomic sequencing reveals the relationship between microbiota composition and quality of Chinese rice wine[J].Sci Rep,2016,6:26621.
[27]RIVAS M N,BURTON O T,WISE P,et al.A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J].J Allergy Clin Immun,2013,131(1):201-212.
[28]王礼霄.半人工湿地植物香蒲根系微生物群落的时空分异及构建过程[D].太原:山西大学,2022.
[29]毛青钟.自动化制生麦曲性能的研究[J].酿酒,2016,43(3):65-72.
[30]王小琪.青藏高原动物肠道微生物数据挖掘与生物标记物筛选研究[D].合肥:中国科学技术大学,2022.
[31]LIU S P,HU J,XU Y Z,et al.Combined use of single molecule real-time DNA sequencing technology and culture-dependent methods to analyze the functional microorganisms in inoculated raw wheat Qu[J].Food Res Int,2020,132:109062.
[32] YU H, LI Q, GUO W, et al.Dynamic analysis of volatile metabolites and microbial community and their correlations during the fermentation process of traditional Huangjiu (Chinese rice wine) produced around Winter Solstice[J].Food Chem,2023:100620.
[33]XIE G F,LI W J,LU J,et al.Isolation and identification of representative fungi from Shaoxing rice wine wheat Qu using a polyphasic approach of culture-based and molecular-based methods[J].J I Brewing, 2007,113(3):272-279.
[34] LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.