随着后疫情时代人们对健康饮酒理念的升温,黄酒作为“世界三大古酒”之一,因其含有丰富的营养成分以及生物活性功能物质备受人们的关注和喜爱[1]。黄酒酿造原料众多,北方多以黍米、玉米为主,南方以糯米、稻米居多,具有极强的地域特色。南阳盆地特产的红色酿酒谷子(简称红谷、红小米),谷粒琥珀色,具有较高的营养价值[2-3],是珍贵的酿造黄酒原材料。以红谷酿造的黄酒酒液色泽明亮,饮入后口感绵甜,味道醇香,已经形成了独具特色的南阳黄酒风格[4-6]。
目前,南阳红谷黄酒的相关研究还处于起步阶段,且以实验室小规模发酵研究为主。李斌等[7]采用南阳红谷黄酒酒曲为研究对象,利用高通量测序方法对红曲、大曲、小曲的微生物菌群多样性进行分析。结果表明,大曲的微生物菌群多样性最高,红曲的最低,且两者间的微生物群落结构差异最大;谷晓东等[8]研究表明,红谷黄酒发酵过程中微生物多样性有显著性变化,并与其理化指标及风味变化具有一定相关性;李杰等[9]采用单因素试验与Box-Behnken试验相结合方法,对麦曲、酿酒曲用量,前、后发酵温度及时间等酿造工艺条件进行优化;王印壮等[10]研究发现,红谷黄酒发酵过程中促进了酚类物质的释放,发酵结束时总酚和总黄酮含量显著增加(P<0.05);陈林玉[11]重点研究了红谷黄酒的功效成分,结果显示相较于糯米黄酒,红谷黄酒中γ-氨基丁酸含量较高,对过氧化氢氧化损伤心肌细胞的保护作用更为显著;王春艳等[12]研究发现,红谷黄酒高级醇产生的主要贡献细菌群为大洋芽孢杆菌属(Oceanobacillus)、克鲁沃菌属(Kluyvera)和魏斯氏菌属(Weissella)。
南阳现有国家级黄酒生产许可证企业29家,企业数量与年产量均占河南省85%以上,但是对上述黄酒企业规模化生产实际缺乏相关研究,这在一定程度上制约了南阳红谷黄酒产业的发展。本研究对南阳市某酒业有限公司红谷黄酒发酵过程进行跟踪取样,采用静态顶空气相色谱-质谱联用(static headspace gas chromatography-mass spectrometry,SHS-GC-MS)法和高通量测序技术测定南阳红谷黄酒发酵过程中挥发性风味物质的变化和微生物群落结构组成,并对两者之间的潜在相关性进行分析。旨在为黄酒酿造功能微生物挖掘、提高南阳红谷黄酒品质提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
红谷黄酒连续发酵样品取自南阳市某酒业有限公司,分别取第0(投料当天)、3、6、10、15、20、30、36天的发酵样品各20 g,分别命名为A0、A1、A2、A3、A4、A5、A6、A7。每个样品做三组平行,实验前放置于-20 ℃进行保存。
1.1.2 化学试剂
FastDNATM Spin土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国MP Biomedicals公司;Agencourt AMPure XP核酸纯化试剂盒:美国Beckman公司;3-辛醇(色谱纯):美国Sigma公司;QIAquick胶回收试剂盒:德国QIAGEN公司。其他试剂均为国产分析纯。
1.2 仪器与设备
ME204E电子分析天平:梅特勒-托利多仪器(上海)有限公司;7890A-5975C气相色谱-质谱联用仪、HP-INNOWAX色谱柱(60 m×250 μm×0.5 μm):美国安捷伦科技有限公司;50/30 μm DVB/CAR/PDMS顶空固相微萃取纤维头:美国Supelco公司;T100TM梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-RAD公司;Illumina Miseq PE250高通量测序仪:美国Illumina公司。
1.3 方法
1.3.1 红谷黄酒挥发性风味物质检测
采用静态顶空气相色谱-质谱法(SHS-GC-MS)对黄酒样品中的挥发性风味物质进行分析检测[13]。黄酒样品8 mL,NaCl 1.5 g,质量浓度为300 mg/L的内标物3-辛醇25 μL,加入至20 mL顶空瓶中。顶空进样器样品处理参数、GC-MS条件设置详见参考文献[12]。
定性定量方法:通过质谱解析及美国国家标准与技术研究所(national institute of standards and technology,NIST)05 a.L标准谱库的比对定性,并采用内标法定量挥发性风味各组分[14]。
1.3.2 聚合酶链式反应及高通量测序
酒醪样品微生物总DNA采用FastDNATM Spin土壤基因组DNA提取试剂盒进行提取。以质检合格的基因组DNA为模板,酒醅样品中细菌16S rDNA的V3~V4区和真菌ITS1~ITS2区分别采用B341F和B785R引物[15]和ITS1FI2和ITS2引物[16]进行PCR扩增。PCR扩增体系:10×PCR buffer 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)2 μL,DNA模板10 ng,正反向引物各0.5 μmol/L,Taq DNA 聚合酶0.05 U,用双蒸水(ddH2O)补充至50 μL。PCR扩增程序参照文献[15-16]进行。
PCR产物切胶纯化后进行精准定量,依托北京擎科生物科技有限公司进行Illumina MiSeq高通量测序。
1.3.3 高通量数据分析
高通量测序获得的原始序列采用Cutadapt(v1.9.1)、Prinseq(v0.20.4)及Flash(1.2.3)软件对其进行质量控制,主要包括融合双末端序列、去除引物和barcode、去掉含有不明确碱基(如N)的序列、去除低复杂度序列、去除碱基长度<200 bp 的序列、去除非靶区域序列以及去除嵌合体等。
经过上述步骤得到的优化序列以97%的相似性进行操作分类单元(operational taxonomic unit,OTU)聚类分析。利用Silva数据库,采用Mothur(1.30.1)软件在不同物种分类水平下统计每个样本的群落组成,同时计算各个样品的覆盖率(Coverage)以及微生物Alpha多样性指数,构建香农指数曲线,并统计分析细菌和真菌群落信息。
1.3.4 红谷黄酒挥发性风味物质与微生物相关性分析
本研究选取黄酒发酵酒醪样品微生物高通量测序结果中相对丰度排序在前20的细菌属和前20的真菌属信息,计算其与挥发性风味物质的Spearman相关系数,以相关系数>0.5且显著性P<0.05为阈值[17],利用Cytoscape 3.6.1可视化挥发性风味物质和微生物群落之间的相互作用。
2 结果与分析
2.1 红谷黄酒发酵过程中挥发性风味物质动态变化
由图1可知,红谷黄酒样品中共检出49种挥发性物质,包括高级醇类13种、酯类10种、酸类6种、烷类6种、醛类6种、酮类4种、烯类2种、酰胺类2种。红谷黄酒在发酵过程中最主要的挥发性风味物质是高级醇类,其次为酯类,两者含量占挥发性风味物质的90%以上。其中异丙醇、异戊醇和苯乙醇是相对含量较高的高级醇类化合物,乙酸乙酯、乙醛和乙酸分别是占比较高的酯类、醛类和酸类物质。由图1可知,投料当天(0 d),挥发性风味组分处于较低水平;发酵3~6 d 增长迅速;发酵第10天,高级醇类、醛类、酸类和酮类均达到峰值,含量分别为44 637 μg/L、2 380 μg/L、647 μg/L和650 μg/L;发酵第15天,酯类物质含量最高,含量增至10 044 μg/L;随着发酵的进行,达到峰值的物质含量不断减少,发酵30 d后趋于稳定;发酵结束时,烷类、烯类和酰胺类物质含量达到了高值。由此可见,黄酒中挥发性风味物质主要产生于发酵前期,南阳红谷黄酒发酵过程中产生的挥发性风味物质的种类和含量变化趋势,与已报道的清爽型黄酒[18]、绍兴机械化黄酒[19]和客家黄酒[20]的相关研究结果相近。
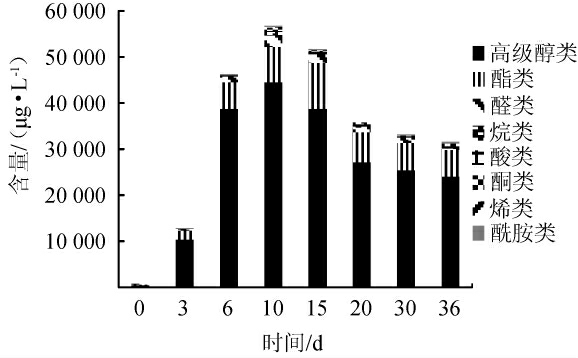
图1 红谷黄酒发酵过程中各类别挥发性风味物质含量的变化
Fig.1 Changes of various categories volatile flavor compounds contents in red-millet Huangjiu during fermentation process
2.2 高通量测序结果及Alpha多样性分析
由表1可知,采用Illumina Miseq测序平台得到红谷黄酒样品细菌有效序列数46 867~85 410,97%相似水平下的OTU数目为138~330;真菌有效序列数为36 897~89 932,OTU数目为130~964。
表1 红谷黄酒样品中的细菌和真菌群落Alpha多样性分析结果
Table 1 Alpha diversity analysis results of bacterial and fungal communities of red-millet Huangjiu samples
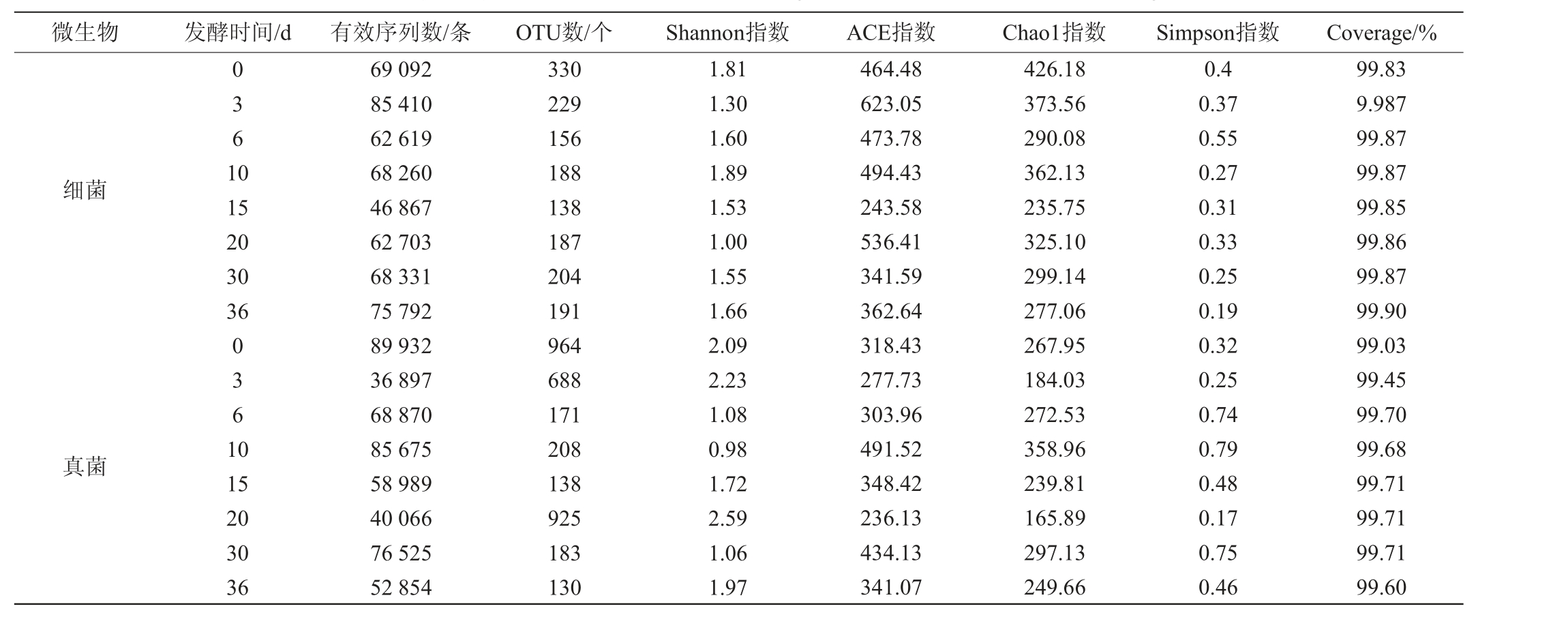
微生物 发酵时间/d 有效序列数/条 OTU数/个 Shannon指数 ACE指数 Chao1指数 Simpson指数 Coverage/%细菌真菌0361 0 15 20 30 36 0361 0 15 20 30 36 69 092 85 410 62 619 68 260 46 867 62 703 68 331 75 792 89 932 36 897 68 870 85 675 58 989 40 066 76 525 52 854 330 229 156 188 138 187 204 191 964 688 171 208 138 925 183 130 1.81 1.30 1.60 1.89 1.53 1.00 1.55 1.66 2.09 2.23 1.08 0.98 1.72 2.59 1.06 1.97 464.48 623.05 473.78 494.43 243.58 536.41 341.59 362.64 318.43 277.73 303.96 491.52 348.42 236.13 434.13 341.07 426.18 373.56 290.08 362.13 235.75 325.10 299.14 277.06 267.95 184.03 272.53 358.96 239.81 165.89 297.13 249.66 0.4 0.37 0.55 0.27 0.31 0.33 0.25 0.19 0.32 0.25 0.74 0.79 0.48 0.17 0.75 0.46 99.83 9.987 99.87 99.87 99.85 99.86 99.87 99.90 99.03 99.45 99.70 99.68 99.71 99.71 99.71 99.60
丰富度指数Chao1和ACE 越大,表明群落物种丰富度越高;多样性指数Shannon越大或Simpson越小,表明群落物种的多样性越高。由表1可知,在红谷黄酒发酵初期(3~10 d),细菌和真菌的丰富度和多样性较高,发酵至第10天,细菌多样性最高,发酵至第20天,真菌的多样性达到峰值。
对已报道的多种类型黄酒发酵过程中细菌、真菌微生物多样性进行研究发现,绍兴黄酒细菌多样性显著高于真菌,Shannon多样性指数细菌是真菌的2~90 倍,OTU数细菌是真菌的4~40倍[18-19,21];燕麦黄酒发酵过程中真菌的Simpson指数无明显变化,约为1.0,细菌是真菌的2~10倍[22];玉米黄酒Shannon指数细菌是真菌的2~4倍[23]。本研究红谷黄酒发酵过程中Shannon指数细菌是真菌的0.5~2.0倍,OTU数量细菌是真菌的0.2~4.0倍,谷晓东等[8]的相关研究显示,Shannon指数细菌与真菌的比例为0.6~4.0倍。结果表明,相较于绍兴黄酒、燕麦黄酒和玉米黄酒,红谷黄酒酿造过程中真菌的多样性更加丰富,这是否在一定程度上影响了两种黄酒呈现出不同风味,尚需进一步深入研究。
2.3 黄酒微生物群落结构分析
2.3.1 细菌群落结构分析
由图2可知,黄酒发酵样品中共得到9个门,其中优势菌门(相对丰度>1%)有2个,分别为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),厚壁菌门在红谷黄酒整个发酵过程的相对丰度为85.94%~98.81%,为绝对优势菌门。
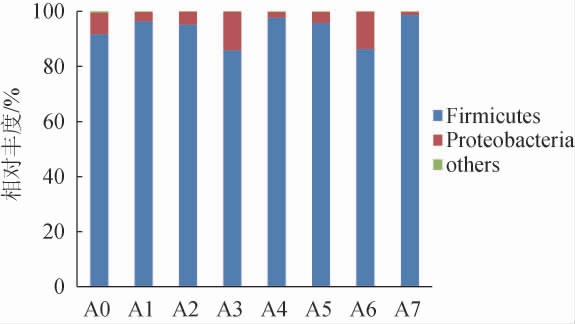
图2 基于门水平红谷黄酒样品中细菌群落结构分析
Fig.2 Analysis of bacterial community structure of red-millet Huangjiu samples based on phylum level
非优势菌属及未分类的OTU归为others。下同。
由图3可知,样品中共检测出53个属,其中相对丰度>1%的优势细菌属共有10个,分别为乳球菌属(Lactococcus)、明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、泛菌属(Pantoea)、气单胞菌属(Aeromonas)、布丘氏菌属(Buttiauxella)、片球菌属(Pediococcus)、不动杆菌属(Acinetobacter)和肠杆菌属(Enterobacter)。乳酸菌能够利用原料中的碳水化合物生成乳酸及其他物质(乙醇、乙酸、二氧化碳等),提高食品的风味以及储存期[24-25]。红谷黄酒发酵过程中的乳酸菌优势显著,主要包括Weissella、Lactococcus、Lactobacillus、Leuconostoc和Pediococcus。入池时绝对优势菌为Lactococcus,其相对丰度为71.1%,发酵前期(3~10 d)以Weissella(37.93%~71.13%)和Lactococcus(20.12%~35.64%)为主要优势乳酸菌,随着发酵进行演替为以Lactobacillus为主的乳酸菌群落,发酵结束时Lactobacillus相对丰度达到63.4%。红谷黄酒乳酸菌群结构的变化与XIAO C等[26-27]的报道结果相一致。
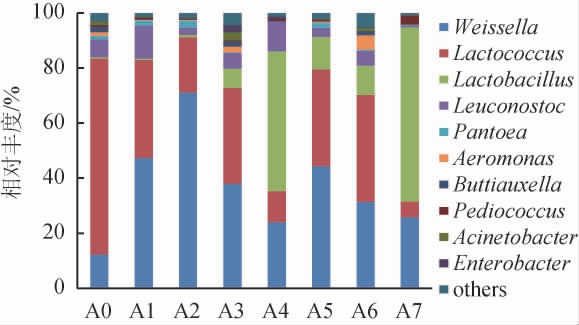
图3 基于属水平红谷黄酒样品中细菌群落结构分析
Fig.3 Analysis of bacterial community structure of red-millet Huangjiu samples based on genus level
2.3.2 真菌群落结构分析
由图4可知,红谷黄酒样品共得到6个真菌门,优势菌门有3个,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和毛霉菌门(Mucoromycota)。在整个发酵过程中Ascomycota是绝对优势真菌门(相对丰度>95%),高含量的Ascomycota对驱动黄酒酒醪活性微生物群落变化起了重要作用[28]。
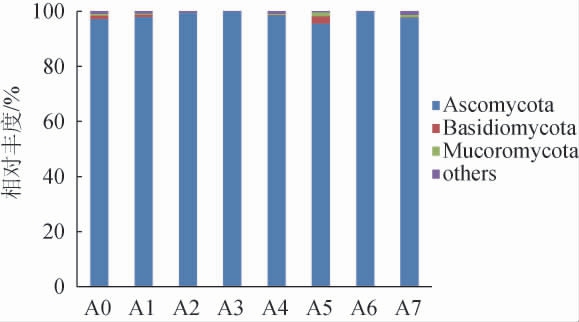
图4 基于门水平红谷黄酒样品中真菌群落结构分析
Fig.4 Analysis of fungal community structure of red-millet Huangjiu samples based on phylum level
由图5可知,共得到73个真菌属,其中优势真菌属共有9个,分别为酵母菌属(Saccharomyces)、假丝酵母属(Candida)、曲霉菌属(Aspergillus)、丝毕赤酵母属(Hyphopichia)、拟威尔嗜杀酵母(Cyberlindnera)、红曲霉属(Monascus)、镰刀菌属(Fusarium)、嗜热真菌属(Thermomyces)和久浩酵母菌属(Guehomyces)。Saccharomyces具有较强的产乙醇能力,在酿酒工业中起着重要作用[29],在红谷黄酒发酵的前期(3~10 d)和后期(30~36 d)Saccharomyces相对丰度占据明显优势。Aspergillus被证实具有强大的产酶能力,这些酶会分解原料,形成酵母菌能够利用的氨基酸,有利于形成黄酒丰富的口感[30],本实验中在红谷黄酒发酵中期(15~20 d)Aspergillus达到峰值(43.14%)。
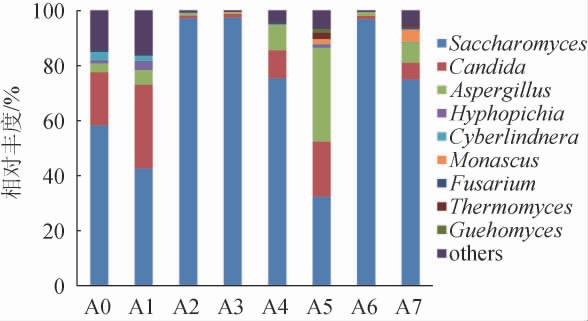
图5 基于属水平红谷黄酒样品中真菌群落结构分析
Fig.5 Analysis of fungal community structure of red-millet Huangjiu samples based on genus level
2.4 红谷黄酒优势微生物与挥发性风味物质的相关性
由图6可知,相关性分析中共有31个有效节点,其中真菌Saccharomyces、Aspergillus和Thermomyces是连接度最大的3个真菌属,细菌Lactobacillus、Leuconostoc和Weissella是连接度最大的3个细菌属。与南阳红谷黄酒酯类物质相关的微生物有Saccharomyces、Aspergillus、Weissella、大洋芽孢杆菌属(Oceanobacilluss)、Lactobacillus、Leuconostoc、Monascus和芽孢杆菌属(Bacillus)。与酸类物质相关的菌有Lactobacillus、Aspergillus、Acinetobacter、Candida和Aeromona。Saccharomyces、Lactobacillus、Aspergillus、Thermomyces、Leuconostoc和Monascus与醇类物质的产生具有较强相关性。醛类物质仅与Saccharomyces相关,酰胺类物质仅与青霉菌属(Penicillium)相关。
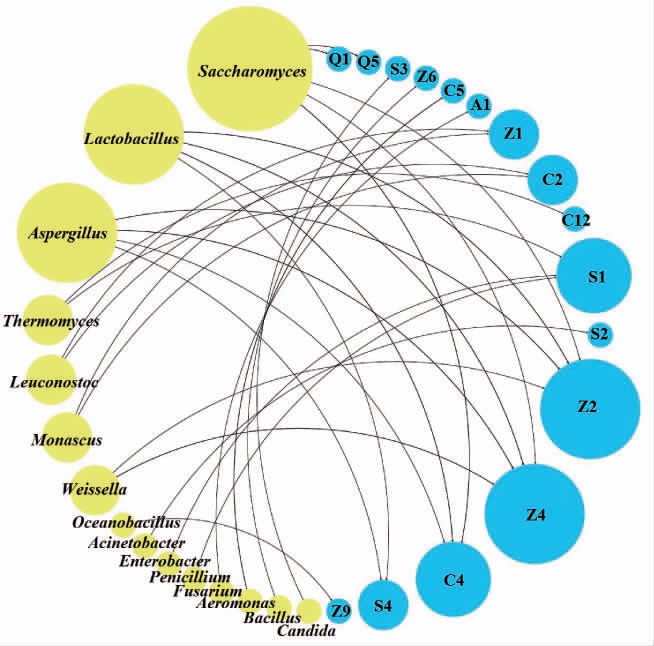
图6 红谷黄酒样品中主要微生物与挥发性风味物质相关性分析
Fig.6 Correlation analysis between main microorganisms and volatile flavor compounds in red-millet Huangjiu samples
Z.酯类;C.醇类;S.酸类;Q.醛类;A.酰胺类。
综上,Spearman相关性结果显示,在南阳红谷黄酒发酵过程中,Saccharomyces、Lactobacillus、Aspergillus、Thermomyces、Leuconostoc、Monascus和Weissella对酯、醇、酸等挥发性风味物质的产生具有主要贡献作用,其中Saccharomyces、Lactobacillus和Aspergillus贡献作用最为显著,这与牟穰等[18-19,31]的研究结果相一致。
3 结论
以南阳市某酒业有限公司连续发酵的红谷黄酒样品为研究对象,采用静态顶空气相色谱-质谱法共检出49种挥发性风味物质,包括高级醇类13种、酯类10种、酸类6种、烷类6种、醛类6种、酮类4种、烯类2种、酰胺类2种。最主要的挥发性风味物质是高级醇类,其次为酯类,挥发性风味物质主要产生在发酵前期。利用高通量测序技术分析微生物群落组成及动态变化,结果显示在红谷黄酒发酵第10天,细菌多样性最高;发酵至第20天,真菌的多样性最高。厚壁菌门和子囊菌门分别是绝对优势细菌门和真菌门,优势细菌属共有10个,分别为魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)等;优势真菌属共有9个,分别为酵母菌属(Saccharomyces)、假丝酵母属(Candida)、曲霉菌属(Aspergillus)等。相关性研究发现,对红谷黄酒挥发性风味物质的主要贡献细菌为Lactobacillus、Leuconostoc和Weissella,真菌为Saccharomyces、Aspergillus、Thermomyces和Monascus。本研究结果可为南阳红谷黄酒的品质控制提供科学依据。
[1]刘月,祁国栋,张炳文.黄酒功能成分的研究进展[J].中国酿造,2015,34(11):27-30.
[2]陈林玉,宋乐园,王云雨,等.红小米化学成分与营养成分分析[J].食品科学,2021,42(18):218-224.
[3]宋乐园.红小米化学成分及质量评价研究[D].郑州:郑州大学,2020.
[4]李杰,许彬,罗建成,等.红小米黄酒酿造工艺研究及体外抗氧化活性评价[J].中国酿造,2021,40(7):123-129.
[5]李爽,陈林玉,王东浩,等.红小米黄酒心肌保护作用及活性成分研究[J].中草药,2022,53(22):7010-7018.
[6]黄筱鹂.“世界美酒特色产区”获奖名单[J].酿酒科技,2019(11):82.
[7]李斌,陈亚楠,孙旭,等.Illumina MiSeq高通量测序分析红谷黄酒酒曲微生物菌群多样性[J].中国酿造,2022,41(9):86-92.
[8]谷晓东,李素萍,杨柳青,等.红谷黄酒发酵过程中微生物多样性与理化指标、挥发性风味的相关性分析[J].食品工业科技,2022,43(23):133-143.
[9]李杰,许彬,罗建成,等.富含γ-氨基丁酸的红小米黄酒酿造工艺参数优化[J].食品研究与开发,2021,42(17):114-121.
[10]王印壮,李素萍,段定定,等.红谷黄酒发酵过程中理化性质和物质变化规律[J].食品研究与开发,2022,43(17):8-15.
[11]陈林玉.红小米黄酒化学成分及质量评价研究[D].郑州:郑州大学,2021.
[12]王春艳,邓洲,武思雨,等.红谷黄酒发酵过程中细菌群落结构分析及其对高级醇的影响[J].中国酿造,2022,41(6):112-116.
[13]李慧星,许彬,罗建成,等.国产威士忌加工过程中挥发性成分的变化及风味的形成[J].食品工业科技,2023,44(12):300-307.
[14]WANG W H,XU Y Q,HUANG H Q,et al.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J].Food Res Int,2021,150:110741.
[15]卫春会,甄攀,张兰兰,等.汾酒酒醅发酵过程中真菌群落的变化规律[J].食品科学,2021,42(14):121-128.
[16]胡超凡.古法手酿绍兴黄酒发酵微生态及功效组分解析[D].杭州:浙江大学,2021.
[17]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[18]牟穰.清爽型黄酒酿造微生物群落结构及其与风味物质相关性研究[D].无锡:江南大学,2015.
[19]刘芸雅.绍兴黄酒发酵中微生物群落结构及其对风味物质影响研究[D].无锡:江南大学,2015.
[20]黄清铧,胡彪,王丽宁,等.客家黄酒发酵过程中挥发性成分分析[J].食品科技,2023,48(2):77-84.
[21]郭伟.不同环境温度条件下传统绍兴黄酒发酵过程中菌群结构及香气物质变化的研究[D].上海:上海应用技术大学,2022.
[22]孙乐平,张伟,徐嘉良,等.燕麦黄酒发酵过程中微生物群落结构变化及对高级醇的影响[J].食品科学技术学报,2020,38(1):43-59.
[23]李永翔,蒋海娇,郭建华.基于高通量测序分析玉米黄酒微生物多样性[J].齐齐哈尔 大学学报(自然科学版),2021,37(3):62-65.
[24]PARK S E,SEO S H,KIM E J,et al.Changes of microbial community and metabolite in kimchi inoculated with different microbial community starters[J].Food Chem,2019,274:558-565.
[25]栗连会.泸型酒酒醅中乳酸菌和乳酸降解菌的多样性和代谢特性[D].无锡:江南大学,2016.
[26] XIAO C,LU Z M,ZHANG X J,et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature daqu[J].Appl Environ Microbiol,2017,83(23):e01550-17.
[27]钱玮,陆震鸣,柴丽娟,等.泸型酒酒醅与窖泥中乳酸菌群落结构差异[J].应用与环境生物学报,2020,26(4):760-765.
[28]王康丽.宏转录组学的浓香型酒醅微生物群落多样性及代谢特征研究[D].郑州:郑州轻工业大学,2021.
[29]冯莉,陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.
[30]CHEN T,WU F H,GUO J J,et al.Effects of glutinous rice protein components on the volatile substances and sensory properties of Chinese rice wine[J].J Sci Food Agr,2020,100(8):3297-3307.
[31]马琳娜.基于Meta分析酿酒微生物与风味物质的关系[D].贵阳:贵州大学,2021.