玉米是全球第一大谷物,被称为“五谷之首”,其产量仅次于水稻,在粮食作物中位居第二位[1-2]。自古以来,谷物发酵食品是非洲西南部和亚洲东南部的一种传统食品[3]。碴条,俗称“酸汤子”,是我国东北地区传统的发酵食品之一,其通过浸泡玉米自然发酵的方式制作而成,在很多东北家庭中十分常见[4]。但由于“酸汤子”自然发酵周期长、微生物菌群复杂,发酵过程中可能会被腐败菌和致病菌污染,发酵过程受很多因素影响。因此,从“酸汤子”自然发酵玉米液中筛选优良发酵菌株对于玉米纯种发酵具有重要意义。
有研究发现,玉米自然发酵过程中的优势菌为乳酸菌,其是一种安全的益生菌,能够预防和缓解糖尿病症状,具有抗菌、抗氧化活性,对于人和动物的健康均有益处[5-8]。乳酸菌可以对不同底物进行发酵,生产不同的发酵食品,如张金兰等[9]通过鼠李糖乳杆菌(Lactobacillus rhamnosus)对枸杞果汁进行发酵,提高了发酵枸杞果汁的抗炎与抗氧化特性;陈晓维等[10]使用植物乳杆菌(Lactobacillus plantarum)与Lactobacillus rhamnosus混合发酵红枣浆,提高了红枣浆的营养成分及抗氧化活性,意在开发新的功能性红枣浆饮品。食品经乳酸菌发酵,在发酵过程中能够产生大量有机酸,使食物快速酸化的同时改善风味;还能代谢产生乙醇、芳香化合物、胞外多糖和多种酶,改善发酵产品品质和感官特征,同时大分子物质被降解,产生游离氨基酸、多肽、游离脂肪等,有利于机体消化吸收,提高食品吸收利用率、延长贮存期[11]。从发酵食品中筛选得到的乳酸菌具有更高的安全性[12],因此,从“酸汤子”自然发酵玉米液中筛选出具有优良发酵特性及益生特性的乳酸菌,使其在玉米发酵生产中迅速成为优势菌,可较早地抑制杂菌生长、保证产品安全并缩短生产周期,对实现发酵玉米的现代化、规模化生产具有重要作用。
本研究采用稀释平板法从“酸汤子”自然发酵玉米液中分离筛选乳酸菌,采用分子生物学技术对其进行菌种鉴定,并通过测定乳酸菌生长特性、产酸特性、耐酸耐胆盐性能、α-淀粉酶抑制活性、抗氧化活性和抑菌性能评价其益生特性,以期得到优良菌株,为我国传统玉米发酵生产提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
整粒玉米、玉米碴:吉林市场;金黄色葡萄球菌(Staphylococcus aureus)BNCC186335、志贺氏菌(Shigella Castellani)BNCC232380、大肠杆菌(Escherichia coli)BNCC269342、沙门氏菌(Salmonella)BNCC333565:北京北纳创联生物技术研究院。
1.1.2 试剂
α-淀粉酶(9 U/g)、牛胆盐(胆酸含量≥60%):上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力检测试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒:南京建成生物工程研究所;铁离子还原能力测定试剂盒:江苏苏州格锐思生物科技有限公司;Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:上海生工生物工程股份有限公司。
1.1.3 培养基
MRS肉汤培养基:蛋白胨10.0 g/L,酵母浸粉5.0 g/L,牛肉膏10.0 g/L,葡萄糖20.0 g/L,无水醋酸钠5.0 g/L,柠檬酸钠5.0 g/L,K2HPO4 2.0 g/L,MgSO4 0.2 g/L,MnSO4 0.05 g/L,吐温80 1 mL/L,pH 6.0~7.0,121 ℃灭菌20 min。MRS固体培养基:MRS肉汤培养基中添加琼脂15 g/L。
LB液体培养基:蛋白胨10.0 g/L,酵母浸粉3.0 g/L,葡萄糖3.0 g/L,NaCl 5.0 g/L,pH 6.2~6.4,121 ℃灭菌20 min。LB固体培养基:LB液体培养基中添加琼脂15 g/L。
1.2 仪器与设备
3-30K高速离心机:德国Sigma公司;MLS-3780高压蒸汽灭菌锅:日本Sanyo公司;SP-756P紫外可见分光光度计:上海光谱仪器有限公司;SpectraMax250全自动酶标仪:美国BioTek公司;OLYMPUS DP71光学显微镜:日本OLYMPUS公司;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国应用生物系统公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
将玉米与玉米碴按照2∶1的比例混合,使用0.1%的过碳酸钠溶液浸泡消毒130 min,清洗干净后加入10倍质量的水,常温下自然发酵。在自然发酵30 d时,取发酵液,参考王璐等[13]的方法分离纯化乳酸菌菌株,选取单菌落进行革兰氏染色及过氧化氢酶试验。
1.3.2 乳酸菌的鉴定
形态观察:将分离纯化的菌株菌液稀释涂布于MRS固体培养基,37 ℃培养48 h,观察菌落形状、大小、隆起形状、边缘和表面等。菌株结晶紫染色后,采用光学显微镜观察菌体形态。
分子生物学鉴定:使用Ezup柱式细菌基因组DNA抽提试剂盒提取分离菌株的基因组DNA,采用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对菌株16S rDNA序列进行PCR扩增。PCR扩增体系:基因组DNA模板(20~50 ng/μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5mmol/L)1μL,酶0.2μL,上下游引物各0.5 μL,补充双蒸水(ddH2O)至25 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃再延伸10 min。PCR扩增产物由生工生物工程(上海)公司进行测定,将测序结果提交至美国国立生物技术信息中心(national center for biotech nologyinformation,NCBI)的GenBank数据库,采用基本局部比对搜索工具(basiclocalalignmentsearchtool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 乳酸菌生长特性的研究
按5%(V/V)的接种量将活化好的菌株接种于MRS肉汤培养基,37 ℃静置培养48 h。每隔2 h取样,在波长600 nm处测定吸光度值(OD600nm值),绘制生长曲线[14]。同时,测定发酵液的pH值,绘制产酸曲线。
1.3.4 乳酸菌益生特性的研究
(1)乳酸菌耐酸、耐胆盐实验
参考GUPTA S等[5]的方法并稍加修改测定乳酸菌的耐酸性能。将活化的乳酸菌按照3%(V/V)的接种量接种于pH 2.0的MRS肉汤培养基中,37 ℃静置培养3 h。在培养0 h与3 h时取样,采用平板计数法测定活菌数,并计算存活率,其计算公式如下:
式中:A为培养3 h的活菌数,CFU/mL;B为培养0 h的活菌数,CFU/mL。
参考陈显玲等[15-16]的方法测定乳酸菌的耐胆盐能力。将活化的乳酸菌按照3%(V/V)的接种量接种于胆盐浓度分别为0.1%、0.2%、0.3%的MRS肉汤培养基中,37 ℃培养6 h。在培养0 h、3 h与6 h时取样,在波长600 nm处测定吸光度值(OD600nm值),并计算其存活率,其计算公式如下:
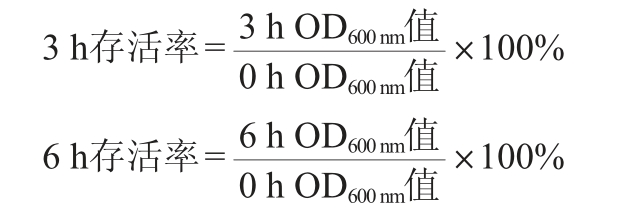
(2)α-淀粉酶抑制率的测定
参考文献[17]的方法分别制备乳酸菌无细胞上清液(cell-free supernatant,CFS)、细胞悬液(intact cells,IC)和无细胞提取物(cell-free extracts,CFE),参考文献[16]的方法测定乳酸菌CFS、IC、CFE的α-淀粉酶抑制率。
(3)抗氧化实验
采用试剂盒测定乳酸菌CFS、IC、CFE的DPPH自由基清除能力、总抗氧化能力(T-AOC)、铁离子还原能力。
(4)抑菌实验
使用牛津杯法测定乳酸菌的抑菌活性[18]。将Staphylococcus aureus、Shigella Castellani、Escherichia coli、Salmonella四种致病菌接种于LB液体培养基中,37 ℃、180 r/min培养14 h,将培养好的致病菌菌液稀释到合适倍数,取100 μL均匀涂布在LB固体培养基上,放置牛津杯;将活化的乳酸菌按照3%(V/V)的接种量接种于MRS肉汤培养基,37 ℃培养24 h,将培养好的乳酸菌菌液在4 ℃条件下6 000 r/min离心10 min,得到乳酸菌上清液,取150 μL加入牛津杯中,加入等量的灭菌MRS培养基为对照,37 ℃静置培养12~24 h,观察并采用游标卡尺测量抑菌圈直径。抑菌圈直径>12 mm说明具有抑菌活性[19]。
1.3.5 数据处理
采用SPSS 20.0统计软件处理数据并进行方差显著性分析,结果以“平均值±标准差”表示,采用Origin2019、GraphPad Prism 8.0软件绘图。
2 结果与分析
2.1 乳酸菌的分离
采用稀释平板法从自然发酵玉米液中分离纯化得到2株疑似乳酸菌菌株,编号为YM-1、YM-2,经革兰氏染色及过氧化氢酶接触酶实验发现,这2株菌株均为革兰氏阳性菌,过氧化氢接触酶实验结果均为阴性,初步表明这2株菌均为乳酸菌。
2.2 乳酸菌菌株的鉴定
2.2.1 形态观察
采用光学显微镜观察菌株YM-1和YM-2的菌落及细胞形态,结果见图1。由图1可知,菌株YM-1的菌落呈圆形,乳白色,不透明,隆起状,表面及边缘光滑整齐,细胞形态呈现连续成片的粗短杆状;菌株YM-2的菌落形态与菌株YM-1相似,区别为菌株YM-2的菌落隆起幅度较小,隆起中间为白色,边缘为半透明的浅白色,细胞形态呈现出聚集性的点状。
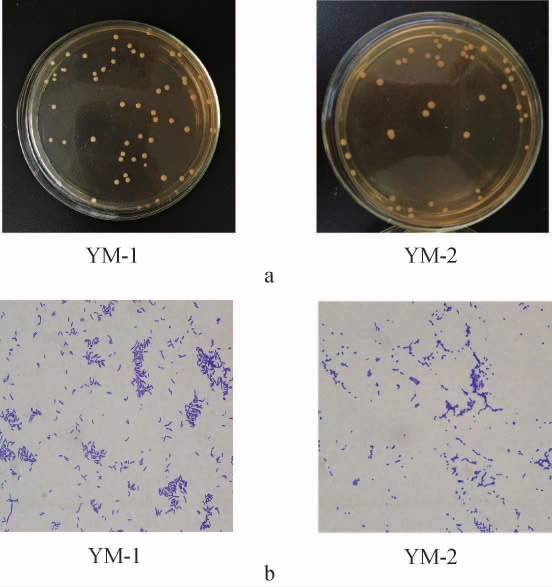
图1 菌株YM-1与YM-2的菌落(a)及细胞(b)形态
Fig.1 Morphology of colony (a) and cell (b) of strains YM-1 and YM-2
2.2.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株YM-1和YM-2的系统发育树,结果见图2。由图2可知,菌株YM-1与植物乳杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近,菌株YM-2与乳酸片球菌(Pediococcus acidilactici)聚于一支,亲缘关系最近。结合形态观察,最终鉴定菌株YM-1和YM-2分别为植物乳杆菌(Lactiplantibacillus plantarum)、乳酸片球菌(Pediococcus acidilactici)。
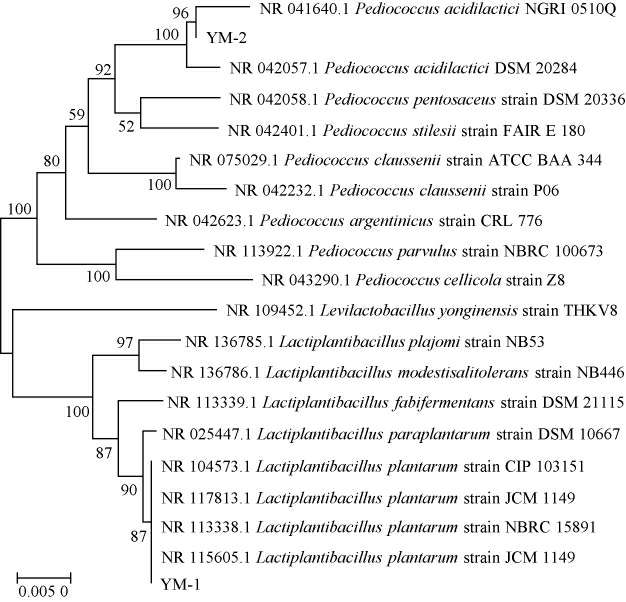
图2 基于16S rRNA基因序列菌株YM-1和YM-2的系统发育树
Fig.2 Phylogenetic tree of strains YM-1 and YM-2 based on 16S rRNA gene sequences
2.3 乳酸菌的生长特性
生长曲线与产酸曲线可直观的显示菌株生长规律,对于菌株在生产实践中的高效利用有指导意义。2株乳酸菌菌株的生长曲线及产酸曲线见图3。由图3a可知,菌株YM-1的迟滞期为0~2 h,对数生长期为2~14 h,稳定期为14~20 h;菌株YM-2的迟滞期为0~4 h,对数生长期为4~14 h,稳定期为16~28 h。在相同培养条件下,菌株YM-1更快进入对数生长期,且生长繁殖能力强,最终菌液OD600 nm值更高。2株乳酸菌菌株生长稳定期持续时间较长,虽然在稳定期内生长速率和生理活性会呈现下降状态,但此时会产生大量代谢产物,是各种有机酸、氨基酸等代谢产物的最佳生物测试期[20],具有较高的利用价值。由图3b可知,2株菌产酸速率与生长速率呈一定的正相关。发酵初期,菌株YM-1的pH值下降速率快,但菌株YM-2持续产酸持续时间长,发酵36 h,2株乳酸菌菌株发酵液的pH值为3.98左右。
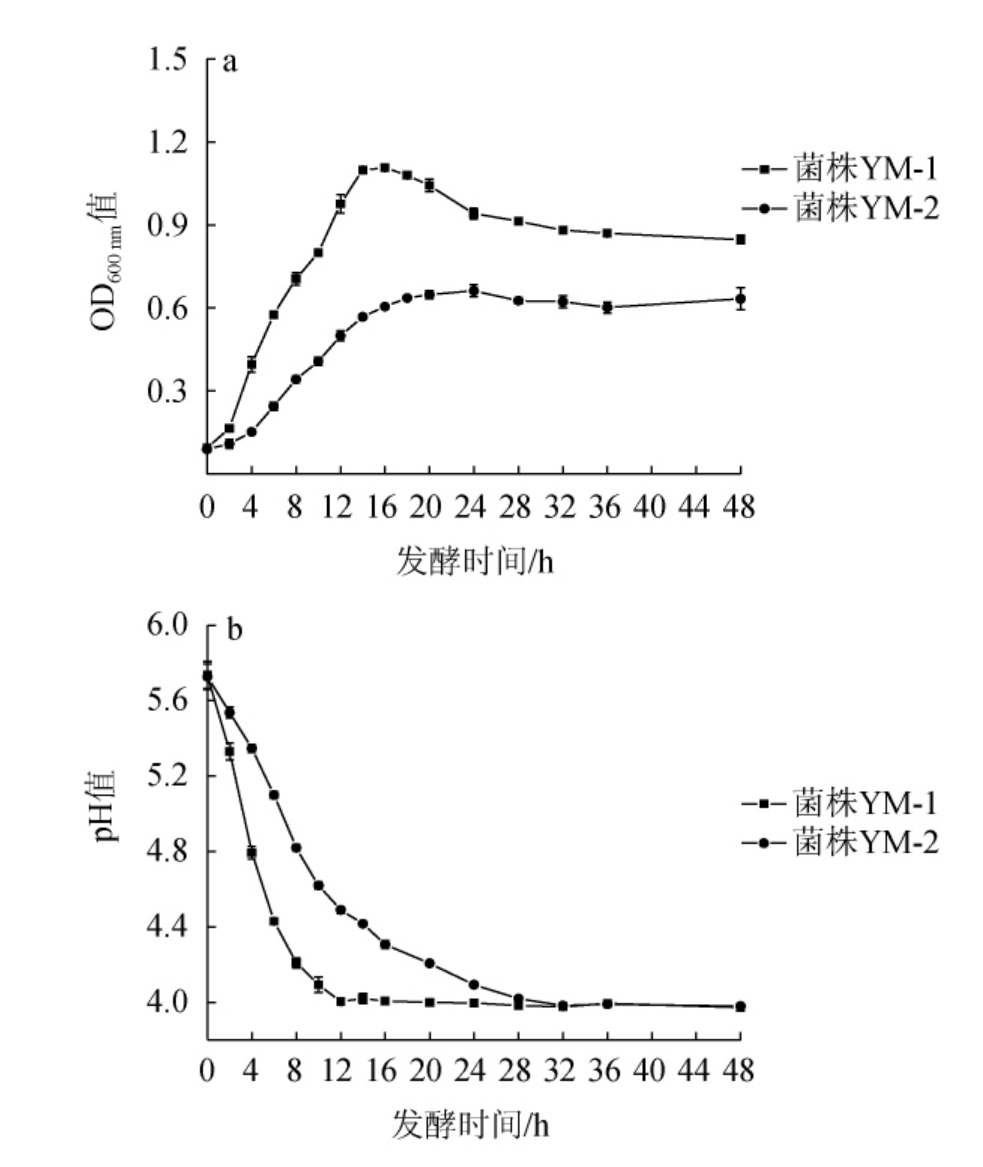
图3 菌株YM-1及YM-2的生长曲线(a)及产酸曲线(b)
Fig.3 Growth curves (a) and acid production curves (b) of strains YM-1 and YM-2
2.4 乳酸菌的益生特性
2.4.1 耐酸能力
益生菌最重要的特性是能够承受低pH的胃液环境[5],其必须在pH值为2~3的条件下存活1.5~2.0 h才能发挥出对宿主健康的益生作用[21]。因此,对2株乳酸菌菌株的耐酸性能进行测定。结果发现,菌株YM-1和YM-2在pH 2.0条件下处理3 h后的存活率分别为96.62%、90.85%,表明这2株乳酸菌菌株具有较高的耐酸性,且菌株YM-1的耐酸性能更高,分析原因可能是不同种类的乳酸菌耐酸能力也不同[22]。
2.4.2 耐胆盐能力
胆盐在脂肪的消化和吸收中起着重要的作用[23],人体小肠内胆盐的含量一般为0.03%~0.30%[24],因此,为了能够让益生菌在小肠中存活进而发挥调节肠道菌群的作用,耐胆盐能力是评价筛选益生菌的一个重要指标[25]。2株乳酸菌在不同胆盐含量条件下的存活率见图4。由图4可知,除菌株YM-1在胆盐含量为0.2%的条件下处理6 h时存活率为99.66%外,其他条件下,2株菌的存活率均>100%,且菌株YM-2在0.1%的胆盐含量条件下处理6 h高达168.41%,说明2株乳酸菌均具有较好的胆盐耐受能力。
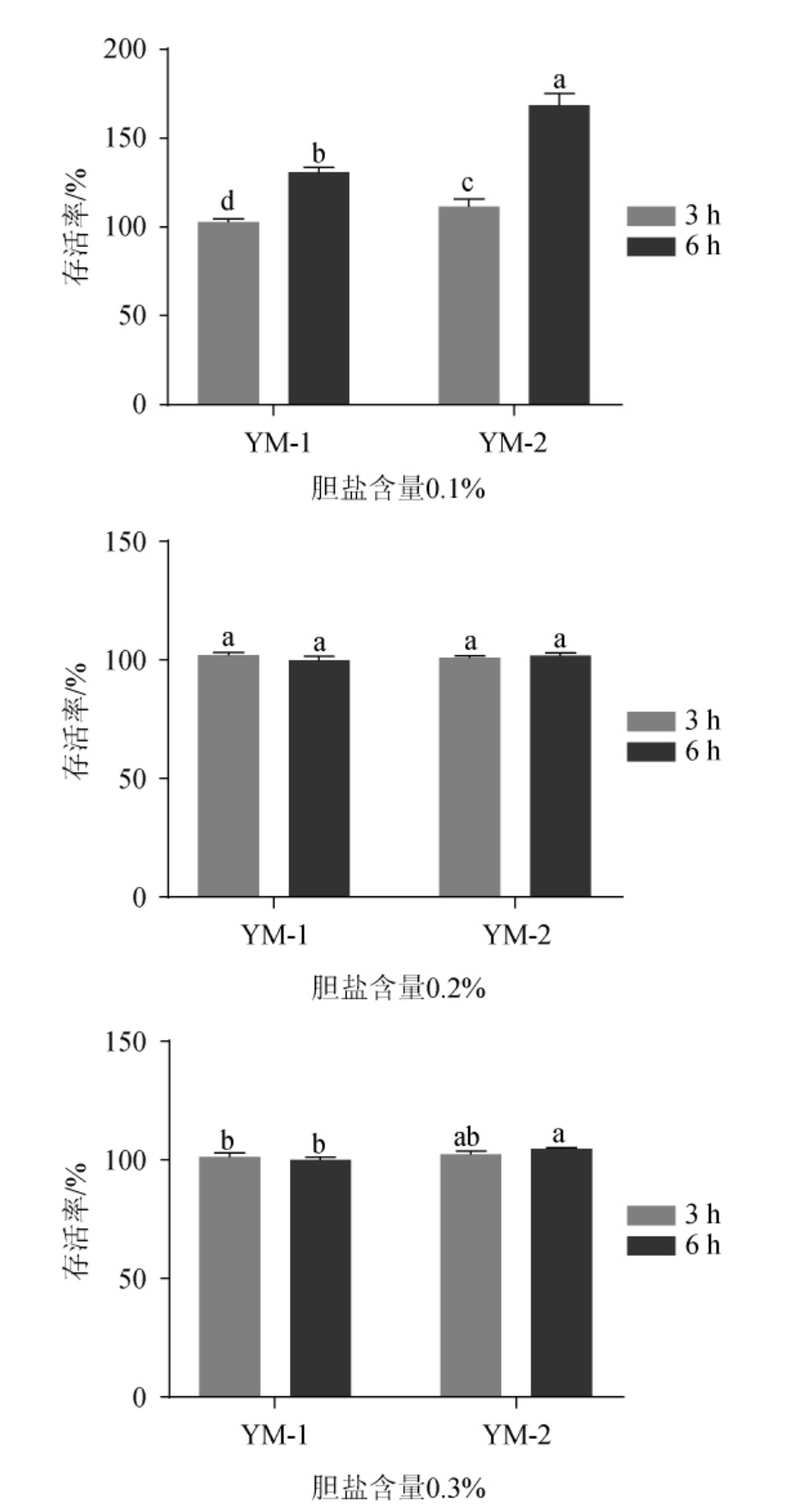
图4 乳酸菌菌株YM-1及YM-2的胆盐耐受性
Fig.4 Bile salt tolerance of lactic acid bacteria strains YM-1 and YM-2
不同小写字母之间表示具有显著性差异(P<0.05)。下同。
2.4.3 α-淀粉酶抑制活性
碳水化合物在人体内经过α-淀粉酶等消化酶水解生成单糖被小肠吸收,通过抑制酶活性控制体内碳水化合物的延缓吸收可达到降低血糖的目的[26-27],消化酶抑制率是体外筛选乳酸菌是否具有降糖活性的重要指标[28]。因此,对2株乳酸菌菌株的α-淀粉酶抑制活性进行测定,结果见表1。由表1可知,2株乳酸菌菌株的CFS对α-淀粉酶均有抑制作用,且菌株YM-2的CFS抑制率更高,为79.52%。而IC、CFE对α-淀粉酶均无抑制作用。因此,可推断出乳酸菌菌株的CFS中含有α-淀粉酶抑制活性物质,与WANG H等[17]的研究结果一致,乳酸菌中α-淀粉酶抑制剂成份可能是蛋白质和糖类化合物的混合物,是一种分子质量较小的活性物质[29]。综上,2株乳酸菌菌株的CFS均对α-淀粉酶有较好的抑制作用,关于其产生的对α-淀粉酶抑制能力物质的化学成分、结构特征及抑制机理还需进一步的研究。
表1 菌株YM-1和YM-2 α-淀粉酶抑制率的测定结果
Table 1 Determination results of α-amylase inhibition rate of strains YM-1 and YM-2

注:“ND”表示未检出,下同。
样品CFS IC CFE α-淀粉酶抑制率/%菌株YM-1 菌株YM-2 72.57±0.01a ND ND 79.52±0.04a ND ND
2.4.4 抗氧化性能
2株乳酸菌菌株的抗氧化性能见表2。由表2可知,菌株YM-1对DPPH自由基的清除能力高于菌株YM-2,且2株乳酸菌菌株的CFS对DPPH自由基的清除能力最强,分别20.14 μg Trolox/mL、20.25 μg Trolox/mL,为其次是IC,CFE对DPPH自由基的清除能力最弱,说明菌株代谢所产生的抗氧化活性物质主要存在于细胞上清液中。2株乳酸菌菌株CFS的总抗氧化能力最强,且菌株YM-2 CFS的总抗氧化能力显著高于菌株YM-1(P<0.05),而2株乳酸菌菌株CFE的总抗氧化能力无显著差异(P>0.05)。2株乳酸菌菌株CFS的铁离子还原能力最高,且菌株YM-1 CFS的铁离子还原能力显著高于菌株YM-2(P<0.05),说明具有还原能力的活性物质在不同菌株、不同部位都存在差异。分析原因一方面可能是超声破碎使部分活性物质失活,另一方面可能是菌株胞外代谢产物中还原力强的物质较多[30]。总之,乳酸菌在面临氧胁迫时会产生一系列抗氧化酶,维持机体氧化还原平衡[31]。结果表明,筛选的2株乳酸菌均表现出了较强的抗氧化活性。
表2 菌株YM-1和YM-2抗氧化能力的测定结果
Table 2 Determination results of antioxidant capacity of strains YM-1 and YM-2
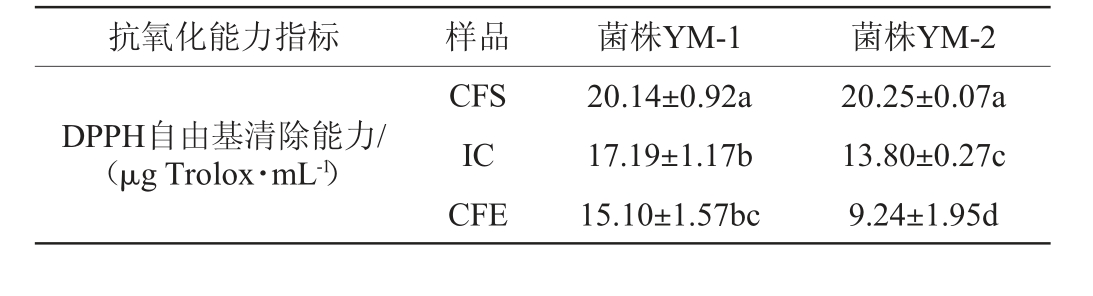
抗氧化能力指标 样品 菌株YM-1 菌株YM-2 DPPH自由基清除能力/(μg Trolox·mL-1)CFS IC CFE 20.14±0.92a 17.19±1.17b 15.10±1.57bc 20.25±0.07a 13.80±0.27c 9.24±1.95d
续表
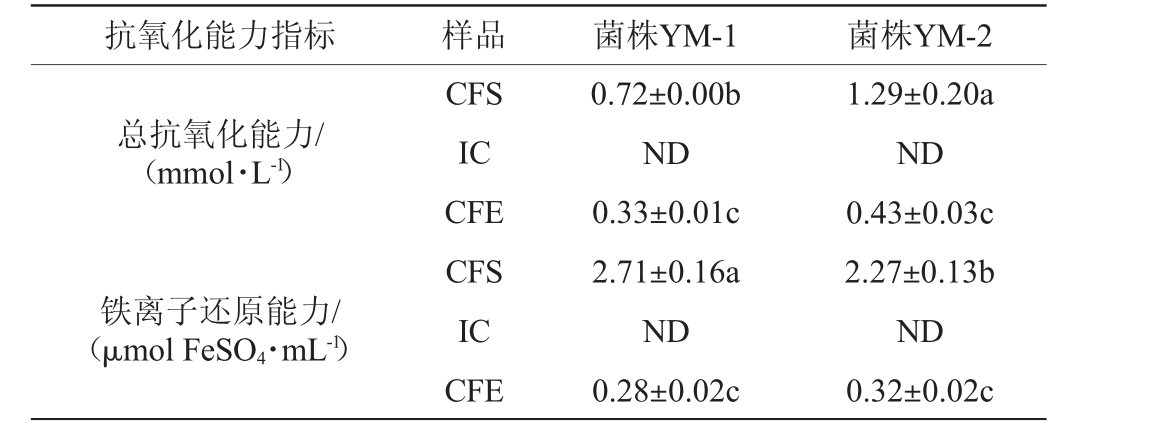
抗氧化能力指标 样品 菌株YM-1 菌株YM-2总抗氧化能力/(mmol·L-1)铁离子还原能力/(μmol FeSO4·mL-1)CFS IC CFE CFS IC CFE 0.72±0.00b ND 0.33±0.01c 2.71±0.16a ND 0.28±0.02c 1.29±0.20a ND 0.43±0.03c 2.27±0.13b ND 0.32±0.02c
2.4.5 抑菌性能
由于自然发酵会产生一定的腐败菌,严重影响食物的安全性,具有抑制腐败菌和致病菌生长的能力也成为筛选植物源益生菌的关键[32]。2株乳酸菌菌株对4种常见致病菌的抑制能力见表3。由表3可知,2株乳酸菌菌株对4种常见致病菌均表现出良好的抑菌活性,且菌株YM-2的抑菌能力强于菌株YM-1。2株乳酸菌菌株对Staphylococcus aureus的抑制能力最明显,其中菌株YM-2对Staphylococcus aureus的抑制能力最强,抑菌圈直径达20.77 mm。分析原因可能是,益生菌生长过程中产生的代谢物中含有一些抗微生物化合物[33],如有机酸[34]、乙醇或细菌素H2O2[35]、蛋白类物质[36]等,可以抑制各种细菌病原体。
表3 菌株YM-1和YM-2抑菌性能的测定结果
Table 3 Determination results of antimicrobial ability of strains YM-1 and YM-2

致病菌Staphylococcus aureus Shigella Castellani Escherichia coli Salmonella抑菌圈直径/mm菌株YM-1 菌株YM-2 18.31±0.22b 18.57±0.33b 15.39±0.15d 14.50±0.63e 20.77±0.15a 17.88±0.36b 16.69±0.06c 16.23±0.56c
3 结论
本研究采用稀释平板法从“酸汤子”自然发酵玉米液中筛选出2株具有益生菌特性的乳酸菌,编号为YM-1、YM-2,经形态观察及分子生物学分别鉴定为植物乳杆菌(Lactiplantibacillus plantarum)和乳酸片球菌(Pediococcus acidilactici)。通过生长特性分析发现,2株乳酸菌菌株均具有稳定的生长状态与良好的产酸能力。通过益生特性分析发现,2株乳酸菌菌株均具有良好的耐酸、耐胆盐能力,且菌株YM-1的耐酸能力更强,菌株YM-2的耐胆盐能力更强;2株乳酸菌菌株的CFS对α-淀粉酶均具有抑制作用,抑制率分别为72.57%与79.52%,说明2株菌具有良好的降血糖的潜力;2株乳酸菌菌株的CFS、IC和CFE均有较强的DPPH自由基清除能力,CFS和CFE具有总抗氧化能力和铁离子还原能力;2株乳酸菌菌株对Staphylococcus aureus、Shigella Castellani、Escherichia coli、Salmonella 4种致病菌均具有良好的抑制作用。本研究可为乳酸菌在玉米发酵食品中的应用提供参考。
[1]罗其琪,顾丰颖,曹晶晶,等.鼠李糖乳杆菌发酵对玉米粉,玉米面团理化特性及发糕品质的影响[J].食品科学,2018,39(18):1-7.
[2]李晓娜,亓鑫,赵卉,等.植物乳杆菌改性玉米粉制作玉米面条的工艺及品质分析[J].食品与发酵工业,2019,45(5):185-189.
[3]熊柳,张兆丽,孙庆杰.乳酸处理对大米淀粉性质的影响[J].粮油食品科技,2010,18(1):13-16.
[4]白雪,赵闪闪,肖志刚,等.酸汤子面团对发酵面包品质的影响[J].食品科学,2021,42(2):135-142.
[5] GUPTA S,MOHANTY U, MAJUMDAR R K.Isolation and characterization of lactic acid bacteria from traditional fermented fish product Shidal of India with reference to their probiotic potential[J].LWT-Food Sci Technol,2021,146(1):111641.
[6]DEC M,PUCHALSKI A,URBAN-CHMIEL R,et al.Screening of Lactobacillus strains of domestic goose origin against bacterial poultry pathogens for use as probiotics[J].Poultry Sci,2014,93(10):2464-2472.
[7]WU T,ZHANG Y,LI W,et al.Lactobacillus rhamnosus LRa05 ameliorate hyperglycemia through a regulating glucagon-mediated signaling pathway and gut microbiota in type 2 diabetic mice[J].J Agr Food Chem,2021,69(31):8797-8806.
[8]SHI J,XIE Q,YUE Y,et al.Gut microbiota modulation and anti-inflammatory properties of mixed lactobacilli in dextran sodium sulfate-induced colitis in mice[J].Food Funct,2021,12(11):5130-5143.
[9]张金兰,魏巍,杨云,等.乳酸菌发酵对枸杞果汁体外抗氧化和抗炎活性的影响[J].中国酿造,2023,42(2):76-82.
[10]陈晓维,温靖,肖更生,等.乳酸菌混合发酵在红枣浆中的发酵特性研究[J/OL].食品与发酵工业:1-10[2023-03-07].DOI:10.13995/j.cnki.11-1802/ts.034347.
[11]LYNCH K M,ZANNINI E,COFFEY A,et al.Lactic acid bacteria exopolysaccharides in foods and beverages: isolation, properties, characterization,and health benefits[J].Annu Rev Food Sci Technol,2018,9(1):155-176.
[12]聂紫玉,吴艳阳,王增光,等.植物源益生乳酸菌的筛选及其特性[J].食品科学,2022,43(18):143-151.
[13]王璐,王伟伟,王艳霞,等.果蔬发酵乳酸菌的筛选,鉴定及发酵性能分析[J].食品科学,2020,41(10):166-171.
[14]陈娟,魏甲乾,祁宏山,等.尾菜青贮用乳酸菌的筛选及理化特性研究[J].饲料研究,2022,45(19):89-92.
[15]陈显玲,农秀丽,卢丽婷,等.来宾酒糟酸菜中降胆固醇乳酸菌的筛选鉴定及发酵工艺研究[J].中国酿造,2022,41(6):93-98.
[16]曹英,侯敏,易光平,等.驼乳制品中抑制α-淀粉酶和α-葡萄糖苷酶活性乳酸菌的筛选及益生特性研究[J].食品工业科技,2022,43(19):191-201.
[17]WANG H,LI L.Comprehensive evaluation of probiotic property,hypoglycemic ability and antioxidant activity of lactic acid bacteria[J].Foods,2022,11(9):1363.
[18]杜东晓,赵龙妹,李旺,等.具有优良抑菌特性乳酸菌的筛选鉴定及活性物质检测[J].微生物学通报,2022,49(8):3165-3178.
[19]宋红丽,杨佳夷,郑立,等.抗铜绿假单胞菌南极微生物的筛选、鉴定及其抑菌谱研究[J].中国酿造,2022,41(11):108-112.
[20]朱艳蕾.细菌生长曲线测定实验方法的研究[J].微生物学杂志,2016,36(5):108-112.
[21] HIROMI K, MASARU N, MIHO K, et al.Identification and probiotic characteristics of Lactococcus strains from plant materials[J].Jpn Agr Res Q,2004,38(2):111-117.
[22]杨旭洲,陈佩瑶,张富新.抗氧化乳酸菌的筛选及其益生特性评价[J].食品与发酵工业,2023,49(10):17-23.
[23]LIU W,CHEN M,DUO L,et al.Characterization of potentially probiotic lactic acid bacteria and bifidobacteria isolated from human colostrum[J].J Dairy Sci,2020,103(5):4013-4025.
[24]焦时阳,王晓彤,侯玉新,等.柿子醋醪中优良乳酸菌的筛选及其耐受性和功能性分析[J].食品工业科技,2023,44(8):161-169.
[25]WON S M,CHEN S,PARK K W,et al.Isolation of lactic acid bacteria from kimchi and screening of Lactobacillus sakei ADM14 with anti-adipogenic effect and potential probiotic properties[J].LWT-Food Sci Technol,2020,126:109296.
[26]张育浩,张得钧,张本印.具有降血糖活性的生物碱及其作用机制[J].中草药,2018,49(15):3692-3702.
[27]熊能,韦圣,胡忠策.α-葡萄糖苷酶抑制剂的研究进展和趋势[J].发酵科技通讯,2018,47(1):58-64.
[28]罗龙龙,任卫合,蔡林海,等.乳酸菌改善糖尿病代谢作用机制研究进展[J].食品工业科技,2021,42(08):404-409.
[29]刘文瑞.产α-淀粉酶抑制剂乳酸菌的筛选及活性成分纯化研究[D].南京:南京农业大学,2020.
[30]吴祖芳,洪松虎,沈锡权,等.乳酸菌高抗氧化活性菌株的筛选及鉴定[J].中国食品学报,2010,10(1):73-78.
[31]段希宇,叶陵,刘成国,等.乳酸菌的抗氧化作用机制[J].微生物学杂志,2017,37(3):111-115.
[32]吴江丽,曾雪峰,刘金桂,等.酸浆中高产酸乳酸菌的筛选及其发酵黄浆水风味特征研究[J].食品与发酵科技,2022,58(3):1-8,33.
[33]KANPIENGJAI A,NUNTIKAEW P,WONGSANITTAYARAK J,et al.Isolation of efficient xylooligosaccharides-fermenting probiotic lactic acid bacteria from ethnic pickled bamboo shoot products[J].Biology,2022,11(5):638.
[34]宫路路,赵志敏,杨颜,等.丹江镇辣椒红酸汤细菌菌群多样性分析及抗食源性致病菌乳酸菌筛选[J].中国酿造,2022,41(9):93-98.
[35]王更辰,任晓镤,郭雪峰,等.抗金黄色葡萄球菌乳酸菌筛选及其抗菌物质特性研究[J/OL].中国动物传染病学报:1-11[2023-03-07].DOI:10.19958/j.cnki.cn31-2031/s.20221110.001.
[36]吕蕾,杨晓萍,王阿利,等.酱油渣中具有抑菌活性的乳酸菌的筛选及其抑菌特性[J].食品工业科技,2022,43(18):137-144.