猕猴桃(Actinidia chinensis Planch),又名奇异果,富含多种营养成分,如维生素、可溶性膳食纤维、氨基酸和矿物质等,被誉为“水果之王”[1]。经过加工,猕猴桃可制成猕猴桃果酒,其独特风味和保健功能备受青睐。但由于发酵菌种和工艺技术的限制,猕猴桃果酒的口感较为平淡,果香不够突出[2]。苹果梨因其形似苹果,果形扁圆而得名[3],其具有丰富的营养物质,如维生素[4]、有机酸[5]、氨基酸[6]、矿物质元素[7]和多酚类物质[8]等。近年来,果酒日渐受到国内酒类消费者的青睐,研发品质优良、口味多样化、又兼具酒味醇香的复合型果酒逐步成为果酒开发的主要方向。
库德毕赤酵母(Pichiakudriavzevii)作为一种非酿酒酵母(non-Saccharomyces),也被称为东方伊萨酵母(Issatchenkia orientalis),是传统发酵过程中一类非常重要的功能酵母,具有较好的耐热、耐乙醇、耐盐和耐糖性能,在高于35 ℃的温度条件下,比酿酒酵母(Saccharomyces cerevisiae)能够更有效的生产乙醇[9-10]。库德毕赤酵母在果酒的酿造过程中具有产生浓郁果香风味的功能,其代谢产物苯乙醇可以显著抑制发酵体系中其他真菌的生长,对菌群具有调控作用[11]。此外,库德毕赤酵母还可以调节酿造环境中乳酸的含量[12]。尽管库德毕赤酵母在果酒的酿造过程中发挥了重要作用,但将其应用于酿造复合果酒的报道较少。
本研究以猕猴桃汁为分离基质,通过传统培养分离法从中分离酵母菌株,通过形态观察、生理生化试验及分子生物学技术对分离菌株进行鉴定,并将其应用于猕猴桃-苹果梨复合果酒的酿造。以复合果酒的酒精度和感官评分为考察指标,利用单因素试验和响应面试验,优化复合果酒的发酵工艺,以期研制出滋味口感、香气、外观更为优质的复合型果酒。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
猕猴桃:河南省南阳市西峡县;苹果梨:吉林省延吉市。
1.1.2 试剂
果胶酶(3 500 U/g):陕西源优生物科技有限公司;亚硫酸氢钠:山东鲁森生物科技有限公司;氨苄青霉素:上海麦克林生化科技有限公司;葡萄糖、蛋白胨、酵母浸出粉:北京奥博星生物技术有限责任公司;琼脂粉:成都市科隆化学品有限公司;葡萄糖、乙醇、硫酸铜、次甲基蓝、酒石酸钾钠、酚酞:成都金山化学试剂有限公司;月桂基硫酸盐胰蛋白胨肉汤、亚硒酸盐胱氨酸增菌液、四硫磺酸盐煌绿增菌液(tetrathionate broth base,TTB)、Baird-Parker琼脂:青岛海博生物技术有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)快速提取试剂盒:上海派森诺生物科技有限公司。本研究所用试剂均为分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[13]:酵母浸粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,pH 6.0。121 ℃高压蒸汽灭菌20 min。固体培养基中添加琼脂粉20 g/L。
分离培养基[14]:YEPD培养基中添加氨苄青霉素25 μg/mL,pH 6.0。
种子培养基:采用YEPD培养基。
1.2 仪器与设备
DHG101型电热鼓风干燥箱:青岛聚创华业分析仪器有限公司;HH-1型数显恒温水浴锅:常州市亿能实验仪器厂;CA-2100H型便携式酒精检测仪:济南江开电子科技有限公司;LB90T型糖度测试仪:上海科晓科学仪器有限公司;SN-EPX-30B型生化培养箱:上海尚仪仪器设备有限公司;LS-50HJ立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;SW-CJ2D超净工作台:上海苏净实业有限公司;DHG-9023A电热干燥箱:上海琅歼实验设备有限公司;HZ150L恒温培养摇床:武汉瑞华仪器设备有限责任公司;V-1000可见分光光度计:翱艺仪器有限公司;TG-16医用离心机:四川蜀科仪器有限公司;Y400显微镜:日本尼康公司;JE2002电子天平:上海欧普特有限公司。
1.3 试验方法
1.3.1 猕猴桃汁中酵母菌株的分离筛选
从放置一段时间后的猕猴桃中挑选出新鲜、熟透、无虫害的猕猴桃,清洗、破碎打浆、随后过滤,即为猕猴桃汁。猕猴桃汁自然发酵7 d,吸取1 mL猕猴桃汁,按10倍梯度稀释至10-7,取100 μL稀释液涂布于分离培养基平板上,每个梯度涂布3个平行。在30 ℃恒温培养箱中培养3 d,同时观察菌落并记录。挑取单菌落在分离培养基上划线分离至纯种,4 ℃条件下斜面保存菌种[15]。
1.3.2 分离菌株的鉴定
形态学观察:将分离得到的菌株接种于种子培养基,30 ℃培养1 d,连续活化培养两代后,取100 μL活化液涂布接种至种子培养基中,30 ℃培养3 d,观察菌落形态,并挑取单菌落,美兰染色制作水浸片后在显微镜下观察细胞形态。
生理生化鉴定:参照贾丽艳等[16]的生理生化试验方法对分离菌株进行糖类发酵试验(葡萄糖、蔗糖、麦芽糖、可溶性淀粉)、碳源同化试验(果糖、半乳糖、木糖、阿拉伯糖、纤维二糖)、氮源同化试验(硝酸铵、硫酸铵、硝酸钾、蛋白胨、酵母粉)。
分子生物学鉴定:利用DNA快速提取试剂盒提取分离菌株的基因组DNA,以其为模板,采用通用引物26S rDNA(5'-GCATATCGGTAAGCGGAGGAAAAG-3')和1492R(5'-GGTCCGTGTTTCAAGACGG-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增结果委托南京派森诺有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对搜索,选择同源性较高的模式菌株的26S rDNA基因序列使用ClustalX2和MEGA11.0软件处理,采用邻接(neighborjoining,NJ)法构建系统进化树。
1.3.3 猕猴桃-苹果梨复合果酒发酵工艺流程及操作要点
猕猴桃、苹果梨→去皮→榨汁→加入亚硫酸氢钠→酶解→过滤→混合→调节糖度→酵母活化→接种、发酵→过滤→澄清→陈酿→灭菌→成品
操作要点:
原料预处理:挑选成熟、无虫害、无霉变的猕猴桃和苹果梨清洗、晾干、去皮、除梗、破碎打浆[17],向果浆中添加0.02%亚硫酸氢钠混匀。
酶解:按照猕猴桃果浆∶水=1∶1(g∶g)、苹果梨果浆∶水=1∶1(g∶g)的比例分别稀释,再分别加入0.01%的果胶酶,50 ℃酶解2 h[18]。
过滤、混合:用8层纱布分别过滤酶解结束的猕猴桃果浆和苹果梨果浆,制得猕猴桃果汁和苹果梨果汁;按猕猴桃果汁和苹果梨果汁质量比1∶1混合均匀。
调节糖度:测定酶解混合后的果汁糖度,加入白砂糖调节糖度为16%[19]。
酵母活化:挑取斜面保存的筛选菌株至种子培养基中于28 ℃培养24 h后,添加少许复合果汁,有利于酵母的生长繁殖,控制种子液OD600nm值为0.6~1.0,酵母活化完成[20]。
酵母接种、发酵:按复合果酒体积接种0.3%筛选菌株,20 ℃发酵至残糖不再变化[21]。
过滤、澄清:发酵结束后,发酵液经4 000 r/min离心10 min,使用100目的果酒专业过滤袋过滤[22]。
陈酿、灭菌:加入0.05%SO2将过滤后的发酵液进行低温(10 ℃)陈酿30 d,即得猕猴桃-苹果梨复合果酒成品[23]。
1.3.4 猕猴桃-苹果梨复合果酒发酵工艺优化单因素试验
以酒精度及感官评分为评价指标,采用单因素轮换法依次考察发酵温度(16 ℃、18 ℃、20 ℃、22 ℃、24 ℃)、分离菌株接种量(0.2%、0.3%、0.4%、0.5%、0.6%)、初始糖度(12%、16%、20%、24%、28%)、猕猴桃果汁与苹果梨果汁质量比(1∶2、1∶1、3∶2、2∶1、5∶2)对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响。
1.3.5 猕猴桃-苹果梨复合果酒发酵工艺优化响应面试验
综合单因素试验的结果,以酒精度(Y1)和感官评分(Y2)为响应值,发酵温度(X1)、分离菌株接种量(X2)、初始糖度(X3)、猕猴桃果汁与苹果梨果汁质量比(X4)为考察因素,采用Design-Expert 13设计4因素3水平的Box-Behnken响应面试验对猕猴桃-苹果梨复合果酒发酵工艺条件进行优化,试验因素与水平见表1。
表1 复合果酒发酵工艺优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for fermentation conditions optimization of compound wine
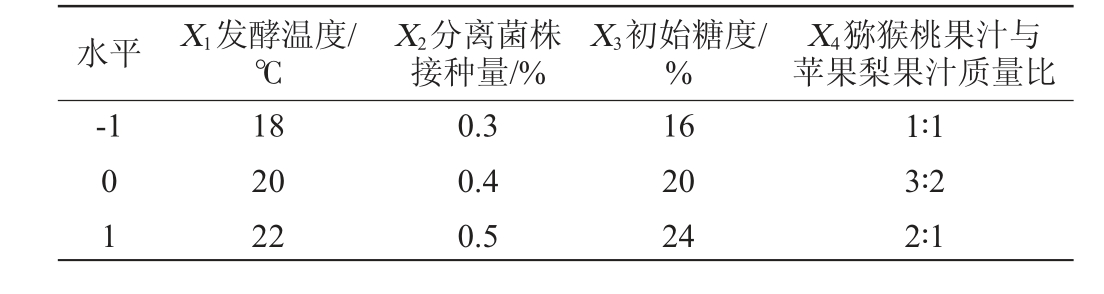
水平 X1发酵温度/℃X4猕猴桃果汁与苹果梨果汁质量比-1 X2分离菌株接种量/%X3初始糖度/%01 18 20 22 0.3 0.4 0.5 16 20 24 1∶1 3∶2 2∶1
1.3.6 检测方法
微生物指标的测定:大肠菌群参照GB 4789.3—2016《食品卫生微生物学检验大肠菌群计数》进行测定,沙门氏菌(Salmonella)参照GB 4789.4—2016《食品微生物学检验沙门氏菌检验》进行测定,金黄色葡萄球菌(Staphylococcus aureus)参照GB 4789.10—2016《食品微生物学检验金黄色葡萄球菌检验》中的第一法进行测定。
理化指标的测定:酒精度测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酸含量的测定采用酸碱滴定法[24],总糖含量的测定采用3,5-二硝基水杨酸法[25]。
感官评价:邀请10位具有复合果酒评审经验的专家对猕猴桃-苹果梨复合果酒的样品进行品评,品评主要涵盖了口感与滋味、香气、色泽、组织状态四个层次。每一个样品评审之后,将该样品在这四个层次的得分进行相加,得出样品的感官评价总分,满分100分,最后将10位专家评分的平均值作为该样品的最终感官得分,具体评价标准见表2[26]。
表2 猕猴桃-苹果梨复合果酒感官评价标准
Table 2 Sensory evaluation standards of kiwifruit and apple pear compound fruit wine

项目 评分标准 分值/分口感与滋味(40分)香气(30分)色泽(10分)组织状态(20分)果酒酸甜适中,口味柔和,果味与酒味协调果酒稍酸或稍甜,有猕猴桃和苹果梨的香味果酒偏酸或偏甜,无猕猴桃或苹果梨的香味,无不良口味酒体寡淡、具有不愉快的气味猕猴桃与苹果梨香气显著且均衡,无异味猕猴桃与苹果梨香气清淡无明显猕猴桃与苹果梨香气无香气,带有不愉悦的气味色泽均匀,呈淡黄色或黄绿色色泽良好色泽较差均匀细腻,澄清、透明,无沉淀和分层澄清、透明,无明显沉淀澄清、略微失光,有轻微沉淀和分层37~40 31~36 25~30 0~24 25~30 20~24 15~19 0~14 7~10 4~6 0~3 16~20 11~15 0~11
1.3.7 数据处理及分析
每个试验重复3次,结果用“平均值±标准差”表示,采用IBM SPSS Statistics 27进行方差分析、数据处理及差异显著性分析,采用Origin 2021绘制柱状图。
2 结果与分析
2.1 酵母菌株的分离筛选
通过平板涂布、纯化,从猕猴桃汁自然发酵液中分离筛选出一株酵母菌,初步命名为AY1-1。
2.2 酵母菌株AY1-1的鉴定
2.2.1 形态观察
酵母菌株AY1-1的形态观察结果见图1。由图1可知,菌株AY1-1的菌落为圆形,乳白色,不透明,凸起,易挑取,四周平整,表面粗糙。菌体为椭圆形,芽殖,且细胞壁较厚。
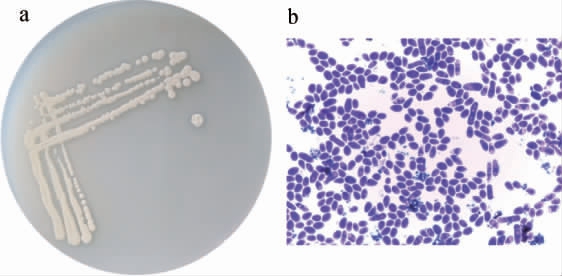
图1 菌株AY1-1的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain AY1-1
2.2.2 生理生化试验结果
菌株AY1-1的生理生化试验结果见表3。由表3可知,菌株AY1-1可发酵葡萄糖和蔗糖,不可发酵麦芽糖和可溶性淀粉;可利用的碳源有果糖和半乳糖,不可利用的碳源有木糖、阿拉伯糖和纤维二糖;可利用的氮源有蛋白胨、硝酸钾和酵母粉,不可利用的氮源是硝酸铵和硫酸铵。结合形态观察,按照《酵母菌的特征与鉴定手册》,初步判定菌株AY1-1为毕赤酵母属(Pichia)[27]。
表3 菌株AY1-1的生理生化试验结果
Table 3 Physiological and biochemical test results of strain AY1-1
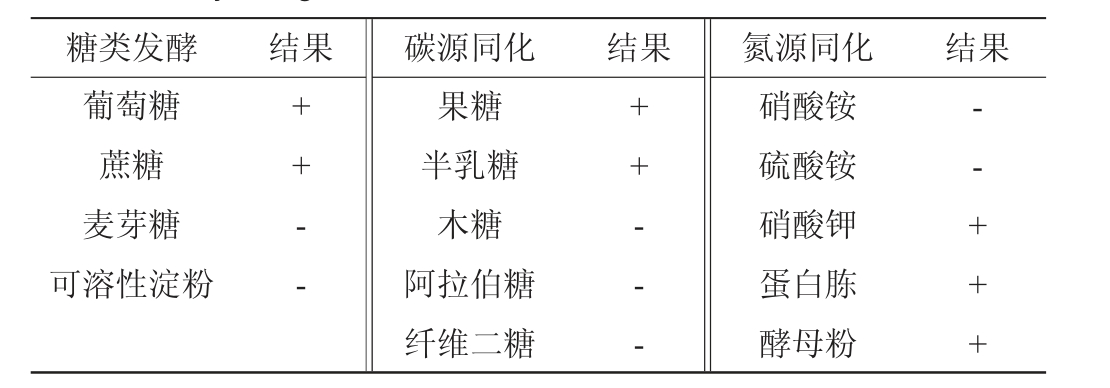
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
糖类发酵 结果 碳源同化 结果 氮源同化 结果葡萄糖蔗糖麦芽糖可溶性淀粉++ - -果糖半乳糖木糖阿拉伯糖纤维二糖++ - - -硝酸铵硫酸铵硝酸钾蛋白胨酵母粉-- + + +
2.2.3 分子生物学鉴定
基于26S rDNA基因序列构建菌株AY1-1的系统发育树,结果见图2。由图2可知,菌株AY1-1与库德毕赤酵母(Pichia kudriavzevii)strain A40Fa1聚于一支,亲缘关系最近。结合形态观察及生理生化试验结果,鉴定菌株AY1-1为库德毕赤酵母(Pichia kudriavzevii)。

图2 基于26S rDNA基因序列菌株AY1-1的系统发育树
Fig.2 Phylogenetic tree of strain AY1-1 based on 26S rDNA gene sequence
2.3 猕猴桃-苹果梨复合果酒发酵工艺优化单因素试验
2.3.1 发酵温度对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
发酵温度对猕猴桃-苹果梨果酒酒精度和感官评分的影响见图3。由图3可知,随着发酵温度的升高,猕猴桃-苹果梨复合果酒的酒精度和感官评分均呈先升高后下降的趋势;当发酵温度为20 ℃时,猕猴桃-苹果梨复合果酒的酒精度和感官评分最高,分别为(10.3±0.1)%vol和(87.5±0.1)分。在一定的温度范围内,温度升高有助于酵母菌生长繁殖,但超过其最适生长温度将会造成酵母菌活性受到抑制,从而导致发酵不充分,影响香气和酒精含量[19]。因此,确定最佳发酵温度为20 ℃。
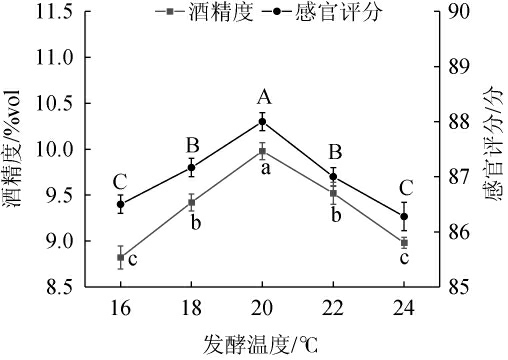
图3 发酵温度对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
Fig.3 Effect of fermentation temperature on alcohol content and sensory score of kiwifruit and apple pear compound wine
同一指标不同字母表示差异显著(P<0.05)。下同。
2.3.2 库德毕赤酵母AY1-1接种量对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
库德毕赤酵母AY1-1接种量对猕猴桃-苹果梨果酒的酒精度和感官评分的影响见图4。由图4可知,随着库德毕赤酵母AY1-1接种量的增加,猕猴桃-苹果梨复合果酒的酒精度和感官评分呈先升高再下降的趋势;当库德毕赤酵母AY1-1接种量为0.4%时,猕猴桃-苹果梨复合果酒的酒精度和感官评分最高,分别为(10.6±0.1)%vol和(87.9±0.1)分。过量的酵母将会过快消耗糖类物质,副代谢产物增多,影响发酵的正常进行,酒精度下降,导致果酒口感不佳[24,28]。因此,确定库德毕赤酵母AY1-1的最佳接种量为0.4%。
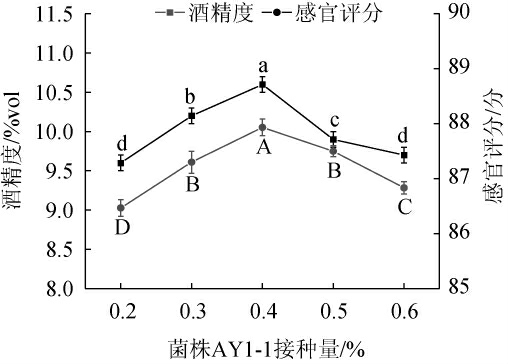
图4 酵母AY1-1接种量对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
Fig.4 Effect of yeast AY1-1 inoculum on alcohol content and sensory score of kiwifruit and apple pear compound wine
2.3.3 初始糖度对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
初始糖度对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响见图5。由图5可知,随着初始糖度的增加,猕猴桃-苹果梨复合果酒的酒精度和感官评分呈先上升后下降的趋势;当初始糖度为20%时,猕猴桃-苹果梨复合果酒的酒精度和感官评分最高,分别为(11.2±0.1)%vol和(88.8±0.1)分。糖分是微生物生长繁殖的重要碳源,存在一个最佳平衡值,糖分过低将会导致微生物不能充分进行生长代谢,糖分过高会抑制微生物生长,同样造成发酵不充分[29]。因此,确定最佳初始糖度为20%。
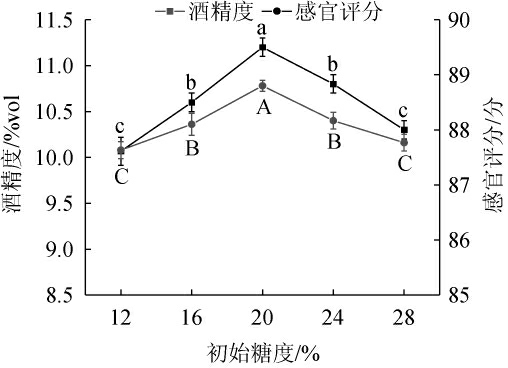
图5 初始糖度对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
Fig.5 Effect of initial sugar concentration on alcohol content and sensory score of kiwifruit and apple pear compound wine
2.3.4 猕猴桃果汁与苹果梨果汁质量比对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
猕猴桃果汁与苹果梨果汁质量比对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响见图6。由图6可知,随着猕猴桃果汁与苹果梨果汁质量比增加,猕猴桃-苹果梨复合果酒感官酒精度和评分呈先上升后下降的趋势;当猕猴桃果汁与苹果梨果汁质量比为3∶2时,猕猴桃-苹果梨复合果酒的酒精度和感官评分最高,分别为(11.8±0.1)%vol和(89.1±0.2)分。因此,确定猕猴桃果汁与苹果梨果汁最佳质量比为3∶2。
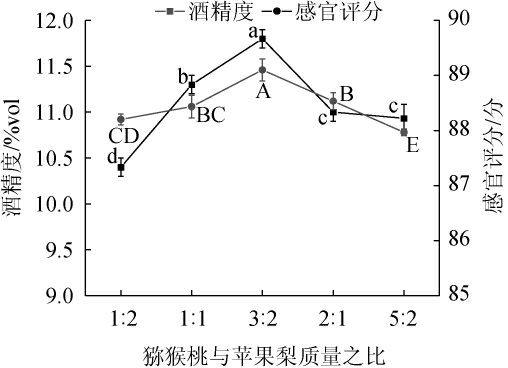
图6 猕猴桃果汁与苹果梨果汁质量比对猕猴桃-苹果梨复合果酒酒精度和感官评分的影响
Fig.6 Effect of mass ratio of kiwifruit and apple pear on alcohol content and sensory score of kiwifruit and apple pear compound wine
2.4 猕猴桃-苹果梨复合果酒发酵工艺优化响应面试验
2.4.1 响应面试验设计
在单因素试验基础上,以酒精度(Y1)和感官评分(Y2)为响应值,发酵温度(X1)、库德毕赤酵母AY1-1接种量(X2)、初始糖度(X3)、猕猴桃果汁与苹果梨果汁质量比(X4)为考察因素,采用Design-Expert 13设计4因素3水平的Box-Behnken响应面试验对猕猴桃-苹果梨复合果酒发酵工艺条件进行优化,试验设计及结果见表4,方差分析见表5和表6。
表4 猕猴桃-苹果梨复合果酒发酵工艺优化响应面试验设计及结果
Table 4 Design and results of Box-Behnken tests for fermentation conditions optimization of compound wine
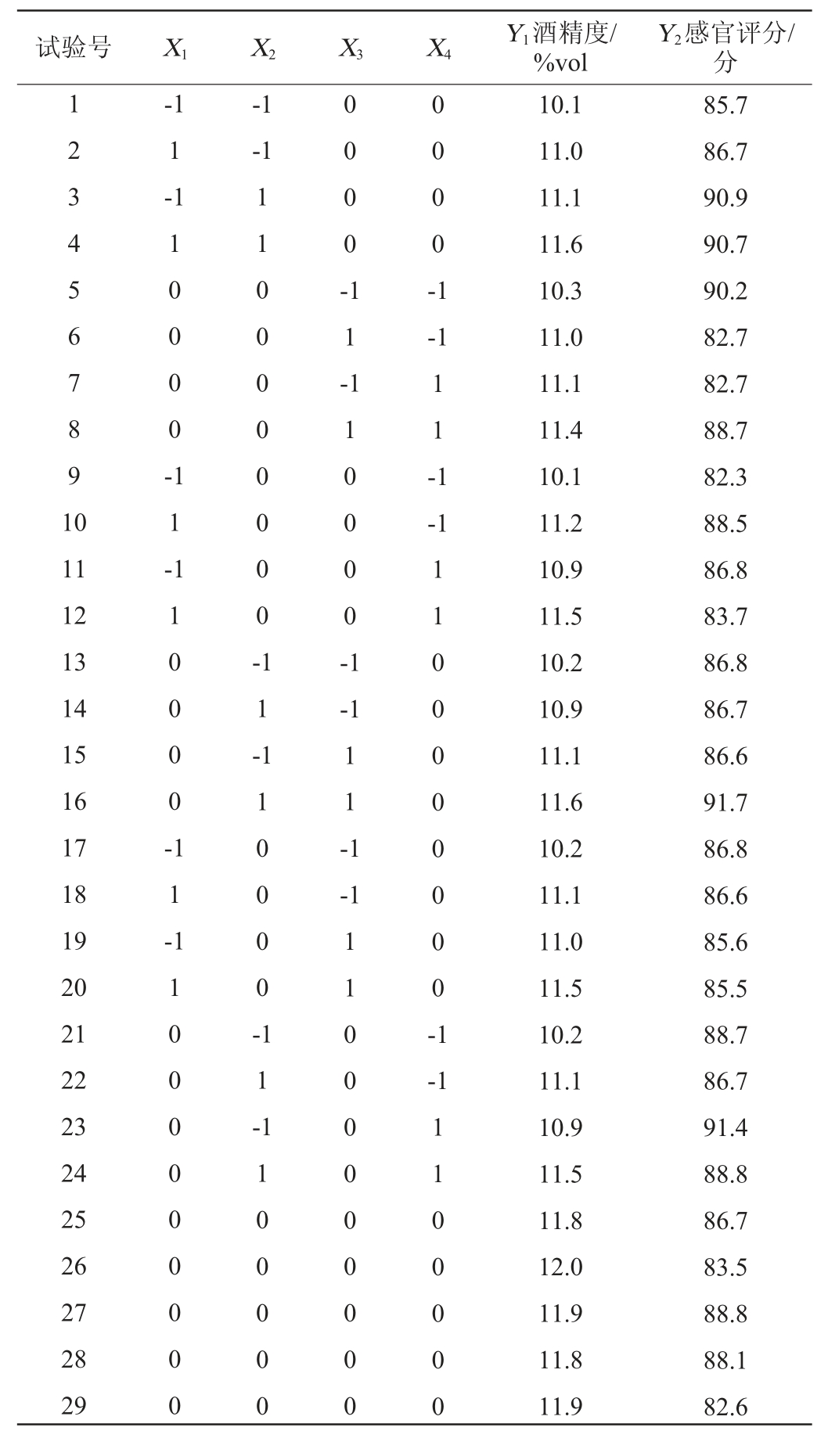
试验号 X1 X2 X3 X4 Y1酒精度/%vol Y2感官评分/分1 2 3 4 5 6 7 8 9 1 0-1 1-1-1-1 1 0 0 0 0 -0 0 0 0 -1 1 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 1 -1 1 0 0 0 0 -1 1 0 0 0 0 0 0 0 0 -1 1 -1 1 0 0 0 0 -1-1 1 1 -1 1 -1-1 1 1 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 -1 1 -1 1 0 0 0 0 0 0 0 0 -1-1 1 1 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 10.1 11.0 11.1 11.6 10.3 11.0 11.1 11.4 10.1 11.2 10.9 11.5 10.2 10.9 11.1 11.6 10.2 11.1 11.0 11.5 10.2 11.1 10.9 11.5 11.8 12.0 11.9 11.8 11.9 85.7 86.7 90.9 90.7 90.2 82.7 82.7 88.7 82.3 88.5 86.8 83.7 86.8 86.7 86.6 91.7 86.8 86.6 85.6 85.5 88.7 86.7 91.4 88.8 86.7 83.5 88.8 88.1 82.6
表5 以酒精度为响应值的回归模型方差分析
Table 5 Regression model variance analysis using alcohol content as response value

注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。下同。
来源 平方和 自由度 均方 F 值 P 值 显著性模型X1 X2 X3 X4 X1X2 X1X3 X1X4 X2X3 X2X4 X3X4 X12 X22 X32 X42残差失拟项纯误差总和9.260 0 1.690 0 1.540 0 1.200 0 0.963 3 0.040 0 0.040 0 0.062 5 0.010 0 0.022 5 0.040 0 1.430 0 1.430 0 1.350 0 1.500 0 0.113 8 0.085 8 0.028 0 9.37 14 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 81.31 207.51 189.50 147.99 118.48 4.92 4.92 7.69 1.23 2.77 4.92 175.60 175.60 166.37 185.08<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1 0.043 6 0.043 6 0.015 0 0.286 1 0.118 4 0.043 6<0.000 1<0.000 1<0.000 1<0.000 1************ * * ********10 4 28 0.661 1 1.690 0 1.540 0 1.200 0 0.963 3 0.040 0 0.040 0 0.062 5 0.010 0 0.022 5 0.040 0 1.430 0 1.430 0 1.350 0 1.500 0 0.008 1 0.008 6 0.007 0 1.23 0.456 5
表6 以感官评分为响应值的回归模型方差分析
Table 6 Regression model variance analysis using sensory evaluation score as response value

来源 平方和 自由度 均方 F 值 P 值 显著性模型X1 X2 X3 X4 X1X2 X1X3 X1X4 X2X3 X2X4 X3X4 X12 X22 X32 X42残差失拟项纯误差总和202.100 0 30.080 0 23.800 0 18.500 0 25.230 0 1.100 0 1.210 0 1.320 0 1.690 0 0.250 0 0.002 5 35.390 0 41.300 0 37.310 0 40.890 0 2.370 0 0.980 8 1.390 0 204.470 0 14 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 85.320 0 177.790 0 140.660 0 109.340 0 149.110 0 6.520 0 7.150 0 7.820 0 9.990 0 1.480 0 0.014 8 209.160 0 244.090 0 220.510 0 241.680 0<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1 0.023 0 0.018 2 0.014 3 0.006 9 0.244 3 0.905 5<0.000 1<0.000 1<0.000 1<0.000 1************ * **********10 4 28 14.440 0 30.080 0 23.800 0 18.500 0 25.230 0 1.100 0 1.210 0 1.320 0 1.690 0 0.250 0 0.002 5 35.390 0 41.300 0 37.310 0 40.890 0 0.169 2 0.098 1 0.347 0 0.282 7 0.952 2
采用Design-Expert 13对表4结果进行多元回归拟合,得到多元二次回归方程:
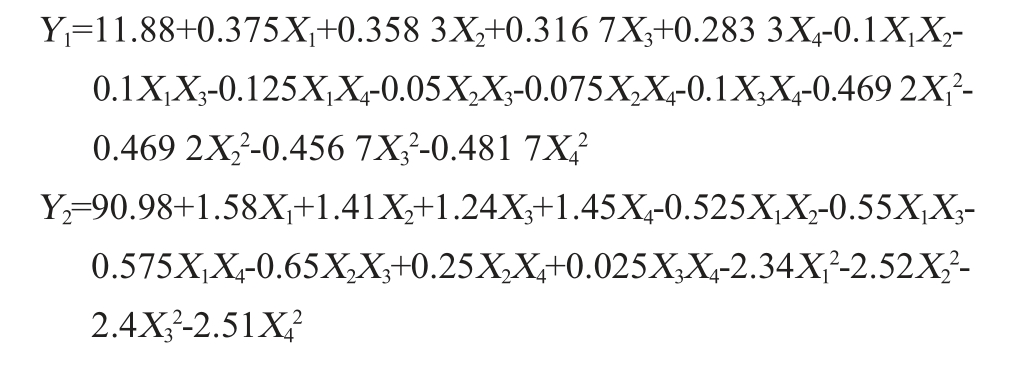
由表5可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明方程模型具有统计学意义且试验误差较小。决定系数R2=0.987 9,调整决定系数R2Adj=0.975 7,表明拟合程度良好,可以采用此模型预测不同条件对酒精度的影响。由表5亦可知,由F值可知,各因素对猕猴桃-苹果梨复合果酒酒精度的影响由大到小依次为:发酵温度(X1)>库德毕赤酵母AY1-1接种量(X2)>初始糖度(X3)>猕猴桃果汁与苹果梨果汁质量比(X4),一次项X1、X2、X3、X4及二次项X12、X22、X32、X42对酒精度的影响极显著(P<0.01);交互项X1X2、X1X3、X1X4、X3X4对酒精度的影响显著(P<0.05)。
由表6可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明方程模型具有统计学意义且试验误差较小。决定系数R2=0.988 4,调整决定系数R2Adj=0.976 8,表明拟合程度良好,可以采用此模型对感官评分进行预测。由表6亦可知,由F值可知,各因素对猕猴桃-苹果梨复合果酒感官评分的影响由大到小依次为:发酵温度(X1)>猕猴桃果汁与苹果梨果汁质量比(X4)>库德毕赤酵母AY1-1接种量(X2)>初始糖度(X3),一次项X1、X2、X3、X4、交互项X2X3及二次项X12、X22、X32、X42对感官评分的影响极显著(P<0.01);交互项X1X2、X1X3、X1X4对感官评分的影响显著(P<0.05)。
为了进一步考察各因素间交互作用对酒精度和感官评分的影响,绘制响应面及等高线图,结果见图7。
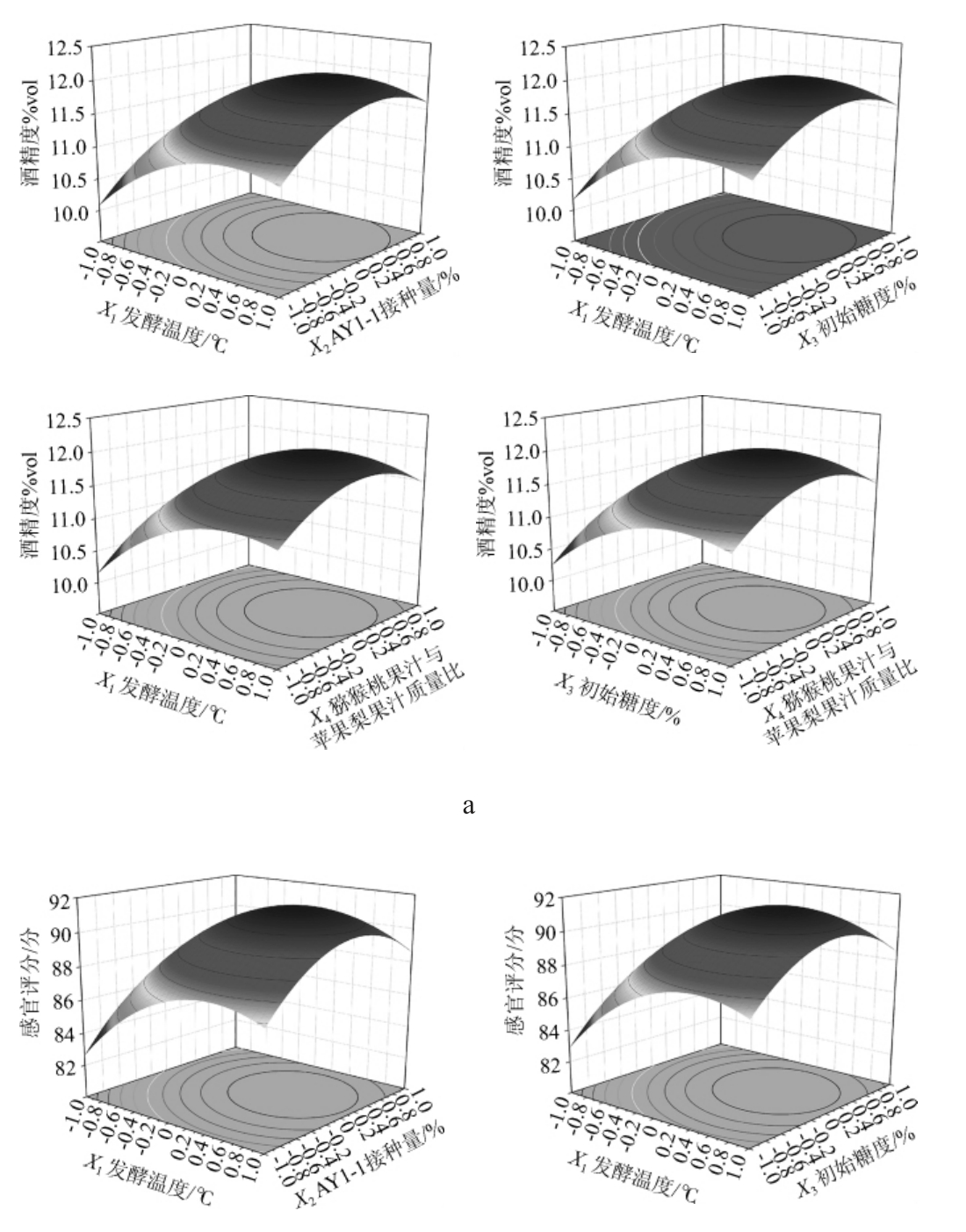
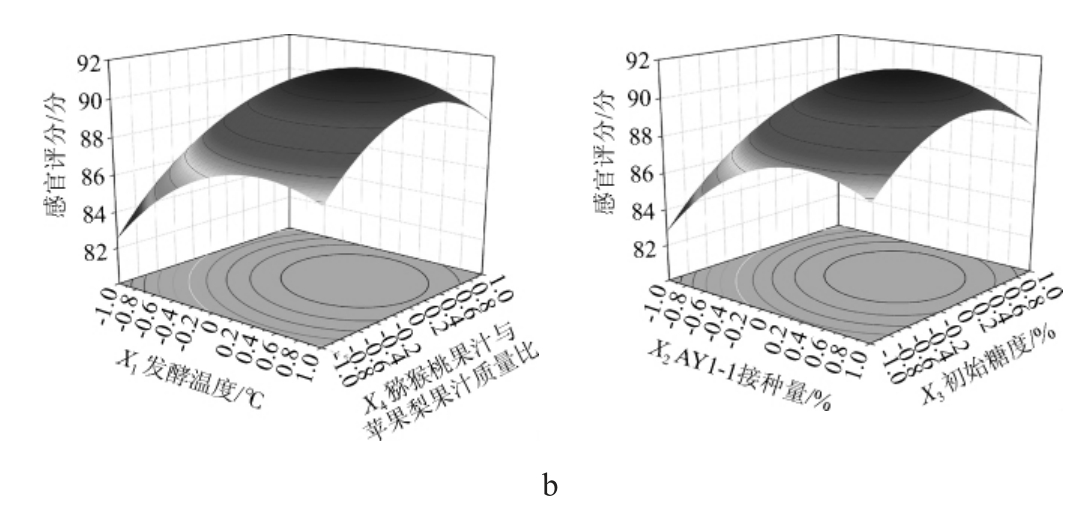
图7 各因素间交互作用对酒精度(a)及感官评分(b)影响的响应面与等高线图
Fig.7 Response surface plots and contour lines of effects of interaction between various factors on alcohol content(a)and sensory score (b)
由图7可知,响应面均呈凸面,说明存在最高值,交互项X1X2、X1X3、X1X4、X3X4对酒精度的影响应面较陡,等高线呈椭圆形;交互项X1X2、X1X3、X1X4对感官评分的影响较陡,等高线呈椭圆形,说明各因素间存在交互作用,对结果影响显著,与方差分析结果一致[30]。
2.4.2 回归模型最优试验组合选择与验证
利用Design-Expert 13.0软件对回归方程进行最优求解,确定获得最高酒精度的试验组合为:发酵温度20.86 ℃、库德毕赤酵母AY1-1接种量0.453%、初始糖度21.556%、猕猴桃果汁与苹果梨果汁质量比1.544∶1。此时,得到猕猴桃-苹果梨复合果酒酒精度理论上的最大值为12.026%vol。根据实际条件调整发酵温度为21 ℃、库德毕赤酵母AY1-1接种量0.45%、初始糖度21.6%、猕猴桃果汁与苹果梨果汁质量比3∶2,在此条件下进行3次平行试验,得到酒精度为(11.9±0.1)%vol,与理论最大值之间的相对误差为1.05%,此时的感官评分为(91.0±0.2)分。说明该模型能够很好地预测发酵温度、库德毕赤酵母AY1-1接种量、初始糖度和猕猴桃果汁与苹果梨果汁质量比对猕猴桃-苹果梨复合果酒酒精度的影响。
利用Design-Expert 13.0软件对回归方程进行最优求解,确定获得最高感官评分的试验组合为:发酵温度20.51 ℃、库德毕赤酵母AY1-1接种量0.424%、初始糖度20.796%、猕猴桃果汁与苹果梨果汁质量比为1.636∶1。此时,猕猴桃-苹果梨复合果酒感官评分理论上的最大值为91.672分。根据实际条件调整发酵温度为21 ℃、库德毕赤酵母AY1-1接种量0.4%、初始糖度20.8%、猕猴桃果汁与苹果梨果汁质量比1.6∶1,在此条件下进行进行3次平行试验,得到感官评分为(91.3±0.1)分,与理论最大值之间的相对误差为0.41%,此时的酒精度为(11.5±0.1)%vol,说明该模型能够很好地预测发酵温度、库德毕赤酵母AY1-1接种量、初始糖度和猕猴桃果汁与苹果梨果汁质量比对猕猴桃-苹果梨复合果酒感官评分的影响,且稳定可行。
在实际生产过程中,综合酒精度和感官评分设计工艺时,应将感官评分作为首选考察指标[31]。因此,确定最优发酵工艺为发酵温度21 ℃、库德毕赤酵母AY1-1接种量0.4%、初始糖度20.8%、猕猴桃果汁与苹果梨果汁质量比1.6∶1,此时酒液澄清,无悬浮沉淀,香气浓郁,酒体丰厚,回味悠长,感官评分为(91.3±0.1)分,酒精度为(11.5±0.1)%vol。
2.5 猕猴桃-苹果梨复合果酒理化指标及微生物指标的测定
通过测定最优发酵工艺得到的猕猴桃-苹果梨复合果酒的理化指标及微生物指标发现,猕猴桃-苹果梨复合果酒总酸含量为4.9 g/L,总糖含量为3.7 g/L,未检出沙门氏菌、大肠杆菌、金黄色葡萄球菌,其理化和微生物指标均符合标准QB/T 5476—2020《果酒通用技术要求》和NY/T 1508—2017《绿色食品果酒》。
3 结论
本研究以自然发酵的猕猴桃汁为分离筛选基质,经传统分离方法分离筛选出一株酵母菌株AY1-1,经形态观察、生理生化试验及分子生物学技术鉴定其为库德毕赤酵母(Pichia kudriavzevii)。将其应用于猕猴桃-苹果梨复合果酒的酿造,通过单因素试验及响应面试验确定猕猴桃-苹果梨复合果酒的最优发酵工艺为发酵温度为21 ℃、库德毕赤酵母AY1-1接种量0.4%、初始糖度20.8%、猕猴桃汁与苹果梨汁质量比1.6∶1,在此发酵工艺条件下,猕猴桃-苹果梨复合果酒色泽淡黄,澄清透明,酒味纯正,有明显的猕猴桃和苹果梨复合果香,口感细腻,果味与酒味协调,感官评分为(91.3±0.1)分,酒精度为(11.5±0.1)%vol,其理化和微生物指标均符合QB/T 5476—2020《果酒通用技术要求》和NY/T 1508—2017《绿色食品果酒》。库德毕赤酵母(Pichia kudriavzevii)的筛选及其在猕猴桃-苹果梨复合果酒中的应用为复合果酒产业发展提供新的途径,对丰富猕猴桃和苹果梨的产品以及开发新型复合果酒有一定的研究意义。
[1]廖傅平.发酵型猕猴桃茶果酒工艺[J].武夷学院学报,2022,41(9):8-11.
[2]刘晓翠,王丽,黎星辰,等.响应面优化猕猴桃酒混合发酵工艺[J].食品工业科技,2019,40(18):65-71,77.
[3]姜伶.浅谈延边州苹果梨生产与贮藏加工现状及发展方向[D].延吉:延边大学,2014.
[4]范昊安,薛淑龙,杜柠,等.苹果梨的营养价值及加工技术研究进展[J].食品研究与开发,2020,41(22):205-212.
[5]张微,刘迪,于婷婷,等.普通型和大果芽变型苹果梨不同发育时期果实有机酸组分差异性[J].北方园艺,2019,435(12):14-19.
[6]宁长春.苹果梨—沙棘复合发酵果酒的研制[D].呼和浩特:内蒙古农业大学,2014.
[7]朴哲虎,石岩,程金良,等.苹果梨果实矿质元素含量与品质的相关性分析[J].安徽农业科学,2018,46(20):159-161.
[8]赵金伟,李范洙,崔泰花,等.苹果梨生育期酚类物质的分析[J].食品工业科技,2009,30(9):105-107.
[9] CIANI M, CANONIICO L, ORO L, et al.Footprint of nonconventional yeasts and their contribution in alcoholic fermentations[J].Biotechnol Progr Beverage Consump,2020:435-465.
[10]林良才,白茹,高滢,等.高耐性库德里阿兹威氏毕赤酵母的筛选及应用[J].食品与发酵工业,2023,49(3):60-67.
[11]ZHANG H,DU H,XU Y.Volatile organic compound-mediated antifungal activity of Pichia spp.and its effect on the metabolic profiles of fermentation communities[J].Appl Environ Microbiol,2021,87(9):e02992-20.
[12]王德培,胡阳,焦富.库德里阿兹威氏毕赤酵母在发酵工业中的研究进展[J].酿酒科技,2021(6):95-101.
[13]李欢欢,曾雪莹,谢娟,等.产香酵母的筛选鉴定及产酯条件优化[J].中国酿造,2022,41(6):87-92.
[14]颜丽.高活力酯化菌株的筛选与优化研究[D].济南:齐鲁工业大学,2020.
[15]刘宜睿,魏雯丽,苏瑶,等.桑葚酒用产香酵母的选育及特性分析[J].食品科技,2022,47(12):1-7.
[16]贾丽艳,张丽,李惠源,等.果香风味导向的库德毕赤酵母FJZ的分离鉴定及生物学特性研究[J].中国食品学报,2021,21(1):276-282.
[17]孙诗雨.红枣沙棘果酒酿造工艺优化研究[D].沈阳:沈阳农业大学,2017.
[18]高清山,魏怀生,刘明洋.柿子果酒的酿造技术研究[J].食品研究与开发,2019,40(13):145-149.
[19]王鹏.响应面法优化无花果-仙人掌果酒的发酵工艺[J].中国酿造,2022,41(4):199-203.
[20]何松.水蜜桃酵母的分离、筛选及酿造工艺研究[D].常州:常州大学,2021.
[21]鲁云风,张四普,牛佳佳,等.猕猴桃百香果酒工艺条件优化[J].食品研究与开发,2022,43(1):105-109.
[22]丁玉萍,王梦泽,刘宇欣,等.单菌与混菌发酵软枣猕猴桃果酒品质比较[J].中国酿造,2023,42(5):145-150.
[23]王东伟,黄燕芬,肖默艳,等.猕猴桃果酒发酵条件优化及其抗氧化特性研究[J].食品安全质量检测学报,2019,10(6):1619-1625.
[24]赵敏,陈环,唐婉莹,等.7种酵母酿造摩尔多瓦葡萄酒的发酵特性比较[J].中国酿造,2020,39(8):102-106.
[25]刘彩婷,周鸿翔,王晓丹,等.八种商业酵母制备蓝莓苹果复合果酒的品质对比[J].中国酿造,2019,38(3):51-58.
[26]魏鑫,杜勇,赖晓琴,等.猕猴桃茶酒工艺条件优化及抗氧化活性分析[J].食品研究与开发,2022,43(23):91-97.
[27]舒学香,周文,吴霞,等.猕猴桃果酒酿造专用酵母菌株的筛选[J].中国酿造,2021,40(8):99-104.
[28]李夏,谢光杰,王东鹏,等.发酵条件对高山葡萄石斛酒品质的影响研究[J].食品安全质量检测学报,2022,13(12):4036-4042.
[29]谭雯文,张齐军,钟梅清,等.杨桃番木瓜复合果酒的工艺研究[J].现代食品,2018,(21):187-191.
[30]甄攀,高文静,李惠源,等.基于响应面法优化高产乙酸乙酯大曲清香型白酒二米查酒醅恒温发酵工艺[J].中国酿造,2023,42(1):186-191.
[31]胡佳星,袁文艳,杨小冲,等.耐酸酵母菌株在沙棘果酒中的应用研究[J].中国酿造,2018,37(5):71-75.