中国白酒是世界六大蒸馏之一。白酒中富含醇类、酯类和有机酸等风味物质[1]。白酒发酵是多种微生物参与的混合发酵,包括酵母菌、细菌和霉菌等[1]。其中,酵母菌是主要的微生物,对挥发性物质的产生有很大的贡献,决定了白酒的风味和品质[2]。
高级醇包括正丙醇、β-苯乙醇、异丁醇、异戊醇、异丙醇等,是白酒中的主要香味物质[3]。适量的高级醇可以使酒体饱满、口味协调,高级醇含量偏低,会使白酒的味道十分寡淡[4-5]。过量的高级醇会使白酒味道苦涩,使人“上头”,对身体造成一定损伤[6]。高级醇主要来源于酵母代谢[7]。选择合适的酿酒酵母(Saccharomyces cerevisiae)、优化发酵工艺和条件可以调节高级醇含量[8]。冯鹏鹏等[9]用常压室温等离子体对S.cerevisiae 680 bg进行不同时长的诱变处理,筛选出低产高级醇的系列菌株,高级醇含量从14.3%降低至11.1%。刘学强等[10]通过对比6株酿酒酵母和2株活性干酵母的高级醇产量,筛选出一株低产高级醇酿酒酵母WY-1。
小曲白酒是白酒的一种,占我国白酒产量的30%左右[11]。乙酸乙酯是小曲清香型白酒的主要香气成分,呈现花香、水果香和甜香,在增加香气、醇厚和改善白酒品质中有重要作用[12]。乙酸乙酯主要来源于产酯酵母。程伟等[13]从清香型白酒酒醅中获得30株酵母,筛选出高产乙酸乙酯的菌株jmz-01。张杰等[14]从小曲中筛选出异常毕赤酵母(Pichia anomala)Y7,其发酵液时乙酸乙酯的含量为408 mg/L,生产应用时其乙酸乙酯产量为2.86 g/L,比传统清香型白酒提高了50%,显示了产酯酵母对白酒品质提升的作用。
酿酒酵母(S.cerevisiae)是产乙醇的主要菌种,但其高级醇产量较高[15];异常威克汉姆酵母(Wickerhamomyces anomalus)有着较好的产乙酸乙酯和β-苯乙醇能力,但产乙醇能力较弱[16]。粟酒裂殖酵母(Schizosaccharomyces pombe)和酿酒酵母顺序接种能够更好地增加酒的醇类、酯类含量及种类,可以提升酒的感官品质[17]。与单一酵母发酵相比,将不同酵母菌、细菌和霉菌进行混合发酵酿酒,可以增加风味物质产量或种类,改善酒的风味[18]。
本研究以实验室保存6株酿酒酵母(Saccharomyces cerevisiae)菌株(编号分别为1-11J、1-11L、1-11M、PK-4、3LCCP-120、H-5)为研究对象,采用高粱糖化液为培养基筛选低产高级醇菌株,并使用气相色谱-质谱联用(gas chromatography- mass spectrometry,GC-MS)技术检测低产高级醇筛选菌株与商业酿酒酵母(S.cerevisiae)H-5的挥发性风味物质。将筛选低产高级醇菌株菌株和异常威克汉姆酵母(Wickerhamomyces anomalus)LL-7以不同比例(1∶1、2∶1、1∶2、5∶1、1∶5)进行混合液态发酵,并将其与菌株LL-7、粟酒裂殖酵母SCC-7混菌固态发酵制备小曲清香型白酒,并对其挥发性风味物质进行检测。本研究旨在为生产高级醇含量低的优质小曲清香型原酒奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
高粱、食用级玉米淀粉、商业酿酒酵母H-5:市售;酿酒酵母(S.cerevisiae)1-11J、1-11L、1-11M、PK-4、3LCCP-120、异常威克汉姆酵母(W.anomalus)LL-7、Z1、粟酒裂殖酵母(Schizosaccharomyces pombe)SCC-7:本实验室保存;根霉曲:本实验室制作;小曲粉:湖北某白酒厂。
1.1.2 化学试剂
叔戊醇(纯度99%):上海麦克林生化科技有限公司;耐高温α-淀粉酶(酶活3×104 U/g):夏盛(北京)生物科技开发有限公司;糖化酶(酶活105 U/g)、蛋白胨、酵母浸粉、蛋白胨、磷酸二氢钾、七水硫酸镁、冰醋酸、孟加拉红(均为生化试剂)、氢氧化钠(分析纯):安琪酵母股份有限公司;葡萄糖、乳酸(均为分析纯):天津科密欧化学试剂有限公司;乙酸戊酯、2-乙基丁酸、丙酸戊醇(纯度均为99%):成都艾科达化学试剂有限公司;薄荷醇(纯度为99%):默克生命科学技术(南通)有限公司。
1.1.3 培养基
马丁孟加拉红培养基:葡萄糖10 g/L、蛋白胨5 g/L、磷酸二氢钾1 g/L、七水硫酸镁0.5 g/L、孟加拉红33.4 mg/L、蒸馏水1 000 mL。121 ℃灭菌20 min[19]。
酵母浸出粉胨葡萄糖(yeast peptone glucose,YPD)培养基:蛋白胨20 g/L、葡萄糖20 g/L、蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min[20]。
YPD固体培养基:在YPD培养基基础上添加1.5%琼脂粉。121 ℃高压蒸汽灭菌20 min。
高粱糖化液培养基:用磨粉机将市售的高粱磨成高粱粉,将高粱粉与蒸馏水以料水比1∶3.6(g∶mL)混匀,混匀后放入水温为65 ℃的水浴锅糊化,水温升至90 ℃后以15 U/g干料添加α-淀粉酶,保温90 min。冷却用乳酸冰醋酸(1∶1,V/V)调节pH至pH 4.0~4.5,按150 U/g干料比添加糖化酶,放入水温为65 ℃的水浴锅中处理30 min。处理完成采用4 000 r/min、10 min进行离心分离,收集上清液分装后放入灭菌锅,115 ℃灭菌25 min[21]。
1.2 仪器与设备
ZXDP-A2160恒温培养箱、ZHWY-2102恒温摇床、ZHJH-C1115B超净工作台:上海智诚公司;BS224S电子天平、ST2100型pH计:奥豪斯仪器(上海)有限公司;7890A气相色谱仪、7890B安捷伦气相色谱-质谱联用仪:美国安捷伦科技有限公司;QHX-300BS-Ⅲ人工气候箱、SPX-300BSH-Ⅱ生化培养箱:上海新苗医疗机械制造有限公司;BOXUN立式压力蒸汽灭菌锅:上海博讯实业有限公司。
1.3 方法
1.3.1 酵母菌株的活化
采用划线分离法纯化菌株,28 ℃培养2 d后获得酵母单菌落[22]。
1.3.2 低产高级醇酿酒酵母的筛选
一级种子液:取不同的菌株一环,接种于100 mL YPD液体培养基中,28 ℃、170 r/min振荡培养24 h,得到一级YPD种子液[23]。
二级种子液:将一级YPD种子液分别以1∶100的体积比接入100 mL YPD液体培养基中,28 ℃、170 r/min 振荡培养24 h,得到二级YPD种子液。
高粱糖化液液态发酵:将二级种子液以5%的体积比接种高粱糖化液。28 ℃发酵5 d,期间每24 h手动缓慢摇匀一次[21]。
低产高级醇酿酒酵母的筛选:将活化的酿酒酵母菌株分别接种高粱糖化液进行纯种发酵,酒样经蒸馏后进行气相色谱分析,比较各菌株的乙醇和高级醇产量,从中筛选出高级醇产量最低的菌株[24]。
1.3.3 筛选低产高级醇菌株与商用酿酒酵母挥发性风味成分分析
为比较筛选低产高级醇酿酒酵母和商用S.cerevisiae H-5产酯、产酸和产醇等风味成分的能力,将筛选出的低产高级醇酿酒酵母和商用S.cerevisiae H-5的二级YPD种子液分别接种于高粱糖化液中,28 ℃发酵5 d后进行挥发性风味成分GC-MS分析。
1.3.4 筛选低产高级醇菌株与异常威克汉姆酵母混合液态发酵
酿酒酵母为主要的产酒酵母,异常威克汉姆酵母为主要的产香酵母,二者均是小曲清香型白酒酿造过程中常见的酵母菌,因而对两株酵母菌进行混合液态发酵研究。菌株1-11J和LL-7的二级YPD种子液,分别按照1∶1、2∶1、1∶2、5∶1、1∶5、1∶0、0∶1(V/V)组合接种于高粱糖化液28 ℃发酵5 d,考察不同菌株1-11J和LL-7配比对液态发酵高级醇含量的影响。
1.3.5 筛选低产高级醇菌株在纯高粱小曲清香型白酒中的应用
高粱预处理方法:①热水泡高粱阶段:料水比为1∶3(g∶mL),90 ℃的热水泡高粱180 min;②蒸煮高粱阶段:蒸煮高粱150 min;③摊高粱阶段:将高粱置于铁盘上,温度降至37~40 ℃。
活性干酵母的制作:活性干酵母能够较长时间保持酵母菌的活力和性能,便于在酒类的酿造生产进行使用,因而对获得的酵母菌进行了活性干酵母制备。挑取菌株接种于YPD液体培养基,置于28 ℃恒温静置培养24 h。按1%接种量再次转接到500 mL的YPD液体培养基,置于28 ℃恒温培静置培养2 h,使用稀释涂布法对酵母菌数量进行测定。取扩培后的菌液100 mL,与300 g食用级玉米淀粉混合均匀,得到活性干酵母。
纯高粱小曲清香型白酒的制备:完成高粱预处理后,将小曲或活性干酵母按不同活菌数比例以酵母总数108CFU/g的比例加入到配糟和高粱中混合均匀,活性干酵母和根霉曲组合发酵,根霉曲的添加量为高粱质量的0.5%。将混合均匀的原料置于塑料盒中模拟堆积发酵过程,控制堆积温度,使其在28 ℃维持24 h。模拟堆积发酵结束后,将堆积原料分装于玻璃瓶中,于28 ℃厌氧酒精发酵15 d,得到纯高粱小曲清香型白酒的酒醅。
筛选菌株高级醇产量较低,产乙酸乙酯的能力较差。异常威克汉姆酵母和粟酒裂殖酵母产酯类等呈香物质能力较强,因而对筛选菌株与两种非酿酒酵母进行混合固态发酵研究,筛选出合适的酵母组合,以达到稳定小曲白酒的出酒率、降低高级醇产量并提高乙酸乙酯产量的目标。分别按照①小曲粉(CK)、②根霉曲与筛选菌株、③根霉曲与筛选菌株和菌株LL-7(1∶1)、④根霉曲与筛选菌株和菌株SCC-7(1∶1)、⑤根霉曲与筛选菌株和菌株Z1(1∶1)、⑥根霉曲与筛选菌株、菌株LL-7及Z1(1∶1∶1)组合进行混菌固态发酵,考察不同菌株组合对纯高粱小曲清香型白酒中高级醇含量的影响。
1.3.6 分析检测
(1)乙醇、高级醇含量的测定
发酵液的处理:取100 mL蒸馏水和100 mL发酵液于500 mL蒸馏瓶中蒸馏,收集前100 mL蒸出液,取蒸馏液1 mL,加入20 μL混合内标(叔戊醇,终浓度为324 mg/L;乙酸正戊酯,终浓度为352 mg/L),混匀后经0.22 μm水系滤膜以用于GC检测。
固态发酵样品的处理:取150 mL蒸馏水和50 g发酵酒醅于500 mL蒸馏瓶中蒸馏,收集前100 mL蒸出液,取蒸馏液1 mL,加入20 μL混合内标,混匀后经0.22 μm水系滤膜以用于GC检测。
GC条件:进样量为1 μL,分流比为10∶1,氢气流速为30 mL/min,空气流速为400 mL/min,氮气流速为10 mL/min,进样口温度为220 ℃,检测器温度为220 ℃;升温程序:60 ℃维持5 min,再以10 ℃/min升温至160 ℃,维持5 min。
(2)挥发性风味成分的测定
样品的预处理:取3 g NaCl至20 mL顶空进样瓶中,加入8 mL蒸馏样和10 μL内标(丙酸辛酯,终质量浓度为60.44 μg/L)。
GC条件:三相萃取头(DVB/CAR/PDMS,50/30 μm),DB-Wax色谱柱(60 m×0.325 mm×0.25 μm);进样口温度250 ℃;载气为高纯氦气(He),流速2 mL/min,不分流;升温程序:50 ℃保持2 min,以4 ℃/min的速率升至230 ℃,保持15 min。MS条件:电子电离(electronic ionization,EI)源,离子源230 ℃,电子能量70 eV,四极杆温度150 ℃,全扫描模式,扫描范围35~350 m/z。
1.3.7 数据处理
试验重复3次,结果以“平均值±标准差”表示,制表软件为Excel 2019,Origin 2021软件制图;通过SPSS 22.0软件分析不同样本间是否存在显著性差异,对数据进行单因素方差分析,使用Tukey方法,假设样本间方差相等,若Tukey HSD检验P>0.05则无显著性差异,P<0.05则呈显著性差异。
2 结果与分析
2.1 低产高级醇酿酒酵母筛选结果
对实验室保存的5株酿酒酵母菌株(编号为:1-11J、1-11L、1-11M、PK-4、3LCCP-120)和市售的1株酵母菌株(编号为H-5)单菌分别接种高粱糖化液进行纯种发酵,28 ℃发酵5 d后进行气相色谱分析比较,结果见表1。
表1 不同酿酒酵母菌株液态发酵产高级醇结果
Table 1 Results of higher alcohols content produced by liquid state fermentation with different Saccharomyces cerevisiae strains
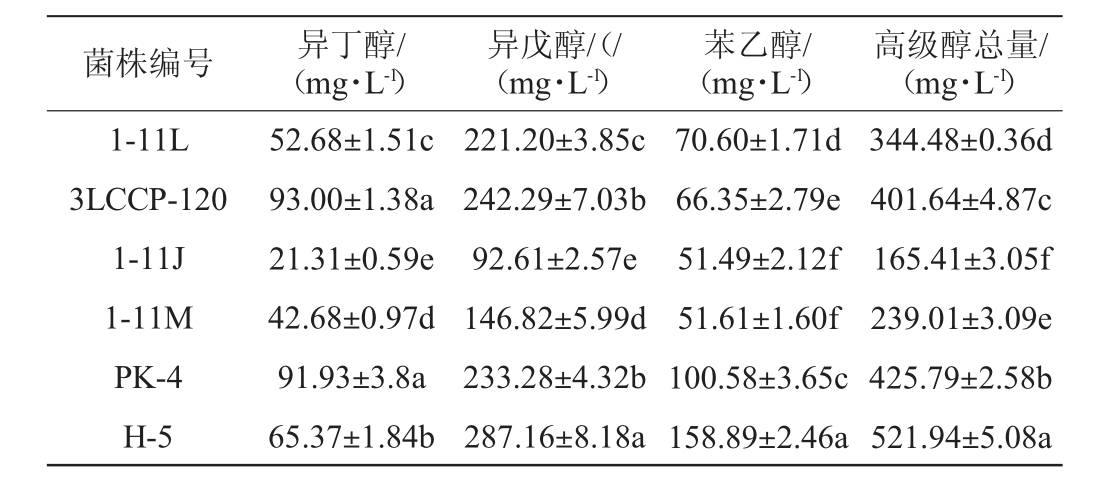
注:同列标注的不同字母表示差异性显著(P<0.05)。
菌株编号 异丁醇/(mg·L-1)异戊醇/(/(mg·L-1)苯乙醇/(mg·L-1)高级醇总量/(mg·L-1)1-11L 3LCCP-120 1-11J 1-11M PK-4 H-5 52.68±1.51c 93.00±1.38a 21.31±0.59e 42.68±0.97d 91.93±3.8a 65.37±1.84b 221.20±3.85c 242.29±7.03b 92.61±2.57e 146.82±5.99d 233.28±4.32b 287.16±8.18a 70.60±1.71d 66.35±2.79e 51.49±2.12f 51.61±1.60f 100.58±3.65c 158.89±2.46a 344.48±0.36d 401.64±4.87c 165.41±3.05f 239.01±3.09e 425.79±2.58b 521.94±5.08a
由表1可知,不同酵母菌株的高级醇产量差别较大。总高级醇产量顺序为菌株H-5>PK-4>3LCCP-120>1-11L>1-11M>1-11J,产量范围为165.41~521.94 mg/L。菌株1-11J液态发酵时的总高级醇含量最低,为165.41 mg/L,比高级醇最高的菌株H-5(521.94 mg/L)低68.31%。菌株1-11J的异戊醇、苯乙醇和异丁醇产量也最低,分别为92.61 mg/L、51.49 mg/L、21.31 mg/L。对异丁醇、异戊醇、苯乙醇和高级醇总和进行显著性分析,与其他菌株相比,菌株1-11J代谢产异丁醇和异戊醇含量显著低于其他组(P<0.05),代谢苯乙醇产量显著低于其他组(P<0.05)。菌株1-11J的高级醇产量显著比其他菌株低(P<0.05)。因此,选择菌株1-11J作为低产高级醇菌株进一步研究。
2.2 两株酿酒酵母液态发酵的挥发性风味成分比较
将筛选出的低产高级醇S.cerevisiae 1-11J和商用酵母S.cerevisiae H-5的二级YPD种子液接种于高粱糖化液中,28℃发酵5d后进行挥发性风味成分GC-MS分析,结果见表2。
表2 酿酒酵母1-11J和H-5发酵液中挥发性风味成分GC-MS分析结果
Table 2 Results of volatile flavor components in fermentation broth of Saccharomyces cerevisiae 1-11J and H-5 analyzed by GC-MS mg/L
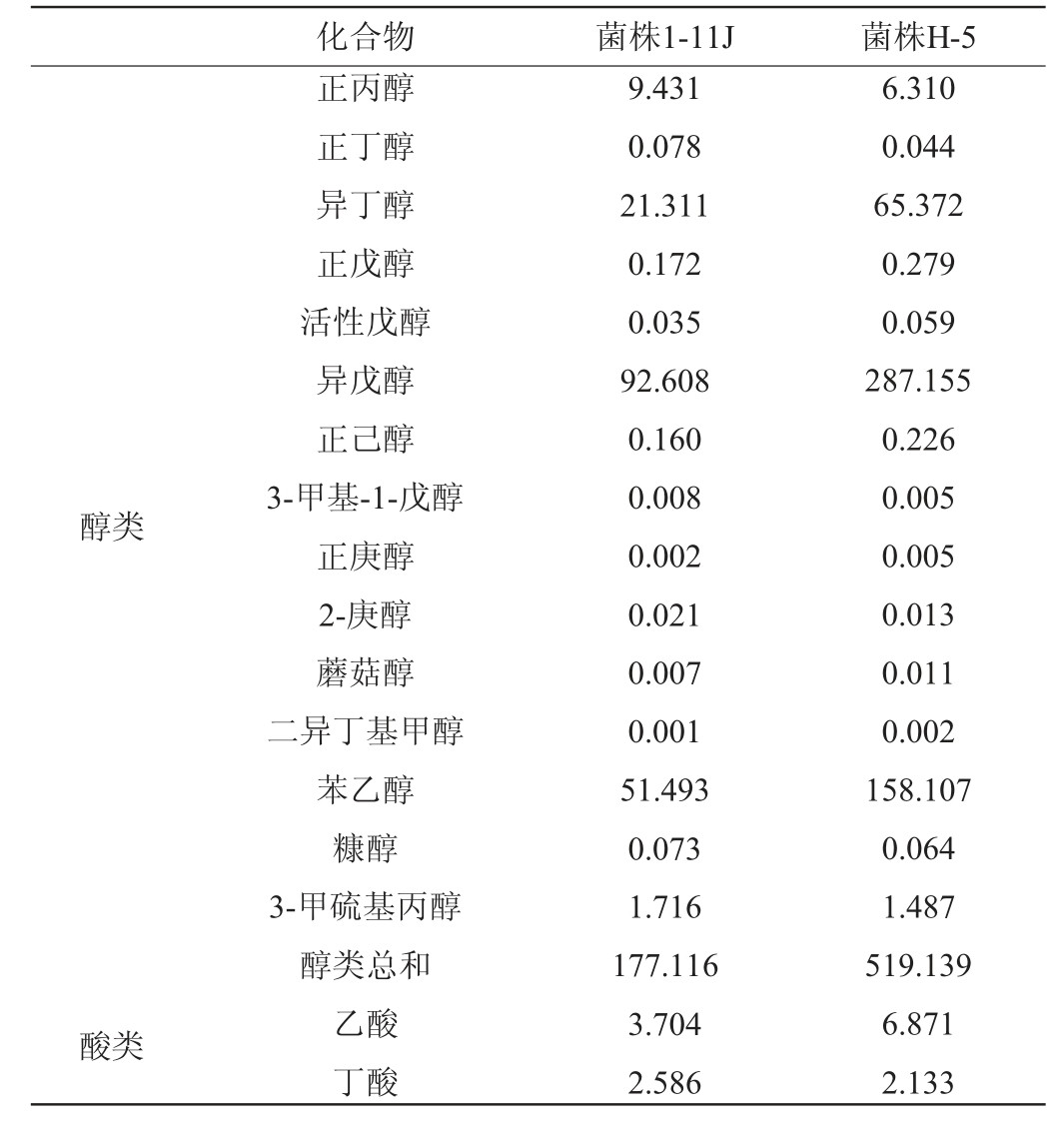
化合物 菌株1-11J 菌株H-5醇类酸类正丙醇正丁醇异丁醇正戊醇活性戊醇异戊醇正己醇3-甲基-1-戊醇正庚醇2-庚醇蘑菇醇二异丁基甲醇苯乙醇糠醇3-甲硫基丙醇醇类总和乙酸丁酸9.431 0.078 21.311 0.172 0.035 92.608 0.160 0.008 0.002 0.021 0.007 0.001 51.493 0.073 1.716 177.116 3.704 2.586 6.310 0.044 65.372 0.279 0.059 287.155 0.226 0.005 0.005 0.013 0.011 0.002 158.107 0.064 1.487 519.139 6.871 2.133
续表
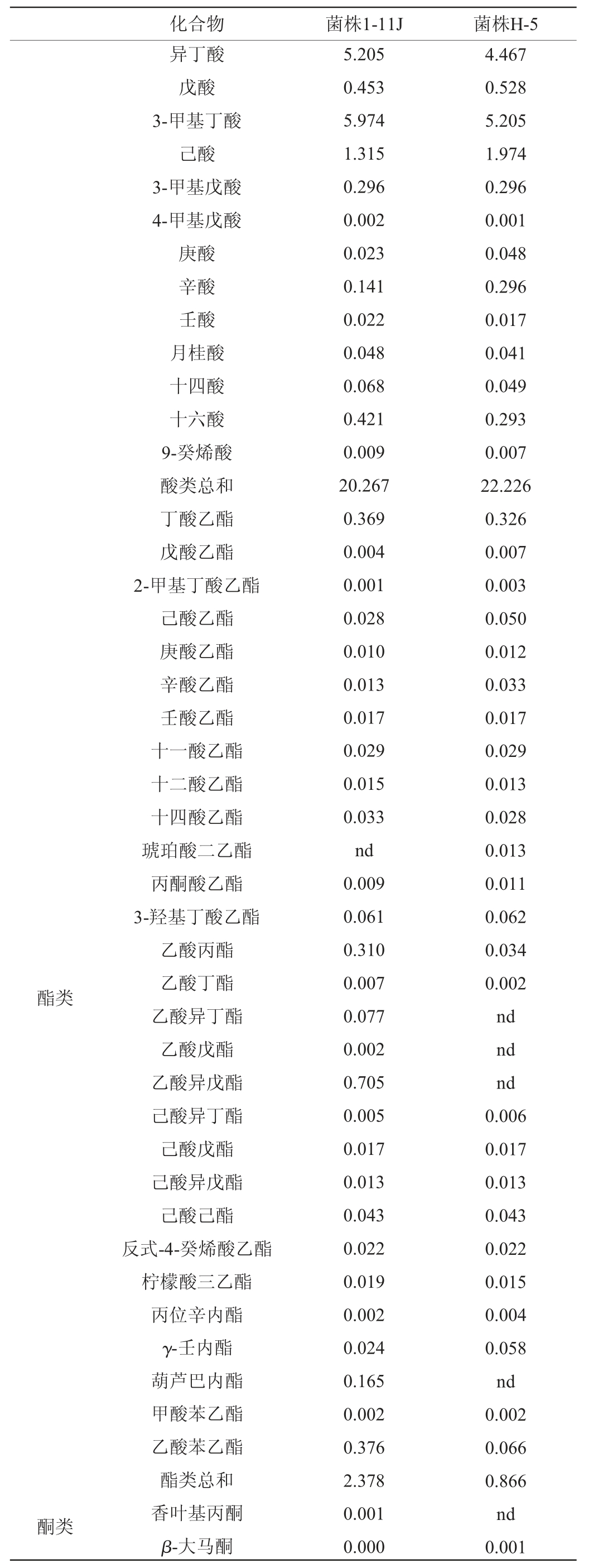
酯类酮类化合物 菌株1-11J 菌株H-5异丁酸戊酸3-甲基丁酸己酸3-甲基戊酸4-甲基戊酸庚酸辛酸壬酸月桂酸十四酸十六酸9-癸烯酸酸类总和丁酸乙酯戊酸乙酯2-甲基丁酸乙酯己酸乙酯庚酸乙酯辛酸乙酯壬酸乙酯十一酸乙酯十二酸乙酯十四酸乙酯琥珀酸二乙酯丙酮酸乙酯3-羟基丁酸乙酯乙酸丙酯乙酸丁酯乙酸异丁酯乙酸戊酯乙酸异戊酯己酸异丁酯己酸戊酯己酸异戊酯己酸己酯反式-4-癸烯酸乙酯柠檬酸三乙酯丙位辛内酯γ-壬内酯葫芦巴内酯甲酸苯乙酯乙酸苯乙酯酯类总和香叶基丙酮β-大马酮5.205 0.453 5.974 1.315 0.296 0.002 0.023 0.141 0.022 0.048 0.068 0.421 0.009 20.267 0.369 0.004 0.001 0.028 0.010 0.013 0.017 0.029 0.015 0.033 nd 0.009 0.061 0.310 0.007 0.077 0.002 0.705 0.005 0.017 0.013 0.043 0.022 0.019 0.002 0.024 0.165 0.002 0.376 2.378 0.001 0.000 4.467 0.528 5.205 1.974 0.296 0.001 0.048 0.296 0.017 0.041 0.049 0.293 0.007 22.226 0.326 0.007 0.003 0.050 0.012 0.033 0.017 0.029 0.013 0.028 0.013 0.011 0.062 0.034 0.002 nd nd nd 0.006 0.017 0.013 0.043 0.022 0.015 0.004 0.058 nd 0.002 0.066 0.866 nd 0.001
续表
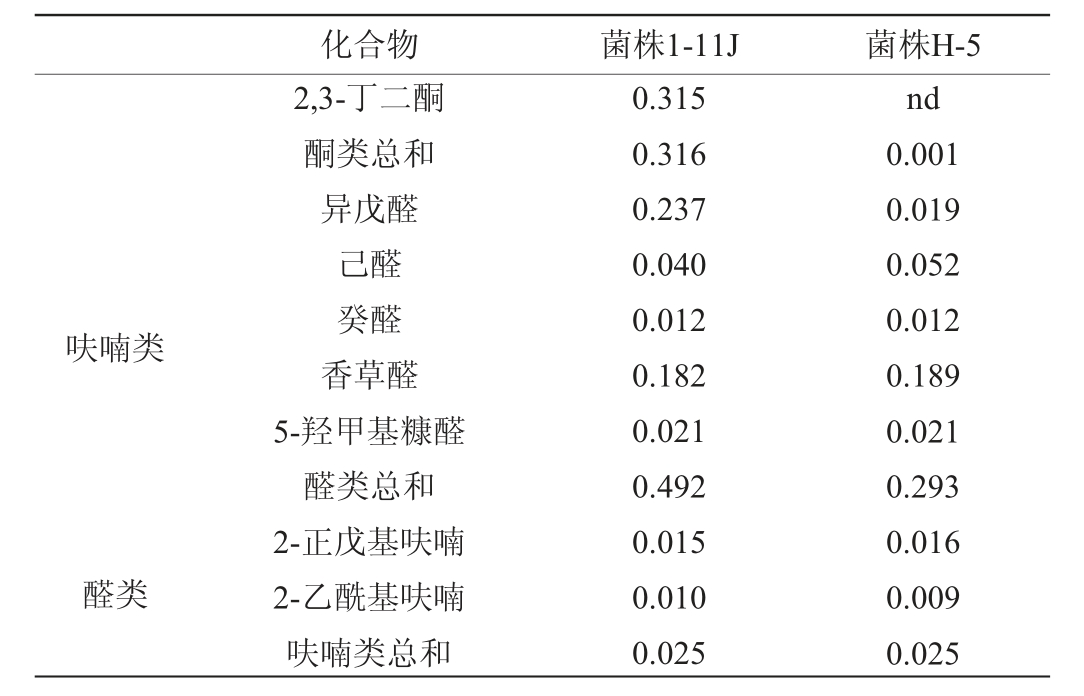
注:“nd”表示未检出。
化合物 菌株1-11J 菌株H-5呋喃类醛类2,3-丁二酮酮类总和异戊醛己醛癸醛香草醛5-羟甲基糠醛醛类总和2-正戊基呋喃2-乙酰基呋喃呋喃类总和0.315 0.316 0.237 0.040 0.012 0.182 0.021 0.492 0.015 0.010 0.025 nd 0.001 0.019 0.052 0.012 0.189 0.021 0.293 0.016 0.009 0.025
由表2可知,菌株1-11J单菌液态发酵共检出68种风味物质,其中15种醇类、15种酸类、28种酯类、3种酮类、5种醛类和2种呋喃类。菌株H-5单菌液态发酵共检出63种风味物质,其中15种醇类、15种酸类、25种酯类、1种酮类、5种醛类和2种呋喃类。与菌株H-5相比,菌株1-11J不产琥珀酸二乙酯,但产乙酸异丁酯、乙酸戊酯和乙酸异戊酯,菌株1-11J产总酯含量比菌株H-5高174.60%。对醇类物质分析,菌株H-5产醇类总和为519.139 mg/L,而菌株1-11J产醇类总和为177.116 mg/L,比菌株H-5产醇类总和低65.88%。菌株1-11J酸类产量为20.267 mg/L,菌株H-5酸类产量为22.225 mg/L,二者差别不大。菌株1-11J呋喃类物质产量和S.cerevisiae H-5相同,没有差别。分析表明,与菌株H-5相比,菌株1-11J具有很好的产酯能力和低产醇的能力。
2.3 菌株1-11J与菌株LL-7混合液态发酵对高级醇含量的影响
将产酒菌株1-11J和产香菌株LL-7按不同的比例接种高粱糖化液中,发酵液中高级醇含量测定结果见表3。由表3可知,菌株1-11J与菌株LL-7比例为1∶5和0∶1时,产乙醇能力最差。与其他组合发酵比较,菌株1-11J与菌株LL-7比例为1∶1时,高级醇总量为226.96 mg/L,乙醇含量为6.61%vol,乙酸乙酯含量为1 265.81 mg/L,高级醇/乙醇的值达到最低为33。因此,选择S.cerevisiae 1-11J与W.anomalus LL-7的接种比例为1∶1进行后续研究。
表3 菌株1-11J和LL-7不同比例组合发酵液中高级醇含量的GC检测结果
Table 3 GC determination results of higher alcohols content in fermentation broth of strain 1-11J and strain LL-7 in different proportions
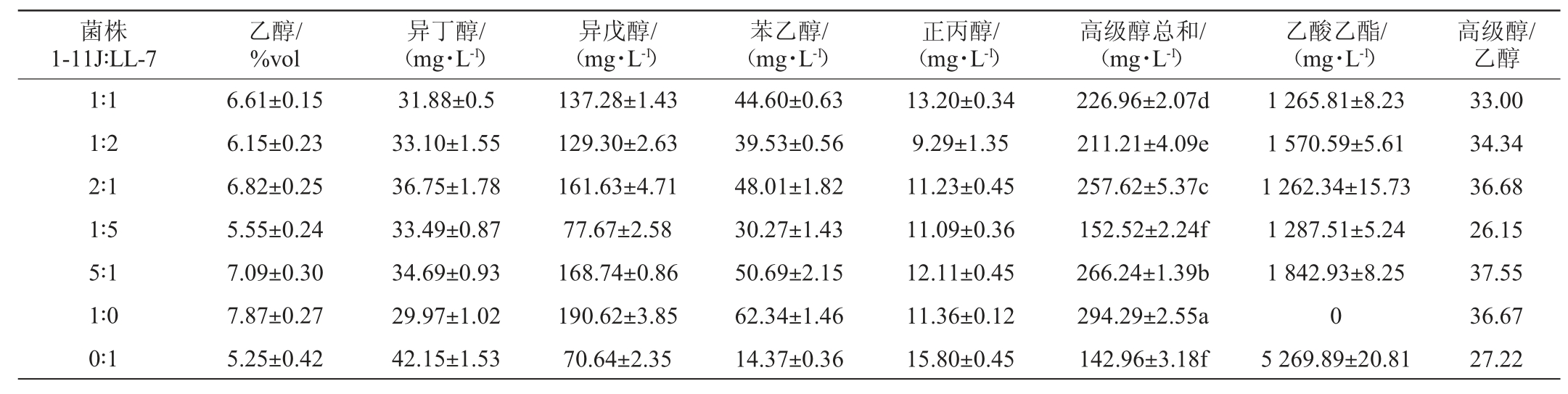
注:同列标注的不同字母表示差异性显著(P<0.05)。下同。
菌株1-11J∶LL-7乙醇/%vol异丁醇/(mg·L-1)异戊醇/(mg·L-1)苯乙醇/(mg·L-1)正丙醇/(mg·L-1)高级醇总和/(mg·L-1)乙酸乙酯/(mg·L-1)高级醇/乙醇1∶1 1∶2 2∶1 1∶5 5∶1 1∶0 0∶1 6.61±0.15 6.15±0.23 6.82±0.25 5.55±0.24 7.09±0.30 7.87±0.27 5.25±0.42 31.88±0.5 33.10±1.55 36.75±1.78 33.49±0.87 34.69±0.93 29.97±1.02 42.15±1.53 137.28±1.43 129.30±2.63 161.63±4.71 77.67±2.58 168.74±0.86 190.62±3.85 70.64±2.35 44.60±0.63 39.53±0.56 48.01±1.82 30.27±1.43 50.69±2.15 62.34±1.46 14.37±0.36 13.20±0.34 9.29±1.35 11.23±0.45 11.09±0.36 12.11±0.45 11.36±0.12 15.80±0.45 226.96±2.07d 211.21±4.09e 257.62±5.37c 152.52±2.24f 266.24±1.39b 294.29±2.55a 142.96±3.18f 1 265.81±8.23 1 570.59±5.61 1 262.34±15.73 1 287.51±5.24 1 842.93±8.25 0 5 269.89±20.81 33.00 34.34 36.68 26.15 37.55 36.67 27.22
表4 固态发酵小曲清香型白酒中高级醇含量的GC检测结果
Table 4 GC determination results of higher alcohols content in Xiaoqu light-flavor Baijiu by solid-state fermentation

组合编号乙醇/%vol异丁醇/(mg·L-1)异戊醇/(mg·L-1)苯乙醇/(mg·L-1)正丙醇/(mg·L-1)高级醇总和/(mg·L-1)乙酸乙酯/(mg·L-1)①②③④⑤⑥5.40±0.14c 6.95±0.18a 5.86±0.23c 6.14±0.25b 6.99±0.27a 6.98±0.25a 38.60±0.68c 40.50±0.55bc 42.99±1.45b 35.17±0.85d 41.34±1.65bc 47.97±2.09a 50.24±1.03d 74.41±3.06a 59.57±1.08c 63.73±1.63b 67.76±1.70ab 66.65±1.53b 8.31±0.33c 15.21±0.73ab 14.03±0.45b 14.68±0.76ab 15.59±0.42a 16.94±0.94a 41.48±0.97c 68.22±1.29a 31.87±1.11d 61.00±1.51b 56.73±2.39b 40.45±1.88c 138.62±1.08d 198.33±3.07a 148.46±0.29c 174.57±1.05b 181.41±3.25a 172.01±5.48b 21.31±0.48c 0 0.00 0.00 34.01±1.15b 438.54±12.96a高级醇/乙醇25.69 28.56 25.36 28.43 25.97 24.60
2.4 纯高粱固态发酵
由表6可知,菌株1-11J活性干酵母和菌株LL-7活性干酵母以1∶1活菌数比例混合发酵时,其乙醇产量比小曲粉的产量提高8.52%,高级醇产量高7.1%,但高级醇/乙醇和小曲粉发酵组差别不大。对各指标进行显著性分析,与小曲粉发酵相比,根霉曲+1-11J+LL-7+SCC-7(1∶1∶1)(组合⑥)的高级醇/乙醇的值最低为24.60,比小曲粉发酵(组合①)降低4.24%,同时乙酸乙酯产量显著增加,最高达438.54 mg/L,比小曲粉发酵提高1 957.91%,为最佳发酵组合。
3 结论
本研究从6株酿酒酵母中筛选到一株低产高级醇的酿酒酵母S.cerevisiae 1-11J,液态发酵时总高级醇产量为165.41 mg/L。对筛选获得的S.cerevisiae 1-11J与商用S.cerevisiaeH-5菌株进行GC-MS分析比较,结果表明,S.cerevisiae 1-11J的醇类物质产量总和比S.cerevisiae H-5低65.88%,总酯产量提高了174.60%。菌株1-11J和菌株LL-7比例为1∶1混合液态发酵,乙酸乙酯含量为1 265.81 mg/L,高级醇/乙醇的值达到最低为33。将S.cerevisiae 1-11J、W.anomaluLL-7和S.pombe SCC-7三种酵母菌按1∶1∶1菌数比配制成组合菌剂,固态小曲清香型白酒发酵表明,与接种传统小曲相比,接种组合菌剂酒样的乙醇含量提高了29.26%,乙酸乙酯含量提高了1957.91%,而总高级醇/乙醇的值比降低了4.24%。本研究为生产高级醇含量低的优质小曲清香型原酒奠定了基础,对小曲白酒品质的提升具有一定的指导意义。
[1] ZHENG X W, HAN B Z. Baijiu, Chinese liquor: History, classification and manufacture[J].J Ethn Foods,2016,3(1):19-25.
[2]WU Q,CHEN L Q,XU Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2013,166(2):323-330.
[3]HU Y L,YANG Q,CHEN D,et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Res Int,2021,140:109876.
[4] CORDEMTE A G, NANDORFY D E, SOLOMON M, et al.Aromatic higher alcohols in wine:Implication on aroma and palate attributes during chardonnay aging[J].Molecules,2021,26(16):4979.
[5]吴海静,钟继仁,田晓林,等.大黄米白酒高级醇产生规律的研究[J].中国酿造,2016,35(11):99-102.
[6]孙中贯,刘琳,王亚平,等.酿酒酵母高级醇代谢研究进展[J].生物工程学报,2021,37(2):429-447.
[7] CHEN D, CHIA J Y, LIU S Q.Impact of addition of aromatic amino acids on non-volatile and volatile compounds in lychee wine fermented with Saccharomyces cerevisiae MERIT.ferm[J].Int J Food Microbiol,2014,170:12-20.
[8]苟静瑜,贾智勇,闫宗科.降低白酒中高级醇含量的研究进展[J].酿酒,2016,43(4):25-29.
[9]冯鹏鹏,周钰涵,高杏,等.低产高级醇工业上面发酵酵母的选育[J].食品与发酵工业,2022,48(5):23-28.
[10]刘学强,钱泓,周正,等.低产高级醇葡萄酒酵母菌株的筛选[J].食品与发酵工业,2016,42(3):73-78.
[11]焦二满,王丽,赵璐.北方清香小曲白酒酿造工艺的初步研究[J].酿酒,2015,42(6):35-37.
[12]刘小改,马美荣,周林艳,等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造,2020,39(10):79-83.
[13]程伟,彭兵,汪焰胜,等.清香型酒醅中一株产乙酸乙酯酵母菌的筛选及其应用性能分析[J].酿酒,2018,45(5):43-47.
[14]张杰,程伟,巩子路,等.一株高产乙酸乙酯酵母菌的筛选及其鉴定[J].酿酒,2018,45(6):59-62.
[15]凌杰.白酒酿造中地衣芽孢杆菌与酿酒酵母的相互作用及应用研究[D].无锡:江南大学,2013.
[16]明红梅,周健,陈蒙恩,等.大曲中异常威克汉姆酵母发酵产苯乙醇的条件优化[J].湖北农业科学,2015,54(14):3492-3496.
[17]郑贻丹,袁先铃.育种技术在酒用酵母中的应用研究进展[J].中国酿造,2023,42(4):29-34.
[18]VIANA F,GIL J V,VALLÉS S,et al.Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J].Int J Food Microbiol,2009,135(1):68-74.
[19]熊小毛,彭俊,缪礼鸿,等.东方伊萨酵母固态菌剂的制备及其在白云边酒酿造过程中的应用效果分析[J].酿酒科技,2020(12):60-64.
[20]向丽萍,范赋强,黄娇,等.包包曲中可培养酵母菌的分离纯化与鉴定[J].酿酒科技,2021(6):29-33.
[21]张明春,梁丽文,张梦阳,等.一株高出酒率的粟酒裂殖酵母菌株的筛选及其在白酒酿造中的应用研究[J].酿酒科技,2022(7):65-70.
[22]杜成龙,王冕,马金同,等.酿酒酵母菌株的筛选与培养条件的优化研究[J].酿酒,2023,50(2):89-92.
[23]张宸瑞,高瑞杰,缪礼鸿,等.高产酸扣囊复膜酵母的筛选与培养基配方优化[J].中国酿造,2021,40(7):153-159.
[24]郝欣,肖冬光,申童,等.低产高级醇酿酒酵母菌株筛选及其单倍体制备[J].酿酒科技,2010(6):35-38.
[25]王奇盛.异常威克汉姆酵母的筛选及其对米酒发酵的风味研究[D].武汉:武汉轻工大学,2022.