以秸秆为代表的木质纤维素类生物质转化为生物能源或生物基化学品将成为我国实现“双碳”承诺的一个政策着力点[1]。然而,木质纤维素由纤维素、半纤维素和木质素等物质相互交联构成难以被生物降解的天然屏障,其组分与结构的异质性和多样性,使得充分降解依赖高效的纤维素酶[2]。里氏木霉(Trichoderma reesei)是目前最重要的工业化生产纤维素酶菌株之一,但其纤维素酶的生物合成需要诱导[3-4]。
前期通过商业β-葡萄糖苷酶生物催化葡萄糖制备的葡萄糖-β二糖混合物(mixture glucose and β-disaccharide,MGD)可高效诱导T.reesei合成纤维素酶,纤维素酶活性达到90.3 IU/mL[5];利用巴斯德毕赤酵母(Pichia pastoris)异源生产黑曲霉来源β-葡萄糖苷酶并用于制备MGD,诱导T. reesei合成纤维素酶,其酶活性达到95.23 IU/mL[6];而CHEN Y M等[7]利用MGD诱导表达改造ACE3基因的T.reesei工程菌,其纤维素酶产量高达102.63 IU/mL。研究表明,MGD诱导T.reesei合成纤维素酶的能力强于纤维素,进一步转录组学结果显示,MGD相比于纤维素作为诱导物条件下纤维素酶转录激活因子Trxyr1基因显著性高表达[8],由此推测Trxyr1基因可能是MGD具有高诱导力的重要原因之一。
T.reesei所产纤维素酶是包括几十种水解酶的复合酶系,主要有降解结晶纤维素的外切纤维素酶、在无定形区域切割纤维素链的内切纤维素酶和将纤维二糖转化为葡萄糖的β-葡萄糖苷酶[9]。除此之外,还有纤维素降解辅助蛋白参与木质纤维素的水解,研究表明,纤维素降解辅助蛋白虽然无糖苷水解酶活性,但可破坏木质纤维素致密的高分子结构,降低木质纤维素结晶度从而协同纤维素酶提高催化速率[10-11]。蛋白质组学研究发现,MGD相比于纤维素诱导物合成纤维素降解辅助蛋白量低,而纤维素酶组分的改变会影响其水解木质纤维素的效率[12]。因此需要明确Trxyr1基因表达量是否会改变纤维素酶系组成从而影响纤维素水解效率,为构建高水解效率纤维素酶系提供参考。
基于此,本研究在T.reesei Rut C30中利用丙酮酸脱羧酶1启动子高效表达同源Trxyr1基因,重组菌株分别使用MGD和纤维素为诱导物以及无诱导物条件下发酵生产纤维素酶,验证MGD高诱导活性主要原因是否为Trxyr1基因高表达。同时利用纤维素酶水解碱预处理玉米秸秆(alkali pretreated corn straw,APCS),探讨过表达Trxyr1基因对纤维素酶系的影响。以期为T.reesei在不同诱导物条件下合成纤维素酶的分子机制提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒与引物
里氏木霉(Trichoderma reesei)Rut C30(NRRL 11460):惠赠于美国农业研究菌种保藏中心;根瘤农杆菌(Agrobacterium tumefaciens)AGL-1与大肠杆菌(Escherichia coli)DH5α感受态:上海唯地生物技术有限公司;含有丙酮酸脱羧酶1启动子和终止子的T.reesei基因表达载体pPTPDC1由本实验室构建保存[12]。本研究使用到的引物见表1。
表1 引物名和基因序列
Table 1 Primer names and gene sequences

引物名 基因序列qPCRsar1-F qPCRsar1-R qPCRxyr1-F qPCRxyr1-R 5'-CGTCTTGTCGTCTTTGGGTCT-3'5'-GGATAGCAACTCGGTCGTTCTT-3'5'-CCATCAACCTTCTAGACGAC-3'5'-AACCCTGCAGGAGATAGAC-3'
1.1.2 主要试剂
TSINGKE TSV-S1 TreliefR SoSoo Cloning Kit无缝克隆试剂盒、TSINGKE TSP501-200高纯度质粒脱氧核糖核酸(deoxyribonucleic acid,DNA)小量提取试剂盒、TSINGKE TSK301S GoldenstarTM RT6互补DNA(complementary DNA,cDNA)Synthesis Kit逆转录酶试剂盒:北京擎科生物科技有限公司;β-葡萄糖苷酶(2 370.3 IU/mL):夏盛(北京)生物科技开发有限公司;限制性内切酶BsiWⅠ:美国New England Biolabs公司;RNAsimple Total RNA Kit 总核糖核酸(ribonucleic acid,RNA)提取试剂盒(离心柱型):天根生化科技(北京)有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)酶试剂盒:宝日医生物技术(北京)有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取200 g土豆煮30 min后用6层纱布过滤,滤液中加入20 g葡萄糖后使用去离子水定容至1L;溶菌肉汤(lysogenybroth,LB)培养基:5 g/L酵母粉,10 g/L胰蛋白胨和10 g/L NaCl;种子培养基:4 g/L葡萄糖,10 g/L玉米浆粉;T.reesei生孢培养基:30 g/L麦芽浸粉,20 g/L琼脂粉;发酵培养基:10 g诱导物或碳源,2 g KH2PO4,1.4 g(NH4)2SO4,1 g蛋白胨,0.3 g尿素,0.4 g CaCl2,5 mg Fe2SO4·H2O,1.7 mg MnSO4·H2O,1.4 mg ZnSO4·7H2O溶于500 mL去离子水,500 mL 0.2 mol/L磷酸二氢钠-柠檬酸缓冲液(pH=5)。发酵培养基的碳源分别为葡萄糖-β二糖混合物(MGD)、葡萄糖或者纤维素。配制固体培养基需添加20 g/L琼脂粉。以上培养基均在115 ℃高压蒸汽灭菌20 min。
葡萄糖-β二糖混合物(MGD)配制[5]:使用0.2 mol/L磷酸氢二钠-柠檬酸缓冲液(pH=4.8)配制600 g/L葡萄糖溶液,加入β-葡萄糖苷酶20 CBU/g葡萄糖,于65 ℃、150 r/min催化72 h后在105 ℃处理5 min失活β-葡萄糖苷酶。
1.2 仪器与设备
SPX-250-Ⅱ型生化培养箱:上海跃进医疗器械有限公司;SW-CJ-1BU洁净工作台:苏州安泰空气技术有限公司;A300基因扩增仪:杭州朗基科学仪器有限公司;ZWYR-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;THZ-82数显恒温振荡器:常州天瑞仪器有限公司;希尔曼S-10生物传感器分析仪:深圳市西尔曼科技有限公司。
1.3 实验方法
1.3.1 碱预处理的玉米秸秆的制备
使用2%NaOH溶液在固液比8%玉米秸秆条件下121 ℃反应90 min后用蒸馏水冲洗至pH为中性,烘干后得到碱预处理的玉米秸秆(APCS),室温保存备用[13-14]。
1.3.2 过表达Trxyr1基因T.reesei工程菌的构建
将T.reesei Rut C30孢子接种到50 mL种子培养基中,28 ℃、150 r/min培养24 h,以8%接种量接入发酵培养基,置摇床28 ℃、150 r/min培养48 h后取样提取RNA,将RNA反转为cDNA;以cDNA为模板,xyr1-F/R(含有20 bp质粒pPTPDC1的同源片段)为引物,扩增Trxyr1基因。利用BsiW1限制性内切酶线性化表达载体pPTPDC1,使用无缝克隆方法将线性化载体与Trxyr1基因连接,构建成功的载体命名为pPTPDC1-xyr1,通过热激法将连接产物转入E.coli DH5α感受态细胞;表达载体构建先后经过聚合酶链式反应(polymerase chain reaction,PCR)和DNA测序验证。
通过根瘤农杆菌介导遗传转化的方法[15]将表达载体pPTPDC1-xyr1中含有Trxyr1表达盒的T-DNA整合到T.reesei Rut C30基因组,使用含300 μg/mL潮霉素B的PDA平板筛选转化子,提取转化子基因组通过PCR和DNA测序验证Trxyr1表达盒是否整合到T. reesei Rut C30基因组并且无碱基突变。将验证正确的转化于命名为T.reesei OExyr1。
1.3.3 T.reesei发酵生产纤维素酶
Rut C30或者重组菌株T.reesei OExyr1的孢子接种到50 mL种子培养基中,置摇床28 ℃、150 r/min培养24 h,以8%接种量接种于50 mL发酵培养基,继续在28 ℃、150 r/min生产纤维素酶。其中发酵培养基分别以10 g/L MGD、葡萄糖或纤维素为碳源,在发酵36 h、48 h和60 h时取发酵液分别测定纤维素酶、外切纤维素酶、内切纤维素酶和β-葡萄糖苷酶活性。
1.3.4 纤维素酶水解碱处理玉米秸秆
将1.3.1节制备的的APCS按照固液比5∶100(g∶mL)加入到0.2 mol/L磷酸二氢钠-柠檬酸缓冲液(pH=4.8)中,将1.3.3节制备的纤维素酶按照5 FPU/g APCS和237.03 IU/g β-葡萄糖苷酶的量加入到酶解反应体系。水解反应条件为50 ℃和150 r/min,每间隔12 h取样直至葡萄糖产量不再提高停止水解反应。
1.3.5 测定方法
(1)酶活分析方法[16]:
β-葡萄糖苷酶的测定:取适当稀释酶液200 μL与200 μL 15 mmol/L纤维二糖溶液混合置50 ℃反应30 min,然后立即于沸水中反应2 min灭酶活,测定葡萄糖含量。将1 mL酶液1 min产生1 μmol葡萄糖定义为1个酶活力单位(IU/mL)。
内切纤维素酶的测定:取适当稀释酶液500 μL与1 mL 2%的羧甲基纤维素(carboxymethyl cellulose,CMC)溶液混合,置50 ℃水浴锅中反应30 min,然后立即加入2 mL的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)于沸水中10 min灭酶活,加入9 mL去离子水,测定波长540 nm处的吸光度值。将1 mL酶液1 min生产1 μmol还原糖定义为1个酶活力单位(IU/mL)。
外切纤维素酶的测定:取适当稀释酶液100 μL与50 μL 1 g/L的对硝基苯纤维二糖苷(p-nitrophenol-D-cellobioside,pNPC)溶液混合,置50 ℃水浴锅中反应30 min,然后立即加入150 μL 10%Na2CO3溶液灭酶,测定波长415 nm处的吸光度值。将1 mL酶液1 min生产1 μmol pNP定义为1个酶活力单位(IU/mL)。
滤纸酶活测定:取适当稀释酶液500 μL、1 mL乙酸钠缓冲液(0.2 mol/L,pH=4.8)、Whatman No.1滤纸条(6 cm×1 cm),置50 ℃水浴锅反应1 h,然后立即加入2 mL的DNS于沸水浴10 min灭酶,加入9 mL去离子水,测定波长540 nm处吸光度值。将1 mL酶液1 min生产1 μmol还原糖定义为1个酶活力单位(IU/mL)。
(2)定量聚合酶链反应分析
分别将接种后发酵36 h的Rut C30和T.reesei OExyr1菌丝提取RNA后反转录为cDNA用于定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)测定。所测试基因qPCR引物如表1。采用2-ΔCt法计算被测基因的相对定量,sar1基因作为管家基因[17-18]。
1.3.6 数据处理
实验均进行3次重复,结果均以“平均值和标准差”表示。使用方差分析(analysis of variance,ANOVA)统计学分析方法,显著性水平设定为P<0.05,极显著水平设定为P<0.01。
2 结果与分析
2.1 过表达Trxyr1基因T.reesei工程菌的构建
研究发现,使用cbh1或者xyn3启动子在T.reesei中表达基因会降低相应外切纤维素酶和木聚糖酶活性[19-20],因此本研究选用丙酮酸脱羧酶1(PDC1)组成型启动子表达内源Trxyr1基因。将筛选出可稳定遗传的阳性转化子命名为T.reesei OExyr1,验证结果如图1所示。构建的过表达Trxyr1基因的质粒图谱见图1A。由图1A可知,T-DNA中包含Trxyr1基因表达盒和潮霉素B筛选标记。以Bsiw1yz-R和qPCRxyr1-F为引物对T.reesei工程菌进行验证,结果见图1B。由图1B可知,以T.reesei Rut C30基因组为模板无PCR产物,而以T.reeseiOExyr1基因组为模板可以克隆出碱基大小为2600bp左右的DNA片段,且与目标DNA大小一致,说明Trxyr1基因表达盒成功整合到T.reesei基因组;进一步对表达盒进行DNA测序验证,结果见图1C。由图1C可知,表达盒中DNA序列与目的序列完全一致,无碱基突变。利用葡萄糖-β二糖混合物(MGD)为诱导物分别培养Rut C30和T.reesei OExyr1菌株36 h后提取RNA对Trxyr1基因进行qPCR分析,结果见图1D。由图1D可知,该基因在MGD诱导下均可检测到表达,但是利用PDC1启动子过表达该基因后发现相比于野生型菌株Trxyr1基因表达量提高了2.44倍(P<0.01),说明Trxyr1基因表达盒不仅仅整合到了T.reesei Rut C30基因组,而且实现了高表达,可用于后续发酵实验。
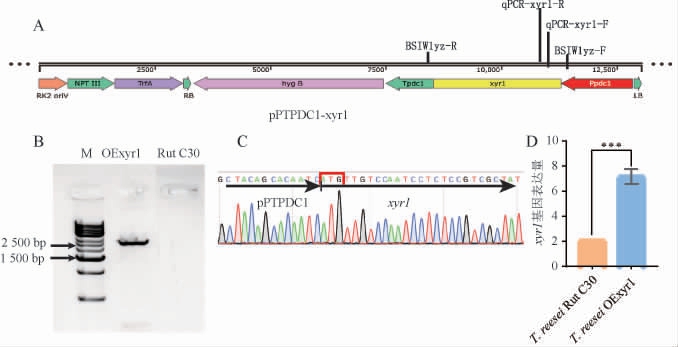
图1 过表达Trxyr1载体的质粒示意图与转化子验证
Fig.1 Plasmid schematic diagram and transformant verification of overexpression Trxyr1 vector
“***”表示差异极显著(P<0.01)。下同。
2.2 T.reesei发酵生产纤维素酶
T.reesei是生产纤维素酶高产菌株,但纤维素酶的生物合成需要诱导。槐糖是目前已知的最强诱导物,但是纯槐糖价格昂贵[21-22];通过β-葡萄糖苷酶催化葡萄糖制备的MGD由于含有槐糖,所以具有很强的诱导能力[5-7]。纤维素是常用的诱导物,虽然诱导外切纤维素酶和内切纤维素酶水平没有MGD强,但其所产纤维素酶组分中含有大量纤维素降解辅助蛋白,从而可能有利于纤维素酶对木质纤维素的水解[12];已知葡萄糖存在条件下由于碳代谢阻遏作用会抑制纤维素酶基因转录[23],且转录组学显示MGD相比于纤维素作为诱导物,Trxyr1基因转录水平显著提高[8],因此需要探讨Trxyr1基因在不同诱导物条件下对T.reesei合成纤维素酶的影响。
以10 g/L MGD为碳源分别诱导野生型菌株T.reesei Rut C30和过表达Trxyr1基因的T.reesei OExyr1菌株生产纤维素酶,结果如图2所示。

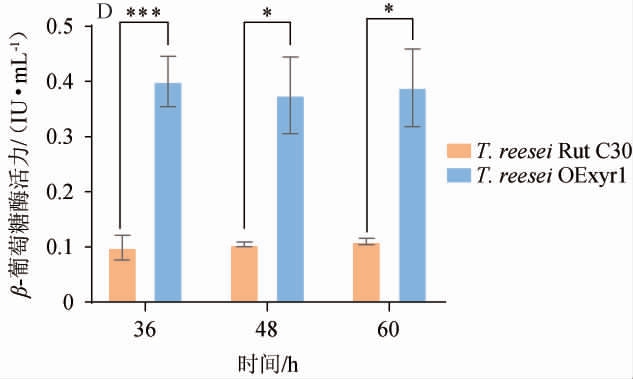
图2 以MGD为碳源对诱导Rut C30和Trichoderma reesei OExyr1生产纤维素酶的影响
Fig.2 Effect of MGD as carbon source on cellulase production by Rut C30 and Trichoderma reesei OExyr1
“*”表示差异显著(P<0.05);“ns”表示无显著差异(P>0.05)。下同。
由图2可知,在发酵48 h时纤维素酶产量达到最高,此时过表达Trxyr1基因的T.reesei OExyr1菌株相比于野生型菌株T.reesei Rut C30的滤纸酶活(图2A)和β-葡萄糖苷酶(图2D)活性分别提高了0.22倍和3.05倍(P<0.01),但是外切纤维素酶(图2B)和内切纤维素酶(图2C)活性无显著性影响(P>0.05)。
以10 g/L纤维素为碳源分别诱导野生型菌株T.reesei Rut C30和过表达Trxyr1基因的T.reesei OExyr1菌株生产纤维素酶,结果见图3。
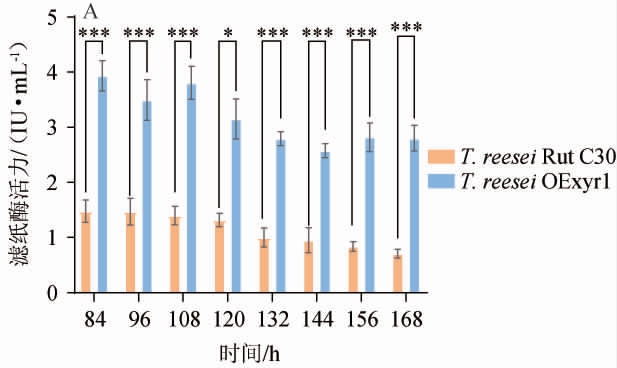

图3 以纤维素为碳源对诱导Rut C30和Trichoderma reesei OExyr1生产纤维素酶的影响
Fig.3 Effect of cellulase as carbon source on cellulase production by Rut C30 and Trichoderma reesei OExyr1
由图3可知,过表达Trxyr1基因的T.reesei OExyr1菌株的滤纸酶活、外切纤维素酶、内切纤维素酶和β-葡萄糖苷酶活性相比于野生型菌株T.reesei Rut C30分别极显著提高了2.95、2.15、2.40和5.37倍(P<0.01),相比于MGD作为诱导物,纤维素酶活性提高更为显著。分析原因主要是以MGD为诱导物本底Trxyr1基因表达量就足够高,这也是最初分析MGD具有高诱导活性的重要原因之一。因此继续过表达Trxyr1基因后提高纤维素酶活性有限,而以纤维素作为诱导物,本底Trxyr1基因表达量不足,而XYR1是已知的T.reesei中最重要的纤维素酶转录激活因子,有报道敲除该基因后,所有纤维素酶基因均无转录[24]。因此过表达Trxyr1基因的工程菌利用纤维素作为诱导物会获得更高的纤维素酶产量。
由于碳阻遏作用导致葡萄糖存在条件下T.reesei生产纤维素酶受到抑制,研究表明,这种抑制主要通过纤维素酶转录抑制因子CRE1调控,而T.reesei Rut C30的cre1基因发生突变,所以其具备在葡萄糖为碳源条件下合成纤维素酶的可能性[25]。以10 g/L葡萄糖为碳源分别诱导野生型菌株T.reesei Rut C30和过表达Trxyr1基因的T.reesei OExyr1菌株生产纤维素酶,结果如图4所示。由图4可知,过表达Trxyr1基因的T.reesei OExyr1菌株的滤纸酶活、外切纤维素酶、内切纤维素酶和β-葡萄糖苷酶活性相比于野生型菌株T.reesei Rut C30分别提高了1.27、1.14、0.45和3.44倍;但与MGD或者纤维素作为诱导物存在时,滤纸酶活分别极显著降低4.42倍和5.86倍(P<0.01)。LV X等[26]利用铜响应启动子tcu1在T.reesei QM9414中过表达Trxyr1基因后使得菌株在非诱导条件下合成纤维素酶,与本研究结果一致,然而鉴定过表达Trxyr1基因对菌株在MGD诱导条件下合成纤维素酶的影响文献尚无报道。
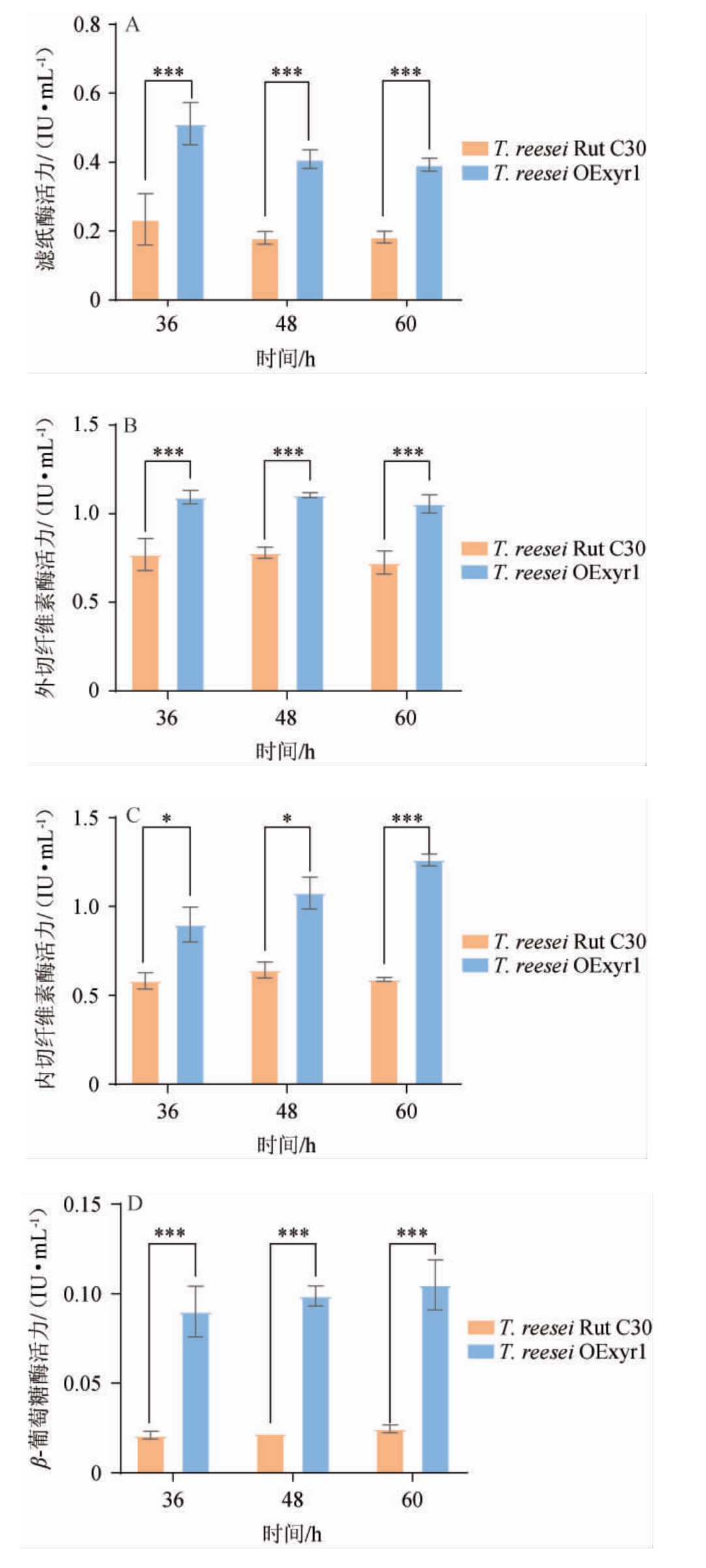
图4 以葡萄糖为碳源对诱导Rut C30和Trichoderma reesei OExyr1生产纤维素酶的影响
Fig.4 Effect of glucose as carbon source on cellulase production by Rut C30 and Trichoderma reesei OExyr1
此外,无论是何种诱导物或者葡萄糖作为碳源,过表达Trxyr1基因后β-葡萄糖苷酶活性相较于其他纤维素酶活性提高最为显著,研究表明,T.reesei普遍存在缺乏β-葡萄糖苷酶,在水解纤维素过程中会导致纤维二糖积累从而抑制外切纤维素酶和内切纤维素酶从而降低水解效率[9],而过表达Trxyr1基因提高β-葡萄糖苷酶活性效果有限,因此后续在水解玉米秸秆实验过程中仍需额外补充商业β-葡萄糖苷酶以克服上述普遍存在的问题。
过表达Trxyr1基因后普遍提高了β-葡萄糖苷酶活性,也可能是以MGD为诱导物提高纤维素酶活性有限的另外一种原因。MGD中含有槐糖,且槐糖是目前已知的诱导T.reesei合成纤维素酶最强诱导物,而槐糖可被β-葡萄糖苷酶降解为葡萄糖,因此β-葡萄糖苷酶活性提高会使槐糖更快被降解,从而不能稳定胞内适宜的槐糖浓度,因此不利于纤维素酶合成。实验室之前在以MGD为诱导物条件下,在T.reesei发酵生产纤维素酶的培养基中添加一定浓度的米格列醇(β-葡萄糖苷酶抑制剂),能提高纤维素酶产量2倍以上[27]。
2.3 纤维素酶水解碱预处理玉米秸秆结果
利用MGD、纤维素或者葡萄糖为碳源分别培养野生型菌株T. reesei Rut C30和过表达Trxyr1基因的T. reesei OExyr1菌株所得粗酶液对APCS进行水解,结果见图5。同时由于野生型菌株T.reesei Rut C30在以葡萄糖为碳源条件下生产纤维素酶的活性太低(图4),所以该组无法进行水解实验。
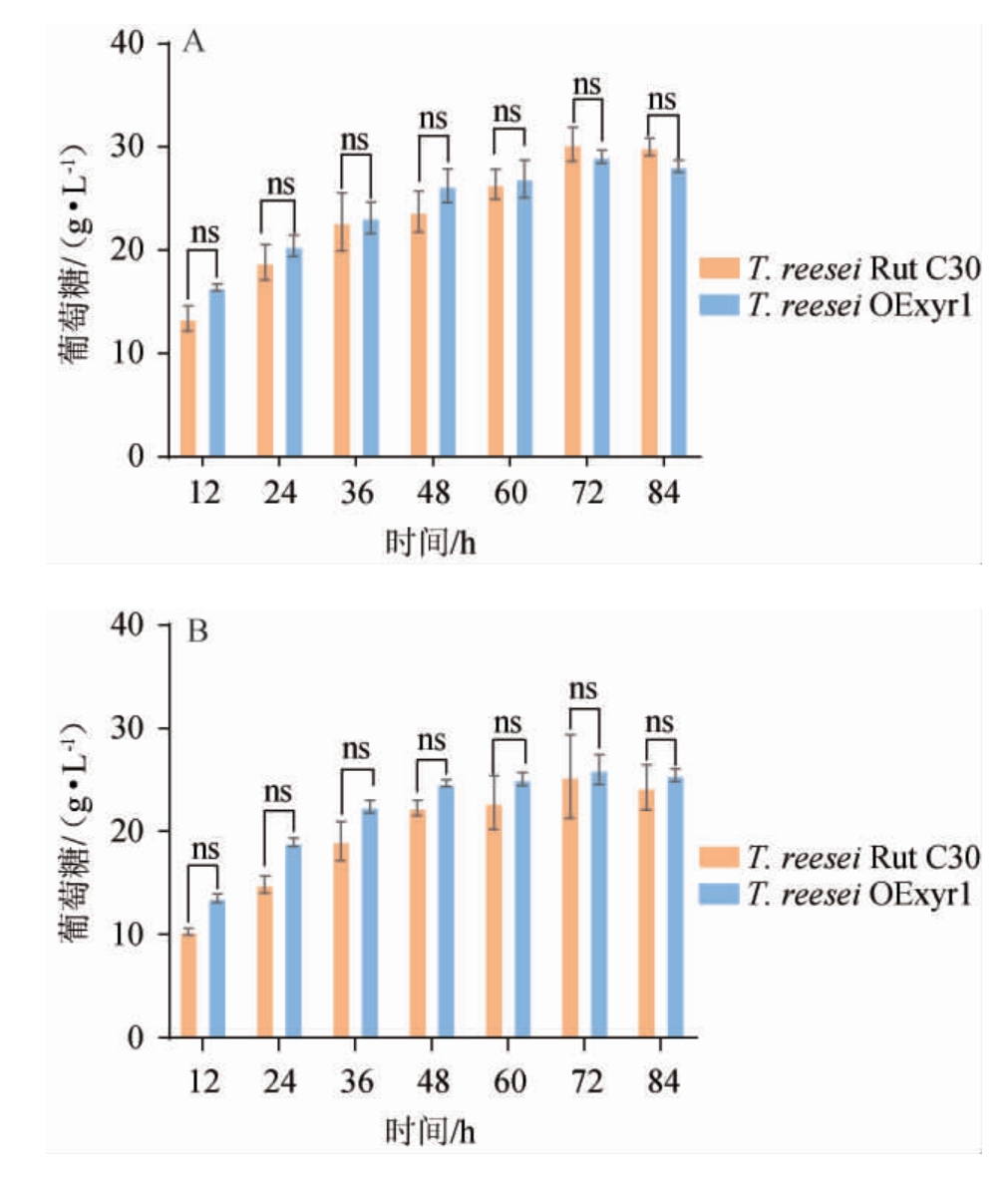
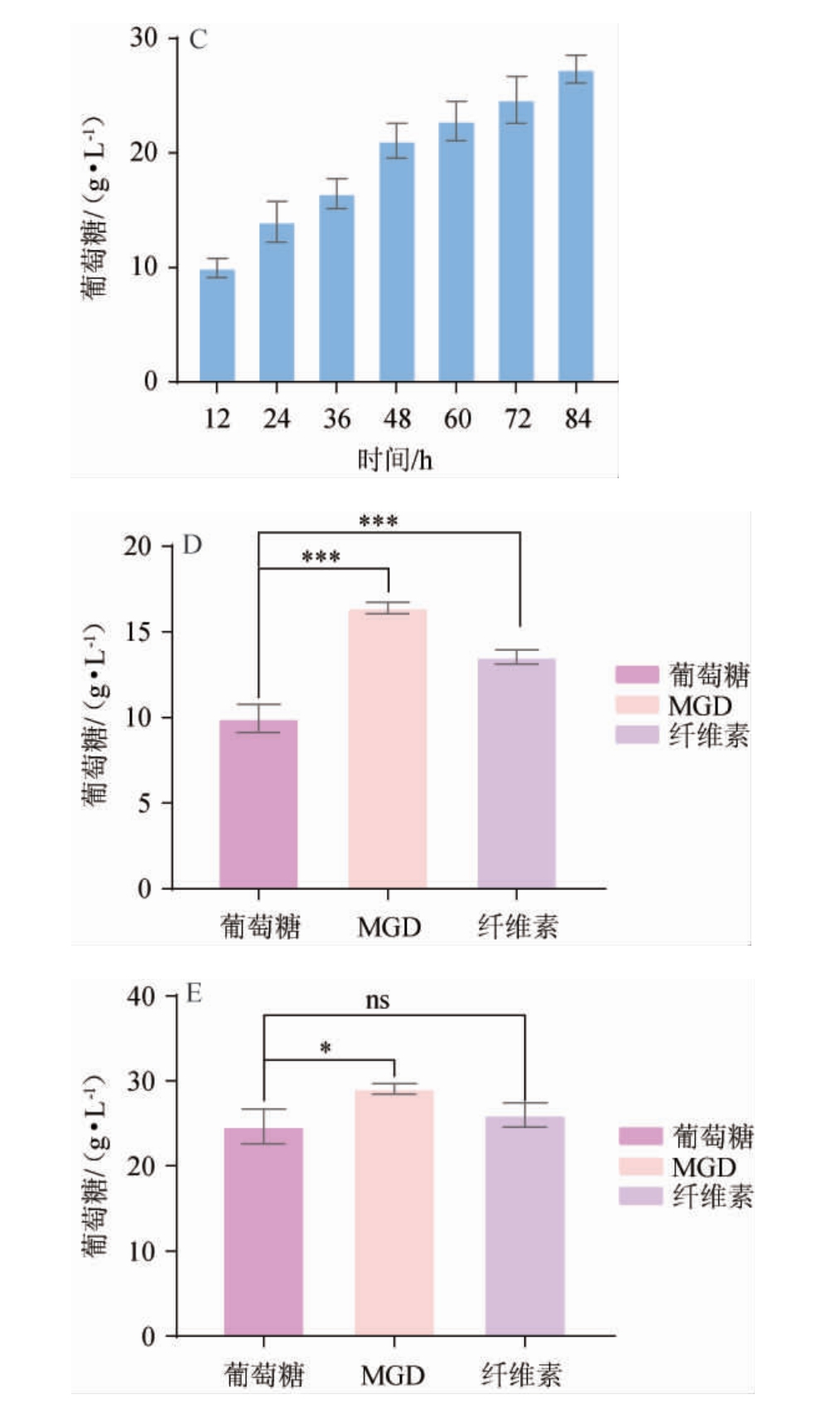
图5 粗酶液水解碱预处理的玉米秸秆释放葡萄糖的变化
Fig.5 Changes of glucose release from corn stalk pretreated with hydrolyzed alkali in crude enzyme solution
A:以MGD为碳源;B:以纤维素为碳源;C:以葡萄糖为碳源;D:T.reesei
OExyr1在三种碳源下所产粗酶液水解APCS后12 h释放葡萄糖量;E:T.reesei OExyr1在三种碳源下所产粗酶液水解APCS后72 h释放葡萄糖量。
由图5可知,野生纤维素酶和工程菌纤维素酶水解APCS均在72 h达到释放葡萄糖量最高值,分别为30.27 g/L和29.07 g/L,且无显著性差异(P>0.05);以纤维素为诱导物所产纤维素酶水解实验结果与图5A结果趋势完全一致,这说明Trxyr1作为全局纤维素酶转录调控因子控制几乎所有纤维素酶基因转录,所以过表达Trxyr1基因对纤维素酶组分影响不大。而图5D显示了在水解初期(12 h),MGD为诱导物所产纤维素酶水解玉米秸秆的效率要极显著高于纤维素或者葡萄糖为碳源所产纤维素酶(P<0.01),但是最终水解释放的葡萄糖量无显著性差异(图5E),这可能是由于MGD所产纤维素酶系中外切纤维素酶和内切纤维素酶占比更大。图5C显示了葡萄糖培养T.reesei OExyr1所产纤维素酶的水解实验,与诱导物存在下相比,释放葡萄糖量并无显著性差异(图5E)(P>0.05),这为T.reesei无诱导物发酵生产纤维素酶提供了新的思路。
3 结论
本研究在T.reesei Rut C30中过表达同源纤维素酶转录激活因子Trxyr1基因,阳性转化子T. reesei OExyr1的Trxyr1基因表达量极显著提高了2.44倍(P<0.01)。在葡萄糖-槐糖混合物作为诱导物下T.reesei OExyr1所产纤维素酶提高有限,而纤维素作为诱导物T.reesei OExyr1所产纤维素酶均得到显著性提高,而T.reesei OExyr1在非诱导条件下可以合成纤维素酶。水解玉米秸秆实验证实Trxyr1作为纤维素酶转录全局调控因子,表达量提高后不会改变纤维素酶系从而影响水解效率,研究成果为进一步确定T.reesei合成纤维素酶的分子机制及构建高产纤维素酶菌株提供参考。
[1]李德尚玉.政府工作报告解读:从能耗“双控”向碳排放“双控”转变金融如何发力?[N].21世纪经济报道,2022-03-10(005).
[2]HIMMEL M E,BAYER E A.Lignocellulose conversion to biofuels:current challenges,global perspectives[J].Curr Opin Biotechnol,2009,20(3):316-317.
[3]FANG H,LI C F,ZHAO J J,et al.Biotechnological advances and trends in engineering Trichoderma reesei towards cellulase hyperproducer[J].Biotechnol Bioprocess Eng,2021,26:517-528.
[4] PETERSON R, NEVALAINEN H. Trichoderma reesei RUT-C30-thirty years of strain improvement[J].Microbiology,2012,158(1):58-68.
[5]LI Y H,LIU C G,BAI F W,et al.Overproduction of cellulase by Trichoderma reesei RUT C30 through batch-feeding of synthesized low-cost sugar mixture[J].Bioresource Technol,2016,216:503-510.
[6] XIA Y,YANG L R,XIA L M.High-level production of a fungal β-glucosidase with application potentials in the cost-effective production of Trichoderma reesei cellulase[J].Process Biochem,2018,70:55-60.
[7] CHEN Y M, WU C, FAN X J, et al.Engineering of Trichoderma reesei for enhanced degradation of lignocellulosic biomass by truncation of the cellulase activator ACE3[J].Biotechnol Biofuels,2020,13:62.
[8]DOS SANTOS CASTRO L,PEDERSOLI W R,ANTONIÊTO A C C,et al.Comparative metabolism of cellulose, sophorose and glucose in Trichoderma reesei using high-throughput genomic and proteomic analyses[J].Biotechnol Biofuels,2014,7:41.
[9] BISCHOF R H, RAMONI J, SEIBOTH B.Cellulases and beyond: the first 70 years of the enzyme producer Trichoderma reesei[J].Microb Cell Fact,2016,15(1):1-13.
[10]EIBINGER M,SIGL K,SATTELKOW J,et al.Functional characterization of the native swollenin from Trichoderma reesei:study of its possible role as C1 factor of enzymatic lignocellulose conversion[J].Biotechnol Biofuels,2016,9(1):1-19.
[11]莫易,冉小琴,王赞丞,等.过表达内源Trswo1基因提高里氏木霉纤维素酶对玉米秸秆的水解效率的研究[J].食品与发酵工业,2023,49(14):60-66.
[12]LI Y H,ZHANG X Y,ZHANG F,et al.Optimization of cellulolytic enzyme components through engineering Trichoderma reesei and on-site fermentation using the soluble inducer for cellulosic ethanol production from corn stover[J].Biotechnol Biofuels,2018,23:11-49.
[13]LI Y H,ZHANG X Y,XIONG L,et a.On-site cellulase production and efficient saccharification of corn stover employing cbh2 overexpressing Trichoderma reesei with novel induction system[J].Bioresource Technol,2017,238:643-649.
[14] MCINTOSH S, VANCOV T.Enhanced enzyme saccharification of Sorghum bicolor straw using dilute alkali pretreatment[J].Bioresource Technol,2010,101(17):6718-6727.
[15]胡懋,曾杨璇,苗华彪,等.根癌农杆菌介导真菌遗传转化的研究及应用[J].微生物学通报,2021,48(11):4344-4363.
[16]GHOSE T K.Measurement of cellulase activities[J].Pure Appl Chem,1987,59:257-268.
[17]刘杜娟,黄火清,苏小运.低纤维素酶背景里氏木霉菌株的构建和应用[J].中国农业科技导报,2020,22(12):50-57.
[18]LI Y H,YU J Z,ZHANG P,et al.Comparative transcriptome analysis of Trichoderma reesei reveals different gene regulatory networks induced by synthetic mixtures of glucose and β-disaccharide[J].Bioresour Bioprocess,2021,8:1-16.
[19]LI C C,LIN F M,LI Y Z,et al.A β-glucosidase hyper-production Trichoderma reesei mutant reveals a potential role of cel3D in cellulase production[J].Microb Cell Fact,2016,15:1-13.
[20] NAKAZAWA H, KAWAI T, IDA N, et al.Construction of a recombinant Trichoderma reesei strain expressing Aspergillus aculeatus β-glucosidase 1 for efficient biomass conversion[J].Biotechnol Bioeng,2012,109(1):92-99.
[21]LI Y H,ZHANG P,ZHU D Y,et al.Efficient preparation of soluble inducer for cellulase production and saccharification of corn stover using in-house generated crude enzymes[J].Biochem Eng J,2022,178:108296.
[22] ZHANG P, LI Q, CHEN Y, et al.Induction of cellulase production in Trichoderma reesei by a glucose-sophorose mixture as an inducer prepared using stevioside[J].RSC Adv,2022,12:17392-17400.
[23] SHIBATA N, KAKESHITA H, IGARASHI K, et al.Disruption of alpha-tubulin releases carbon catabolite repression and enhances enzyme production in Trichoderma reesei even in the presence of glucose[J].Biotechnol Biofuels,2021,14(1):1-16.
[24]CAO Y L,ZHENG F L,ZHANG W X,et al.Trichoderma reesei XYR1 recruits SWI/SNF to facilitate cellulase gene expression[J].Mol Microbiol,2019,112(4):1145-1162.
[25]ANTONIÊTO C,CRISTINA A,DE PAULA G,et al.Trichoderma reesei CRE1-mediated carbon catabolite repression in response to sophorose through RNA sequencing analysis[J].Curr Genomics,2016,17(2):119-131.
[26] LV X X, ZHENG F L, LI C Y, et al.Characterization of a copper responsive promoter and its mediated overexpression of the xylanase regulator 1 results in an induction-independent production of cellulases in Trichoderma reesei[J].Biotechnol Biofuels,2015,8(1):1-14.
[27]LONG T T,ZHANG P,YU J Z,et al.Regulation of β-disaccharide accumulation by β-glucosidase inhibitors to enhance cellulase production in Trichoderma reesei[J].Fermentation,2022,8(5):232.