酱香型白酒作为我国十二大白酒香型之一,深受广大消费者喜爱[1]。堆积发酵是酱香型白酒独特且极其重要的生产工序之一[2]。堆积发酵是一个开放式过程,主要作用是富集周围环境中的微生物,对蒸煮糊化后的淀粉进行糖化,产生多种酶类并在这些酶的催化作用下形成酱香风格的前体物质及香味物质,为后续的窖内发酵提供重要的微生物和酶类[3]。经过堆积,酒醅中细菌、酵母菌种类有所增加,数量也会发生较大的变化,细菌由开始时的占总数67%以上降为13%左右,酵母菌则由34%左右提高至86%[4],堆积过程也被称作为“二次制曲”[5-7]。因此,高温堆积过程对酱香型白酒的品质影响不言而喻。
传统酱香型白酒以一年为一个生产周期,经历两次投粮,九次蒸煮,八次堆积发酵,七次蒸馏取酒[8]。一般都遵循重阳下沙,导致造沙、一轮次酒和二轮次酒在冬季进行生产[9]。由于冬季气温低,低温对微生物的生长和繁殖不利,近年来酱香型白酒企业机械化操作逐渐普及,使得酱酒糟醅堆积发酵阶段堆子升温不均匀或升温缓慢,导致酱酒产质量受到严重影响。针对酱酒糟醅堆子不升温问题,研究表明,采用倒堆技术可使酒醅的溶氧增加,从而促进微生物的生长繁殖,有效提高堆子升温速率[10];袁再顺等[11]研究发现,经破堆移位处理,异常堆子可恢复正常升温且能显著增加二轮次酒醅中还原糖含量,有效降低酒醅的总酸含量与水分含量;研究表明,在酱酒生产第二轮次堆积时使用破堆移位工艺,能有效降低酒醅的酸度,促进淀粉转化,使得酒醅微生物属的丰富度和多样性明显增加,有利于好氧菌属如芽孢杆菌属(Bacillus)、高温放线菌属(Thermoactinomyces)等微生物生长。通过增加堆积过程中糟醅的溶氧,从而促进微生物生长繁殖,提高堆积升温的速率[12-13]。酱酒生产中存在冬季生产时堆积发酵阶段升温缓慢进而影响发酵进程及发酵质量的行业共性难题。
本研究以酱香型白酒生产车间的二轮次堆积过程中相邻的两个堆子为研究对象,对接种与未接种堆子分别从堆积时间、入窖糟醅酸度、微生物组成、产酒率及基酒风格方面进行比较。以期考察接种堆积成熟糟醅对冬季酱香型白酒堆积发酵及其产酒量和质量的影响,为进一步加强酱香型白酒酿造生产工艺的把控提供参考。
1 材料与方法
1.1 材料与试剂
选择某酱酒企业同一车间、同一时间、相同操作方式的2轮次堆积发酵升温缓慢的糟醅A堆和B堆。其中A堆按照车间正常生产操作进行堆积,B堆在上堆过程中接种堆积成熟堆子的糟醅(表面带白色菌体的糟醅层,接种量为糟醅总质量0.5%)。分别在堆顶(离堆顶10 cm)、堆中间(离地高度100~120 cm)及堆底部(离地高度20~30 cm)的堆子外层(堆子表层15 cm厚)进行采样并混合均匀,对堆顶(离堆顶10 cm)、堆中间(离地高度100~120 cm)及堆底部(离地高度20~30 cm)的堆子内层(距表层1.0~1.5 m)糟醅进行采样并混合均匀。其中A堆堆外层样品记作WJZ-W,堆内层样品记作WJZ-N;B堆堆外层样品记作JZ-W,堆内层样品记作JZ-N;将已达到入窖条件堆子的表面厚约15 cm、长有白色菌体的糟醅(堆积成熟糟醅)刮取收集,用于接种,样品记作MZJS。
Soil 脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit试剂盒:美国Omega公司;氢氧化钠、酚酞指示剂:泸州聚合化工有限公司。所用试剂均为国产分析纯。
1.2 仪器与设备
ME20A电子分析天平:瑞士Mettler-Toledo公司;5804R冷冻离心机:德国Eppendorf公司;TL2010S中通量组织研磨破碎仪:鼎浩源科技发展(天津)有限公司;NanoDrop2000微量紫外可见分光光度计:美国Thermo Scientific公司。
1.3 方法
1.3.1 堆积时间测算
以接种堆积成熟糟醅和未接种堆积成熟糟醅的堆子为研究对象,自上堆完成之日起记录时间,到堆子达到入窖条件(堆积顶温达到45~50 ℃,且堆子表层长有白色点状菌体,闻有发酵香、花果香及轻微酒香)后计时结束,计算堆积时间。
1.3.2 糟醅酸度的测定
糟醅酸度的测定:采用酸碱中和滴定法[4]。
1.3.3 产酒率的测定
窖池的糟醅在窖内自然发酵30 d之后,将出窖糟醅进行人工上甑,之后蒸馏取酒(蒸汽压力0.08 MPa),综合酒精度55%vol,称取基酒质量,出酒率计算公式如下:
1.3.4 糟醅基因组提取及宏基因组测序
称取糟醅样品MZJS、WJZ-W、WJZ-N、JZ-W、JZ-N各5 g左右样品,先将样品放置液氮冷冻,之后加入至组织研磨破碎仪中进行研磨破碎处理(1 500 r/min研磨5 min)。使用Soil DNA试剂盒进行样品总DNA抽提,之后采用1%琼脂糖凝胶电泳检测DNA提取效果,采用微量分光光度计检测其纯度和浓度。检测合格后,将5份DNA样品寄送至上海美吉生物医药科技有限公司,进行宏基因组测序。
1.3.5 数据分析
(1)数据质控
①使用fastp0.20.0[14](https://github.com/OpenGene/fastp)对reads 3'端和5'端的adapter序列进行质量剪切;②使用fastp0.20.0[14](https://github.com/OpenGene/fastp)去除剪切后长度<50 bp、平均碱基质量值<20以及含N碱基的reads,保留高质量的pair-end reads和single-end reads;③通过软件BWA0.7.9a[15](http://bio-bwa.sourceforge.net)将reads比对宿主DNA序列,并去除比对相似性高的污染reads。
(2)拼接组装与基因预测
使用软件MEGAHIT1.1.2[16](https://github.com/voutcn/megahit)对优化序列进行拼接组装。在拼接结果中筛选≥300 bp的contigs(重叠群)作为最终的组装结果。使用Prodigal[17]/MetaGene[18](http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果中的contigs进行开放阅读框(openreadingframes,ORFs)预测。选择核酸长度≥100 bp的基因,并将其翻译为氨基酸序列。
(3)非冗余基因集构建
用CD-HIT4.6.1[19](http://www.bioinformatics.org/cd-hit/)对所有样品预测出来的基因序列进行聚类(参数为:90%identity、90%coverage),每类取最长的基因作为代表序列,构建非冗余(non-redundant,NR)基因集。
(4)基因丰度计算
使用SOAPaligner[20]软件2.21(http://soap.genomics.org.cn/),分别将每个样品的高质量reads与非冗余基因集进行比对(95%identity),统计基因在对应样品中的丰度信息。
(5)物种分类学注释
使用Diamond0.8.35[21](http://www.diamondsearch.org/index.php)将非冗余基因集的氨基酸序列与NR数据库基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)进行比对,其参数设置期望值e-value为1e-5),并通过NR库对应的分类学信息数据库获得物种注释,然后使用物种对应的基因丰度总和计算该物种的丰度。
1.3.6 基酒风格评定
窖池的糟醅完成窖内自然发酵30 d之后,进行出窖蒸馏取酒,按照糟醅在窖池中的位置,分为上、中、下层糟醅,每层糟醅进行单独蒸馏取酒。分层取酒后每种来源的基础酒均经过三个经过专业训练的品酒师进行尝评,记录尝评等级及感官描述,酱酒基酒风格评价标准见表1。
表1 酱酒基酒风格评价标准
Table 1 Evaluation standards of the style of sauce-flavor Baijiu

等级 香气 口感基酒优级基酒一级基酒二级窖底一级窖底二级酱香显著,有复合的特殊香,伴有花果香酱香明显,微有粮香,花果香明显有酱香,香气较纯正窖香浓郁,有明显酱香和曲香,香气浓郁窖香显著,有酱香和曲香,香气纯正酱味较突出,有咸鲜感,酒体较醇厚、丰满细腻,尾净,后味长酱味显著,略带咸鲜味感,酒体醇和,后味较长酱味明显,酒体醇和,后味较长窖味显著,酱味明显,酒体醇和,味甜,后味长,尾净窖味明显,有酱味明显,酒体较醇和,味甜,后味较长
2 结果与分析
2.1 堆积天数及入窖糟醅酸度
接种堆积成熟糟醅的堆子,堆积4 d可入窖,堆子表面白色点状菌体丰富,堆积顶温达到48 ℃,闻有发酵香、花果香,未接种的堆子堆积6 d才可达到入窖条件,白色菌体不丰富,堆积顶温45 ℃,闻有明显乙酸味。未接种堆积成熟糟醅堆子的外层酸度为3.56 mmol/10 g,内层酸度为3.95 mmol/10 g,接种成熟糟醅堆子外层酸度为2.09 mmol/10 g,内层酸度为2.18 mmol/10 g,说明接种堆积成熟糟醅可有效降低堆积糟醅酸度,促进微生物生长,有效缩短堆积时间。
2.2 测序与基因组信息注释
通过Illumina 4000平台对5个样本进行宏基因组测序,最终获得383 442 246个clean reads。对clean reads进行拼接组装和基因预测,优化的片段利用软件MEGAHIT 1.1.2进行拼接组装,最终对>300 bp的contigs进行统计,选择最优的组装结果,组装后共获得1 394 670条contigs,总序列的长度为1 307 200 011 bp。
2.3 接种糟醅和未接种糟醅堆子的真菌群落结构分析
由图1A可知,堆积成熟糟醅(MZJS)在科水平上主要真菌群落组成为毕赤酵母科(Pichiaceae)(85%)、酵母科(Saccharomycetaceae)(5.2%)、曲霉科(Aspergillaceae)(1.9%)及双足囊科(Dipodascaceae)(1.1%)。接种堆子堆积外层糟醅(JZ-W)在科水平上主要真菌群落组成与样品MZJS一致,其主要真菌组成为毕赤酵母科(76.6%)、酵母科(8.9%)、嗜热子囊菌科(Thermoascaceae)(5.1%)及曲霉科(4.2%)。接种堆子堆积内层糟醅(JZ-N)在科水平上的主要真菌群落组成主要为丝裂孢科(Trichocomaceae)(35.7%)、曲霉科(22.5%)、嗜热子囊菌科(6.4%)、Rhizopodaceae(4.2%)、Lichtheimiaceae(3.9%)、毛霉菌科(Mucoraceae)(3.9%)、酵母科(2.0%)及毕赤酵母科(1.5%)。未接种堆子堆积外糟醅(WJZ-W)在科水平上的主要真菌群落组成为曲霉科(25.1%)、丝裂孢科(23.3%)、嗜热子囊菌科(11.9%)、Rhizopodaceae(11.7%)、Lichtheimiaceae(5.4%)、酵母科(4.2%)及毛霉菌科(1.6%)。未接种堆子堆积内层糟醅(WJZ-N)在科水平上主要真菌群落组成为曲霉科(26.0%)、丝裂孢科(22.4%)、嗜热子囊菌科(19.3%)、Rhizopodaceae(6.4%)、Lichtheimiaceae(4.7%)及酵母科(2.4%)。
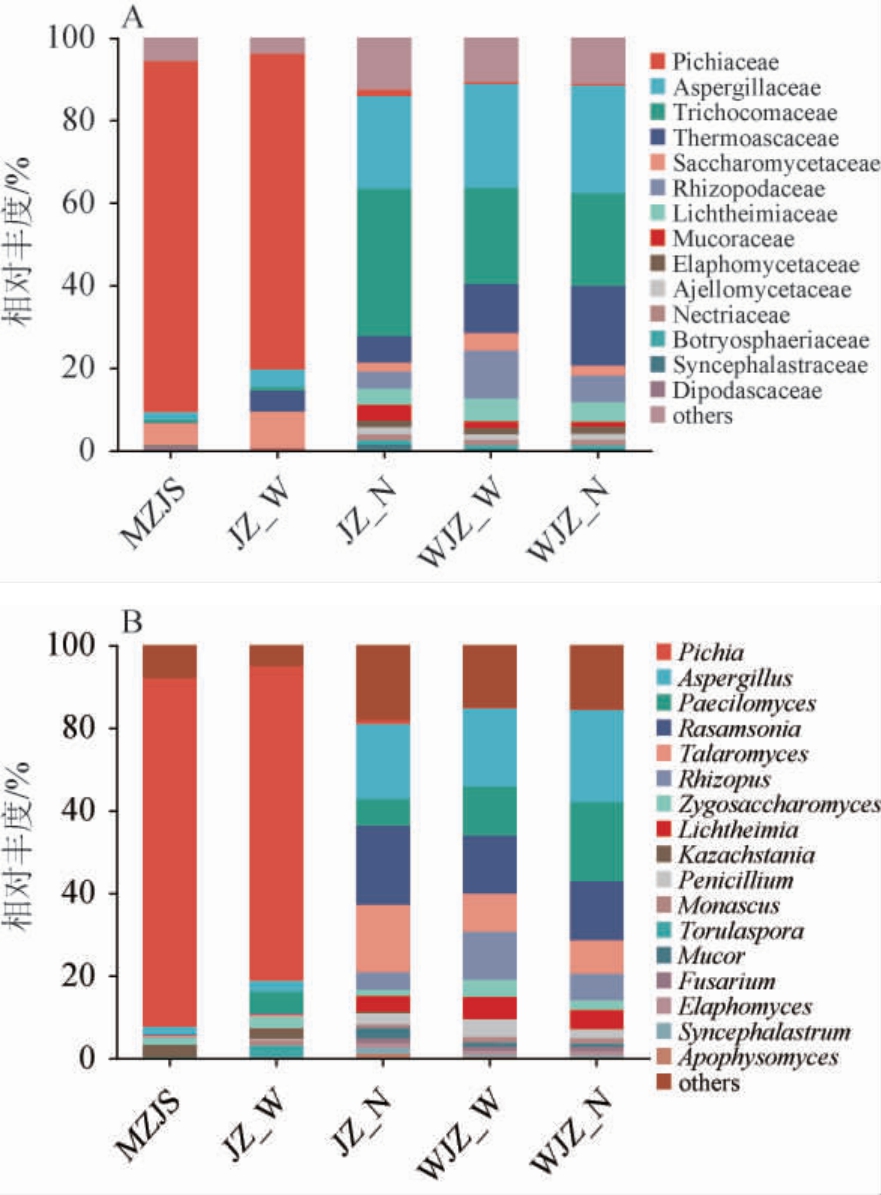
图1 基于科水平(A)及属水平(B)糟醅样品真菌群落结构
Fig.1 Fungal community structure of fermented grains samples based on family level (A) and genus level (B)
由图1B可知,堆积成熟糟醅(MZJS)在属水平上的主要真菌组成为毕赤酵母属(Pichia)(84.2%)、哈萨克斯坦酵母属(Kazachstania)(3.0%)、曲霉属(Aspergillus)(1.8%)及接合酵母属(Zygosaccharomyces)(1.6%)。接种堆子堆积外层糟醅(JZ-W)在属水平上的主要真菌群落组成为毕赤酵母属(76.1%)、拟青霉属(Paecilomyces)(5.1%)、有孢圆酵母属(Torulaspora)(2.9%)、接合酵母属(2.7%)、曲霉属(2.6%)及哈萨克斯坦酵母属(2.5%),与样品MZJS的真菌组成相近。接种堆子堆积内层糟醅(JZ-N)与未接种堆子堆积外层糟醅(WJZ-W)及未接种堆子堆积内层糟醅(WJZ-N)真菌群落组成在属水平上相似,主要真菌属均为曲霉属、拟青霉属、Rasamsonia、篮状菌属(Talaromyces)、根霉属(Rhizopus)、接合酵母属、Lichtheimia及青霉属(Penicillium)。
无论在科水平还是属水平上,接种堆积成熟糟醅后可使堆子外层基本与成熟糟醅的真菌群落组成相似,尤其使得酵母菌大量繁殖,但接种堆子堆积内层糟醅的真菌群落组成未得到明显改善,这可能与堆子内层为厌氧状态,而大多数酵母菌在厌氧状态下繁殖不够旺盛有关。
2.4 接种糟醅和未接种糟醅堆子的细菌群落结构分析
由图2A可知,堆积成熟糟醅(MZJS)在科水平上主要细菌组成为醋杆菌科(Acetobacteraceae)(54.0%)、乳酸杆菌科(Lactobacillaceae)(14.9%)、芽孢杆菌科(Bacillaceae)(11.3%)、高温放线菌科(Thermoactinomvcetaceae)(8.6%)及盐单胞菌科(Halomonadaceae)(3.8%)。接种堆子堆积外层糟醅(JZ-W)在科水平上主要细菌群落组成与成熟糟醅基本一致,但在比例上稍有不同,其主要细菌科组成为醋杆菌科(32.7%)、乳酸杆菌科(28.7%)、高温放线菌科(16.2%)、芽孢杆菌科(5.0%)、假诺卡氏菌科(Pseudonocardiaceae)(4.2%)及盐单胞菌科(3.1%)。接种堆子堆积内层糟醅(JZ-N)在科水平上的细菌群落组成主要为高温放线菌科(63.5%)、乳酸杆菌科(25.1%)及芽孢杆菌科(4.2%)。未接种堆子堆积外糟醅(WJZ-W)在科水平上的主要细菌群落组成为芽孢杆菌科(66.4%)、高温放线菌科(6.5%)、乳酸杆菌科(5.6%)、假诺卡氏菌科(4.5%)、葡萄球菌科(Staphylococcaceae)(3.4%)及Erwiniaceae(2.3%)。未接种堆子堆积内层糟醅(WJZ-N)科水平上主要细菌群落组成为芽孢杆菌科(33.6%)、高温放线菌科(21.7%)、假诺卡氏菌科(10.2%)、葡萄球菌科(8.3%)、乳酸杆菌科(4.8%)、Erwiniaceae(4.4%)及肠杆菌科(Enterobacteriaceae)(2.6%)。

图2 基于科水平(A)及属水平(B)糟醅样品细菌群落结构
Fig.2 Bacterial community structure of fermented grains samples based on family level (A) and genus level (B)
由图2B可知,堆积成熟糟醅(MZJS)在属水平上的主要细菌组成为醋酸菌属(Acetobacter)(49.3%)、乳酸菌属(Lactobacillus)(12.1%)、高温放线菌属(Thermoactinomyces)(8.3%)、芽孢杆菌属(Bacillus)(7.2%)、Peribacillus(3.9%)及盐单胞菌属(Halomonas)(3.7%)。接种堆子堆积外层糟醅(JZ-W)的细菌群落组成在属水平上与样品MZJS相似,主要细菌群落组成为醋酸菌属(30.6%)、乳酸菌属(23.3%)、高温放线菌属(15.5%)、糖多孢菌属(Saccharopolyspora)(3.1%)及芽孢杆菌属(3.0%)。接种堆子堆积内层糟醅(JZ-N)与其他4个样品的细菌群落组成有明显区别,其中高温放线菌属占了极大比例,其主要组成为高温放线菌属(61.7%)、魏斯氏菌属(Weissella)(4.7%)、Acetilactobacillus(4.6%)、Lactiplantibacillus(3.6%)、Levilactobacillus(3.5%)、芽孢杆菌属(3.5%)及Leuconostoc(2.4%)。未接种堆子堆积外层糟醅(WJZ-W)和未接种堆子堆积内层糟醅(WJZ-N)在属水平上的细菌群落组成主要以芽孢杆菌属为主,其细菌组成主要有枝芽孢杆菌属(Virgibacillus)、芽孢杆菌属、高温放线菌属、糖多孢菌属、海洋芽孢杆菌属(Oceanobacillus)、葡萄球菌属(Staphylococcus)、热芽孢杆菌属(Caldibacillus)、Kroppenstedtia、Ornithinibacillus、Lentibacillus。
相比于未接种堆子,接种后堆子内层微生物则以高温放线菌为主,高温放线菌能代谢产生酯化酶、淀粉酶、磷酸酶等多种酶和风味及其前体物[22],该菌在酱香型白酒酿造体系中属于一类具有重要应用潜力的微生物资源,有研究证实高温放线菌具有良好的产吡嗪风味组分的能力,并对其代谢产吡嗪的途径及机理进行了初步解析[23-24];未接种堆子内外层与高温大曲中的微生物组成相近,以芽孢杆菌为主[25]。
2.5 产酒率分析
两个堆子入窖后经30 d发酵,进行蒸馏取酒,产酒率结果见图3。由图3可知,接种堆积成熟糟醅的窖池的出酒率为3.1%,未接种堆积成熟糟醅的窖池的出酒率为1.2%。接种堆积成熟糟醅的窖池出酒率比未接种堆积成熟糟醅的窖池产酒率提高2.58倍。
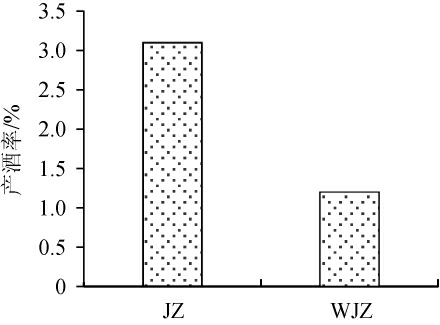
图3 接种及未接种成熟糟醅堆子轮次出酒率
Fig.3 Liquor yield of inoculated with and without mature fermented grains in round liquor
2.6 基酒风格评定
由表2可知,未接种堆积成熟糟醅窖池的基础酒风格较单一,由于堆积时间长,导致糟醅酸度高,进而导致基础酒酸度高;接种堆积成熟糟醅窖池的基础酒风格更加复合,入口酸度适中,酒体较细腻。整体而言,接种堆积成熟糟醅的基酒风格要好于未接种堆积成熟糟醅。
表2 接种与未接种成熟糟醅堆子基酒风格评定结果
Table 2 Style evaluation results of base liquor inoculated with and without mature fermented grains
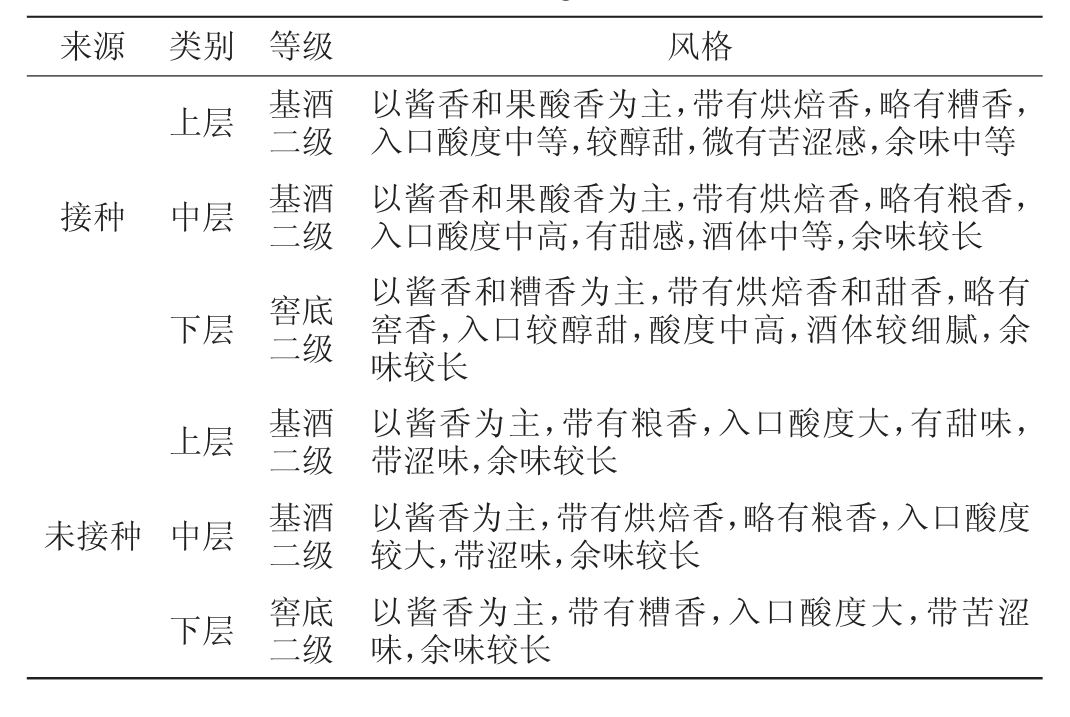
来源 类别 等级 风格上层接种中层下层上层未接种中层下层基酒二级基酒二级窖底二级基酒二级基酒二级窖底二级以酱香和果酸香为主,带有烘焙香,略有糟香,入口酸度中等,较醇甜,微有苦涩感,余味中等以酱香和果酸香为主,带有烘焙香,略有粮香,入口酸度中高,有甜感,酒体中等,余味较长以酱香和糟香为主,带有烘焙香和甜香,略有窖香,入口较醇甜,酸度中高,酒体较细腻,余味较长以酱香为主,带有粮香,入口酸度大,有甜味,带涩味,余味较长以酱香为主,带有烘焙香,略有粮香,入口酸度较大,带涩味,余味较长以酱香为主,带有糟香,入口酸度大,带苦涩味,余味较长
3 结论
本研究提出通过接种堆积成熟糟醅堆子表层的、长有白色斑点菌体的糟醅至堆积升温缓慢的堆子,通过对比接种和未接种堆子的堆积天数、糟醅入窖酸度、微生物组成、产酒率及基酒风格。结果表明,接种堆积成熟糟醅可将堆积天数由6 d缩短至4 d,有效解决堆积升温缓慢问题,同时可将堆子外层糟醅酸度由3.56 mmol/10 g降低至2.09 mmol/10 g,将堆子内层糟醅酸度由3.95 mmol/10 g降低至2.18 mmol/10 g,使糟醅达到入窖酸度标准;同时接种堆积成熟糟醅可基本复制母种糟醅的微生物组成,使堆子外层大量富集酵母菌、醋酸菌、乳酸菌和高温放线菌,堆子内层大量富集高温放线菌、醋酸菌、乳酸菌及芽孢杆菌。接种堆积成熟糟醅使得基酒的产量提高2.58倍,基础酒风格更加复合,入口酸度适中,酒体较细腻。
[1]金尚萍,惠明,田青.酱香型白酒风味物质及影响因素的研究进展[J].发酵科技通讯,2022,51(3):164-168,181.
[2]周恒刚.酱香型白酒生产工艺的堆积[J].酿酒科技,1999(1):5-7.
[3]吴成,程平言,谢丹,等.酱香型白酒四轮次堆积发酵理化因子、风味物质与微生物群落相关性研究[J].食品科学,2023,44(2):240-247.
[4]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:366.
[5]梁泺,范宏筠,税梁扬,等.“FD工艺”对酱香型白酒堆积过程的影响[J].食品工业科技,2023,44(4):181-188.
[6]张守财.堆积发酵对酱香型白酒风味形成的作用及其控制[J].福建轻纺,2006(11):17-18.
[7]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[8]蒙德俊,张娇娇,郭炳豪,等.酱香型白酒轮次基酒酸类风味物质与酒醅微生物的相关性分析[J].食品科技,2022,47(10):77-83.
[9]税梁扬,梁泺,周帅,等.“FD工艺”对酱香型白酒堆积过程真菌群落结构和酒体品质的影响[J].酿酒科技,2022(9):25-32.
[10]王邦坤,张维山.倒堆技术在北方酱香型白酒生产中的应用[J].酿酒,2022,49(2):88-91.
[11]袁再顺,胡萍,陈乾,等.破堆移位解决酱香酒冬季堆积发酵异常研究[J].食品与机械,2019,35(4):14-19.
[12]潘学森,刘民万,董伟杰,等.北方酱酒的核心产区——青州产区的生产实践与思考[J].酿酒,2022,49(6):100-103.
[13]席玉,席永佶,李朝云.通氧发酵技术对酱香白酒堆积过程的影响研究[J].酿酒科技,2022(5):72-76.
[14]CHEN S F,ZHOU Y Q,CHEN Y R,et al.fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[15]LI H,DURBIN R.Fast and accurate short read alignment with Burrows-Wheeler transform[J].Bioinformatics,2009,25(14):1754-1760.
[16]LI D H,LIU C M,LUO R B,et al.MEGAHIT:an ultra-fast single-node solution for large and complex metagenomics assembly via succinct de Bruijn graph[J].Bioinformatics,2015,31(10):1674-1676.
[17] HYATT D, CHEN G L, LOCASCIO P F, et al.Prodigal: prokaryotic gene recognition and translation initiation site identification[J].BMC Bioinformatics,2010,11:119.
[18]NOGUCHI H,PARK J,TAKAGI T.MetaGene:prokaryotic gene finding from environmental genome shotgun sequences[J].Nucleic Acids Res,2006,34(19):5623-5630.
[19]FU L M,NIU B F,ZHU Z W,et al.CD-HIT:accelerated for clustering the next-generation sequencing data[J].Bioinformatics, 2012, 28(23):3150-3152.
[20] LI R Q,LI Y R,KRISTIANSEN K,et al.SOAP: short oligonucleotide alignment program[J].Bioinformatics,2008,24(5):713-714.
[21] BUCHFINK B, XIE C, HUSON D H.Fast and sensitive protein alignment using DIAMOND[J].Nat Methods,2015,12(1):59-60.
[22]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[23]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[24]LI D N,HUANG W,WANG C X,et al.The complete genome sequence of the thermophilic bacterium Laceyella sacchari FBKL4.010 reveals the basis for tetramethylpyrazine biosynthesis in Moutai-flavor Daqu[J].Microbiologyopen,2019,8(12):e922.
[25]杨阳,禄凌飞,刘光钱,等.不同发酵顶温大曲中细菌群落结构的差异性分析[J].食品与发酵工业,2023,49(13):70-77.