酸度是影响葡萄酒质量的重要因素,葡萄酒中有机酸的种类与含量会对葡萄酒风味造成显著的影响[1]。适量的酸度可以较好地平衡葡萄酒的风味,防止腐败,并在葡萄酒陈酿过程中发挥重要作用[2]。过高的酸度则会导致葡萄酒酒味酸涩、酒体粗糙。葡萄酒的酸度一般应控制在6~10 g/L,而葡萄果实的酸度一般在12.0~20.0 g/L,因此需要在酿造过程中进行适当的降酸处理[3-4]。目前葡萄酒降酸的方法主要有3类,包括化学降酸法、物理降酸法和生物降酸法[5]。化学降酸法是通过在葡萄酒中加入碱式盐如KHCO3、CaCO3,与酒石酸形成不溶性的酒石酸氢盐或中性钙盐,从而达到降酸目的。该方法时间短、成本低、操作方便,但是会对葡萄酒的风味造成影响[6]。物理降酸法包括冷冻处理和离子交换法,对于大部分需要带皮发酵的红葡萄酒不适用,成本较高且降酸程度有限[7]。生物降酸是在葡萄酒发酵过程中利用微生物分解葡萄酒中的有机酸,从而达到降酸目的[8]。近年来生物降酸成为葡萄酒降酸研究的热点,乳酸菌、酵母菌等均可发挥较好的降酸作用,但对其作用机理尚缺乏系统的研究,发酵过程调控机制尚不明晰[9-10]。
山葡萄为我国特色酿酒葡萄品种,具有良好的抗寒、抗病能力,主要分布于黑龙江、吉林、辽宁、内蒙古等地。仅吉林省山葡萄栽培面积可达7 000 km2,年产山葡萄鲜果15万t左右,为山葡萄酒的酿造提供了良好的资源[11]。山葡萄高糖高酸,果实的含糖量一般为80~150 g/L,有机酸含量一般为10~25 g/L,显著高于欧亚种群[12]。适宜的降酸发酵是改善山葡萄酒风味,酿造高品质山葡萄酒重要途径。
1 具有生物降酸功能菌株
研究表明乳酸菌、非酿酒酵母、少部分真菌均具有分解有机酸的能力。赵玉平等[13]以柠檬酸为唯一碳源分离筛选降解柠檬酸的菌株,经鉴定为毕赤酵母属(Pichia sp.),该菌株能有效降解山楂汁中的柠檬酸而对山楂中黄酮的含量影响较小。陈思睿等[14]对红树莓鲜果和果园土壤的微生物进行分离纯化,筛选到2株具有较强降解柠檬酸能力的菌株,经鉴定均为陆生伊萨酵母(Issatchenkia terricola),该菌株对筛选培养基中柠檬酸的降解率可达67.23%。白玉峰等[15]利用苹果酸降解指示培养基显色法筛选能够降酸苹果酸的酵母菌,该方法是在培养基中添加L-苹果酸作为主要碳源,同时添加溴甲酚绿作为酸碱指示剂,通过培养基的颜色变化可以观察出菌株降解苹果酸能力的强弱。何志刚等[16]从自然发酵的枇杷酒和刺葡萄酒中分离出能够降解苹果酸和柠檬酸的2株酿酒酵母,将其应用于葡萄酒酿造,可使葡萄酒总酸下降13.76%。不同来源筛选获得的降酸菌株见表1。目前乳酸菌如酒酒球菌(Oenococcus oeni),非酿酒酵母如毕赤酵母(Pichia sp.)、美极梅齐酵母(Metschnikowia pulcherrima)、陆生伊萨酵母(Issatchenkia terricola)已被应用于葡萄酒酿造。
表1 不同来源的降酸菌株
Table 1 Acid-reducing strains from different sources

菌株类型 来源 可降解酸的种类 降酸率/% 参考文献酒酒球菌(Oenococcus oeni)植物乳杆菌(Lactobacillus plantarum)东方伊萨酵母(Issatchenkia orientalis)陆生伊萨酵母(Issatchenkia terricola)毕赤酵母(Pichia sp.)发酵毕赤酵母(Pichia fermentans)库德毕赤酵母(Pichia kudriavzevii)美极梅齐酵母(Metschnikowia pulcherrima)酿酒酵母(Saccharomyces cerevisiae)酿酒酵母(Saccharomyces cerevisiae)二孢接合酵母(Zygosaccharomyces bisporus)草酸青霉(Penicillium oxalicum)黑曲霉(Aspergillus niger)公酿一号葡萄酒印度葡萄浆果新疆玛纳斯红树莓鲜果废水、果实样品桔子、柠檬、土壤葡萄酒发酵液宁夏贺兰山赤霞珠葡萄自然发酵汁自然发酵黑莓果酒自然发酵枇杷酒长白山蓝靛果山葡萄种植土壤土壤、山葡萄果实苹果酸苹果酸柠檬酸柠檬酸柠檬酸柠檬酸苹果酸苹果酸苹果酸苹果酸、柠檬酸苹果酸、柠檬酸、酒石酸酒石酸、苹果酸、柠檬酸酒石酸88.95 59.00 18.12 67.23 82.04 95.58 62.30 99.00 21.25 13.76 42.60 71.90 70.00曹颖等[17]NIKHANJ P等[18]郝爱玲等[19]陈思睿等[14]赵玉平等[13]ZHONG W等[20]DEL MONACO S M等[21]白玉峰等[15]朱佳娜等[22]何志刚等[16]卢思言等[23]吴曼毓等[24]文连奎等[25]
2 葡萄酒生物降酸机制研究
2.1 葡萄酒苹果酸-乳酸发酵降酸途径
葡萄原料中的苹果酸酸度较高,会导致葡萄酒口感酸涩,降解葡萄酒中过量的苹果酸可提高葡萄酒的风味品质。利用乳酸菌将苹果酸转化为乳酸的途径为苹果酸-乳酸发酵(malolactic fermentation,MLF),经过MLF发酵酸感尖锐的苹果酸被降解为柔和的乳酸,是酿造优质葡萄酒的重要环节[26-28]。乳杆菌属、明串珠菌属、片球菌属、酒球菌属等葡萄酒乳酸菌可以进行MLF发酵,而其中研究较多的为酒球菌属的酒酒球菌(Oenococcus oeni)[29]。葡萄酒酿造过程中酒酒球菌MLF反应机制及影响因素见图1。
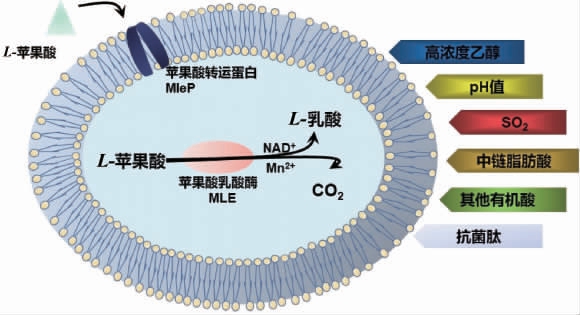
图1 葡萄酒酿造过程中酒酒球菌苹果酸-乳酸发酵机制及影响因素
Fig.1 Mechanism and influence factors of malolactic fermentation of Oenococcus oeno during wine fermentation process
由图1可知,在MLF过程中,酿酒葡萄原料中的苹果酸在苹果酸乳酸酶(malolactic enzyme,MLE)的作用下转化为乳酸,同时释放出二氧化碳。苹果酸乳酸酶为诱导酶,当苹果酸及碳源存在时,细胞内可合成苹果酸乳酸酶。MLF一般发生在乳酸菌生长的稳定期,反应过程需要有NAD+和Mn2+。一些与苹果酸结构相似的有机酸如琥珀酸、富马酸、柠檬酸和酒石酸等会与苹果酸竞争苹果酸乳酸酶的位点从而抑制和影响苹果酸乳酸发酵[30]。
葡萄酒发酵过程中较低的pH值、高乙醇含量、SO2、中链脂肪酸(medium-chain fatty acids,MCFAs)均会对MLF产生抑制。pH是影响MLF的主要因素,可为MLF提供质子梯度,并影响菌株的生长状况。当pH值为3.0~4.5时,pH值越高,MLF越容易发生。当pH值低于3.2,同时体系中有柠檬酸时,MLF则会受到抑制[31]。SO2含量过高也会抑制葡萄酒发酵过程中的MLF,一般情况下当发酵葡萄酒中总二氧化硫含量高于100mg/L,即可阻止MLF发生[32]。葡萄酒含糖量会对MLF产生影响,高鹏飞等[33]研究显示,一定含糖量能促进酒酒球菌MLF发酵作用,当葡萄酒含糖量为10 g/L时,有利于启动MLF发酵,苹果酸降解率最高。乙醇对MLF有极强的干扰作用,体系乙醇浓度升高,MLF效率降低。
2.2 非酿酒酵母苹果酸-酒精发酵机制
葡萄酒酿造过程中还可以依靠酵母菌通过苹果酸-酒精发酵(maloalcoholic fermentation,MAF)途径达到降酸的目的[34],其MAF途径见图2。
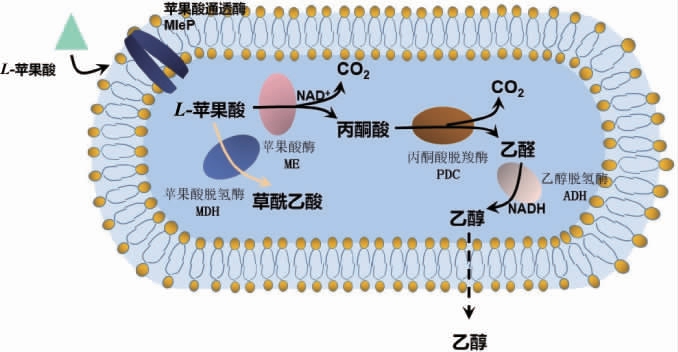
图2 裂殖酵母苹果酸酒精发酵途径
Fig.2 Pathway of maloalcoholic fermentation of Schizosaccharomyces pombe
由图2可知,裂殖酵母(Schizosaccharomyces pombe)可以利用体内的苹果酸酶(malic enzyme,ME)将苹果酸转化为丙酮酸,丙酮酸则通过乙醛途径被转化为乙醇并释放到环境中。裂殖酵母苹果酸酶位于细胞质中并具有较高的底物亲和力,编码基因mae2的编码区与不同来源的12种苹果酸酶有高度的同源性,包括苹果酸结合位点和辅酶结合位点。此外裂殖酵母还有效率极高的苹果酸转运系统。苹果酸通透酶(malate permease,MleP)是苹果酸的转运蛋白,对胞外的二元酸如苹果酸、琥珀酸、α-酮戊二酸等具有选择透过性,特别对苹果酸具有较高的偏好性。产朊假丝酵母(Candida utilis)和裂殖酵母虽然具备一定的降解苹果酸的能力,但葡萄糖对两者的调节作用有明显的差异。裂殖酵母只有在葡萄糖等碳源存在的情况下,才能有效转运并降解苹果酸。而产朊假丝酵母对苹果酸跨膜运输具有机制诱导效应并受到葡萄糖的抑制[35]。酿酒酵母的苹果酸酶只存在于线粒体中,并且缺乏有效的转运系统,因此在葡萄酒发酵过程中酿酒酵母降解苹果酸的效率较低[36]。
裂殖酵母在果酒降酸方面已经得到国际葡萄与葡萄酒组织(international organization of vine and wine,OIV)的认可,研究显示裂殖酵母可以在开始发酵4 d内完成苹果酸发酵,而此过程中产生的丙酮酸对于红葡萄酒色泽有良好的作用[37-38]。与耐热克鲁维酵母相比,裂殖酵母具有更好的定殖能力和乙醇耐受力,可以始终存在于酒精发酵过程[39]。但其在发酵过程中产生不良风味及过多的乙酸,影响了裂殖酵母在葡萄酒酿造中的应用。酿酒酵母也会通过抑制非酿酒酵母的生长和对糖的代谢,影响非酿酒酵母的降酸能力[40]。赵美等[41]研究显示,裂殖酵母与商业酿酒酵母以1 000∶1的比例接种时,酿酒酵母对裂殖酵母生长影响较弱,酒样中苹果酸可被完全降解,同时提升了酒体色泽,增加了酒体的果香和花香。
2.3 苹果酸降解过程中的主要酶系
苹果酸生物降解过程中的主要酶系如表2所示,苹果酸乳酸酶(MLE)是MLF过程中降解苹果酸的功能酶,MLE以NAD+为辅酶,Mn2+为激活剂,将L-苹果酸转变成L-乳酸[42]。乳酸乳球菌的苹果酸-乳酸酶基因(mleS)最先被克隆和表达。裂殖酵母降解苹果酸主要依赖苹果酸通透酶(malate permease,MleP)和苹果酸酶(malic enzyme,ME),二者为MAF途径的关键酶[43]。苹果酸酶可催化苹果酸氧化脱羧生成丙酮酸和CO2。苹果酸脱氢酶(malate dehydrogenase,MDH)可催化苹果酸脱氢变为草酰乙酸,不同来源的苹果酸脱氢酶在一级结构上表现出较低的相似性,其活性受反馈抑制调节,过量的草酰乙酸和还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)可强烈抑制苹果酸脱氢酶活性。
表2 苹果酸生物代谢相关酶系
Table 2 Malic acid metabolism related enzyme system

酶种类 作用 菌株 编码基因苹果酸乳酸酶催化苹果酸转化为乳酸苹果酸酶催化苹果酸转化为丙酮酸苹果酸通透酶(苹果酸转运蛋白)转运胞外苹果酸至胞内苹果酸脱氢酶催化苹果酸转化为草酰乙酸乳酸乳球菌酒酒球菌片球菌产朊假丝酵母裂殖酵母酒酒球菌乳酸乳球菌裂殖酵母裂殖酵母mleS mleA mleD cme1 mae2 mleP mleP mae1 mdh1
3 葡萄酒生物降酸发酵策略
葡萄酒发酵过程中生物降酸途径及策略如图3所示,以调节葡萄酒成品酸度,提升本土葡萄酒风味及品质。①提升苹果酸乳酸发酵中酒酒球菌的抗逆性;②采用具有降酸作用的非酿酒酵母进行混合发酵;③构建酿酒酵母工程菌加强酿造过程中苹果酸降解。
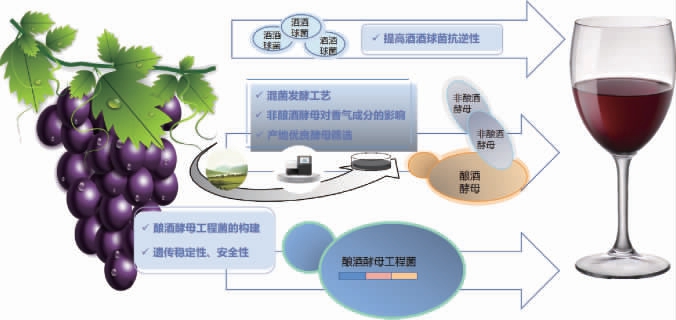
图3 葡萄酒生物降酸途径与策略
Fig.3 Pathway and strategy of biological acid reduction of wine
3.1 提高酒酒球菌抗逆性
YANG K等[44]研究显示,酸和乙醇胁迫会导致酒酒球菌热休克蛋白和应激相关基因表达加强,可以作为酒酒球菌调控pH、乙醇等环境压力的一种途径。QI Y等[45]建立了酒酒球菌基因组规模代谢网络模型以研究其酸耐受机制,研究发现,酒酒球菌可通过严谨反应(stringentresponse,SR)、丙酮酸重新分配、减弱糖酵解、增强其他碳源利用、增强核苷酸补救途径反应等应对发酵过程中的高酸环境。在葡萄酒进行苹果酸-乳酸发酵时,或者冻干制备酒酒球菌发酵剂时,可以采用发酵前给与菌株预适应、添加外源成分(谷胱甘肽、氨基酸)等方法提高酒酒球菌抗胁迫能力[46-47]。陈其玲等[48]研究了酒酒球菌耐酸胁迫能力与β-葡萄糖苷酶活性的相关性,采用离子注入诱变的方法筛选出耐酸的酒酒球菌突变菌株,菌株的β-葡萄糖苷酶活性与菌株酸胁迫能力显著相关。谢昉书等[49]对酒酒球菌突变株苹果酸-乳酸发酵能力进行了分析,研究结果表明,突变株表现出良好抗胁迫能力和苹果酸-乳酸发酵能力,当系统中乙醇含量为14%时,突变株对苹果酸的降解量可达1.49 g/L。MLF降酸途径也可以与其他降酸方法共同使用,以提高降酸效果,对葡萄酒的成分也会产生良好的作用。袁林等[50]采用混酿结合MLF发酵的方式进行降酸发酵,可有效降低公酿一号葡萄酒的酸度。
3.2 基于苹果酸-酒精发酵的混菌发酵降酸策略
梁丽红等[51]以不同比例混合接种耐热克鲁维酵母(Lachancea thermotolerans)和裂殖酵母发酵美乐葡萄酒,当二者的接种比例为105∶1时,苹果酸降解率可达70.71%。此外该接种方式可提高酒样中高级醇、中链脂肪酸乙酯、琥珀酸二乙酯和乳酸乙酯等香气物质的含量。混菌发酵时采用顺序接种策略有利于非酿酒酵母在发酵前期的高代谢表达,也可以降低不同菌株之间的拮抗作用[52]。高娉娉等[53]研究了不同接种方式对黑比诺干红葡萄酒品质的影响,裂解酵母与酿酒酵母顺序接种发酵葡萄酒,其苹果酸和组胺含量低于裂殖酵母单独接种及同时接种。顺序接种发酵还使葡萄酒中醇类、酯类和萜烯类物质增加,感官品质也优于另外两种接种方式。陈景桦等[54]研究了发酵毕赤酵母(Pichia fermentans)和酿酒酵母混合发酵葡萄酒潜力,通过延迟接种酿酒酵母来支持发酵毕赤酵母菌株的生长,能够提高产品中甘油的含量,产物中挥发酸含量最低,为0.2 g/L,且不会对葡萄酒香气产生负面影响。研究表明,泽普林假丝酵母(Candida zemplinina)、葡萄有孢汉逊酵母(Hanseniaspora uvarum)、陆生伊萨酵母(Issatchenkia terricola)等多种非酿酒酵母均具有降低苹果酸含量,调节葡萄酒有机酸平衡的作用,可应用于葡萄酒混菌发酵工艺,为葡萄酒的风味调控和品质提升提供新的策略[55-57]。
3.3 构建酿酒酵母工程菌用于葡萄酒酿造中苹果酸降解
随着对葡萄酒苹果酸代谢相关酶系研究的深入以及基因工程技术的发展,研究者可以采用将苹果酸降解相关基因导入酿酒酵母细胞中的方法,构建酿酒酵母工程菌,提升其对苹果酸降解能力,可以避免混菌发酵对葡萄酒风味的影响。BONY M等[58]应用乳酸乳球菌苹果酸乳酸酶基因(mleS)和裂殖酵母苹果酸通透酶基因(mae1)构建载体,在酿酒酵母中进行共表达,苹果酸的降解率可提高到80%。
4 结论与展望
应用生物降酸方法对葡萄酒特别是山葡萄酒生产工艺进行优化具有良好的前景,一方面可以依托独特的产地优势,筛选具有降酸作用的本土酵母,促进产区特色葡萄酒的风土表达;另一方面应对混菌发酵机制进行深入研究,建立酿酒酵母与非酵母混合发酵体系,优化混菌发酵工艺。葡萄酒生物降酸机理的研究及应用将深刻影响本土葡萄酒品质提升及高端葡萄酒产品的开发。
[1]WANG H,NI Z J,MA W P,et al.Effect of sodium sulfite,tartaric acid,tannin,and glucose on rheological properties,release of aroma compounds,and color characteristics of red wine[J].Food Sci Biotechnol,2018,28(2):395-403.
[2]MATO I,SUAREZ-LUQUE S,HUIDOBRO J F.A review of the analytical methods to determine organic acids in grape juices and wines[J].Food Res Int,2005,38(10):1175-1188.
[3]文连奎,赵薇,张微,等.果酒降酸技术研究进展[J].食品科学,2010,31(11):325-328.
[4]ALICE V.Biological demalication and deacetification of musts and wines:can wine yeasts make the wine taste better?[J].Fermentation,2017,3(4):51.
[5]LI N,WEI Y,LI X,et al.Optimization of deacidification for concentrated grape juice[J].Food Sci Nutr,2019,7(6):2050-2058.
[6]李霄雪,吴艳艳,刘行知,等.化学降酸剂处理对刺葡萄酒香气的影响[J].中国食品学报,2017,17(11):245-253.
[7] ZHONG W, LI X Y, YANG H, et al.A novel, effective, and feasible method for deacidifying kiwifruit wine by weakly basic ion exchange resins[J].J Food Process Eng,2019,42(2):e12969.
[8] REDZEPOVIC S, ORLIC S, MAJDAK A, et al.Differential malic acid degradation by selected strains of Saccharomyces during alcoholic fermentation[J].Int J Food Microbiol,2003,83(1):49-61.
[9] DROZDZ I,MAKAREWICZ M,TUSZYNSKI T.Isolation and identification of microorganisms including lactic acid bacteria and their use in microbial deacidification of wines from domestic vineyards[J].Pol J Microbiol,2013,62(3):331-334.
[10] GARDONI E,BENITO S, SCANSANI S, et al.Biological deacidification strategies for white wines[J].S Afr J Enol Vitic,2021,42(2):114-122.
[11]亓桂梅,赵艳侠,昝林生,等.世界抗寒葡萄育种成果及应用概述[J].东北农业科学,2022,47(1):108-111.
[12]牛生洋,刘崇怀,刘强,等.葡萄种质果实有机酸组分及其含量特性[J].食品科学,2022,43(12):228-234.
[13]赵玉平,杜连祥,刘丽丽,等.降解山楂汁中柠檬酸酵母菌的筛选及其降酸特性研究[J].微生物学报,2004,44(2):235-239.
[14]陈思睿,唐琳琳,冯建文,等.高效降解柠檬酸酵母菌的筛选鉴定及其在红树莓果汁中降酸特性[J].食品科学,2020,41(22):133-139.
[15]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[16]何志刚,李维新,梁璋成,等.优良降酸酿酒酵母的分离和鉴定[J].中国食品学报,2013,13(5):191-197.
[17]曹颖,郑玉娟,刘龙祥,等.葡萄酒苹果酸-乳酸发酵优良菌株的筛选与发酵性能分析[J].食品研究与开发,2021,42(11):138-144.
[18] NIKHANJ P, KOCHER G S.Optimization of malolactic fermentation parameters with isolated and characterized lactic acid bacteria associated with grape berries[J].J Food Process Pres,2020,44(12):e14905.
[19]郝爱玲,冯莉,秦义,等.降解柠檬酸酵母菌的筛选及其发酵性能研究[J].中国食品学报,2018,18(11):72-80.
[20] ZHONG W, CHEN T, YANG H, et al.Isolation and selection of non-Saccharomyces yeasts being capable of degrading citric acid and evaluation its effect on kiwifruit wine fermentation[J].Fermentation,2020,6(1):25.
[21] DEL MONACO S M, BARDA N B, RUBIO N C, et al.Selection and characterization of a Patagonian Pichia kudriavzevii for wine deacidification[J].J Appl Microbiol,2014,117(2):451-464.
[22]朱佳娜,王英,李思睿,等.自然发酵黑莓果酒中降酸酵母的筛选与鉴定[J].中国食品学报,2012,12(10):182-187.
[23]卢思言,曾祥玉,王鑫源,等.蓝靛果中可降解有机酸的酵母菌株筛选及鉴定[J].食品工业科技,2021,42(20):126-133.
[24]吴曼毓,蒋海芹,贺阳,等.山葡萄有机酸降解菌的筛选、分离及鉴定[J].食品研究与开发,2020,41(23):199-205.
[25]文连奎,张俊艳,赵薇,等.酒石酸降解菌的筛选及鉴定[J].食品科学,2011,32(3):134-137.
[26] LERM E, ENGELBRECHT L, DU TOIT M.Malolactic fermentation:the ABC's of MLF[J].S Afr J Enol Vitic,2010,31(2):186-212.
[27]LASIK M.The application of malolactic fermentation process to create good-quality grape wine produced in cool-climate countries:a review[J].Eur Food Res Technol,2013,237(6):843-850.
[28] MENDES FERREIRA A, MENDES-FAIA A.The role of yeasts and lactic acid bacteria on the metabolism of organic acids during winemaking[J].Foods,2020,9(9):1231.
[29]BALMASEDA A,BORDONS A,REGUANT C,et al.Non-Saccharomyces in wine: effect upon Oenococcus oeni and malolactic fermentation[J].Front Microbiol,2018,9:534.
[30]SON H S,HWANG G S,PARK W M,et al.Metabolomic characterization of malolactic fermentation and fermentative behaviors of wine yeasts in grape wine[J].J Agr Food Chem,2009,57(11):4801-4809.
[31]康毅,刘树文.苹果酸-乳酸发酵过程酒酒球菌碳源代谢分析研究进展[J].食品科学,2012,33(19):326-330.
[32]REGUANT C,CARRETE R,CONSTANTI M,et al.Population dynamics of Oenococcus oeni strains in a new winery and the effect of SO2 and yeast strain[J].FEMS Microbiol Lett,2005,246(1):111-117.
[33]高鹏飞,丁玉萍,刘东旭,等.工艺条件对寒地山葡萄酒生物降酸的影响探究[J].中国酿造,2016,35(12):90-93.
[34] VOLSCHENK H, VAN VUUREN H J, VILJOEN-BLOOM M.Maloethanolic fermentation in Saccharomyces and Schizosaccharomyces[J].Curr Genet,2003,43(6):379-391.
[35]黄鹭强,张丽萍,雷秀清,等.粟酒裂殖酵母mae1基因的克隆及其在产朊假丝酵母中的整合表达[J].福建农林大学学报(自然科学版),2012,41(5):513-517.
[36] LOIRA I, MORATA A, PALOMERO F, et al.Schizosaccharomyces pombe: a promising biotechnology to modulate wine composition[J].Fermentation,2018,4(3):70.
[37]MYLONA A E,FRESNO J M D,PALOMERO F,et al.Use of Schizosaccharomyces,strains for wine fermentation-effect on the wine composition and food safety[J].Int J Food Microbiol,2016,232:63-72.
[38] BENITO S, PALOMERO F, MORATA A, et al.New applications for Schizosaccharomyces pombe in the alcoholic fermentation of red wines[J].Int J Food Sci Technol,2012,47(10):2101-2108.
[39]BENITO Á,CALDERON F,PALOMERO F,et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules,2015,20(6):9510-9523.
[40]BRANCO P,VIANA T,ALBERGARIA H,et al.Antimicrobial peptides(AMPs)produced by Saccharomyces cerevisiae induce alterations in the intracellular pH,membrane permeability and culturability of Hanseniaspora guilliermondii cells[J].Int J Food Microbiol,2015,205:112-118.
[41]赵美,田秀,李敏,等.粟酒裂殖酵母与酿酒酵母共同接种发酵对‘黑比诺’干红葡萄酒品质的影响[J].食品科学,2021,42(24):108-116.
[42] SUMBY K M, BARTLE L, GRBIN P R, et al.Measures to improve wine malolactic fermentation[J].Appl Microbiol Biotechnol,2019,103(5):2033-2051.
[43]SUBDEN R E, KRIZUS A, OSOTHSILP C, et al.Mutational analysis of malate pathways in Schizosaccharomyces pombe[J].Food Res Int,1998,31(1):37-42.
[44]YANG K,DAI X,FAN M,et al.Influences of acid and ethanol stresses on Oenococcus oeni SD-2a and its proteomic and transcriptional responses[J].J Sci Food Agr,2021,101(7):2892-2900.
[45]QI Y,WANG H,CHEN X,et al.Altered metabolic strategies:elaborate mechanisms adopted by Oenococcus oeni in response to acid stress[J].J Agr Food Chem,2021,69(9):2906-2918.
[46]MARGALEF-CATALA M,ARAQUE I,WEIDMANN S,et al.Protective role of glutathione addition against wine-related stress in Oenococcus oeni[J].Food Res Int,2016,90:8-15.
[47] YANG K, ZHU Y, QI Y, et al.Analysis of proteomic responses of freeze-dried Oenococcus oeni to access the molecular mechanism of acid acclimation on cell freeze-drying resistance[J].Food Chem,2019,285:441-449.
[48]陈其玲,任晓宁,王玲,等.酒酒球菌β-葡萄糖苷酶活性与耐酸胁迫能力的相关性分析[J].食品科学,2017,38(2):115-120.
[49]谢昉书,文向圆,刘树文.酒酒球菌(Oenococcus oeni)耐酸突变株苹果酸-乳酸发酵能力分析[J].食品科学,2019,40(2):93-101.
[50]袁林,赵红玉,李华,等.公酿一号混酿葡萄酒降酸效果及多酚组分评价[J].食品与发酵工业,2019,45(23):66-72.
[51]梁丽红,高娉娉,张馨文,等.优选本土非酿酒酵母混合发酵在干红葡萄酒中的应用潜力分析[J].食品与发酵工业,2022,48(14):118-124,130.
[52]RENAULT P,COULON J,MOINE V,et al.Enhanced 3-sulfanylhexan-1-ol production in sequential mixed fermentation with Torulaspora delbrueckii/Saccharomyces cerevisiae reveals a situation of synergistic interaction between two industrial strains[J].Front Microbiol,2016,7:293.
[53]高娉娉,温华婷,赵美,等.粟酒裂殖酵母接种方式对黑比诺干红葡萄酒品质的影响[J].浙江农业学报,2021,33(12):2397-2405.
[54]陈景桦,马小琛,李婷,等.优选发酵毕赤酵母与酿酒酵母混合发酵的葡萄酒酿造应用潜力[J].食品科学技术学报,2018,36(5):26-34.
[55]APONTE M,BLAIOTTA G.Potential role of yeast strains isolated from grapes in the production of Taurasi DOCG[J].Front Microbiol,2016,27(7):809.
[56]GE Q,GUO C,YAN Y,et al.Contribution of non-Saccharomyces yeasts to aroma-active compound production,phenolic composition and sensory profile in Chinese Vidal icewine[J].Food Biosci,2021,46:101152.
[57] SHI W K, WANG J, CHEN F S, et al.Effect of Issatchenkia terricola and Pichia kudriavzevii on wine flavor and quality through simultaneous and sequential co-fermentation with Saccharomyces cerevisiae[J].LWT-Food Sci Technol,2019,116:108477.
[58] BONY M, BIDART F, CAMARASA C, et al.Metabolic analysis of S.cerevisiae strains engineered for malolactic fermentation[J].FEBS Lett,1997,410(2-3):452-456.