龋病已被世界卫生组织(world health organization,WHO)认定为影响人类健康的第三大疾病[1]。细菌黏附在牙齿表面形成牙菌斑后,在适宜温度下发酵产酸而破坏牙釉质形成龋齿[2]。变异链球菌(Streptococcus mutans)是引起龋齿的主要病原菌[3]。它能够引起口腔微环境酸化,同时适应微酸性口腔环境,抑制口腔微生态系统中其他共生菌的活力[4]。同时,酸化的口腔微环境会使牙齿中的钙和磷酸盐释放到唾液中,破坏牙体结构[5]。
植物性化学成分是预防龋药物研究开发的重要来源。本文对变异链球菌生物被膜的形成机制进行综述,并以此为基础,综述黄酮、多酚、萜类等植物性化学成分对生物被膜的抑制作用,旨在为开发预防口腔疾病的功能性食品提供理论参考。
1 变异链球菌生物被膜的形成机制
变异链球菌(Streptococcus mutans)在宿主表面的初始黏附是形成生物被膜的关键步骤。细菌黏附主要分为可逆性和不可逆性黏附两个阶段。可逆性黏附主要依靠非特异性相互作用,如:范德华力、静电(双电层)作用、疏水、亲水及渗透作用[6]。在不可逆性黏附阶段,菌体分泌的Ag I/II、SpaP、SrtA等表面黏附蛋白特异性识别菌体表面的糖蛋白、糖脂等,与菌毛、鞭毛等发生特异性黏附[7-8]。同时,随着不可逆作用力逐渐增强,菌体感知信号分子后以信号转导的方式激活生物被膜调控基因的表达。这样菌体可快速改变生理特征,以适应环境变化。已知致龋相关信号转导途径有:双组分信号传导系统(two-component signal transduction system,TCS)[9]、LuxS/2型自诱导物(autoinducer-2,AI-2)介导的群体感应(quorum sensing,QS)系统[10]、第二信使分子环二腺苷酸(cyclic diadenosine monophosphate,c-di-AMP)[11]。完成初始黏附后,菌体利用丙氨酸消旋酶(alanine racemase,Alr)[12]、粘性蛋白[13]、糖基转移酶等合成水不溶性胞外多糖(exopolysaccharides,EPS)、蛋白质等胞外基质。生物被膜的形成机制涉及多层次多方面,目前且尚未形成完整体系。
1.1 变异链球菌生物被膜的主要成分及功能
1.1.1 胞外多糖
胞外多糖(EPS)是生物被膜的主要成分。葡萄糖基转移酶(glucosyltransferase,Gtf)和果糖基转移酶(transfructosylase,Ftf)利用蔗糖分别合成葡聚糖和果聚糖。葡聚糖富含α-1,3-糖苷键、α-1,6-糖苷键和β-1,6-糖苷键。其中,GtfB合成的水不溶性葡聚糖以α-1,3-糖苷键连接,GtfD合成的水溶性葡聚糖以α-1,6-糖苷键连接[14]。果聚糖是由Ftf合成,富含β-2,6-糖苷键。GtfB、GtfD和Ftf分别是由gtfB、gtfD、ftf基因编码产生的蛋白质。EPS的产生很大程度依赖QS系统,并受c-di-GMP信号通路协调影响[15]。
1.1.2 蛋白质
生物被膜中的蛋白质可分为菌体表面基质蛋白和分泌到胞外的蛋白组分。表面基质蛋白主要有鞭毛、Ⅳ型菌毛和功能性淀粉样蛋白等菌体表面附属物[16-17]。细胞表面附属物通过影响细菌运动和固体表面附着,调节细菌黏附、机械稳定性和群体感应等功能[18]。胞外蛋白是具有调节生物被膜弹性功能的葡聚糖结合蛋白(glucan binding protein,Gbp)家族[19]。S.mutans的Gbp类蛋白控制菌的黏附力,促进生物被膜的弹性。蛋白酶K可降解Gbp蛋白达到破坏生物被膜的立体结构的效果[20-21]。EPS与胞外蛋白基质结合能为生物被膜的生长提供支架,维持结构稳定性。
1.2 变异链球菌生物被膜的调控机制
1.2.1 表面蛋白介导的黏附过程
表面蛋白是细胞壁上主要的黏结蛋白之一,介导牙面初始黏附(非蔗糖依赖性黏附)和菌体的聚集,具有良好的免疫原性。许多表面黏附蛋白都需要一个含有保守的分选信号LPXTG序列,具体黏附过程见图1[22]。
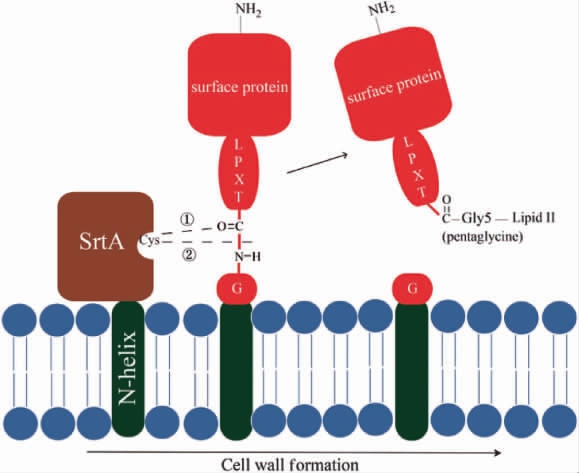
图1 表面蛋白黏附过程(SrtA酶)
Fig.1 Process of surface protein adhesion (SrtA enzyme)
表面蛋白催化苏氨酸和甘氨酸处断裂,同时SrtA酶中保守的半胱氨酸与苏氨酸形成硫醚连接。暴露的苏氨酸的羟基端与细胞壁前体(脂质Ⅱ)结构上的甘氨酸形成酰胺连接,然后经过转糖基反应和转肽反应形成成熟的肽聚糖,细胞壁达到成熟,表面蛋白即被共价连接到细胞壁上。S.mutans固定在牙齿表面的Ag I/II、P1和SpaP。表面黏附蛋白不仅在菌体初始黏附中起作用、参与生物被膜的形成,还与唾液中的糖蛋白相互作用、促进血小板凝集,使细菌侵入牙釉质引起龋齿[23]。
1.2.2 双组分调控系统
双组分信号传导系统(TCS)作为细菌感应外界环境变化和调节内部基因表达的分子开关,对于调控在牙齿上的附着能力以及后期牙菌斑的形成有着至关重要的作用。TCS是由1个组氨酸蛋白激酶(histidine protein kinase,HK)和1个反应调控蛋白(response regulator,RR)组成。S.mutans的TCS研究主要集中在ComDE、VicRK[24]、CiaRH[25]系统见图2[26-27]。
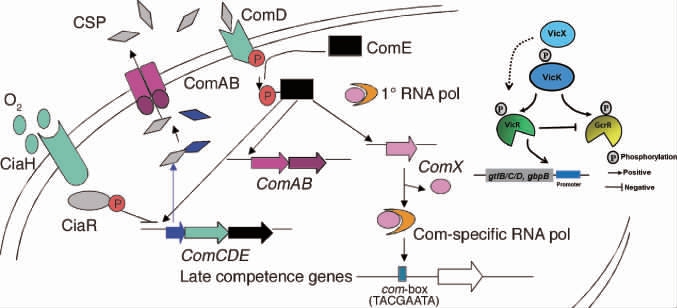
图2 双组分调控系统
Fig.2 Two-component regulatory system
S.mutans的com基因家族由comA、comB、comC、comD、comE、comX构成,这些基因及基因产物构成了一个由感受态刺激肽(competence stimulating peptide,CSP)介导的ComDE信号系统。HK蛋白ComD感应外界环境中CSP后,先发生自磷酸化形成同源二聚体,然后将磷酸根转移至RR蛋白ComE。磷酸化后的ComE能够作用于转录调节子ComCDE、ComAB和ComX,进而直接激活调控gtfB、gtfC、gtfD和ftf的转录。VicRK系统由vicR、vicK、vicX等基因组成:vicK编码HK,vicR编码胞内RR,而vicX则编码可能参与VicRK系统的调控辅助蛋白。VicK蛋白上的PAS结构域感应外界氧气、张力和菌体内部氧化还原电势的变化,以磷酸化的形式传递给VicR。磷酸化后的VicR能够直接调节gtfB、gtfC、gtfD、gbpB等基因表达[28]。这是由于CiaH具有结合钙、氧气的结构域,CiaRH系统是细菌感受氧气变化的主要途径。CiaH感受环境变化后使膜内CiaR磷酸化,抑制ComCDE的活性,菌体自身合成的CSP减少,菌体繁殖能力增加。随着菌体氧气逐渐消耗,CiaRH对ComCDE的抑制作用减弱,菌体自身合成CSP的能力恢复,被ComD感受后又会作用于ComCDE系统。此外,ciaR、ciaH和ciaX等基因构成的ciaRH操纵子在链球菌种中具有高度保守性[29],这一发现揭示了CiaRH系统的调控机制具有普适性。
1.2.3 LuxS/AI-2群体感应系统
AI-2是一类呋喃酰硼酸二酯,其合成主要依赖于在细菌中的保守序列luxS基因编码的S-核糖同型半胱氨酸酶(S-ribosylhomocysteinase,LuxS),其来源于活化甲基循环(activated methyl cycle,AMC)的代谢产物。S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)经AMC形成中间产物S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH)。然后,由5'-腺苷高半胱氨酸核苷酸酶(Pfs)催化SAH生成S-核糖基同型半胱氨酸(S-ribosylhomocysteine,SRH)。LuxS催化SRH中硫醚键的裂解,生成同型半胱氨酸和AI-2信号分子前体物4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)。DPD通过自身环化重排作用生成AI-2信号分子。而同型半胱氨酸经过反应生成新的SAM,进入新一轮循环。因此,以信号分子AI-2进行密度感应也被称为LuxS/AI-2群体感应系统(图3[30-31])。
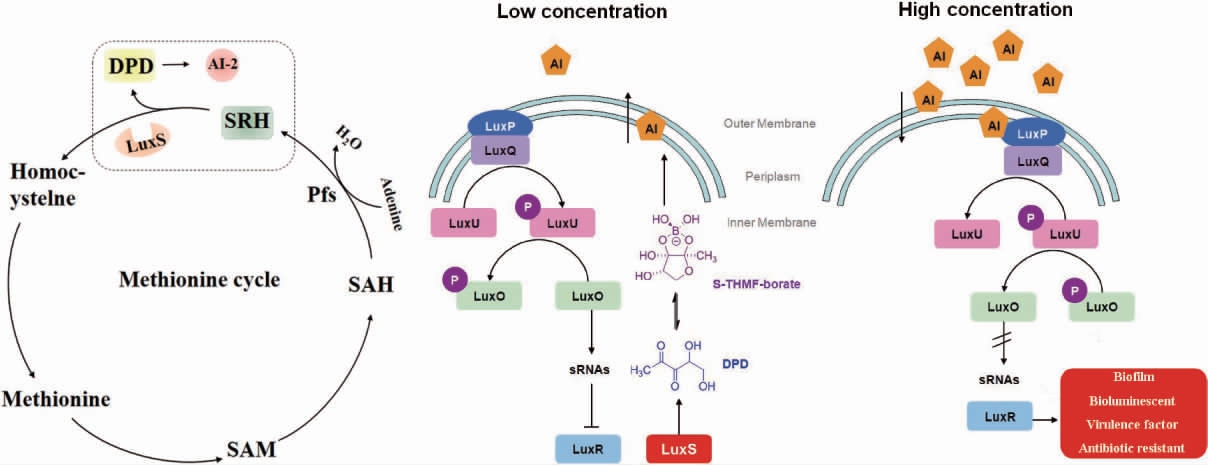
图3 LuxS/AI-2群体感应系统
Fig.3 LuxS/AI-2 quorum sensing system
菌体有自身的AI-2识别机制,细胞膜上LuxP感受环境中的AI-2浓度。当AI-2浓度较低时,LuxQ蛋白自磷酸化,并传递给LuxU一个磷酸基团,LuxU继续将其传递给效应蛋白LuxO,磷酸化的LuxO激活小核糖核酸(small ribonucleic acid,sRNA)的表达,抑制LuxR并促进LuxS的表达,使菌体AI-2信号分子产量提高;当环境中AI-2浓度较高时,磷酸酶LuxQ反向传递磷酸基团,sRNA的活性受到抑制,促进LuxR表达,从而激活毒力基因的转录。
菌体不仅能够利用自身合成的AI-2,也可利用外源添加的AI-2。例如:表兄链球菌(Streptococcus sobrinus)产生的AI-2抑制S.mutans的gbpC和dblB基因表达量,诱导蔗糖依赖性黏附[32]。因此,外源添加AI-2也是调控生物被膜的有效途径。
1.2.4 胞内第二信使转导通路
胞内第二信使分子环二腺苷酸(c-di-AMP)和环二鸟苷酸(cyclic-diguanylate,c-di-GMP)调控生物被膜的研究是近年来的研究热点。在初始黏附阶段,c-di-GMP调节鞭毛的合成、控制鞭毛转动速度、调节gtfB基因的表达,促进菌体表面黏附[33-34]。第二信使转导通路的关键蛋白是近年来计算机辅助虚拟筛选开发新型生物被膜抑制剂的新靶点。
2 植物性化学成分对变异链球菌生物被膜的抑制作用机制研究
已发现的抑制S.mutans生物被膜的植物性化学成分主要有生物碱、环状化合物、酚类化合物及其衍生物、萜类及其衍生物4大类。其中,酚类化合物及其衍生物结构多样、种类众多,可分为黄酮类、酚酸类、苯乙醇类、苯丙烷类、醌类、单宁类、氧杂蒽酮类等细类。这些不同类型的化合物具有不同化学结构,这决定了它们抑制生物被膜功效和机制上的差异,具体见表1。
表1 植物化学成分对变异链球菌生物被膜的抑制作用研究
Table 1 Inhibition of Streptococcus mutans biofilms by phytochemicals
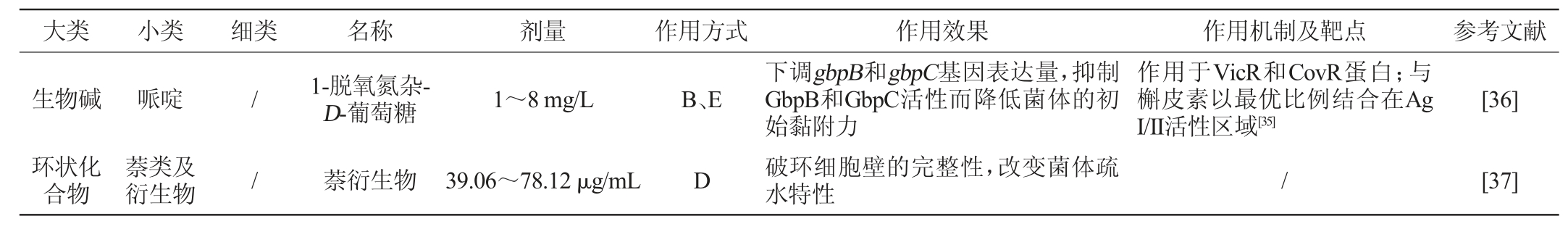
大类 小类 细类 名称 剂量 作用方式 作用效果 作用机制及靶点 参考文献生物碱环状化合物哌啶萘类及衍生物//1-脱氧氮杂-D-葡萄糖1~8 mg/L萘衍生物39.06~78.12 μg/mL B、E D下调gbpB和gbpC基因表达量,抑制GbpB和GbpC活性而降低菌体的初始黏附力破环细胞壁的完整性,改变菌体疏水特性作用于VicR和CovR蛋白;与槲皮素以最优比例结合在Ag I/II活性区域[35]/[36][37]
续表

注:A:抑制糖基转移酶活性;B:结合表面蛋白;C:抑菌;D:改善菌体表面特性;E:群体感应。“/”:未知。
大类 小类 细类 名称 剂量 作用方式 作用效果 作用机制及靶点 参考文献查尔酮类黄酮醇黄酮类查尔酮儿茶素芹菜素5~500 μmol/L 1.95~1 000 μg/mL 1.33 mmol/L B C A抑制生物被膜破环菌体细胞壁结构,抑制生物被膜的初始黏附阶段生物被膜中的菌体数量和胞外多糖产量降低;葡萄糖基转移酶和果糖基转移酶活性降低通过与Sortase H139A酶活性位点上的半胱氨酸形成迈克尔加成反应,减少表面蛋白的黏附/糖基转移酶[38][39][40]黄酮类酚类化合物及其衍生物酚酸类苯乙醇类苯丙烷(素)类醌类1.5 mg/mL 0.007 8~2 mg/mL黄烷酮60.7 μg/mL 60.2 μg/mL 30 μmol/L 35.9 μmol/L木脂素类37.3 μmol/L// / / / / / / / / / /槲皮素槲皮素-3-O-阿拉伯糖苷山奈酚-3-芸香糖甙异鼠李素-3-O-β-芸香糖苷桑黄素二氢赤藓醇去氢二松柏醇9'-O-β-D-吡喃葡萄没食子酸没食子酸甲基酯水杨酸3-甲基戊二酰-β-吡喃葡萄糖苷红景天苷咖啡酸绿原酸0.062 5~8 mg/mL 0.062 5~4 mg/mL 3.8 mg/mL 92.4~96.2 μg/mL// /肉桂醛100 μmol/L迷迭香酸姜黄素大黄素金丝桃素20.1 μmol/L 15 μmol/L 0.1~5 μg/mL 5 μg/mL A、B C A/C、E E E B葡萄糖基转移酶、果糖基转移酶和表面蛋白Pac的活性降低抑菌功效菌体运动性、代谢活力降低;葡萄糖基转移酶、果糖基转移酶活性降低清除生物被膜破坏菌体细胞膜,降低菌体代谢活力;破坏生物被膜立体结构而清除生物被膜抑制生物被膜抑制生物被膜清除生物被膜葡萄糖基转移酶、果糖基转移酶、表面蛋白Pac/糖基转移酶/理论计算方法推测这几种化合物可作用于细胞膜上感受蛋白[50]作用于LuxS相关的群体感应系统,与LuxR结合,启动毒力因子的表达,提高对环境压力的适应性/分子间作用力:嵌入细胞膜磷脂双分子层,影响碳氢链与磷脂双分子层的范德华力,解离非磷脂双分子层结构[41][42][43][44][45][46][47][48][49][51-52][53][54-55][56][57-58][59]萜类及其衍生物单宁类氧杂蒽酮二萜类倍半萜类// / / / /单宁酸原花青素α-倒捻子素异贝壳杉烯酸黄姜根醇金合欢醇0.4 mg/mL 0.5~1.5 mg/mL 150 μmol/L 3~4 μg/mL 14.5~125 μg/mL 0.25~1.33 mmol/L A C、E ADDC抑制生物被膜影响菌体抗逆性相关基因的表达清除生物被膜改变菌体的黏附能力和产酸能力改变菌体的黏附能力和产酸能力抑菌作用糖基转移酶糖酵解途径// / /[60][61-63][64][65][66][67-68]
2.1 不同种类的植物化学成分对生物被膜的抑制机制
哌啶的氨基咪唑类结构可作用于comDE、gtfC基因,影响QS系统的信号级联反应[69]。例如:1-脱氧氮杂-D-葡萄糖、槲皮苷均可降低S.mutans表面蛋白Ag I/II或Spa P的产量、抑制EPS产生。
黄酮类是具有二苯基丙烷(C6-C3-C6)骨架的一系列化合物,包括查尔酮、橙酮、黄烷酮、黄酮、异黄酮、二氢黄酮醇、花色苷和原花色素等。黄酮类物质对初期黏附阶段的生物被膜具有抑制糖基转移酶活力、破坏细胞壁结构、结合黏附作用的菌体表面蛋白等功效。例如:儿茶素的抑菌作用、查尔酮的抑制表面蛋白黏附功能、芹菜素抑制糖基转移酶活力、黄烷酮类物质具有抗表面蛋白黏附和抑制EPS产量双重功效。
酚酸类对生物被膜具有抑制效果但不具有清除效果,其对生物被膜的抑制作用体现在抑菌和抑制糖基转移酶活力两方面。如酚酸类物质能穿过生物被膜影响菌体代谢活力。水杨酸等酚酸类物质能降低GtfB酶活性,抑制EPS的产生。
苯丙素类物质对初始黏附到成熟阶段的生物被膜均具有抑制作用。如咖啡酸、绿原酸在初始黏附阶段能够改变菌体渗透压、破环细胞膜、降低菌体代谢活力;在生物被膜形成阶段,肉桂醛可以与LuxS/AI2型群体感应关键蛋白LuxR结合,抑制生物被膜的形成[70]。对于已经形成的成熟生物被膜,绿原酸能够有效破坏生物被膜的立体结构。一些苯丙素类物质还能与LuxR结合、干扰QS系统相关基因的表达、阻断信号分子与受体蛋白结合[71]。例如:姜黄素能下调QS系统中comC、comD和comE的表达量,同时降低EPS和QS信号分子产量[72-73]。
萜烯是由小的异戊二烯单元(5个碳的结构)组成的碳氢化合物,通过相互连接而形成的链状结构。萜类化合物通常按分子中异戊二烯单元的数量进行分类。随着萜类及其衍生物的功能性和营养价值得到不断证实,萜类及其衍生物成为未来食品关注的新热点。抑制生物被膜方面,一些二萜类和倍半萜类能改变菌体表面特性、降低菌体黏附能力。例如:金合欢醇抑制S.mutans菌体生长;异贝壳杉烯酸和黄姜根醇改变菌体的黏附能力和产酸能力。另外,大麻中的萜烯类物质不仅抑制S.mutans菌体生长,还能抑制gbpB及vicR和wapA(决定生物被膜结构相关基因)的表达。
2.2 功效成分挖掘策略
通过组学分析和理论计算两种方式进行功效成分挖掘。基于不同极性提取物的差异组学可以明确荷叶提取物的降尿酸的功效来自于类黄酮、生物碱和类黄酮的交互作用,通过缺失和重组实验可进一步明确功效化合物[74]。基于超高效液相色谱串联四级杆轨道阱质谱(ultra high liquid chromatography-Q-Exactive Orbitrap-mass spectrum,UHPLCQ-Exactive Orbitrap-MS)分析白花秦艽的化学成分,利用网络药理学进一步筛选影响PTGS2和肿瘤坏死因子(tumor necrosis factor,TNF)靶点的功效成分[75]。采用理论计算的技术从植物性成分中筛选群体感应系统抑制物(quorum sensing inhibitors,QSI)近年来被广泛应用于食品、水产、口腔治疗领域。丁婷[76]以假单胞菌(Pseudomonas)的LuxI和LuxR蛋白为靶点,从传统中药数据库中虚拟筛选出苯甲醇作为群体感应抑制剂,结合实验证实苯甲醇确实具有抑制生物被膜的效果。
3 结论与展望
抑制生物被膜的植物性化学成分种类多样,具有多层面、多靶点的优势。已发现的这些成分抑制生物被膜的机制包括:抑制菌体生长、破坏菌体细菌膜结构和功能、改变菌体表面特性、抑制糖基转移酶活力、作为群体感应抑制剂、破坏生物被膜结构的分子间作用力。另外,生物被膜形成机制复杂,仍然需要不断挖掘靶点蛋白。例如:生物被膜的初始黏附阶段主要受细菌膜表面蛋白和微环境的电位、pH、离子强度等因素影响。形成生物被膜后受到双组分调控系统、群体感应调控系统、二级信使转导通路等调控。这就导致了虽然植物性化学成分的杀菌、抑菌效果广受关注,抑制生物被膜的研究仍处于起步阶段。
虽然植物化学成分替代抗生素预防龋齿以及促进口腔健康的研究不断有新突破,但已发现的抑制生物被膜的成分较多,而清除生物被膜功效的成分很少。目前仅发现绿原酸、氧杂蒽酮等极少数成分具有清除生物被膜功效;这些成分对生物被膜的抑制作用研究仅集中在有效成分的筛选和功效确认,关于作用机制、作用靶点鲜有研究;虽然利用基因敲除技术可以明确植物性成分上调或下调哪些关键基因的表达量,但这些成分调控细菌生物被膜的分子机制不明。
筛选抗S.mutans生物被膜功效的植物性化学成分不仅有助于改善龋齿相关问题,也能挖掘更多植物性原料的新功效,解析已知功效性原料的物质基础。
[1]谢周杰,张昭,刘力伟,等.变形链球菌中的次级代谢产物及其在口腔生物被膜中的生态功能[J].生物工程学报,2017,33(9):1547-1554.
[2]BANAS J A.Virulence properties of Streptococcus mutans[J].Front Biosci-Landmrk,2004,9:1267-1277.
[3] FAKHRUDDIN K S, NGO H C, SAMARANAYAKE L P.Cariogenic microbiome and microbiota of the early primary dentition:A contemporary overview[J].Oral Dis,2019,25(4):982-995.
[4]LAMONT R J,KOO H,HAJISHENGALLIS G.The oral microbiota:dynamic communities and host interactions[J].Nat Rev Microbiol, 2018,16(12):745-759.
[5]CHEN X Q,DALIRI E B M,TYAGI A,et al.Cariogenic biofilm:Pathology-related phenotypes and targeted therapy[J].Microorganisms, 2021,9(6):1311.
[6]MUZAMIL A R,GUPTA K,MANDAL M.Microbial biofilm:formation,architecture,antibiotic resistance,and control strategies[J].Braz J Microbiol,2021,52(4):1701-1718.
[7]PUJA Y,VERMA S,BAUER R,et al.Deciphering streptococcal biofilms[J].Microorganisms,2020,8(11):1835.
[8] MATSUMOTO-NAKANO M.Role of Streptococcus mutans surface proteins for biofilm formation[J].Jpn Dent Sci Rev,2018,54(1):22-29.
[9]YUAN H L,LE Y J,GUO Z,et al.The role and regulatory network of the CiaRH two-component system in streptococcal species[J].Front Microbiol,2021,12:693858.
[10] YUAN K Y, HOU L L, JIN Q Q, et al.Comparative transcriptomics analysis of Streptococcus mutans with disruption of LuxS/AI-2 quorum sensing and recovery of methyl cycle[J].Arch Oral Biol, 2021, 127:105137.
[11] PENG X,ZHANG Y,BAI G C, et al.C-di-AMP mediates biofilm formation[J].Mol Microbiol,2016,99(5):945-959.
[12] LIU S Y, WEI Y, ZHOU X, et al.Function of alanine racemase in the physiological activity and cariogenicity of Streptococcus mutans[J].Sci Rep,2018,8:5984.
[13]WERLANG C A,CHEN W G,AOKI K,et al.Mucin O-glycans suppress quorum-sensing pathways and genetic transformation in Streptococcus mutans[J].Nat Microbiol,2021,6(5):574-582.
[14]TOMONORI H,TAKU F.The findings of glucosyltransferase enzymes derived from oral streptococci[J].Jpn Dent Sci Rev,2022,58:328-335.
[15]马悦,吴梦洁,李卓思,等.食品接触表面生物被膜形成机制及防控方法研究进展[J].食品科学,2023,44(7):276-285.
[16] CHEN D R, CAO Y N, YU L X, et al.Characteristics and influencing factors of amyloid fibers in S.mutans biofilm[J].Amb Expr,2019,31:1-9.
[17] ANA L B B, SEBASTIAN O, MOMIN H, et al.Enhanced purification coupled with biophysical analyses shows cross-β structure as a core building block for Streptococcus mutans functional amyloids[J].Sci Rep,2020,10:5138.
[18]刘静聪,方金玉,朱军莉.细菌生物被膜基质的研究进展[J].微生物学报,2022,62(1):47-56.
[19]SENADHEERA M D,GUGGENHEIM B,SPATAFORA G A,et al.A VicRK signal transduction system in Streptococcus mutans affects gtf-BCD, gbpB, and ftf expression, biofilm formation, and genetic competence development[J].J Bacteriol,2005,187(12):4064-4076.
[20] CHEN R R, DU M Q, LIU C.Strategies for dispersion of cariogenic biofilms:applications and mechanisms[J].Front Microbiol,2022,13:1-12.
[21]云莉,倪雅丽.茴香醛对变异链球菌的抗菌活性和抗生物被膜活性[J].热带生物学报,2022,13(6):614-621.
[22]LUO H,LIANG D F,BAO M Y,et al.In silico identification of potential inhibitors targeting Streptococcus mutans sortase A[J].Int J Oral Sci,2017,9(1):53-62.
[23]郑赛男,蒋丽,李伟.口腔细菌黏附机制的研究进展[J].国际口腔医学杂志,2016,43(2):223-227.
[24]WANG S,LONG L,YANG X,et al.Dissecting the role of VicK phosphatase in aggregation and biofilm formation of Streptococcus mutans[J].J Dent Res,2021,100(6):631-638.
[25]MOSTERDC,MOINEAUS,GALES AC.Primed CRISPR-Casadaptation and impaired phage adsorption in Streptococcus mutans[J].Msphere,6(3),DOI:10.1128/mSphere.00185-21.
[26] LEI L, LONG L, YANG X, et al.The VicRK two-component system regulates Streptococcus mutans virulence[J].Curr Iss Mol Biol,2019,32:167-200.
[27] CVITKOVITCH D G,LI Y,ELLEN R P.Quorum sensing and biofilm formation in streptococcal infections[J].J Clin Invest,2003,112(11):1626-1632.
[28]STIPP R N,BOISVERT H,SMITH D J,et al.CovR and VicRK regulate cell surface biogenesis genes required for biofilm formation in Streptococcus mutans[J].Plos One,2013,8(3):58271.
[29]HE L,LE Y,GUO Z,et al.The role and regulatory network of the CiaRH two-component system in streptococcal species[J].Front Microbiol,2021,12:693858.
[30] LIU Z, ZHANG L, WANG J, et al.Virtual screening and biological evaluation of anti-biofilm agents targeting LuxS in the quorum sensing system[J].Nat Prod Commun,2021,16(6):1-10.
[31] LI J, FAN Q, JIN M, et al.Paeoniflorin reduce luxS/AI-2 system-controlled biofilm formation and virulence in Streptococcus suis[J].Virulence,2021,12(1):3062-3073.
[32]刘蕾,桂萌,武瑞赟.LuxS/AI-2型群体感应系统调控细菌生物被膜形成研究进展[J].食品科学,2016,37(19):254-262.
[33]熊儒恒,阎俊,谢晶.生物被膜初始粘附调控机制研究进展及其在食品品质控制中应用[J].食品科学,2023,44(13):203-215.
[34] DIEGO O S,REGINE H.A c-di-GMP-based switch controls local heterogeneity of extracellular matrix synthesis which is crucial for integrity and morphogenesis of Escherichia coli macrocolony biofilms[J].J Mol Biol,2019,431(23):4775-4793.
[35] ISLAM B, SHAHPER N K, IRFANUL H, et al.Novel anti-adherence activity of mulberry leaves: inhibition of Streptococcus mutans biofilm by 1-deoxynojirimycin isolated from Morus alba[J].J Antimicrob Chemoth,2008,62(4):751-757.
[36] HASAN S, KUNAL S, MOHD D, et al.Inhibition of major virulence pathways of Streptococcus mutans by quercitrin and deoxynojirimycin:A synergistic approach of infection control[J].Plos One, 2014, 9(3):91736.
[37]KHAN R,ZAKIR M,KHANAM Z,et al.Novel compound from Trachyspermum ammi(Ajowan caraway)seeds with antibiofilm and antiadherence activities against Streptococcus mutans: a potential chemotherapeutic agent against dental caries[J].J Appl Microbiol, 2010, 109(6):2151-2159.
[38] DAYNEA J, RICHARDS W, WRIGHT M, et al.Molecular basis of Streptococcus mutans sortase A inhibition by the flavonoid natural product trans-chalcone[J].Chem Commun,2015,51:10483-10485.
[39]XIN X,ZHOU X D,WU C D.Tea catechin epigallocatechin gallate inhibits Streptococcus mutans biofilm formation by suppressing gtf genes[J].Arch Oral Biol,2012,57(6):678-683.
[40]SILVA L N,ZIMMER K R,MACEDO A J,et al.Plant natural products targeting bacterial virulence factors[J].Chem Rev,2016,116(16):9162-9236.
[41]ZENG Y,NIKITKOVA A,ABDELSALAM H,et al.Activity of quercetin and kaemferol against Streptococcus mutans biofilm[J].Arch Oral Biol,2019,98:9-16.
[42]PRABU G R,GNANAMANI A,SADULLA S,et al.Guaijaveri-a plant flavonoid as potential antiplaque agent against Streptococcus mutans[J].J Appl Microbiol,2006,101(2):487-495.
[43]YANG W Y,WON T H,AHN C H,et al.Streptococcus mutans sortase A inhibitory metabolites from the flowers of Sophora japonica[J].Bioorg Med Chem Lett,2015,25(7):1394-1397.
[44]HUANG P,HU P,ZHOU S Y,et al.Morin inhibits sortase A and subsequent biofilm formation in Streptococcus mutans[J].Curr Microbiol,2014,68(1):47-52.
[45]LEE S,SONG I H,LEE J H,et al.Sortase A inhibitory metabolites from the roots of Pulsatilla koreana[J].Bioorg Med Chem Lett,2014,24(1):44-48.
[46]KANG M S,OH J S,KANG I C,et al.Inhibitory effect of methyl gallate and gallic acid on oral bacteria[J].J Microbiol,2008,46(6):744-750.
[47]SENDAMANGALAM V,CHOI O K,KIM D,et al.The antibiofouling effect of polyphenols against Streptococcus mutans[J].Biofouling,2011,27(1):13-19.
[48]YANG W Y,WON T H,AHN C H,et al.Streptococcus mutans sortase A inhibitory metabolites from the flowers of Sophora japonica[J].Bioorg Med Chem Lett,2015,25(7):1394-1397.
[49]COENYER T,BRACKMAN G,RIGOLE P,et al.Eradication of Propionibacterium acnes biofilms by plant extracts and putative identification of icariin,resveratrol and salidroside as active compounds[J].Phytomedicine,2012,19(5):409-412.
[50] ANNAPOORANI A, UMAMAGESWARAN V, PARAMESWARI R,et al.Computational discovery of putative quorum sensing inhibitors against LasR and RhlR receptor proteins of Pseudomonas aeruginosa[J].J Comput Aid Mol Des,2012,26(9):1067-1077.
[51]LUIS A,SILVA F,SOUSA S,et al.Antistaphylococcal and biofilm inhibitory activities of gallic, caffeic, and chlorogenic acids[J].Biofouling,2014,30(1):69-79.
[52] BRIGIDA D A,BUOMMINO E,GRAZIA D A, et al.Spectroscopic identification and anti-biofilm properties of polar metabolites from the medicinal plant Helichrysum italicum against Pseudomonas aeruginosa[J].Bioorg Med Chem Lett,2013,21(22):7038-7046.
[53]KARUNANIDHI A,THOMAS R,BELKUM A,et al.In vitro antibacterial and antibiofilm activities of chlorogenic acid against clinical isolates of Stenotrophomonas maltophilia including the trimethoprim/sulfamethoxazole resistant strain[J].Biomed Res Int,2013,2013:1-7.
[54]BEEMA S R M,SELVARAJ C,SINGH S K,et al.In silico and in vitro studies of cinnamaldehyde and their derivatives against LuxS in Streptococcus pyogenes: effects on biofilm and virulence genes[J].J Mol Recogn,2014,27(2):106-116.
[55] BRACKMAN G, DEFOIRDT T, MIYAMOTO C, et al.Cinnamaldehyde and cinnamaldehyde derivatives reduce virulence in Vibrio spp.by decreasing the DNA-binding activity of the quorum sensing response regulator LuxR[J].BMC Microbiol,2008,8:149.
[56]FIGUEIREDO N L,AGUIAR S R M M,FALÉ P L,et al.The inhibitory effect of Plectranthus barbatus and Plectranthus ecklonii leaves on the viability, glucosyltransferase activity and biofilm formation of Streptococcus sobrinus and Streptococcus mutans[J].Food Chem,2010,119(2):664-668.
[57]HU P,HUANG P,CHEN M W.Curcumin reduces Streptococcus mutans biofilm formation by inhibiting sortase A activity[J].Arch Oral Biol,2013,58(10):1343-1348.
[58] LI B, LI X, LIN H, et al.Curcumin as a promising antibacterial agent:Effect on metabolism and biofilm formation in S. mutans[J].Biomed Res Int,2018,2018:1-11.
[59] COENYE T, HONRAET K, RIGOLE P, et al. In vitro inhibition of Streptococcus mutans biofilm formation on hydroxyapatite by subinhibitory concentrations of anthraquinones[J].Antimicrob Agents Ch,2007,51(4):1541-1544.
[60]SENDAMANGALAM V,CHOI O K,KIM D,et al.The antibiofouling effect of polyphenols against Streptococcus mutans[J].Biofouling,2011,27(1):13-19.
[61]FENG G,KLEIN M I,GREGOIRE S,et al.The specific degree-of-polymerization of A-type proanthocyanidin oligomers impacts Streptococcus mutans glucan-mediated adhesion and transcriptome responses within biofilms[J].Biofouling,2013,29(6):629-640.
[62] DUARTE S, GREGOIRE S, SINGH A P, et al.Inhibitory effects of cranberry polyphenols on formation and acidogenicity of Streptococcus mutans biofilms[J].Fems Microbiol Lett,2006,257(1):50-56.
[63] KOO H, DUARTE S, MURATA R M, et al.Influence of cranberry proanthocyanidins on formation of biofilms by Streptococcus mutans on saliva-coated apatitic surface and on dental caries development in vivo[J].Caries Res,2010,44(2):116-126.
[64] MOHAMED G A, IBRAHIM S R M, SHAABAN M I A, et al.Mangostanaxanthones I and II,new xanthones from the pericarp of Garcinia mangostana[J].Fitoterapia,2014,98:215-221.
[65] JEONG S I, KIM B S, KEUM K S, et al.Kaurenoic acid from Aralia continentalis inhibits biofilm formation of Streptococcus mutans[J].Evid-Based Compl Alt,2013,2013:1-9.
[66]RUKAYADI Y,HWANG J K.Effect of coating the wells of a polystyrene microtiter plate with xanthorrhizol on the biofilm formation of Streptococcus mutans[J].J Basic Microb,2006,46(5):410-415.
[67] KOO H, HAYACIBARA M F, SCHOBEL B D, et al.Inhibition of Streptococcus mutans biofilm accumulation and polysaccharide production by apigenin and tt-farnesol[J].J Antimicrob Chemoth,2003,52(5):782-789.
[68]JEON J G,PANDIT S,XIAO J,et al.Influences of trans-trans farnesol,a membranetargeting sesquiterpenoid, on Streptococcus mutans physiology and survival within mixed-species oral biofilms[J].Int J Oral Sci,2011,3(2):98-106.
[69] LIU C, WORTHINGTON R J, MELANDER C, et al.A new small molecule specifically inhibits the cariogenic bacterium Streptococcus mutans in multispecies biofilms[J].Antimicrob Agents Ch, 2011, 55(6):2679-2687.
[70]BEEMA S R M,SELVARAJ C,SINGH S K,et al.In silico and in vitro studies of cinnamaldehyde and their derivatives against LuxS in Streptococcus pyogenes: effects on biofilm and virulence genes[J].J Mol Recognit,2014,27(2):106-116.
[71] MARCHESE A, ARCIOLA C R, COPPO E, et al.The natural plant compound carvacrol as an antimicrobial and anti-biofilm agent:mechanisms,synergies and bio-inspired anti-infective materials[J].Biofouling,2018,34(6):630-656.
[72] LI B, LI X, LIN H, et al.Curcumin as a promising antibacterial agent:Effects on metabolism and biofilm formation in S. mutans[J].Biomed Res Int,2018,https://doi.org/10.1155/2018/4508709.
[73] HOYER L L, ERNESTO C. Candida albicans agglutinin-like sequence(AIs)family vignettes:A review of AIs protien structure and function[J].Front Microbiol,2016,7:1-15.
[74]田宇晨.双功能荷叶提取物的制备、关键活性成分筛选及降尿酸功效初探[D].广州:华南理工大学,2021.
[75]韩娜娜,王鹏龙,陈红珊,等.基于成分分析-活性筛选-网络药理学的白花秦艽抗氧化物质研究基础[J].中华中医药杂志,2022,37(10):5883-5890.
[76]丁婷.基于荧光假单胞菌群体感应的抑制剂筛选及抑制机理探究[D].无锡:江南大学,2019.