真菌毒素是真菌在生长繁殖过程中产生的次生有毒代谢产物,目前已知的真菌毒素有400 余种[1-3]。真菌毒素的产生是真菌用来保护自身免受微生物、线虫、昆虫、动物包括人类的伤害而产生的[4],同样,直接接触真菌毒素对人类和动物具有致癌、致畸、致突变和免疫抑制等作用[5-6]。其中黄曲霉毒素(aflatoxins,AFs)、赭曲霉毒素A(ochratoxin A,OTA)、赭曲霉毒素B(ochratoxin B,OTB)、玉米赤霉烯酮(zearalenone,ZON)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)及其衍生物3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyl deoxynivalenol solution,3-ADON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyl deoxynivalenol solution,15-ADON)都是较为常见的真菌毒素。目前,国家明确制定了粮食中的真菌毒素限量标准[7],并在日常监督抽查中严格要求质量安全性问题。
白酒酿造过程中使用的曲药是一种以小麦、大麦、豌豆、高粮、玉米等粮食原料含有微生物菌系、微生物酶系和复合曲香物质等的微生态制品[8]。曲药作为酿造的产酒、生香剂[9],在酿酒生产中具有以下作用:提供菌源和酶系、具有糖化并发酵的作用、具有生香的作用。以大曲为例,生产工艺主要涉及到五个部分:选配原料、润粮破碎、压制成型、接种发酵和贮存后熟。由于其制曲工艺的复杂多样化,使得曲药中微生物多样化,大曲中的霉菌主要有曲霉属、根酶属、毛酶属、青霉属、红曲霉属和犁头霉属等丝状真菌[10-12]。由于微生物的丰富多样性,在大曲制作和贮存的过程中可能会产生多种毒素。
当前,已有研究者对大曲中真菌毒素的检测进行了初步研究。李觅等[13]研究采用酶联免疫法对浓香型白酒生产过程中的各个样品(大曲、酒醅、丢糟、黄水、基酒、成品酒)中的相关真菌毒素进行了定量分析。结果表明,AFB1、OTA在大曲、酒醅、丢糟和黄水中均有检出,在基酒和成品酒中的含量未达到检出水平,桔霉素在所有样品中未检出。张春林[10]利用高效液相色谱法分析了泸州老窖公司制曲生态园大曲中的霉菌毒素含量,选取了4种霉菌毒素:AFB1、OTA、DON和桔霉素(citrinin,CIT)进行实验检测分析。检测结果表明,大曲中的AFB1、OTA、DON测得含量以粮食中毒素的限量作为参考依据,均在国家安全限量范围内[7]。
目前真菌毒素的检测方法主要有酶联免疫吸附法[14]、薄层色谱法[15]、毛细管电泳法[16]、液相色谱法[17]、液相色谱质谱联用法[18]等方法。目前,粮食标准LS/T 6133—2018《粮油检验主要谷物中16种真菌毒素的测定液相色谱-串联质谱法》[19]和农业标准NY/T3803—2020《饲料中37种霉菌毒素的测定液相色谱-串联质谱法》[20]均采用了高效液相色谱串联质谱(high performance liquid phase secondary mass spectrometry,HPLC-MS/MS)法进行多种毒素检测,由于HPLC-MS/MS法具有更高效、灵敏、准确的优势,该方法适用基质为谷物和饲料以及坚果及干制水果[21]、小麦[22]、牛奶[23]、粮谷[24]、调味品[25]、葡萄酒[26]等基质。
本研究建立一种高效液相色谱-串联质谱(HPLC-MS/MS)法同时测定白酒曲药中真菌毒素检测方法,结合制曲原料和工艺,综合考虑容易被污染的常见真菌毒素,选定黄曲霉毒素B1、B2、G1、G2,OTA、OTB,DON、3-ADON、15-ADON,ZON共10种真菌毒素,通过对液相质谱条件及样品前处理条件优化,并进行方法学验证,对不同香型曲药进行真菌毒素检测,旨在控制真菌毒素给白酒品质、生产环境及生产人员带来的安全风险。
1 材料与方法
1.1 材料与试剂
1.1.1 白酒曲药
3组浓香型白酒成品曲药样品、3组酱香型白酒成品曲药样品、2组清香型白酒成品曲药样品、14组浓香型白酒和酱香型白酒曲药的制曲工艺过程样品(共22份白酒曲药样品):泸州本地酒企。
1.1.2 化学试剂
黄曲霉毒素B1(AFB1)、B2(AFB2)、G1(AFG1)、G2(AFG2)、玉米赤霉烯酮(ZON)、脱氧雪腐镰刀菌烯醇(DON):青岛普瑞邦生物工程有限公司;3-乙酰基脱氧雪腐镰刀菌烯醇(3-ADON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-ADON)、赭曲霉毒素A(OTA)、赭曲霉毒素B(OTB)、U-[13C17]-黄曲霉素B1、U-[13C18]-玉米赤霉烯酮、U-[13C15]-脱氧雪腐镰刀菌烯醇:北京坛墨质检科技有限公司;13C20-赭曲霉毒素A:北京美正检测技术有限公司;乙腈、甲醇、甲酸、冰乙酸(均为色谱纯):上海安谱实验科技股份有限公司。
1.2 仪器与设备
Triple QuadTM 5500液相色谱串联质谱仪:美国SCIEX公司;3-18KS高速冷冻离心机:德国Sigma公司;OA-SYS氮吹仪:美国Organomation公司;QUINTIX65-1CN分析天枰:德国Sartorius公司;Transferpette-S微升移液器:德国Brand公司;QuEChERS净化柱(提取盐包含4 g硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠,净化管(15 mL)含900 mg硫酸镁、150 mg SPA、15 mg GCB):安捷伦科技(中国)有限公司;Pribolab-MFC100净化柱(MFC100 5 mL):青岛普瑞邦生物工程有限公司;Waters-PRIME HLB净化柱(PRIME HLB 6 mL/200mg):沃特世科技(中国)有限公司;Agela-P/N MYT10-B净化柱(IC-MYT10-B 1 mL):天津博纳艾杰尔科技有限公司。
1.3 方法
1.3.1 样品前处理方法
曲药样品提取:在50 mL 离心管中称取5 g 经粉碎机粉碎的均匀白酒曲药试样,加入内标(U-[13C17]-黄曲霉素B1 10 ng;U-[13C18]-玉米赤霉烯酮400 ng;13C20-赭曲霉毒素A 200 ng;U-[13C15]-脱氧雪腐镰刀菌烯醇400 ng),加入20 mL甲酸-乙腈-水(1∶19∶80,V/V),涡旋振荡10 min,超声提取10 min(温度50 ℃,能量值90%)。4 000 r/min离心5 min后,上清液待净化。
5种不同的净化方式详细操作如下:
方式①直接提取后溶剂置换的方式:取1 mL经提取的上清液氮吹(40 ℃水浴)后,用初始流动相(0.1%乙酸水-乙腈(90∶10,V/V))复溶至1 mL。过0.22 μm有机滤膜,供LC-MS/MS仪测定。
方式②~④分别采用型号为Pribolab-MFC100、Agela-P/N MYT10-B、Waters-PRIME HLB净化柱:取5 mL经提取的上清液过上述3种前处理净化柱,取1 mL经净化的清液氮吹(40℃水浴)后用初始流动相(0.1%乙酸水-乙腈(90∶10,V/V))复溶至1 mL。过0.22 μm 有机滤膜,供LC-MS/MS仪测定。
方式⑤采用型号为Agilent-QuEChERS净化包进行前处理:称取均匀试样5.0 g置于50 mL离心管中,准确加入5.0 mL水,涡旋,样品充分浸润后,加入15 mL甲酸-乙腈-水(1∶19∶80,V/V),涡旋振荡10min,超声10min,加入QuEChERS提取盐包(4 g 硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠),振摇1 min,10 000 r/min条件下离心5 min。取8.0 mL上清液转移至含有复合吸附剂(900 mg硫酸镁、150 mg SPA、15 mg GCB)的dSPE净化管中,涡旋1 min,10 000 r/min 条件下离心5 min。再取净化管中上清液1.0 mL至氮吹管中,于40 ℃水浴下,氮气吹干。用初始流动相(0.1%乙酸水-乙腈(90∶10,V/V))复溶至1 mL。过0.22 μm有机滤膜,供LC-MS/MS仪测定。
1.3.2 高效液相色谱条件
采用ACQUITY UPLC R HSS T3 C18色谱柱(2.1 mm×100 mm,1.8 μm);流速0.35 mL/min;进样量10 μL;柱温40 ℃;流动相梯度洗脱程序见表1。
表1 流动相梯度洗脱程序
Table 1 Gradient elution program of mobile phase
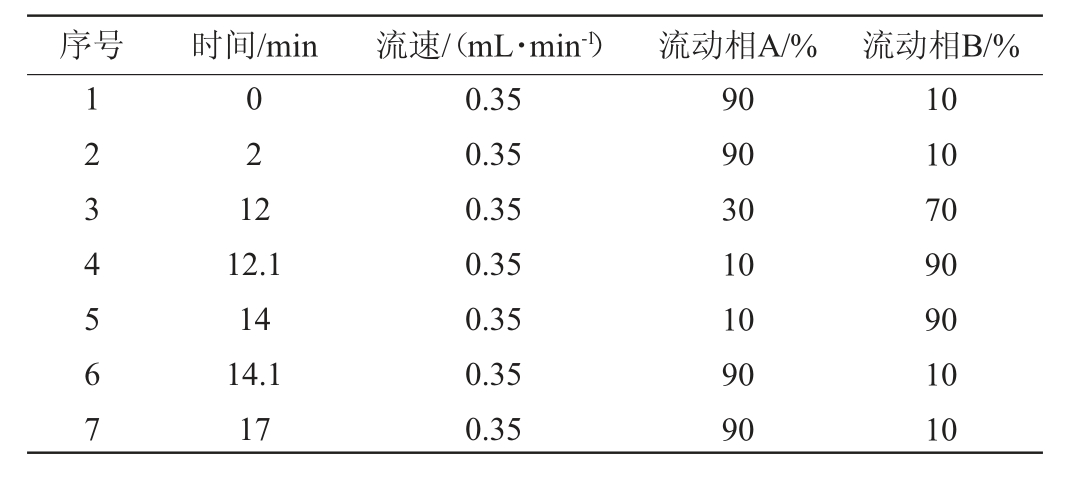
序号 时间/min 流速/(mL·min-1)流动相A/% 流动相B/%1234567 021 2 12.1 14 14.1 17 0.35 0.35 0.35 0.35 0.35 0.35 0.35 90 90 30 10 10 90 90 10 10 70 90 90 10 10
1.3.3 质谱条件
电喷雾离子(electrospray ionization,ESI)源;质谱扫描方式:正离子模式;检测方式:多反应监测(multi-reaction monitoring,MRM)模式;气帘气:35 psi;离子化电压:5 500 V;离子源温度550 ℃;喷雾气:45 psi;辅助加热气:50 psi;碰撞气:高纯氩气(Ar)。真菌毒素质谱参数见表2。
表2 真菌毒素检测质谱参数
Table 2 Mass spectrometry parameters of mycotoxins detection
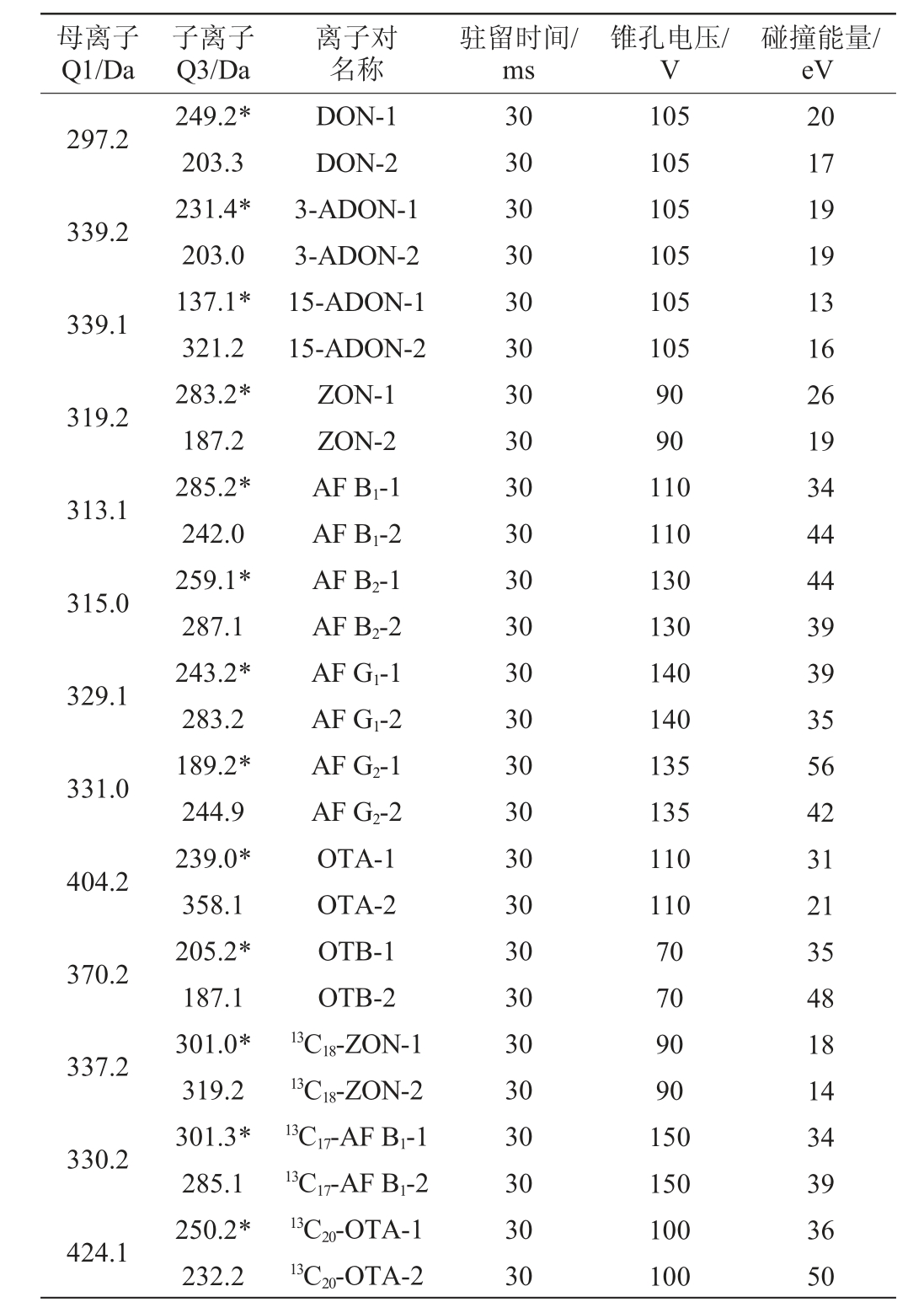
注:“*”表示定量离子。
母离子Q1/Da子离子Q3/Da离子对名称驻留时间/ms锥孔电压/V碰撞能量/eV 297.2 339.2 339.1 319.2 313.1 315.0 329.1 331.0 404.2 370.2 337.2 330.2 424.1 249.2*203.3 231.4*203.0 137.1*321.2 283.2*187.2 285.2*242.0 259.1*287.1 243.2*283.2 189.2*244.9 239.0*358.1 205.2*187.1 301.0*319.2 301.3*285.1 250.2*232.2 DON-1 DON-2 3-ADON-1 3-ADON-2 15-ADON-1 15-ADON-2 ZON-1 ZON-2 AF B1-1 AF B1-2 AF B2-1 AF B2-2 AF G1-1 AF G1-2 AF G2-1 AF G2-2 OTA-1 OTA-2 OTB-1 OTB-2 13C18-ZON-1 13C18-ZON-2 13C17-AF B1-1 13C17-AF B1-2 13C20-OTA-1 13C20-OTA-2 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 105 105 105 105 105 105 90 90 110 110 130 130 140 140 135 135 110 110 70 70 90 90 150 150 100 100 20 17 19 19 13 16 26 19 34 44 44 39 39 35 56 42 31 21 35 48 18 14 34 39 36 50
1.3.4 方法学验证
按照GB/T 27404—2008《实验室质量控制规范食品理化检测》的要求:①考察各类毒素检测标准曲线的线性关系是否满足R2>0.99;②考察目标化合物的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)。③取实验室中经检测含有较低真菌毒素的白酒曲药样品,添加低、中、高3个浓度水平的10 种真菌毒素标准溶液,进行6次平行实验,计算加标回收率以及精密度实验结果相对标准偏差(relative standard deviation,RSD),考察该方法的精密度及准确度。
1.3.5 统计学分析
试验过程中,通过Analyst Software采集质谱数据,SCIEX OS软件进行真菌毒素的定性和定量分析。采用SPSS 23.0软件和OriginPro 2021对实验数据进行统计分析和绘图。
2 结果与分析
2.1 仪器条件的优化
真菌毒素在结构性质上存在差异,为了得到最优的目标化合物分离效率,通过查阅相关方法标准[20]和实际试验结果探寻最优质谱条件,选择正离子模式进行质谱扫描方式。在试验中改变去簇电压(declustering potential,DP)及碰撞能量(collision energy,CE)等质谱条件得到各目标化合物的最佳出峰状态,并确定真菌毒素的质谱条件参数。
按照表1洗脱梯度,改变流动相A(水、0.1%甲酸水、0.1%乙酸水)、流动相B(甲醇、乙腈),选择不同流动相后考察相同浓度标准溶液(质量浓度均为0.2 μg/L AFB1、AFB2、AFG1、AFG2,质量浓度均为0.2 μg/L OTA、OTB,质量浓度为0.6 μg/L ZON,质量浓度为3.0 μg/L DON,质量浓度为20 μg/L 15-ADON,质量浓度为0.6 μg/L 3-ADON)条件下真菌毒素定量离子的响应情况。结果见图1。
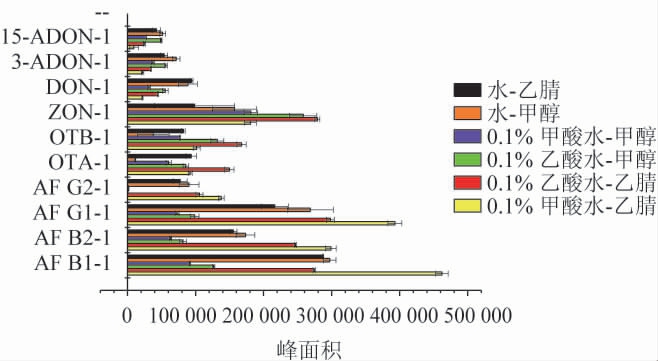
图1 不同流动相对真菌毒素检测响应值的影响
Fig.1 Effects of different mobile phase on response values of mycotoxins detection
由图1可知,当选择0.1%甲酸水-甲醇、0.1%乙酸水-甲醇作为流动相时,此时AFG2响应值显著低于其他流动相(P<0.05);选择0.1%甲酸水-甲醇作为流动相时,AFG2的峰面积为1 622.6±561.5;选择0.1%乙酸水-甲醇作为流动相时,AFG2的峰面积为927.3±28.7。由于AFG2响应情况不理想,因此不选择此两种流动相。当选择0.1%甲酸水-乙腈作为流动相时,四种黄曲霉毒素响应值显著高于其他流动相(P<0.05),但DON、3-ADON、15-ADON三种脱氧雪腐类的真菌毒素响应情况不理想。当选择0.1%乙酸水-乙腈作为流动相时,ZON、OTA、OTB响应值显著高于其他流动相(P<0.05),此时,AFB1、AFB2、AFG1、AFG2的响应值仅低于选择0.1%甲酸水-乙腈作为流动相时的响应值,且此时脱氧雪腐类毒素响应较为理想。因此,选择0.1%乙酸水-乙腈作为最适流动相。
在优化质谱条件和高效液相色谱条件下,每种真菌毒素平行测定2次,10种真菌毒素定量离子MRM色谱图见图2。由图2可知,得到10种真菌毒素定性和定量离子峰图,各离子峰分离效果、峰形及响应情况均良好。
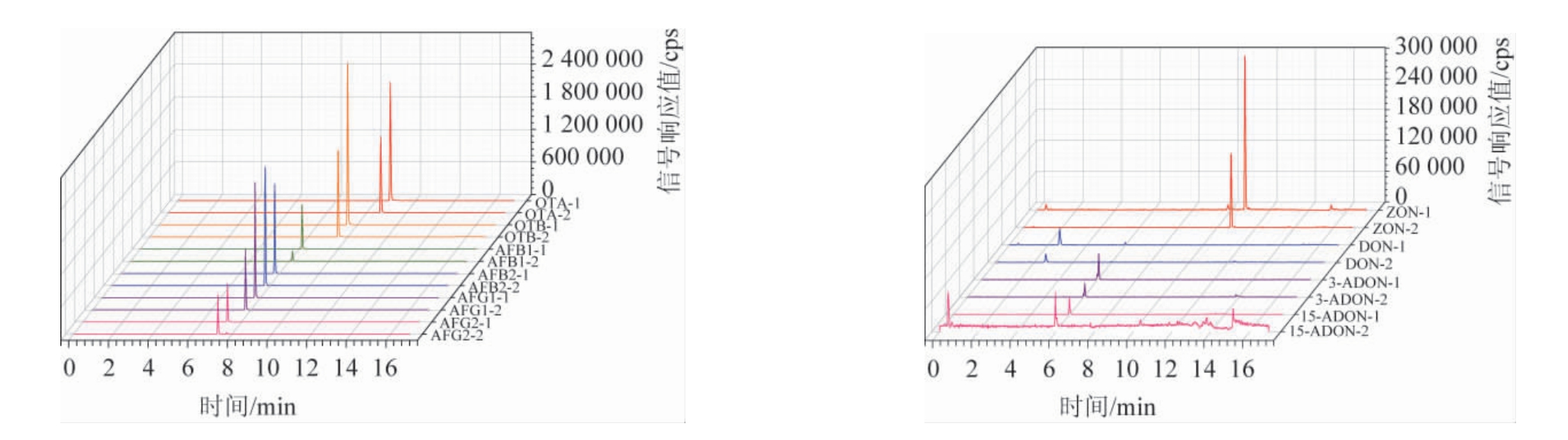
图2 10种真菌毒素定量离子、定性离子MRM色谱图
Fig.2 MRM chromatograms of quantitative ion and qualitative ion of 10 mycotoxins
2.2 前处理条件的优化
在上述最佳仪器条件下,再优化样品前处理条件。通过考察在样品基质中加入一定浓度混合标液(AFB1、AFB2、AFG1、AFG2:20 μg/kg,OTA、OTB:20 μg/kg,ZON:20 μg/kg,DON、15-ADON、3-ADON:40 μg/kg),采用3种不同前处理方式进化后目标物定量离子的响应情况,结果见图3。
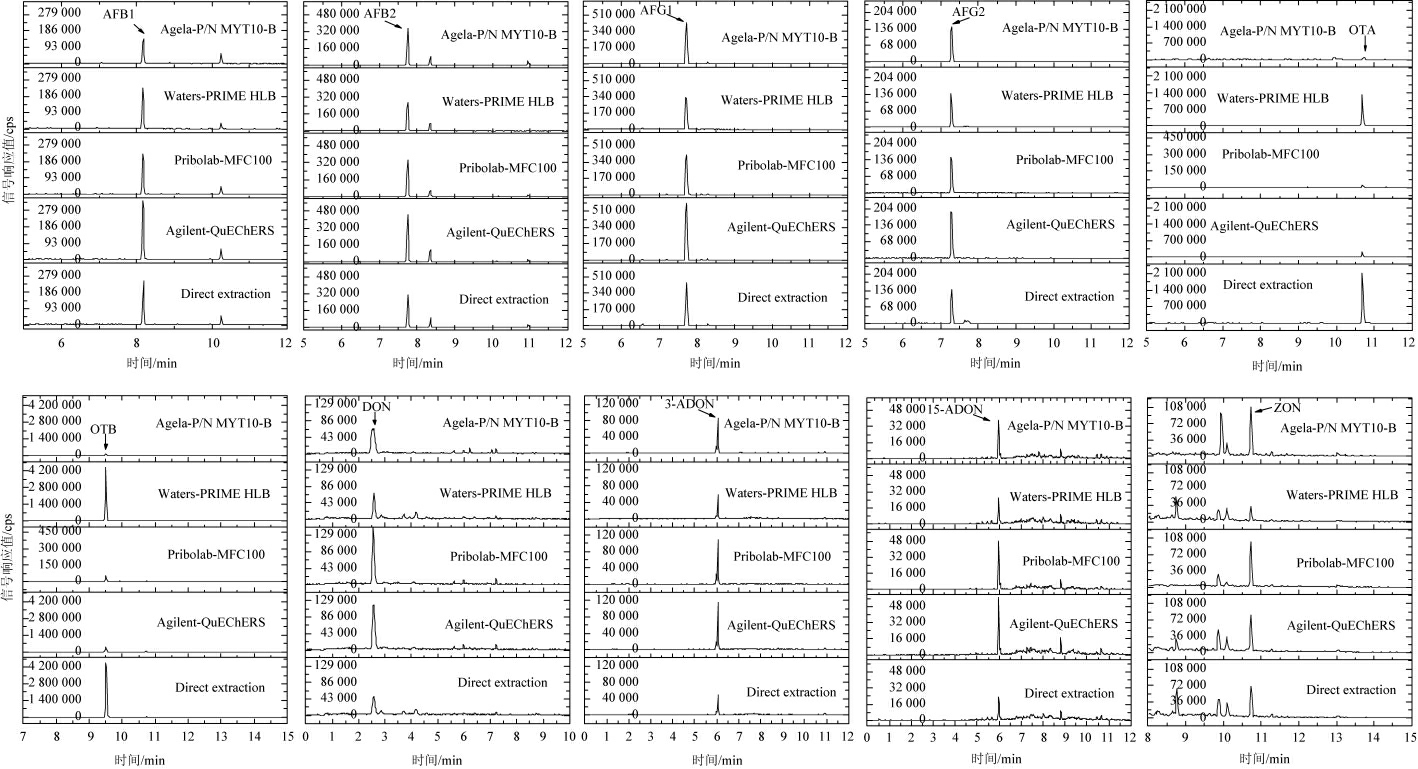
图3 不同前处理对真菌毒素检测响应值的影响
Fig.3 Effects of different pretreatment on response values of mycotoxins detection
由图3可知,黄曲霉毒素AFB1、AFB2、AFG1、AFG2在采用四种前处理方式进化后,目标峰响应情况都有较好的结果,上机测得目标峰最大响应值范围为AFB1:140 412~336 577 cps,AFB2:275 594~452 195 cps,AFG1:331 687~595 427 cps,AFG2:127 116~193 186 cps。赭曲霉毒素OTA、OTB 经Agela-P/N MYT10-B、Pribolab-MFC100、Agi lent-QuEChERS这三种净化产品处理后,OTA、OTB目标峰响应不理想,上机测得目标峰最大响应值分别为:OTA经Agela-P/N MYT10-B处理后,最大响应值为252 918 cps,OTA经Pribolab-MFC100处理后,最大响应值为22 676 cps,OTA经Agilent-QuEChERS处理后,最大响应值为17 005 cps,OTA直接提取未净化最大响应值为2 142 702 cps,OTA经Waters-PRIME HLB处理后,最大响应值为4 541 872 cps,相似的OTB也有相同的规律,经不同前处理后目标峰响应情况如下:OTB-Agela-P/N MYT10-B:423 966 cps,OTB-Pribolab-MFC100:54 252 cps,OTB-Agilent-QuEChERS:176 881 cps,OTB-直接提取未净化:4 548 988 cps,OTB-Waters-PRIME HLB:4 541 872 cps。综上,赭曲霉毒素OTA、OTB经Agela-P/N MYT10-B、Pribolab-MFC100、Agilent-QuEChERS这三种净化产品处理后,相比未经净化处理和经Waters-PRIME HLB小柱净化处理的检测样,目标峰响应情况显著降低。因此,排除Agela-P/N MYT10-B、Pribolab-MFC100、Agilent-QuEChERS三种前处理方式。对比Waters-PRIME HLB小柱净化和直接提取的方式,玉米赤霉烯酮ZON经Waters-PRIME HLB小柱净化处理目标峰响应情况相对较弱,ZON-直接提取未净化:69 752 cps,ZON-Waters-PRIME HLB:33 319 cps,但目标峰峰形、去除杂峰情况较为理想;且其他9种毒素经Waters-PRIME HLB处理后响应情况良好:OTA为1 316 134 cps,OTB为4 541 872 cps,AFB1为235 738 cps,AFB2为275 594 cps,AFG1为331 687 cps,AFG2为138 938 cps,DON为69 986 cps,3-ADON为59 228 cps,15-ADON为26 112 cps。直接提取后溶剂置换的方法得到的样品上机后得到的各类目标物色谱图中杂峰较多,且由于曲药中基质对脱氧雪腐烯醇类毒素抑制效果明显,因此未经净化的的样品测得脱氧雪腐烯醇类毒素目标峰响应情况和峰形相对较差。因此,选择Waters-PRIME HLB净化柱作为曲药中真菌毒素测定的前处理小柱。
2.3 方法学验证
10种真菌毒素标准曲线线性方程、线性范围、相关系数、检出限及定量限见表3。由表3可知,10 种目标化合物标准曲线在0.5~500 μg/L线性范围内均具有良好的线性关系(相关系数R2均>0.99)。根据各目标化合物在谱图上的出峰高度和出峰附近的平均噪声高度计算各化合物的信噪比,以3倍信噪比和10倍信噪比目标化合物的定量离子峰面积对应的质量浓度为检出限(LOD)和定量限(LOQ)。10种真菌毒素的检出限为0.5~5 μg/kg,定量限为2~20 μg/kg。该方法的灵敏度、准确率及测得真菌毒素种类均优于已有的液相色谱法[10]、酶联免疫法[13]对曲药中真菌毒素的测定方法。
表3 10种真菌毒素标准曲线线性方程、线性范围、相关系数、检出限及定量限
Table 3 Linear equation of standard curve, linear range, correlation coefficient, limits of detection and limits of quantification of 10 mycotoxins

真菌毒素线性范围/(μg·L-1)检出限/(μg·kg-1)定量限/(μg·kg-1)相关系数R2 标准曲线回归方程ZON AFB1 AFB2 AFG1 AFG2 OTA OTB DON 3-ADON 15-ADON 0.5~100 0.5~20 0.5~20 0.5~20 0.5~20 0.5~20 0.5~20 0.5~500 0.5~500 0.5~500 3.0 0.5 0.5 0.5 0.5 0.5 0.5 5.0 0.5 0.5 10 2222222 022 0.999 3 0.999 3 0.998 0 0.997 9 0.997 8 0.998 8 0.999 2 0.999 6 0.993 9 0.990 1 y=0.965 1x+0.061 8 y=0.282 1x-0.009 4 y=0.444 8x+0.109 2 y=0.576 1x+0.161 2 y=0.204 1x+0.038 9 y=1.206x-0.001 3 y=1.553x-0.000 3 y=0.859 7x+0.016 2 y=1.219x+0.018 2 y=0.482 3x+0.005 7
2.4 回收率和精密度实验
取实验室中经检测含有较低真菌毒素的白酒曲药样品,添加3个浓度水平的10种真菌毒素标准溶液,进行6次平行实验(n=6),计算6次加标实验的平均回收率以及精密度试验结果相对标准偏差,结果见表4。由表4可知,10种真菌毒素的平均回收率为63.8%~129.6%,精密度试验结果相对标准偏差RSD为1.4%~9.1%。GB/T 27404—2008《实验室质量控制规范食品理化检测》[27]的要求,当加标量小于1 mg/kg时,实验室内变异系数≤11%,回收率要求为60%~120%。因此,除DON在加标量为80 μg/kg时回收率为129.6%偏离要求,其余验证结果均满足GB/T 27404—2008中回收率和精密度的要求。
表4 10种真菌毒素加标回收率及精密度实验结果
Table 4 Results of recovery rates and precision tests of 10 mycotoxins
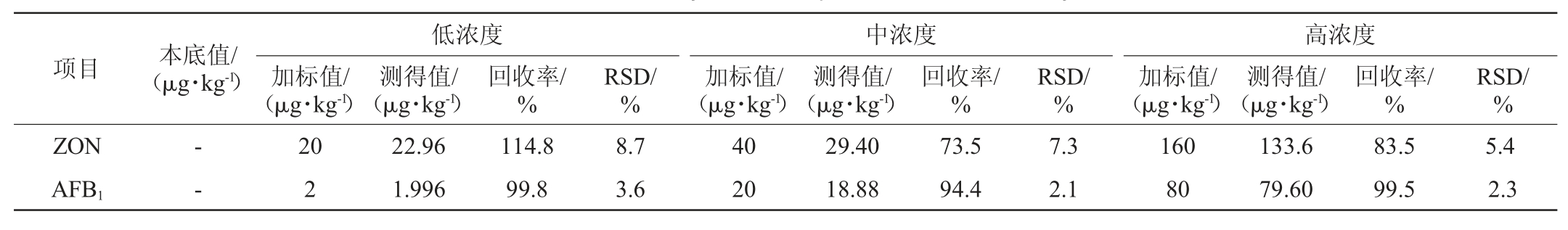
项目 本底值/(μg·kg-1)低浓度加标值/(μg·kg-1)测得值/(μg·kg-1)回收率/%ZON AFB1--20 2 22.96 1.996 114.8 99.8 RSD/%中浓度加标值/(μg·kg-1)RSD/%8.7 3.6测得值/(μg·kg-1)回收率/%40 20 29.40 18.88 73.5 94.4 7.3 2.1高浓度加标值/(μg·kg-1)测得值/(μg·kg-1)回收率/%160 80 133.6 79.60 83.5 99.5 RSD/%5.4 2.3
续表
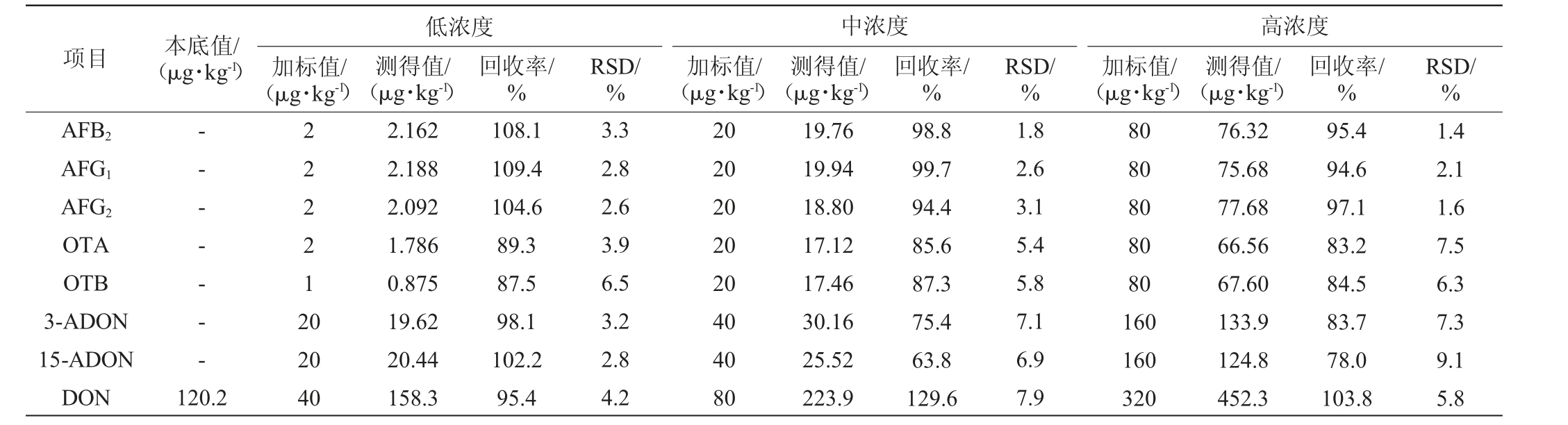
注:“-”表示未检出。
项目 本底值/(μg·kg-1)低浓度加标值/(μg·kg-1)测得值/(μg·kg-1)回收率/%RSD/%中浓度加标值/(μg·kg-1)测得值/(μg·kg-1)回收率/%RSD/%AFB2 AFG1 AFG2 OTA OTB 3-ADON 15-ADON DON 1.8 2.6 3.1 5.4 5.8 7.1 6.9 7.9-- - - - - -222212 0 120.2 20 40 2.162 2.188 2.092 1.786 0.875 19.62 20.44 158.3 108.1 109.4 104.6 89.3 87.5 98.1 102.2 95.4 3.3 2.8 2.6 3.9 6.5 3.2 2.8 4.2 20 20 20 20 20 40 40 80 19.76 19.94 18.80 17.12 17.46 30.16 25.52 223.9 98.8 99.7 94.4 85.6 87.3 75.4 63.8 129.6高浓度加标值/(μg·kg-1)测得值/(μg·kg-1)回收率/%80 80 80 80 80 160 160 320 76.32 75.68 77.68 66.56 67.60 133.9 124.8 452.3 95.4 94.6 97.1 83.2 84.5 83.7 78.0 103.8 RSD/%1.4 2.1 1.6 7.5 6.3 7.3 9.1 5.8
2.5 实际白酒曲药样品测定
对浓香型和酱香型白酒生产过程中曲药样品、不同生产厂家不同香型白酒成品曲药样品中的真菌毒素含量进行测定,结果见表5。
表5 22份白酒曲药样品中真菌毒素的检测结果
Table 5 Determination results of mycotoxins in 22 Baijiu Jiuqu samples μg/kg
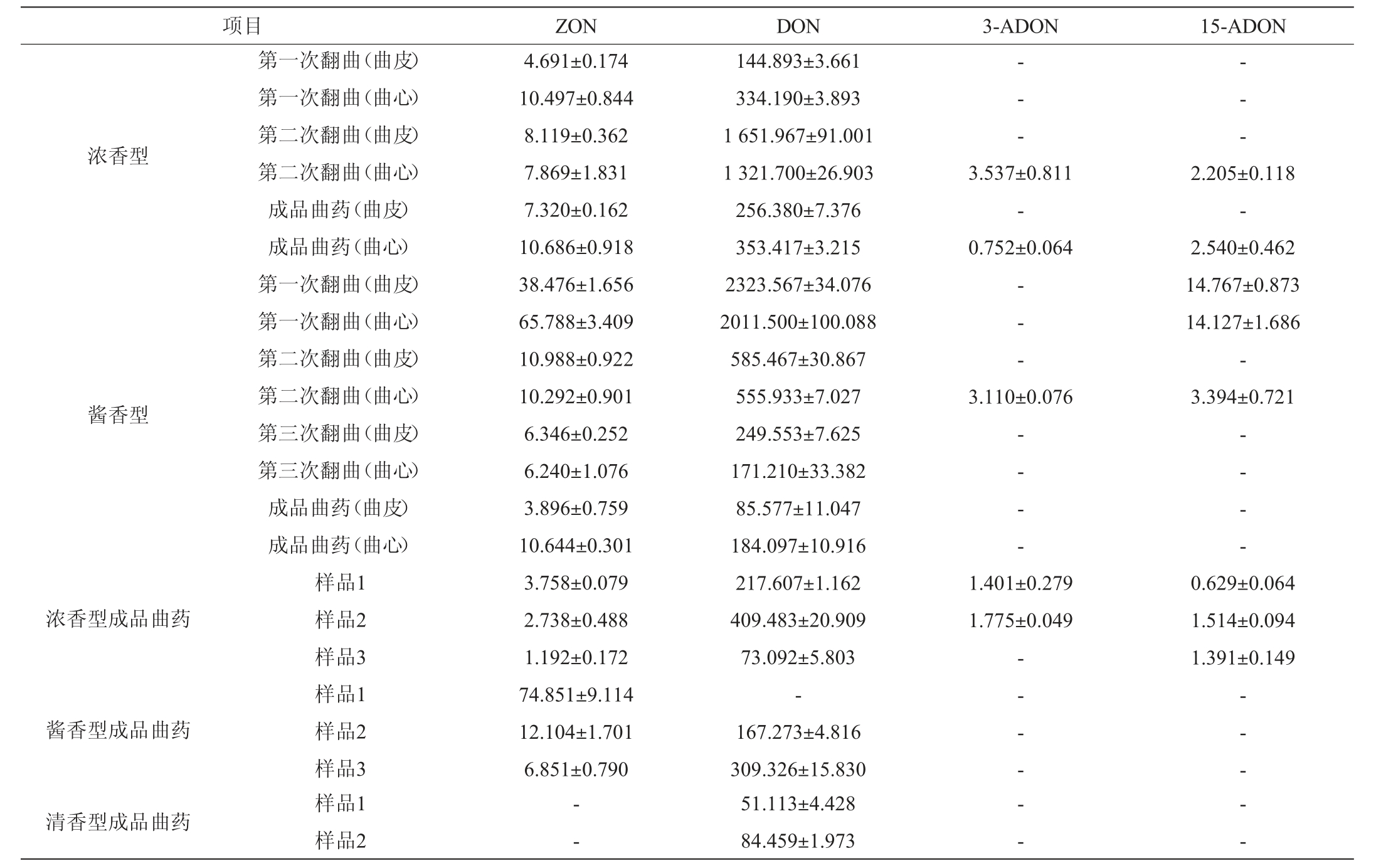
注:“-”表示未检出。
浓香型酱香型浓香型成品曲药酱香型成品曲药清香型成品曲药项目 ZON DON 3-ADON 15-ADON第一次翻曲(曲皮)第一次翻曲(曲心)第二次翻曲(曲皮)第二次翻曲(曲心)成品曲药(曲皮)成品曲药(曲心)第一次翻曲(曲皮)第一次翻曲(曲心)第二次翻曲(曲皮)第二次翻曲(曲心)第三次翻曲(曲皮)第三次翻曲(曲心)成品曲药(曲皮)成品曲药(曲心)样品1样品2样品3样品1样品2样品3 4.691±0.174 10.497±0.844 8.119±0.362 7.869±1.831 7.320±0.162 10.686±0.918 38.476±1.656 65.788±3.409 10.988±0.922 10.292±0.901 6.346±0.252 6.240±1.076 3.896±0.759 10.644±0.301 3.758±0.079 2.738±0.488 1.192±0.172 74.851±9.114 12.104±1.701 6.851±0.790 144.893±3.661 334.190±3.893 1 651.967±91.001 1 321.700±26.903 256.380±7.376 353.417±3.215 2323.567±34.076 2011.500±100.088 585.467±30.867 555.933±7.027 249.553±7.625 171.210±33.382 85.577±11.047 184.097±10.916 217.607±1.162 409.483±20.909 73.092±5.803-167.273±4.816 309.326±15.830-- --- -3.537±0.811-0.752±0.064-- -3.110±0.076 2.205±0.118-2.540±0.462 14.767±0.873 14.127±1.686-3.394±0.721-- - --- - -1.401±0.279 1.775±0.049-- - -0.629±0.064 1.514±0.094 1.391±0.149-- -样品1样品2--51.113±4.428 84.459±1.973——
由表5可知,22份白酒曲药样品均检出真菌毒素,其中检出率较高的真菌毒素包括呕吐毒素、玉米赤霉烯酮两大类毒素,4种黄曲霉毒素AFB1、AFB2、AFG1、AFG2和2种赭曲霉毒素OTA、OTB均未检出。参照国标GB 2761—2017《食品安全国家标准食品中真菌毒素限量》中规定谷物中脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮的限量分别为1 000 μg/kg和60 μg/kg,但尚未查见有对3-ADON和15-ADON的限量标准。结果显示,8份不同香型成品曲药样品中,未检测到脱氧雪腐镰刀菌烯醇超标样品,这可能是由于成品曲药在制作过程中经理自然发酵升温和通风干燥的过程,毒素在后续工艺有所降解;检测到一份成品曲药中玉米赤霉烯酮含量超限量标准,含量为(74.851±9.114)μg/kg,且其他曲药样品中玉米赤霉烯酮含量极低,这可能是由于不同酒厂在制曲配料和工艺上所有差异而导致的。在对浓香型曲药生产翻曲过程中取样进行真菌毒素检测时,检出真菌毒素变化规律呈显著增加再降低的变化趋势(P<0.05)。在对酱香型曲药生产翻曲过程中取样进行检测时,检出毒素变化规律从第一次翻曲开始呈显著降低的变化趋势(P<0.05);取样过程中,由于未监测到原料或者曲料中毒素含量,在酱香型曲药第一次翻曲前同样存在毒素上升的可能。曲药在制作翻曲到成品曲要的过程中,毒素含量均显著降低(P<0.05)。白酒曲药制作工艺中曲砖经历接种发酵后需要翻曲、储存后熟的过程,在此过程中会经历不断升温、通风、干燥,这样可能导致了毒素的降低。
3 结论
本研究通过对前处理条件的优化以及对仪器条件中色谱和质谱条件的优化,建立了一种可以同时检测白酒曲药中10种真菌毒素的检测方法。曲药样品经溶剂(0.1%乙酸水-乙腈90∶10,V/V)萃取后,以PRIME HLB净化柱进行前处理选择0.1%乙酸水-乙腈作为流动相。该方法在0.5~500 μg/L线性范围内均具有良好的线性关系(相关系数R2均>0.99),检出限为0.5~5 μg/kg,定量限为2~20 μg/kg;平均加标回收率为63.8%~129.6%;精密度实验结果相对标准偏差(RSD)为1.4%~9.1%;基本满足国标GB/T 27404—2008的要求。利用该方法检测白酒曲药样品,检出率较高的真菌毒素包括DON、3-ADON、15-ADON、ZON,4种黄曲霉毒素AFB1、AFB2、AFG1、AFG2和2种赭曲霉毒素OTA、OTB均未检出。本研究建立真菌毒素检测方法,可及时测定生产环节中毒素的污染情况,从而控制毒素给白酒品质、生产环境及生产人员带来的安全风险。
[1]何卓霖,李子琨,穆蕾,等.同位素内标-高效液相色谱-串联质谱法同时测定小麦和玉米中19种真菌毒素[J].中国粮油学报,2022,37(7):150-157.
[2] KARSAULIYA K, YAHAVI C, PANDEY A, et al.Co-occurrence of mycotoxins:A review on bioanalytical methods for simultaneous analysis in human biological samples,mixture toxicity and risk assessment strategies[J].Toxicon,2022,218:25-39.
[3]DE OLIVEIRA C A F,DE NEEFF D V,DE PINHO CARÃO A C,et al.Mycotoxin impact on egg production[J].Egg Innov Strat Improv,2017:581-596.
[4] TAN H X, ZHOU H Y, GUO T, et al.Recent advances on formation,transformation,occurrence,and analytical strategy of modified mycotoxins in cereals and their products[J].Food Chem,2023,405:134752.
[5]TAHEUR F B,KOUIDHI B,AL QURASHI Y M,et al.Review:Biotechnology of mycotoxins detoxification using microorganisms and enzymes[J].Toxicon,2019,160:12-22.
[6]NGUYEN V T T,KÖNIG S,EGGERT S,et al.The role of mycotoxins in neurodegenerative diseases:current state of the art and future perspectives of research[J].Biol Chem,2021,403(1):3-26.
[7]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 2761—2017 食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2017.
[8]张宿义,徐德富.泸型酒技艺大全[M].北京:中国轻工业出版社,2010:154-164.
[9]向慧平,林宜锦,关统伟,等.四川浓香型大曲生产中酵母菌、芽孢杆菌与工艺指标的关联性分析[J].食品科学,2020,41(2):196-201.
[10]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[11]张元洪.固态发酵酱香型白酒过程中霉菌的研究进展[J].酿酒科技,2021(1):65-70.
[12]文章,程鹏,陈才,等.白酒大曲真菌群落结构多样性研究技术与进展[J].中国酿造,2020,39(5):17-22.
[13]李觅,邓杰,杨跃寰,等.真菌毒素在浓香型白酒生产过程中的安全性检测[J].中国酿造,2015,34(10):129-133.
[14] CHEN Y J, ZHANG S P, HONG Z S, et al.A minotope peptide-based dual-signal readout competitive enzyme-linked immunoassay for nontoxic detection of zearalenone[J].J Mater Chem, 2019, 7(44): 6972-6980.
[15]赵磊,吴明宸,于亚楠,等.酶联免疫和薄层层析法检测茶叶中黄曲霉毒素B1的评价[J].黑龙江医药,2018,31(6):1190-1194.
[16]李铭慧,张丽君,李莎.毛细管电泳法检测薏苡仁和红曲米中真菌毒素[J].食品科技,2021,46(2):335-340.
[17]王韦岗,强敏,端礼钦.复合免疫亲和柱-高效液相色谱法同时测定谷物及其制品中9种真菌毒素[J].色谱,2018,36(12):1330-1336.
[18]马桂娟,朱捷,汤丽华,等.分散固相萃取-UPLC-MS/MS同时测定枸杞籽油中14种真菌毒素[J].食品与发酵科技,2019,55(1):95-100.
[19]国家粮食和物资储备局.LS/T 6133—2018 粮油检测主要谷物中16种真菌毒素的测定液相色谱-串联质谱法[S].北京:中国标准出版社,2018.
[20]中华人民共和国农业农村部.NY/T 3803—2020 饲料中37 种霉菌毒素的测定液相色谱-串联质谱法[S].北京:中国农业出版社,2020.
[21]汪薇,余婷婷,张莉,等.QuEChERS联合UPLC-Orbitrap/MS同时测定检测坚果和干制水果中60种真菌毒素[J].中国食品卫生杂志,2022,34(4):707-714.
[22]郑嘉,王红旗,刘继红,等.超高效液相色谱-串联质谱法检测小麦中19种真菌毒素[J].食品安全质量检测学报,2022,13(16):5382-5390.
[23]丁学妍,邵瑞婷,张涵璐.超高效液相色谱-串联质谱法测定牛奶中24种真菌毒素[J].食品科学,2022,43(24):325-334.
[24]王丽娟,李超,陈嘉杰,等.QuEChERS结合高效液相色谱-串联质谱法测定粮谷中16种真菌毒素[J].酿酒科技,2020(3):86-92.
[25]王东旭,王新财,王凤丽,等.挥发性铵盐盐析辅助液液萃取结合超高效液相色谱-串联质谱法测定酱油中4种黄曲霉毒素[J].食品安全质量检测学报,2022,13(14):4634-4640.
[26]周春红,彭文静.超高效液相色谱-三重四级杆质谱多反应监测模式测定葡萄酒中41种农药和7种真菌毒素残留[J].食品与发酵工业,2023,49(4):264-271.
[27]中华人民共和国国家监督检验检疫总局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.