青稞酒是以青稞为原料发酵而成的低度酒,清香突出、入喉回味悠长,深受藏族人民的喜爱[1]。青稞酒中富含多种人体所需的微量元素,适量饮用可以改善睡眠和降低胆固醇,同时对人体有保健功效[2-5]。青稞酒文化历史悠久,民族特色鲜明,是藏族人民日常生活中必不可少的饮品[6-8]。但是目前西藏传统青稞酒普遍采用开放式生产、多微共酵、自然接种[9],存在发酵过程可控性差、风味不稳定等问题,这些已严重影响青稞酒产业化发展和市场空间的拓展[10-13]。
微胶囊是以天然或合成的高分子材料为壁材,在微小封闭的胶囊中包埋气体、液体或固体[14]。微胶囊技术现在已成为应用范围广、发展相对完善的高新技术之一,在微生物、食品添加剂、日化领域、能源以及化学药物的固定化方面均有应用[15]。国内外将包埋技术多应用在污水处理方面,使得微生物对环境的耐受性明显提高,从而增强净水能力[16]。在食品领域,国内外研究热点是将益生菌进行包埋,保护其免受外界环境或人体胃酸和胆盐环境的侵害,提高益生菌的存活率[17]。也有研究利用微胶囊技术生产固定化酵母,这种酵母具有密度高、稳定性良好等优点,可缩短发酵周期,实现节能减排[18]。
微胶囊由于原料、壁材、芯材和制备工艺的不同,导致其外观形貌差异明显。常用的有机载体多为大分子聚合物,如海藻酸钠、琼脂、纤维素、卡拉胶等,其中海藻酸钠是食品级的原料,产量高、廉价易得,不会改变酵母细胞的生物活性,能防止酵母细胞在发酵过程中受到其他不利因素的影响,是固定化酵母常用的载体[19]。杨杰等[20]利用海藻酸钠固定化酵母应用于百香果汁酒精发酵中,最终乙醇产量与对照组相比提高了7.3%,糖类物质利用更充分,发酵更彻底。本研究以海藻酸钠-壳聚糖(alginate-chitosan,AC)为原料,氯化钙为辅料,研究不同粒径的微胶囊表观形貌及内部结构的变化,以硬度为评价指标。优化酵母微胶囊制备的最佳工艺条件,探究固定化酵母与游离酵母发酵特性的差异,为固定化酵母在传统青稞酒中的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
青稞(品种为喜拉22):由西藏自治区农牧科学院提供;酿酒酵母(Saccharomyces cerevisiae)J5:分离于西藏青稞酒曲,保存于中国食品发酵工业研究院实验室。
1.1.2 化学试剂
酵母浸粉、蛋白胨:北京奥博星生物技术有限责任公司;葡萄糖:天津市光复科技发展有限公司;海藻酸钠:广东汕头西陇化工公司;无水氯化钙(纯度>96%):浙江兰溪城南化工厂;壳聚糖:国药集团化学试剂有限公司;冰乙酸:天光科技发展有限公司。以上均为分析纯或生化试剂。
1.2 仪器与设备
CTA-XTPLUS型质构仪:英国Stable Micro Systems公司;iS10红外光谱仪:美国尼高力公司;SU8020场发射扫描电子显微镜:日本日立公司;BX51光学显微镜:奥林巴斯(中国)有限公司;PHS-3C pH计:上海仪电科学仪器股份公司;LRH-250电子恒温培养箱:上海一恒科学仪器有限公司;5-21R高速冷冻离心机:湖南恒诺仪器设备有限公司。
1.3 试验方法
1.3.1 固定化酵母泥的制备
一级种子液:在无菌环境下,从斜面接种酵母J5于5 mL酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD)中,30 ℃培养24 h。
二级种子液:在无菌环境下,将一级种子液接种于95 mL YPD培养基中,30 ℃培养24 h。菌液经4 000 r/min离心10 min弃去上清液得到酵母泥,计数得到酵母数量级保持在1010 CFU/mL(以血球计数法计数)。
1.3.2 微胶囊制备过程
参考谭檑华等[21]的方法并加以修改,称取3 g海藻酸钠,加60 mL蒸馏水,置于65 ℃的恒温水浴锅中,搅拌至海藻酸钠完全溶解,冷却备用。取10 g酵母泥与海藻酸钠溶液充分混合后定容至100 mL。使用注射器将混合溶液缓慢滴入氯化钙溶液中,即刻形成球形颗粒,缓慢搅拌使其在氯化钙溶液中充分固化,微胶囊充分固化后在壳聚糖溶液中覆膜,待覆膜完成后用蒸馏水洗涤备用。
1.3.3 不同粒径微胶囊包埋率的测定
使用四种规格不同的注射器(1 mL、2 mL、5 mL、10 mL)进行不同粒径微胶囊的制备,参考周紫薇等[22]的方法进行包埋率的测定。
1.3.4 酵母微胶囊固定化工艺条件优化单因素试验
通过预试验的结果选取海藻酸钠添加量2%、氯化钙添加量2%、固化时间1.5 h、壳聚糖添加量0.6%和覆膜时间15 min为基础条件,设定海藻酸钠添加量(1.5%、2.0%、2.5%、3.0%、3.5%),氯化钙添加量(1%、2%、3%、4%、5%),固化时间(0.5 h、1.0 h、1.5 h、2.0 h、2.5 h),壳聚糖添加量(0.2%、0.4%、0.6%、0.8%、1.0%),覆膜时间(5 min、10 min、15 min、20 min、25 min)进行单因素试验,考察不同因素对海藻酸钠-壳聚糖固定化载体硬度的影响。
1.3.5 酵母微胶囊固定化工艺条件优化响应面试验
在单因素试验的基础上,选取海藻酸钠添加量(A)、氯化钙添加量(B)、壳聚糖添加量(C)为自变量,以微胶囊硬度(Y)为响应值,设计Box-Behnken试验,因素与水平见表1。
表1 酵母微胶囊固定化工艺条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for immobilization process conditions optimization of yeast microcapsules
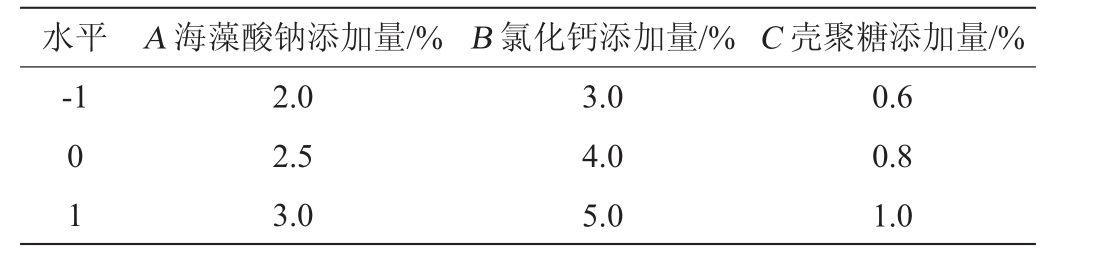
水平 A 海藻酸钠添加量/% B 氯化钙添加量/% C 壳聚糖添加量/%-1 0 1 2.0 2.5 3.0 3.0 4.0 5.0 0.6 0.8 1.0
1.3.6 青稞酒的酿造工艺
将青稞粉碎,按照料水比1∶6(g∶mL)加入蒸馏水,糊化10 min,降温至85 ℃加入α-淀粉酶液化,60 ℃时加入糖化酶恒温保持1 h,初始糖度为90 g/L,用纱布过滤后离心,90 ℃灭菌30 min,冷却备用。在500 mL锥形瓶中加入200 mL糖化液,接入2 g固定化微胶囊颗粒,对照组接入0.2 g酵母,使得酵母接种量均达到1×107 CFU/mL,在28 ℃生化培养箱中进行发酵。
1.3.7 测定方法微胶囊载体硬度:采用CTA-XTPLUS质构仪,选用5 mm的圆柱形探头,探头感应力为2.0g,下降速度为2mm/s,触及微胶囊表面后速度变为0.25 mm/s,当圆柱形探头下降到90%时测试结束,测得微胶囊载体的硬度,单位为g。
微胶囊外观形貌分析:采用扫描电子显微镜(scanning electron microscope,SEM)进行观察,取微胶囊样品固定在样品载物台上,进行喷金处理,喷金时间为150 s,喷镀Pt,测试电压为3 kV,测试电流为10 mA[23]。
微胶囊官能团结构分析:采用傅里叶变换红外光谱仪(fourier transform infrared spectrometer,FTIR)进行测定,用KBr压片法制备,微胶囊样品与KBr质量比为1∶100,波数400~4 000 cm-1,分辨率4 cm-1[24]。
青稞酒理化指标的分析:参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》,pH值使用pH计进行测定;总酸的测定采用酸碱滴定法;总糖的测定采用斐林试剂滴定法;酒精度的测定采用蒸馏法。
1.3.8 数据处理
采用SPSS 26ANOVA检验对数据进行方差及显著性分析,使用Origin 9.8进行绘图,采用Design-Expert 12分析响应面回归模型。每个样品重复3次。
2 结果与分析
2.1 不同粒径微胶囊的硬度与酵母包埋率的测定
微胶囊制作时,注射器型号不同,制备的微胶囊粒径也不同,分析不同粒径微胶囊的硬度与酵母包埋率之间的关系,结果见表2。
表2 不同粒径微胶囊的硬度与酵母包埋率的测定结果
Table 2 Determination results of hardness of microcapsule with different particle size and embedding rate of yeast

粒径/mm 硬度/g 包埋率/%1.78±0.05 2.44±0.11 3.04±0.07 3.97±0.06 1 613.27±14.11 1 515.80±14.96 1 454.87±22.15 1 308.67±16.77 88.70±1.85 84.77±2.25 80.83±2.36 73.76±2.40
AC微胶囊的机械强度是固定化酵母的首要影响因素,机械强度高的微胶囊才能经受多次连续发酵。由表2可知,粒径越小,硬度越大,且对应的酵母包埋率也越高,这可能是与小颗粒有较大比表面积的缘故[25]。因此,选用粒径最小的微胶囊(1.78 mm)包埋酵母最为适宜。
2.2 微胶囊扫描电镜图及FTIR图
通过SEM观察AC微胶囊,结果见图1。由图1可知,其形态呈圆形或椭圆,表面存在孔状结构。低倍镜下表面有凹陷(图1-a),在高倍镜下观察到表面粗糙多孔(图1-b、图1-c),但较为连续和均匀,说明覆盖了残留在微胶囊表面的菌株,因此当外界环境不利时可以提高酵母菌的生存能力。

图1 不同倍镜下微胶囊扫描电镜图
Fig.1 Scanning electron microscopy of microcapsules at different magnification
利用FTIR分析AC微胶囊各种材料的相互作用以及内部结构,结果见图2。由图2可知,FTIR光谱在3 423 cm-1处有显著吸收带,此峰是-OH伸缩振动的强吸收峰,在羟基间形成氢键而影响呈现较宽[26]。在1 639 cm-1和1 409 cm-1处为COO-的反对称和对称伸缩振动,在1 026 cm-1处吸收峰很强为C-O-C伸缩振动,与赵梦月等[27]研究一致。因此,说明微胶囊粒径大小不影响其内部结构。
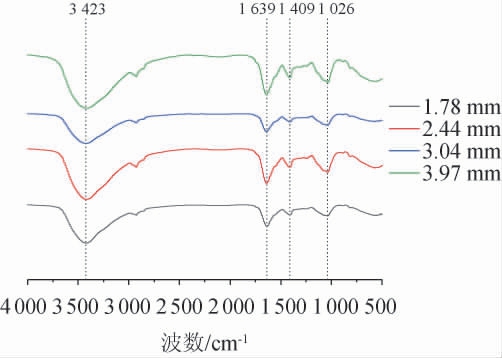
图2 四种不同粒径海藻酸钠-壳聚糖微胶囊FTIR图谱
Fig.2 FTIR spectra of 4 alginate-chitosan microcapsules with different particle sizes
2.3 酵母微胶囊固定化工艺条件优化单因素试验结果
2.3.1 海藻酸钠添加量对酵母微胶囊硬度的影响
由图3可知,随着海藻酸钠添加量的增加,酵母微胶囊硬度也随之增加,这是由于钠离子与钙离子充分反应,形成稳定的网状结构。海藻酸钠添加量为1.5%~2.0%时,酵母微胶囊硬度逐渐增加;随后硬度增加速度减缓,在海藻酸钠添加量为3.0%时硬度达到了较高的水平(1 525.36 g);在海藻酸钠添加量为3.0%~3.5%时,继续增加海藻酸钠添加量,酵母微胶囊硬度增加不明显,当海藻酸钠添加量为3.5%时,反应体系的黏度太大,导致制备酵母微胶囊的难度增大,与李建飞[28]的研究相近。因此,选择海藻酸钠添加量为3%。
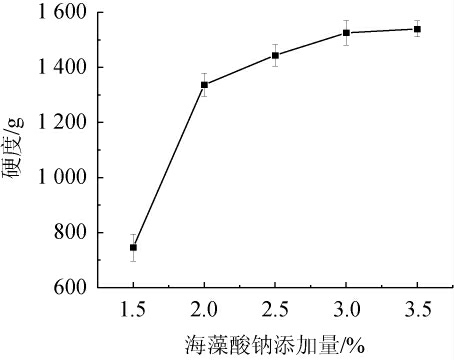
图3 海藻酸钠添加量对酵母微胶囊硬度的影响
Fig.3 Effect of sodium alginate addition on hardness of yeast microcapsules
2.3.2 氯化钙添加量对酵母微胶囊硬度的影响
海藻酸钠与钙离子交联形成稳定的凝胶球,由图4可知,随着氯化钙添加量增加,酵母微胶囊硬度呈现出先增加后减小的趋势。当氯化钙含量为1%~2%时,形成的酵母微胶囊形状呈椭圆形,有拖尾现象发生,可能是由于钙离子含量低,海藻酸钠与钙离子交联的速度变慢;当氯化钙含量为2%~4%时,酵母微胶囊形呈圆形,表面光滑,富有弹性,硬度得到了大幅度提高,在氯化钙添加量为4%时达到了最大值,为1 538.58 g,与徐岳正等[29]的研究结果一致;当氯化钙添加量为4%~5%时,硬度出现下降,原因可能是钙离子含量太大,形成的微胶囊载体太脆,机械强度也有所下降。因此,选择氯化钙添加量为4%。
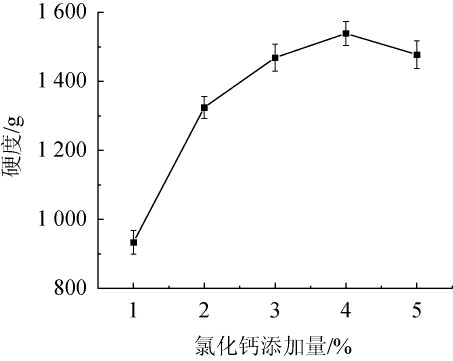
图4 氯化钙添加量对酵母微胶囊硬度的影响
Fig.4 Effect of calcium chloride addition on hardness of yeast microcapsules
2.3.3 壳聚糖添加量对酵母微胶囊硬度的影响
AC胶囊膜的形成是壳聚糖中的氨基与海藻酸钠中的羟基通过正负离子吸引而成[30]。酵母微胶囊的硬度随着壳聚糖添加量的增加而增加。由图5可知,壳聚糖含量为0.2%时,体系中的氨基含量少,在酵母微胶囊表面形成的膜不稳定;壳聚糖添加量为0.4%~0.8%,酵母微胶囊呈多孔球形,固化膜完整,有良好的稳定性,在壳聚糖添加量为0.8%时硬度达到最大1 339.64 g;壳聚糖添加量为0.8%~1.0%时,硬度没有明显变化,微胶囊表面粗糙,壳聚糖完全反应后还有残留,造成原料浪费。因此选择壳聚糖添加量为0.8%。
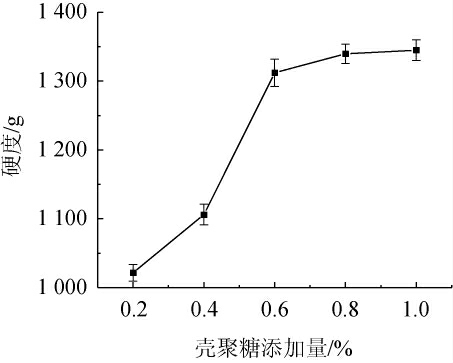
图5 壳聚糖添加量对酵母微胶囊硬度的影响
Fig.5 Effect of chitosan addition on hardness of yeast microcapsules
2.3.4 固化时间对酵母微胶囊硬度的影响
由图6可知,随着固化时间的延长,酵母微胶囊硬度呈逐渐增加趋势。当固化时间为0.5~2.0 h时,酵母微胶囊硬度增加比较明显,在固化时间为2.0 h时硬度达到较高的水平1 410.62 g,因为固化时间越长,海藻酸钠与氯化钙的反应越完全,形成的酵母微胶囊越牢固,硬度越大。当固化时间为2.0~2.5 h时,酵母微胶囊的硬度趋势也逐渐趋于平缓,没有明显变化。因此,选择固化时间为2.0 h。
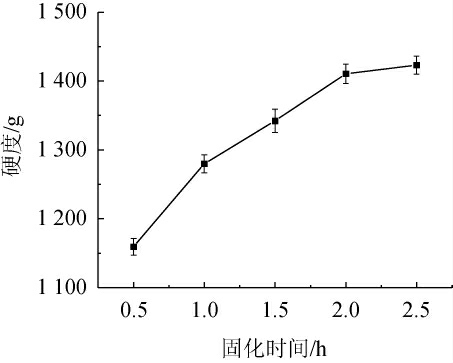
图6 固化时间对酵母微胶囊硬度的影响
Fig.6 Effect of curing time on hardness of yeast microcapsules
2.3.5 覆膜时间对酵母微胶囊硬度的影响
由图7可知,随着覆膜时间的延长,酵母微胶囊硬度呈逐渐增加趋势。这可能是由于覆膜时间越长,海藻酸钠与壳聚糖溶液的反应越完全,形成的外膜越致实,导致硬度越大。覆膜时间为5~15 min时,酵母微胶囊硬度明显增加,在覆膜时间为15 min时硬度较高,达到了1 340.66 g;在覆膜时间为15~25 min时,硬度增加不明显,仅增加11.72 g。因此,选择覆膜时间为15 min。
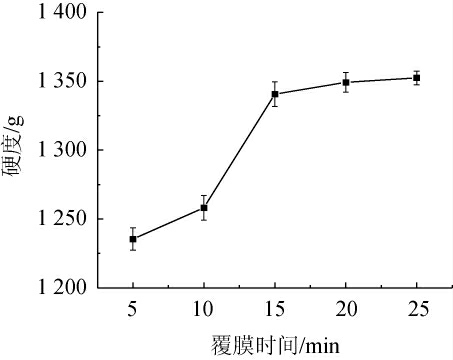
图7 覆膜时间对酵母微胶囊硬度的影响
Fig.7 Effect of coating time on hardness of yeast microcapsules
2.4 酵母微胶囊固定化条件优化响应面试验结果
2.4.1 响应面试验结果及方差分析
用Design-Expert12软件进行模型的建立及显著性检验,以酵母微胶囊硬度(Y)为响应值,选择海藻酸钠添加量(A)、氯化钙添加量(B)、壳聚糖添加量(C)为自变量,进行Box-Behnken试验,试验设计及结果见表3,方差分析见表4。
表3 酵母微胶囊固定化工艺条件优化响应面试验设计及结果
Table 3 Design and results of response surface experiments for immobilization process conditions optimization of yeast microcapsules
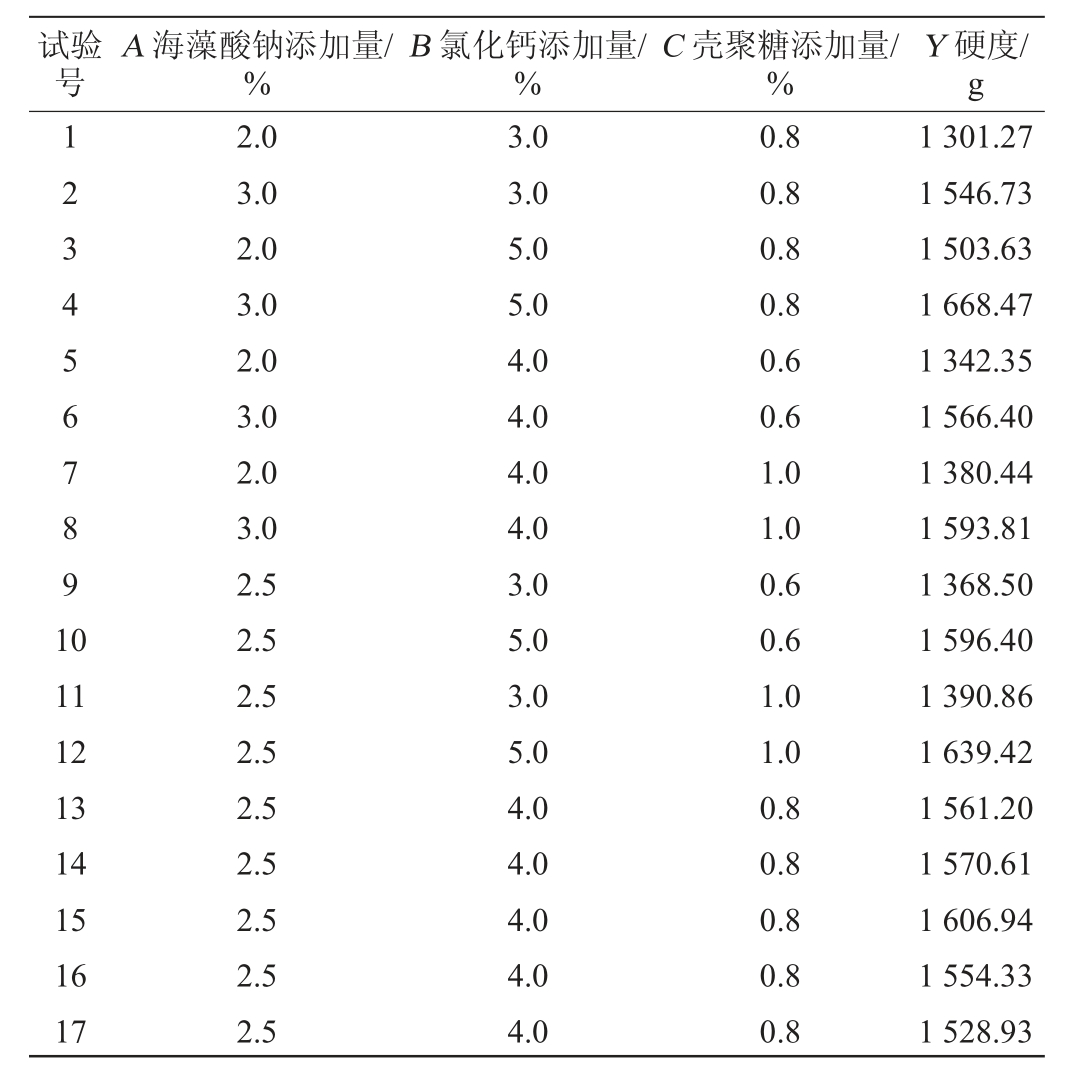
试验号A 海藻酸钠添加量/%B 氯化钙添加量/%C 壳聚糖添加量/%Y 硬度/g 1234567891 0 11 12 13 14 15 16 17 2.0 3.0 2.0 3.0 2.0 3.0 2.0 3.0 2.5 2.5 2.5 2.5 2.5 2.5 2.5 2.5 2.5 3.0 3.0 5.0 5.0 4.0 4.0 4.0 4.0 3.0 5.0 3.0 5.0 4.0 4.0 4.0 4.0 4.0 0.8 0.8 0.8 0.8 0.6 0.6 1.0 1.0 0.6 0.6 1.0 1.0 0.8 0.8 0.8 0.8 0.8 1 301.27 1 546.73 1 503.63 1 668.47 1 342.35 1 566.40 1 380.44 1 593.81 1 368.50 1 596.40 1 390.86 1 639.42 1 561.20 1 570.61 1 606.94 1 554.33 1 528.93
表4 回归模型方差分析
Table 4 Variance analysis of regression model
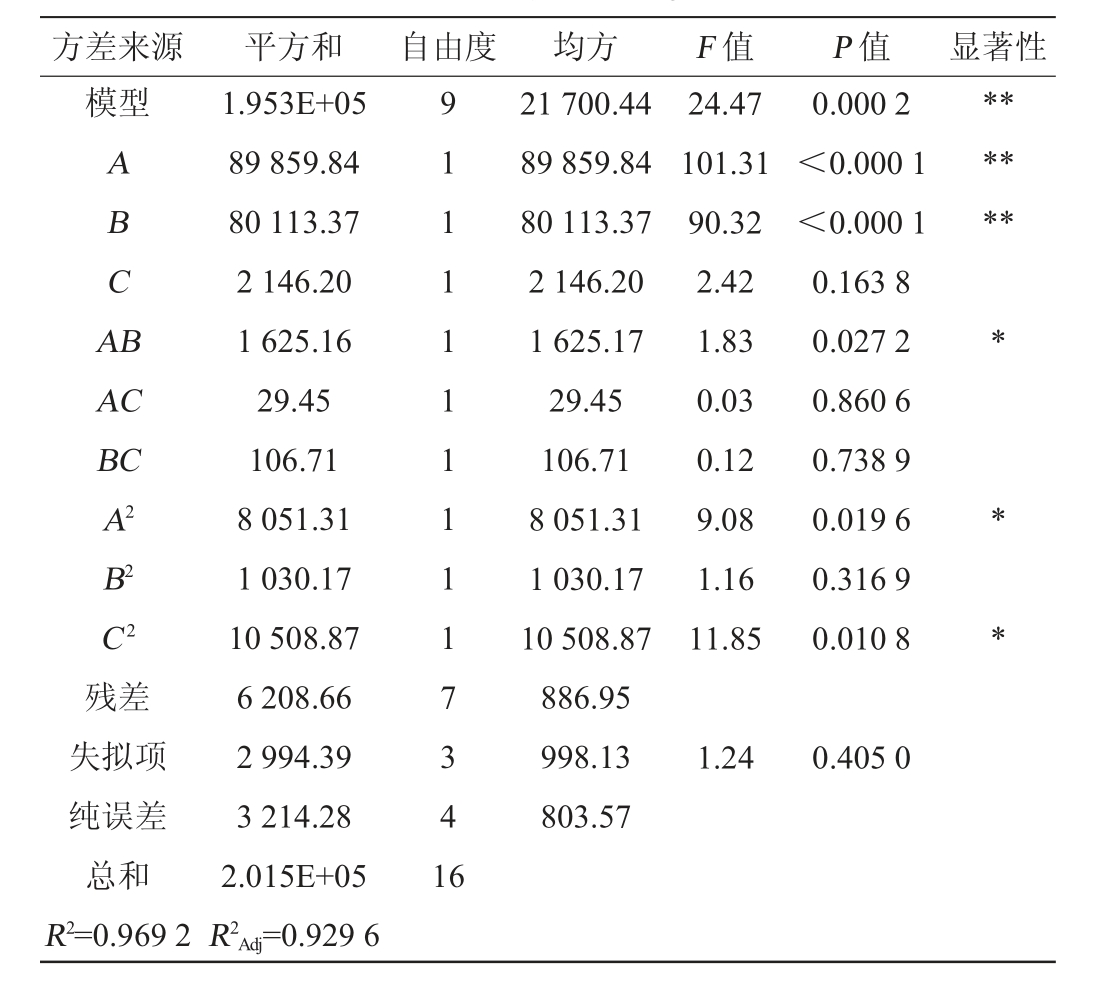
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2 C2残差失拟项纯误差总和R2=0.969 2 1.953E+05 89 859.84 80 113.37 2 146.20 1 625.16 29.45 106.71 8 051.31 1 030.17 10 508.87 6 208.66 2 994.39 3 214.28 2.015E+05 R2Adj=0.929 6 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 21 700.44 89 859.84 80 113.37 2 146.20 1 625.17 29.45 106.71 8 051.31 1 030.17 10 508.87 886.95 998.13 803.57 24.47 101.31 90.32 2.42 1.83 0.03 0.12 9.08 1.16 11.85 0.000 2<0.000 1<0.000 1 0.163 8 0.027 2 0.860 6 0.738 9 0.019 6 0.316 9 0.010 8**1.24 0.405 0
对表3数据进行回归分析,得出二次回归方程:Y=1 564.40+105.98A+100.07B+16.38C-20.16AB-2.71AC+5.17BC-43.73A2-15.64B2-49.96C2。
由表4可以看出,模型P值<0.01,表明响应面回归模型极显著;失拟项P>0.05,表示影响不显著,说明该模型有较高的拟合性。模型决定系数R2=0.969 2,校正决定系数R2Adj=0.929 6,说明该模型能较好反映酵母微胶囊的硬度与A、B、C因素的关系。从方差分析结果可得,一次项A、B对结果影响极显著(P<0.01),交互项AB和二次项A2、C2对结果影响显著(P<0.05)。
2.4.2 各因素间交互作用分析
各因素间交互作用对结果影响的响应曲面和等高线见图8。海藻酸钠添加量(A)、氯化钙添加量(B)与壳聚糖添加量(C)两两交互作用,均对酵母微胶囊的硬度有影响。由图8可知,A与B响应面曲线较为陡峭,等高线形状趋近于椭圆形,说明两者对硬度的交互作用较强,影响显著;A与C、B与C的等高线形状接近正圆,两两交互作用较弱,影响不显著。这与方差分析结果一致。
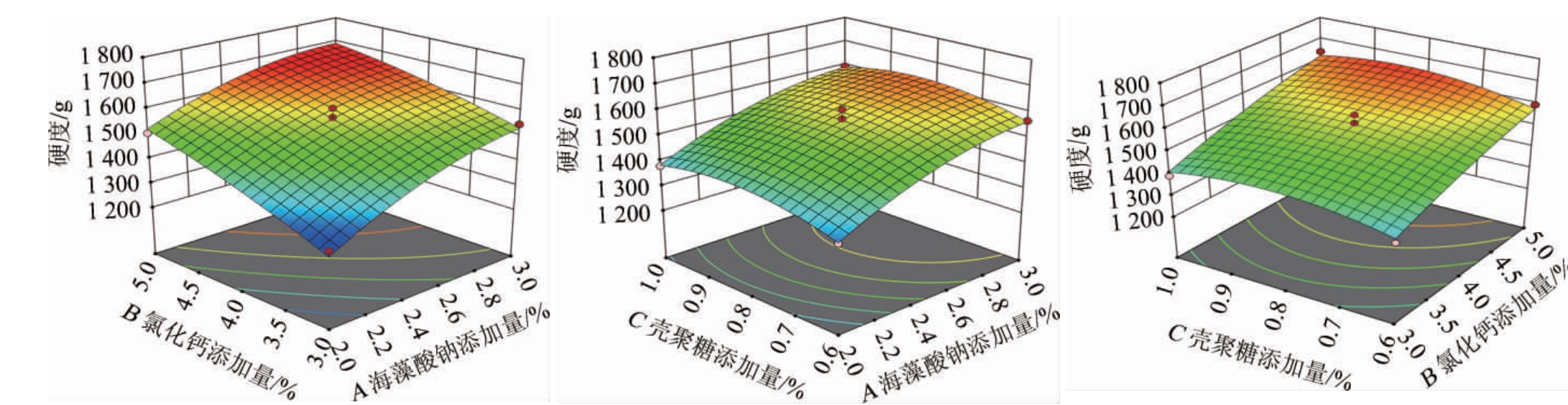
图8 各因素间交互作用对酵母微胶囊硬度影响的响应曲面及等高线
Fig.8 Response surface plots and contour lines of effects of interaction between various factors on hardness of microcapsules
2.4.3 验证试验
利用Design-Expert12软件分析得到酵母微胶囊最佳制备工艺条件为:海藻酸钠添加量为3%,氯化钙添加量为4%,壳聚糖添加量为0.834%,在此条件下硬度值可达1 627.52 g,为保证预测值与真实值具有一致性,并结合试验实际操作,将酵母微胶囊制备最佳条件修改为:海藻酸钠添加量为3%,氯化钙添加量为4%,壳聚糖添加量为0.8%,在此条件下进行3次平行试验,试验平均硬度值为1 615.54 g,与预测值接近,表明试验结果是可靠的。由此可知,利用响应面法优化制备微胶囊载体的工艺是可行的。
2.5 微胶囊固定化酵母与游离酵母对青稞酒发酵性能的影响
按照1.3.6方法,分别添加微胶囊固定化酵母与游离酵母,取不同时间的发酵液进行理化指标的测定,pH值、总酸、总糖、酒精度的变化趋势见图9。固定化酵母在第一代发酵结束后倒出发酵液,补充新鲜的培养液继续进行发酵,以此类推连续发酵三代。
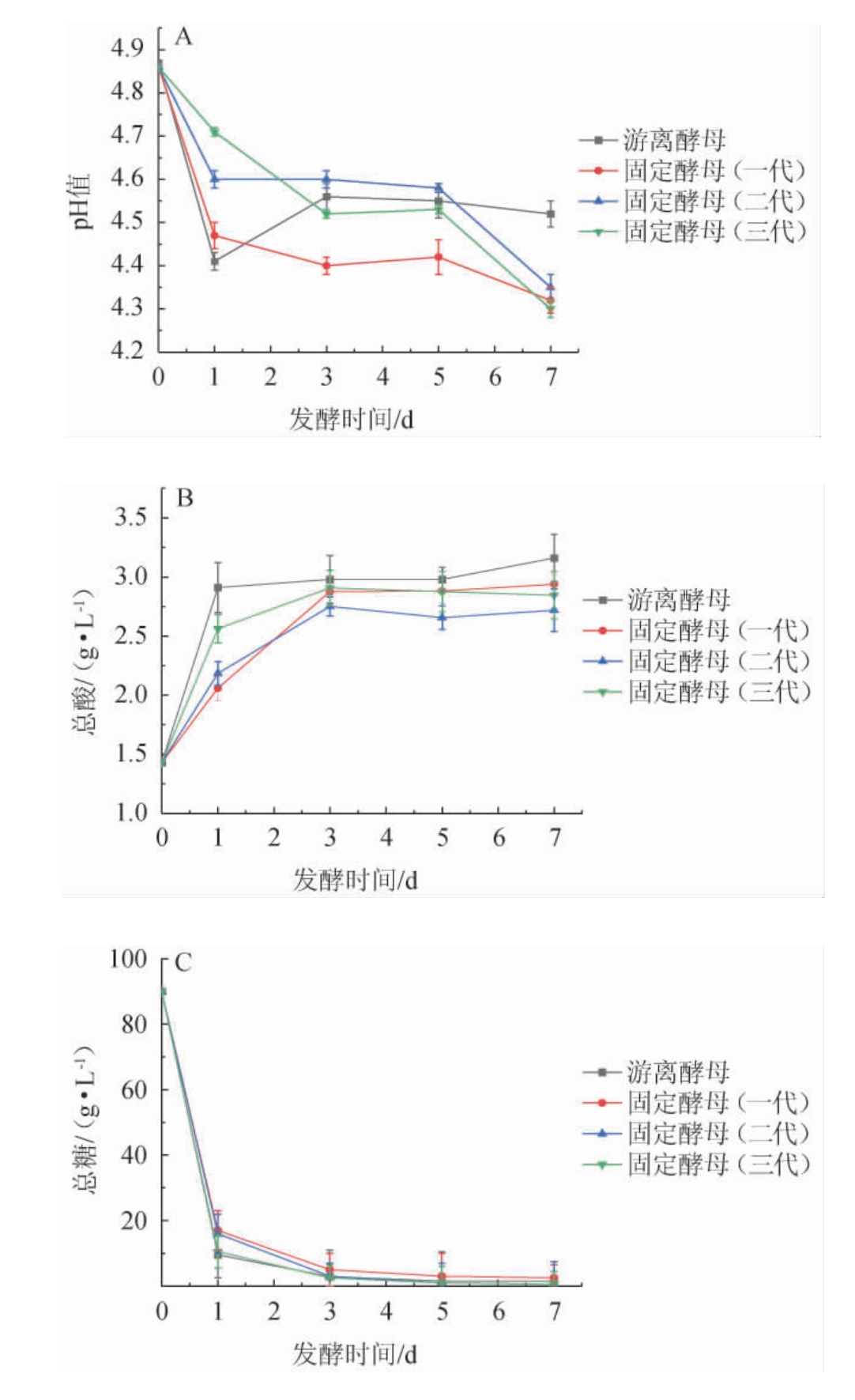
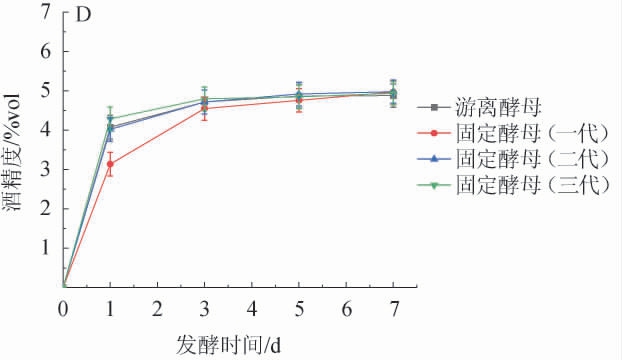
图9 青稞酒发酵过程中pH值(A)、总酸含量(B)、总糖含量(C)及酒精度(D)的变化趋势
Fig.9 Variation trend of pH (A), total acid content (B), total sugar content (C) and alcohol content (D) during fermentation of highland barley wine
青稞酒发酵初期,微生物繁殖较快,产酸能力较强,使得pH值降低,随着发酵的进行,酒精含量的上升在一定程度上限制了酵母产酸,同时一些碱性物质也开始生成,使得pH值有所上升。由图9A可知,在第1天游离酵母的pH值低于三批次固定化酵母,说明游离酵母在开始阶段产生的酸性物质较多。游离酵母与固定化酵母最终发酵液pH值在4.3~4.5之间,差异性显著(P<0.05)。
在青稞酒的发酵过程中,总酸含量总体上都是先快速升高,后趋于平稳。由图9B可知,在发酵第1天,不同代数固定化发酵的总酸含量明显低于游离酵母发酵。发酵结束后,固定化发酵的总酸含量平均值为2.8 g/L,低于游离酵母发酵3.16 g/L,比对照组低0.36 g/L,差异性显著(P<0.05)。说明酵母J5细胞被固定化后,对酸类物质的生成有一定的抑制作用。
由图9C可知,整体呈现先快后稳定下降的趋势。发酵第1天游离酵母的降糖速率比固定化酵母发酵快,但随着固定化酵母繁殖代数的增加,降糖速率也逐渐在加快,到第三代时与游离发酵的降糖趋势基本一致,而且在第二代发酵结束后总糖含量低于游离酵母,发酵结束后的总糖含量无明显变化(P>0.05)。
由图9D可知,酒精度的变化趋势与总糖含量变化趋势正好相反,在发酵期间呈现先快后稳的上升趋势,固定化酵母的起酵速度低于游离酵母,可能是由于酵母被包埋在颗粒内部,减少了酵母细胞与糖化液的接触,从而影响了酒精的生成,发酵结束后,三代固定化酵母的酒精度平均值为4.96%vol,均高于游离酵母发酵的酒精度(4.88%vol),发酵结束后的酒精度含量无明显变化(P>0.05)。说明固定化酵母适合青稞酒发酵,且酒精度比对照组高0.08%vol。通过固定化酵母与对照组发酵性能对比,第一代固定化酵母在发酵前3 d,消耗的糖与生成的酒精都没有对照组多,说明固定化酵母在启动阶段比较慢,会有一个迟滞期,在第一代时比较明显;第二、三代的发酵性能与游离酵母趋势一致。发酵结束后,酒精度比对照组高0.08%vol,总糖与对照组无显著差异(P>0.05),而总酸含量比对照组低0.36 g/L。
3 结论
通过SEM观察到酵母微胶囊形态呈圆形,表面存在孔状结构,FTIR分析表明粒径大小不影响微胶囊的内部结构。由单因素试验和响应面优化得出,制备酵母微胶囊的最佳制备条件为:海藻酸钠添加量3%,氯化钙添加量4%,壳聚糖添加量为0.8%,固化时间2 h,覆膜时间15 min。在此优化条件下,微胶囊载体硬度可达1 615.54 g,颗粒呈球形,颜色为乳白色,结构完整。将其应用于青稞酒发酵,酒精度比对照组高0.08%vol,总糖与对照组无显著差异(P>0.05),而总酸含量比对照组低0.36 g/L。微胶囊固定化酵母技术在青稞酒发酵中具有实际可操作性,能够提升青稞酒发酵过程中的稳定性,为传统青稞酒的扩大生产以及品质的提升提供实验探究和理论指导。
[1]GUO L X,LUO Y M,ZHOU Y,et al.Exploring microbial dynamics associated with flavours production during highland barley wine fermentation[J].Food Res Int,2020,130:108971.
[2] ZHANG K Z, YANG J G, QIAO Z W, et al.Assessment of β-glucans,phenols, flavor and volatile profiles of hulless barley wine originating from highland areas of China[J].Food chem,2019,293:32-40.
[3]卢灏泽,杨帆,贾福晨,等.西藏传统青稞酒的相关研究及前景分析[J].轻工科技,2021,37(5):19-21.
[4]LYU Y M,MA S,LIU J K,et al.A systematic review of highland barley:Ingredients,health functions and applications[J].Grain Oil Sci Technol,2022,5(1):34-43.
[5]耿晓杰,张玉红,薛洁,等.西藏青稞小曲中优良微生物的筛选与鉴定[J].食品与发酵工业,2019,45(15):66-73.
[6]李玉英,赵文娟,陈占秀,等.青稞酒生产工艺优化研究进展[J].酿酒,2018,45(5):50-52.
[7]陈占秀,喇录忠,黄和强,等.青稞酒大曲微生物的分离鉴定及可培养微生物变化规律分析[J].酿酒科技,2021(6):54-59.
[8]张文会.西藏青稞加工现状与存在问题分析[J].粮食加工,2016,41(5):43-44.
[9] BEVILACQUA A, CAMPANIELLO D, SPERANZA B, et al.Microencapsulation of Saccharomyces cerevisiae into alginate beads: a focus on functional properties of released cells[J].Foods,2020,9(8):1051.
[10]刘凯凤,杨丽,郑胜蓝,等.山西老陈醋中优势产酸菌的分离纯化及功能分析[J].食品工业科技,2020,41(6):124-130.
[11]贾福晨,张晓蒙,于佳俊,等.基于响应面法西藏传统青稞酒的酿造工艺[J].食品与发酵工业,2019,45(22):171-178.
[12]尹小庆,靳玉龙.国内青稞酒企业的发展现状概述[J].西藏农业科技,2021,43(4):96-99.
[13]王凤忠,张玉红,次旦央金,等.西藏青稞产业发展现状及对策建议[J].西藏农业科技,2019,41(2):1-5.
[14]MADENE A,JACQUOT M,SCHER J,et al.Flavour encapsulation and controlled release-a review[J].Int J Food Sci Technol, 2006, 41(1):1-21.
[15]RAJ G V S B,DASH K K,et al.Microencapsulation of betacyanin from dragon fruit peel by complex coacervation: Physicochemical characteristics, thermal stability, and release profile of microcapsules[J].Food Biosci,2022,49:101882.
[16]GUO Q,LI S,DU G G,et al.Formulation and characterization of microcapsules encapsulating carvacrol using complex coacervation crosslinked with tannic acid[J].LWT-Food Sci Technol,2022,165:113683.
[17]靳浩文,朱巧梅.益生菌微胶囊技术对益生菌存活率影响的研究进展[J].食品安全导刊,2022(25):181-183.
[18]OBRADOVIC N,PAJIC-LIJAKOVIC I,KRUNIC T,et al.Effect of encapsulated probiotic starter culture on rheological and structural properties of natural hydrogel carriers affected by fermentation and gastrointestinal conditions[J].Food Biophys,2020,15(1):18-31.
[19]史雁飞,闫凤翔,张泽锟,等.异常威克汉姆酵母Y5-5固定化条件优化及对其酿酒过程的影响[J].食品工业科技,2019,40(12):45-50.
[20]杨杰,韦娇霞,黄翠姬,等.固定化酵母应用于百香果汁酒精发酵的研究[J].食品科技,2020,45(8):84-91.
[21]谭檑华,周建弟,刘杨露,等.利用固定化酵母进行黄酒主发酵的初步研究[J].中国酿造,2012,31(1):162-166.
[22]周紫薇,项郑昊,周化岚,等.乳化法制备毕赤酵母微胶囊的条件优化[J].工业微生物,2021,51(6):14-22.
[23]李振杰,熊亚妹,刘远上,等.复凝聚法制备甜橙油纳米微胶囊的研究[J].轻工学报,2022,37(2):44-50.
[24]KALUŠEVIC' A M,LEVIC' S M,CˇALIJA B R.et al.Effects of different carrier materials on physicochemical properties of microencapsulated grape skin extract[J].Food Sci Technol,2017,54:3411-3420.
[25]张明栋,孙琪,刘国栋,等.氧化锆粉体粒度与比表面积的关系探究[J].有色冶金设计与研究,2021,42(2):16-19.
[26]刘月,高云云,李珊,等.山羊乳-FOS/GOS库德毕赤酵母DS8-1微胶囊的制备及体外评价[J].食品科学,2021,42(6):94-103.
[27]赵梦月,段续,任广跃,等.山茱萸黄酮微胶囊制备工艺及性质研究[J].食品与发酵工业,2023,49(7):181-189.
[28]李建飞.流态化微胶囊固定酵母技术在啤酒生产中的应用研究[D].乌鲁木齐:新疆农业大学,2007.
[29]徐岳正,王晶晶,蒋予箭,等.不同包埋量固定化酵母对黄酒发酵及风味的影响[J].酿酒科技,2020(5):65-69.
[30]袁庆兰,李锐扬,宋欢,等.海藻酸钠/壳聚糖/海藻酸钙微胶囊机械强度的研究[J].广州化工,2021,49(14):55-58.