大曲是一种经过自然接种、高温发酵而制成的菌酶合一的发酵剂[1]。酒曲中微生物的种类、数量、产酶特性在一定程度上决定着酒曲质量及其活性指标,同时也影响着原酒的品质[2]。大曲微生物多样性的研究表明,在芝麻香型白酒大曲中,微生物主要以芽孢杆菌属(Bacillus)和红曲霉属(Monascus)为主[3-4];而酱香型高温大曲中细菌以芽孢杆菌属和高温放线菌属(Thermoactinomyces)居多[5-6],真菌主要为曲霉属(Aspergillus)、嗜热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces)[7];清香型白酒大曲的优势菌种主要为不耐高温的微生物[8-9]。传统的酱香型和浓酱兼香型白酒的生产均使用高温大曲。根据传统制曲工艺,高温大曲发酵好后需经3个月左右的贮存后才能使用,期间发生多种生化反应,使得微生物区系结构、酶系结构都会发生重大变化[10]。梁丽文等[11]研究表明,高温大曲在贮存4个月时微生物数量和发酵力达到高峰。施思等[10]研究表明,中温大曲发酵力的提升是由于高发酵力菌种在大曲贮存期间逐渐占据优势,从而影响大曲发酵能力。通常认为大曲制曲工艺中理化性质和大曲微生物群落间存在一定的相关性[12]。在陶融型大曲中,曲醅酸度与细菌数量、糖化力与霉菌数量、发酵力与酵母数量等指标之间呈显著正相关[13]。罗惠波等[14]研究发现,在泸州老窖大曲制备和储存过程中,发酵温度的变化对原核微生物多样性影响较小,而发酵后期的湿度可能是造成原核微生物多样性改变的重要原因。
本研究采用高通量测序技术,并结合传统的微生物计数法,对不同贮存期高温大曲的曲皮和曲心中微生物群落的演替以及与大曲理化性质之间的相关性进行了分析,旨在解析高温大曲在贮存过程中不同部位的微生物群落的变化规律,为揭示成熟大曲的微生物结构特征及其发酵机理提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
不同贮存期的黄色高温大曲样品:湖北白云边酒业股份有限公司。大曲样品贮存时间及编号见表1。
表1 本研究所用大曲样品信息
Table 1 Information of Daqu samples used in study
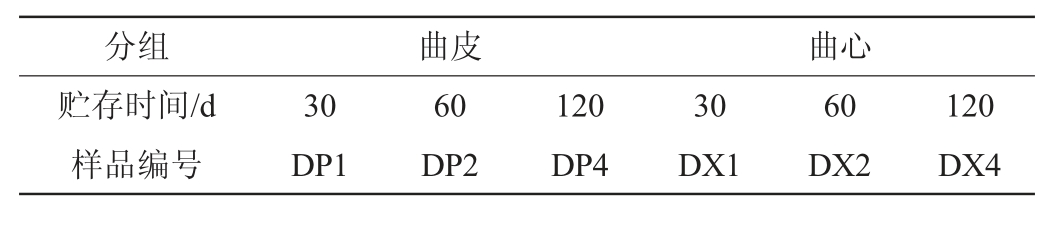
分组 曲皮 曲心贮存时间/d样品编号30 DP1 60 DP2 120 DP4 30 DX1 60 DX2 120 DX4
1.1.2 化学试剂
宏基因组抽提所用试剂Tris-base、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA):德国BioFroxx公司;十二烷基硫酸钠(sodiumdodecylsulfate,SDS):美国BIOSHARP公司。其余试剂均为国药集团化学试剂有限公司分析纯。
1.1.3 培养基
牛肉膏蛋白胨培养基[15]:NaCl 5 g/L、牛肉膏5 g/L、蛋白胨10 g/L、蒸馏水1 000 mL;调节培养基pH7.2~7.4,121 ℃灭菌25 min。
MRS培养基[15]:蛋白胨10 g/L、牛肉膏10 g/L、酵母提取物5 g/L、葡萄糖20 g/L、乙酸钠5 g/L、柠檬酸二胺2 g/L、吐温-80 1 g/L、磷酸氢二钾0.4 g/L、硫酸镁0.58 g/L、硫酸锰0.29 g/L、碳酸钙20.0 g/L、蒸馏水1 000 mL,115 ℃灭菌30 min。
马丁-孟加拉红培养基[15]:葡萄糖10 g/L、蛋白胨5 g/L、KH2PO4 1 g/L、MgSO4·7H2O 0.5 g/L、孟加拉红33.4 mg/L、链霉素溶液30 μg/mL、蒸馏水1 000 mL,121 ℃灭菌25 min。
1.2 仪器与设备
T100-Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司;Eppendorf-E100小型台式高速离心机:艾本德(中国)有限公司。
1.3 方法
1.3.1 样品采集
大曲制曲车间(同批次)随机抽取贮存期分别为30 d、60 d、120 d高温大曲曲砖各10块,取表皮2 cm样品作为曲皮,其余部分为曲心,粉碎后混合均匀并过20目筛后保存备用。
1.3.2 大曲基因组的抽提
称取50 g样品,采用苯酚-氯仿-异戊醇(25∶24∶1,V/V)抽提脱氧核糖核酸(deoxyribonucleic acid,DNA)[6],经无水乙醇沉淀,然后用无菌水将其溶解。最后采用土壤DNA抽提试剂盒对溶液进行纯化操作。
1.3.3 PCR扩增及高通量测序
利用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和506R(5'-GGACTACHVGGGTWTCTAAT-3')对原核微生物16S rRNA基因V3-V4区进行PCR扩增。PCR扩增体系(20 μL):5×FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2 μL,上、下游引物0.8 μL(5 μmol/L),FastPfu聚合酶0.4 μL,模板DNA 10 ng,用重蒸水补足至20 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共进行27个循环;72 ℃再延伸10 min。对内部转录间隔区1(internal transcribed spacer,ITS1)进行PCR 扩增,采用的引物为真核生物通用引物:F(5'-GTGAATCATCGARTC-3'),R(5'-TCCTCCGCTTATTGAT-3'),PCR扩增条件:96 ℃预变性3 min;96 ℃变性30 s,50 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸7 min;每个PCR样本设置3个平行,所得产物混合后2%琼脂糖凝胶电泳检测,最后通过Illumina HiSeq测序平台,对扩增子片段进行高通量测序[16-17]。
1.3.4 序列数据处理与分析
得到的高通量测序数据截去Barcode和引物序列后使用FLASH(1.2.7)[18]对每个样品reads进行拼接,得到原始数据(Raw Tags);经过过滤处理得到高质量的Tags数据(Clean Tags)[19];参照Qiime(1.7.0)[20]的Tags质量控制流程处理后,序列通过(UCHIME Algorithm)[21]与数据库(Gold database)进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。利用Uparse软件(Uparse v7.0.1001)[22]对所有样品的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),同时会选取OTUs的代表性序列,依据其算法原则,筛选的是OTUs中出现频数最高的序列作为OTUs的代表序列。最终利用QIIME(v1.7.0)对微生物群落多样性进行分析、样品微生物群落主坐标分析(principal coordinate analysis,PCoA)和典型相关性分析(canonical correlation analysis,CCA)[23-25]。
1.3.5 理化指标的检测
pH值测定:参考GB 5009.237—2016《食品pH值的测定》[26];总氮测定:参考GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法[27];淀粉、还原糖的测定:参考GB 5009.9—2016《食品中淀粉的测定》[28];水分的测定:参考GB 5009.3—2016《食品中水分的测定》[29]。
2 结果与分析
2.1 稀释性曲线与Shannon曲线
为探究高温大曲曲皮和曲心微生物,采用Illumina HiSeq高通量测序技术对不同贮存期的曲皮和曲心微生物多样性进行分析,结果见图1。由图1可知,在稀释性曲线中,随着测序深度的增加,曲线急剧上升后趋于平缓,样品优质序列覆盖率>98%,说明此时测序数据量较为合理。
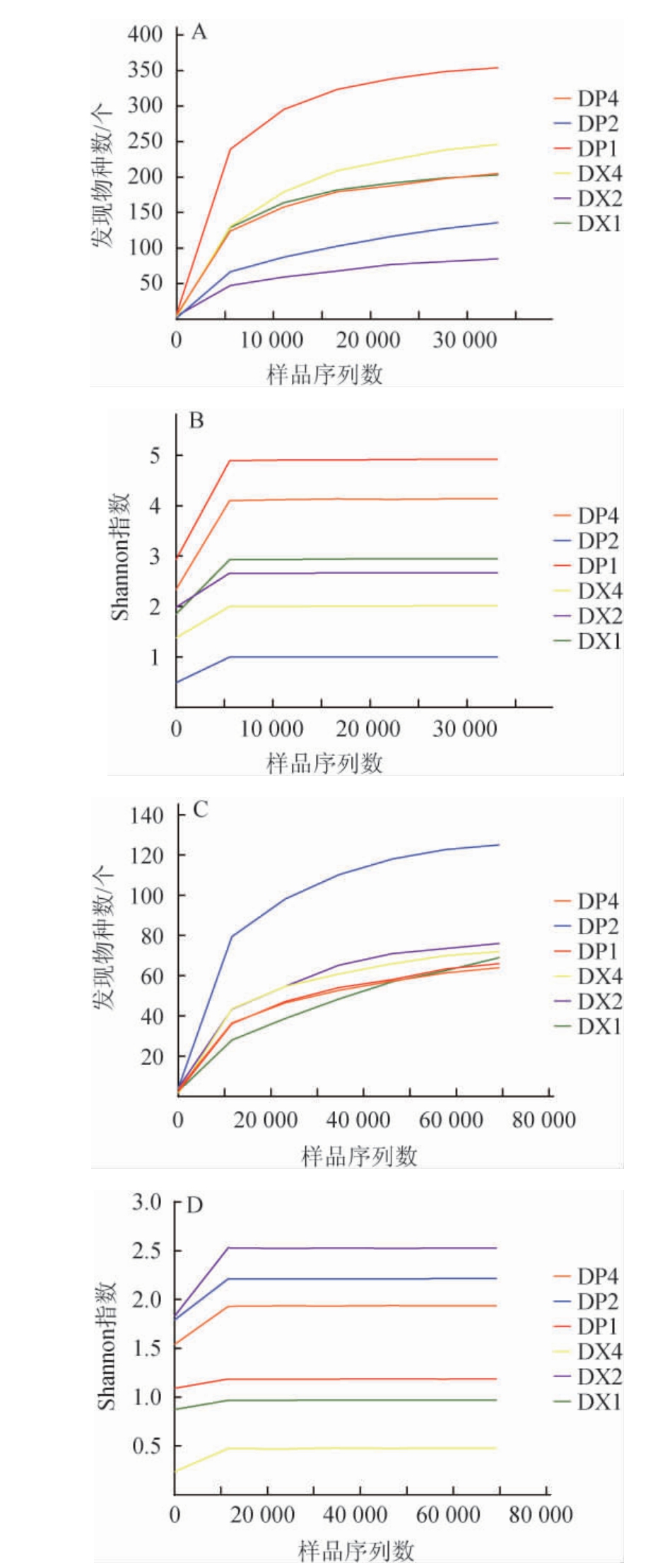
图1 不同贮存期大曲曲皮、曲心样品稀释性曲线和Shannon曲线
Fig.1 Rarefaction curve and Shannon curve of Daqu surface and central of different storage
(A)16 S rRNA基因样本稀释曲线;(B)16S rRNA基因样本Shannon曲线;(C)ITS1样本稀释曲线;(D)ITS1样本Shannon曲线。
2.2 高通量测序质控及多样性分析
原核及真核微生物测序质控与多样性分析结果分别见表2。此次测序共检测到16S rRNA基因V3-V4区序列314 707条,OTUs总计666个,ITS1区序列462 160条,OTUs总计192个。由表2可知,在储存30 d的大曲曲皮中,微生物的多样性最高,Shannon指数为4.92;在30 d和60 d的储存阶段,表征曲皮中微生物多样性的Shannon指数急剧降低至1.01;随着储存期延长至120 d,曲皮中的微生物多样性得到一定程度的恢复,Shannon指数回升至4.13。曲心中微生物多样性在整个储存期间逐渐降低,Shannon指数由最初30 d的2.95缓慢降低至120 d的2.02。在整个大曲储存期间,曲皮曲心中真核微生物的多样性均呈现先升高再降低的趋势,Shannon指数在储存60 d时达到最大值,分别为2.22和2.53,然后逐渐降低。储存120 d的大曲曲心中微生物多样性最低,其Shannon指数为0.47。
表2 微生物测序质控与多样性分析
Table 2 Quality control and diversity analysis of microorganism
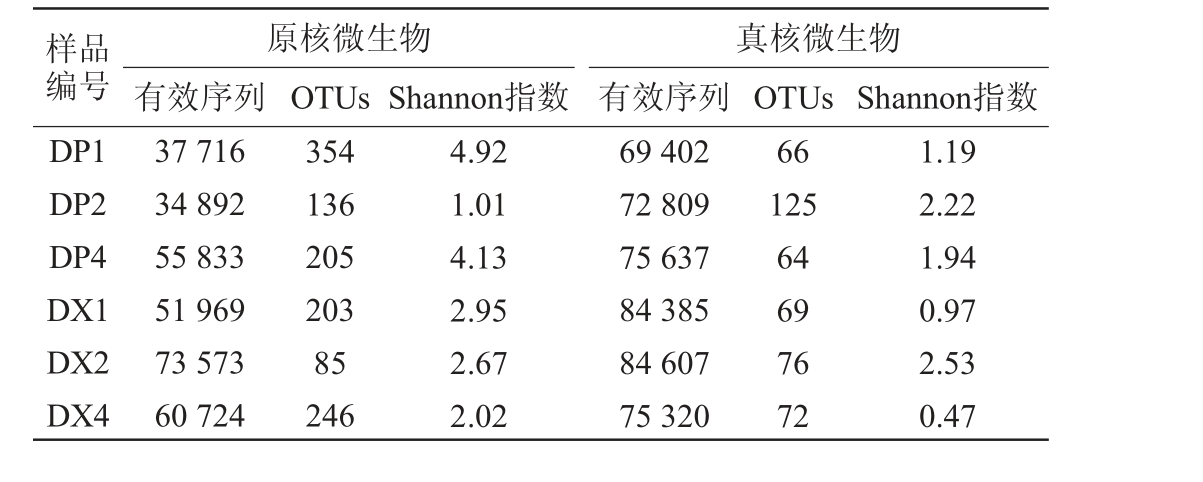
样品编号DP1 DP2 DP4 DX1 DX2 DX4原核微生物有效序列 OTUs Shannon指数真核微生物有效序列 OTUs Shannon指数37 716 34 892 55 833 51 969 73 573 60 724 354 136 205 203 85 246 4.92 1.01 4.13 2.95 2.67 2.02 69 402 72 809 75 637 84 385 84 607 75 320 66 125 64 69 76 72 1.19 2.22 1.94 0.97 2.53 0.47
2.3 曲皮和曲心微生物群落结构
针对不同贮存期大曲曲皮曲心原核、真核微生物的门水平、属水平进行了分析,结果见图2。由图2可知,经过高通量测序及质控后所得OTUs的代表序列进行比对,除去不能有效比对的序列外,原核微生物测序共鉴定出20个门,280个属。其中相对含量>1%的有:厚壁菌门(Firmicutes)(81.8%),变形菌门(Proteobacteria)(7.7%),放线菌门(Actinobacteria)(6.1%)。相比原核微生物,真核微生物测序鉴定出的物种相对较少,共有4个门,57个属。子囊菌门(Ascomycota)占72.9%,接合菌门(Zygomycota)占26.8%,担子菌门(Basidiomycota)占0.2%。
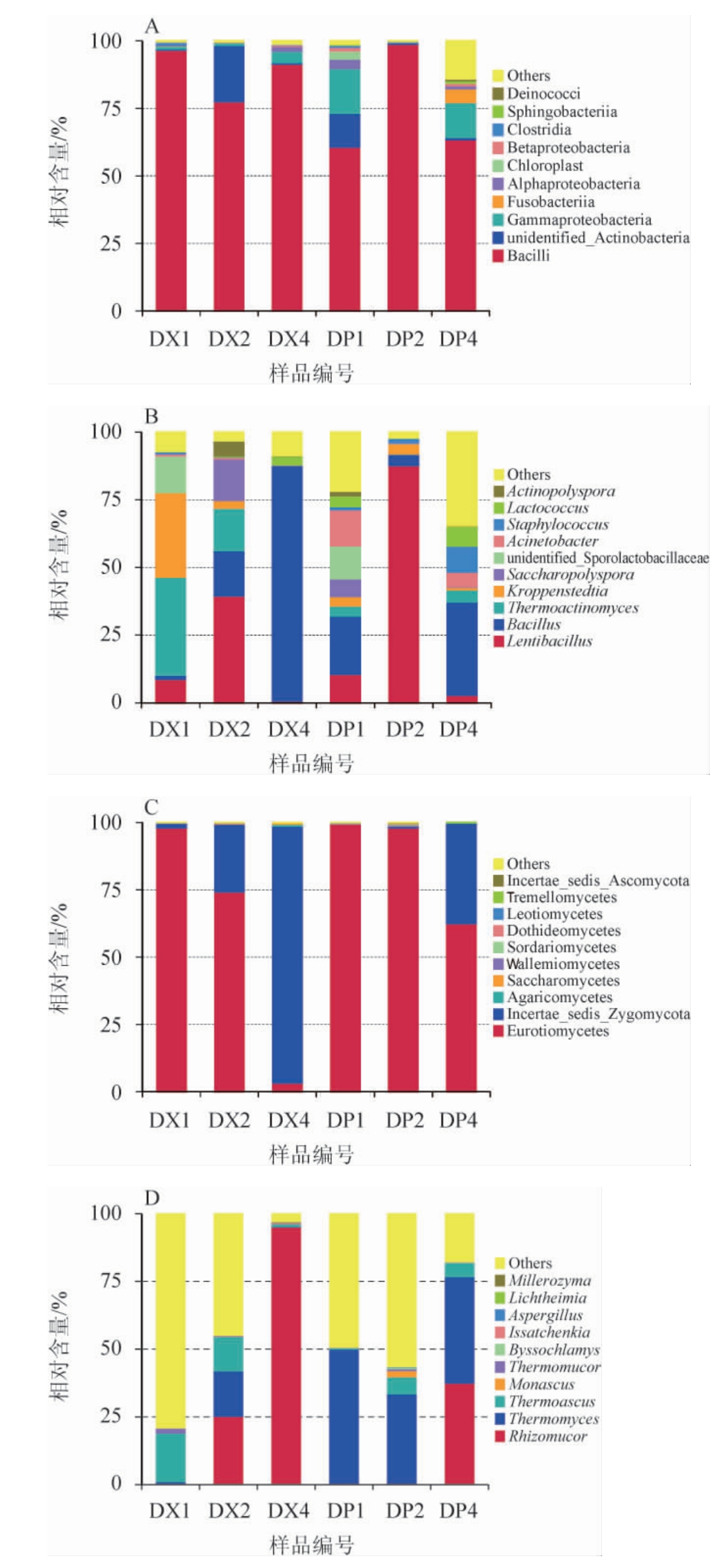
图2 基于门水平及属水平不同贮存期大曲曲皮、曲心样品微生物群落结构
Fig.2 Microbial community structure in Daqu surface and central of different storage at phylum level and genus level
A:原核生物门水平;B:原核生物属水平;C:真核生物门水平;D:真核生物属水平。
为了详细分析大曲经过不同时间的贮存曲皮和曲心微生物群落的变化情况,选择属水平制作原核微生物物种聚类热图和真核微生物物种聚类热图,结果见图3。由图3可知,在贮藏期间,曲皮中解淀粉芽孢杆菌(B.amyloliquefaciens)占比从13.57%降低至8.69%,地衣芽孢杆菌(B.licheniformis)占比从4.26%增长至24.21%,不动杆菌属(Acinetobacter sp.)占比从12.89%降低至4.27%,嗜热子囊菌(T.aurantiacus)占比从48.29%降低至15.52%;曲心中地衣芽孢杆菌比例从未检出增长至占47.7%,解淀粉芽孢杆菌占比从0.93%增长至40.1%,微小根毛霉从贮存30 d时的未检出增长至120 d时占比达95.08%,而Kroppenstedtia eburnea占比自30.52%降低至0.01%,高温放线菌(T.vulgaris)占比从31.81%降低至0.05%,嗜热子囊菌占比从78.65%降低至1.23%。
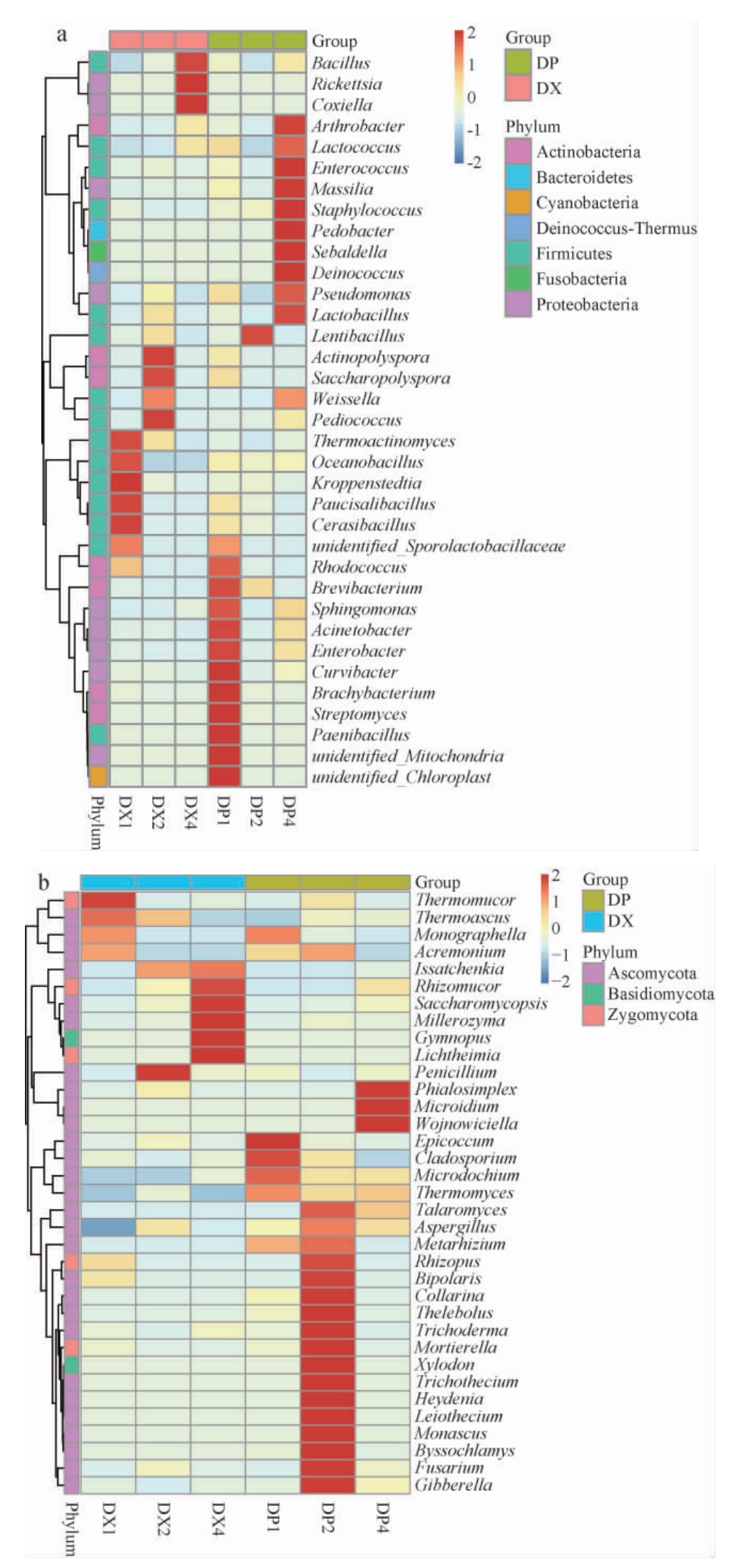
图3 原核(a)及真核(b)微生物属水平上物种聚类分析热图
Fig.3 Heat map of clustering analysis of prokaryotic (a) and eukaryotic (b) microbes at genus level
2.4 微生物群落的PCoA结果
不同贮存时间大曲曲皮、曲心原核、真核微生物群落的PCoA分析见图4。由图4A可知,120d曲心独自位于第一象限,120 d曲皮独自位于第二象限。可见贮存期达到120 d后原核微生物的菌群结构和之前相比发生了很大的改变。大曲曲皮贮存30 d、60 d原核微生物群落结构没有显著性差异,都在第四象限。由图4B可知,不同贮存期大曲曲心真核微生物群落分别位于第一、二、三象限,群落结构差异性很明显。
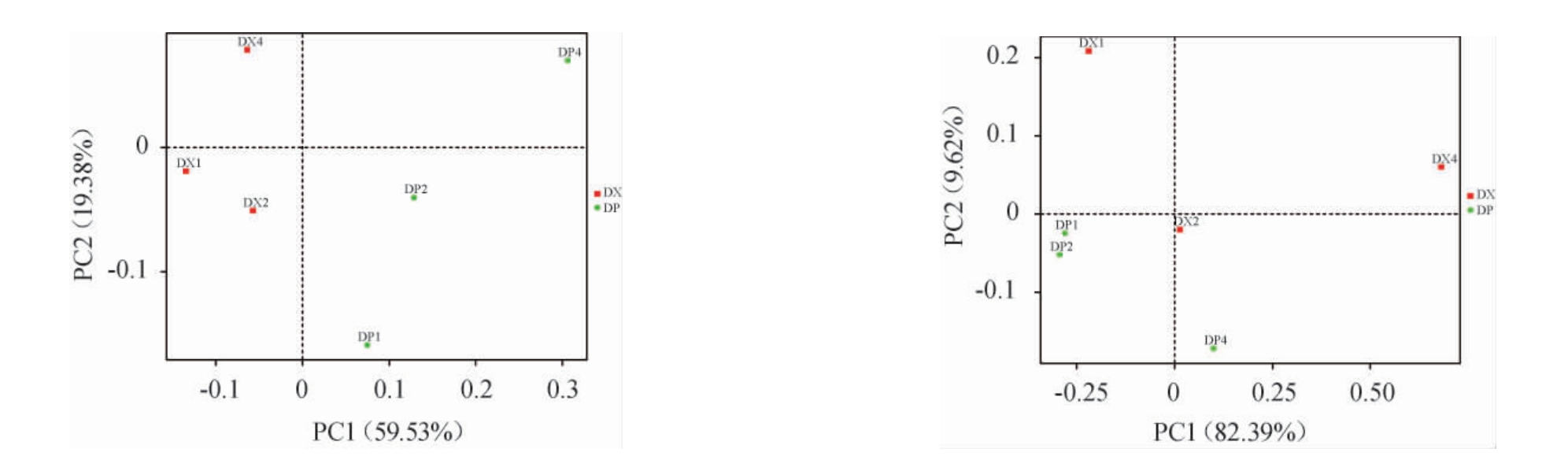
图4 不同贮存期大曲曲皮和曲心微生物群落主坐标分析结果
Fig.4 Principal coordinate analysis results of microbial community of Daqu surface and central part in different storage period
2.5 微生物同现性分析
通过高通量测序获得的大曲曲皮和曲心原核、真核微生物群落结构,随着贮存时间的推移,其结构也有不同的变化。这其中不同种属的微生物之间也存在着相互作用,但传统方法只能研究个别菌株的相互作用。大曲中原核、真核微生物相互作用关系见图5。由图5可知,原核微生物同现性网络关系较为复杂,大量厚壁菌门(Firmicutes)物种集中在网络中央,与其他大多数原核微生物都有相关性,多数为负相关,但芽孢杆菌属与其他原核微生物大都呈正相关。醋酸菌门(Acidobacteria)在网络中下部,几乎与所有物种都呈负相关。由图5可知,真核微生物间关系相对简单,较为关注的几种真核微生物的关系为:复膜孢酵母属(Saccharomycopsis)与伊萨酵母属(Issatchenkia)、横梗霉属(Lichtheimia)、根毛霉属(Rhizomucor)、毕赤酵母属(Pichia)两两均为负相关,明梭孢属(Monographella)与上述真菌均为正相关。
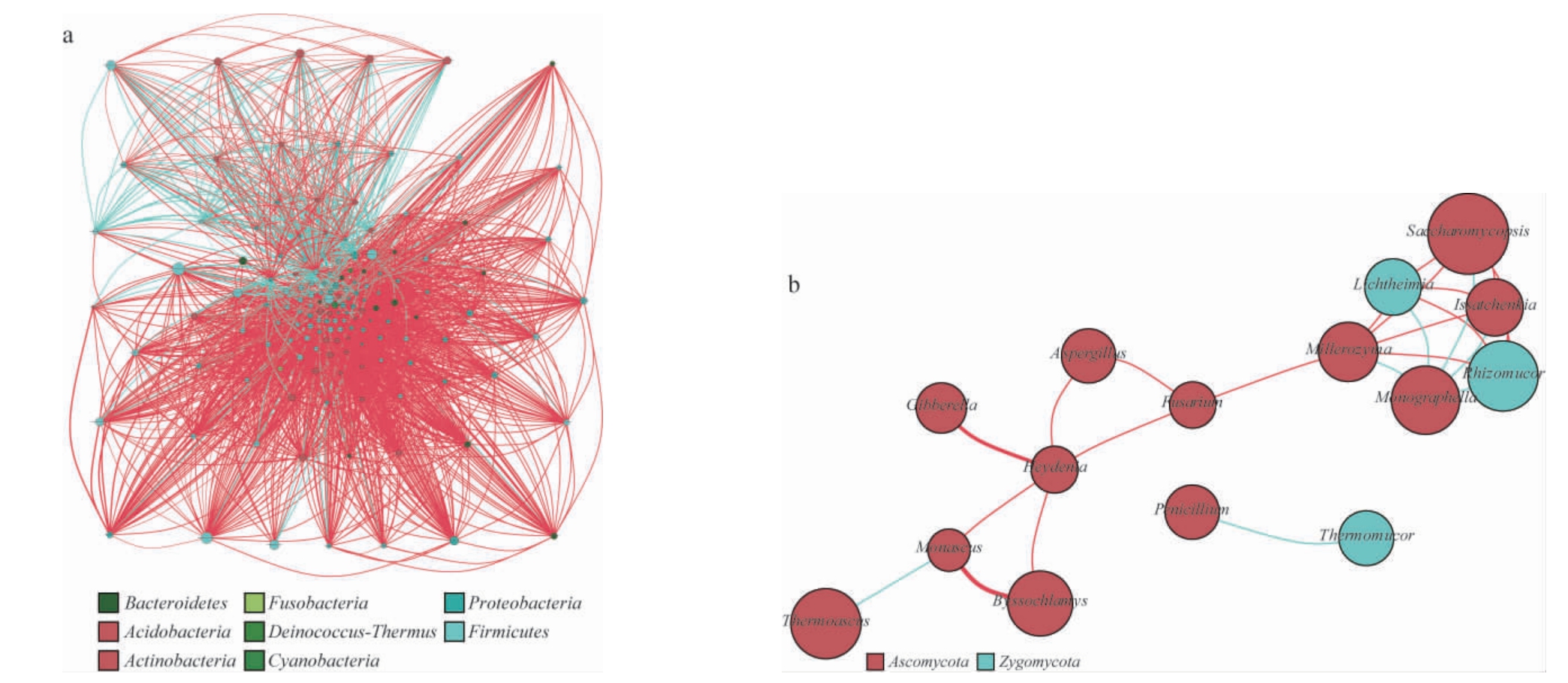
图5 贮存过程中大曲原核(a)及真核(b)微生物同现性网络分析
Fig.5 Cooccurence network analysis of prokaryotic (a) and eukaryotic (b) microorganisms during storage
蓝线为正相关,红线为负相关。下同。
2.6 不同贮存期大曲曲皮、曲心中可培养微生物计数
由表3可知,除曲皮中的乳酸菌外,贮存120 d的大曲曲皮和曲心微生物活菌数远高于贮存30 d和60 d的大曲。贮存期为120 d样品相比30 d样品,曲皮和曲心中细菌总数分别高出89.5倍和21.7倍;在曲皮中乳酸菌数稍有降低,而曲心乳酸菌经贮存后提升18.5倍。孟加拉红平板上长出的多为霉菌,酵母数量极少。与贮存30 d的大曲相比,贮存120 d的大曲真菌数量也增长显著,其中曲皮和曲心中真菌数量增长分别达82.9倍和13.9倍。
表3 不同贮存期大曲曲皮曲心的微生物计数结果
Table 3 Microbial count results of Daqu surface and central part in different storage periods×104(CFU·g-1)
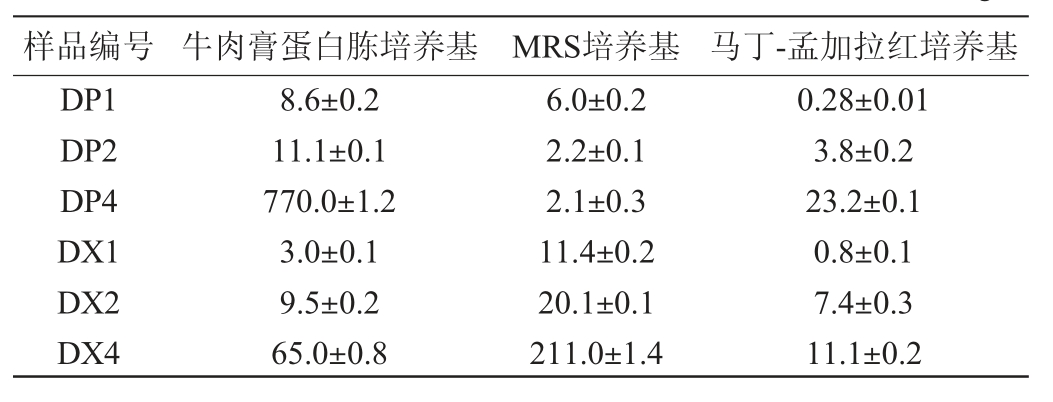
样品编号 牛肉膏蛋白胨培养基 MRS培养基 马丁-孟加拉红培养基DP1 DP2 DP4 DX1 DX2 DX4 8.6±0.2 11.1±0.1 770.0±1.2 3.0±0.1 9.5±0.2 65.0±0.8 6.0±0.2 2.2±0.1 2.1±0.3 11.4±0.2 20.1±0.1 211.0±1.4 0.28±0.01 3.8±0.2 23.2±0.1 0.8±0.1 7.4±0.3 11.1±0.2
2.7 不同贮存期大曲曲皮和曲心的理化指标
由表4可知,曲心pH值在经过120 d的贮存相对保持不变,且高于曲皮;曲皮pH随着时间逐步升高。在贮存过程中大曲曲皮和曲心的水分均逐渐降低,曲心水分相对较高,贮存30 d的大曲曲心水分仍达14.22%。曲皮中总氮随时间不断降低,曲心中则是在60 d时升高后保持不变。曲皮中还原糖含量均高于曲心,且随时间延长逐渐升高。
表4 不同贮存期大曲曲皮、曲心的理化指标
Table 4 Physical and chemical indexes of Daqu surface and central part in different storage periods
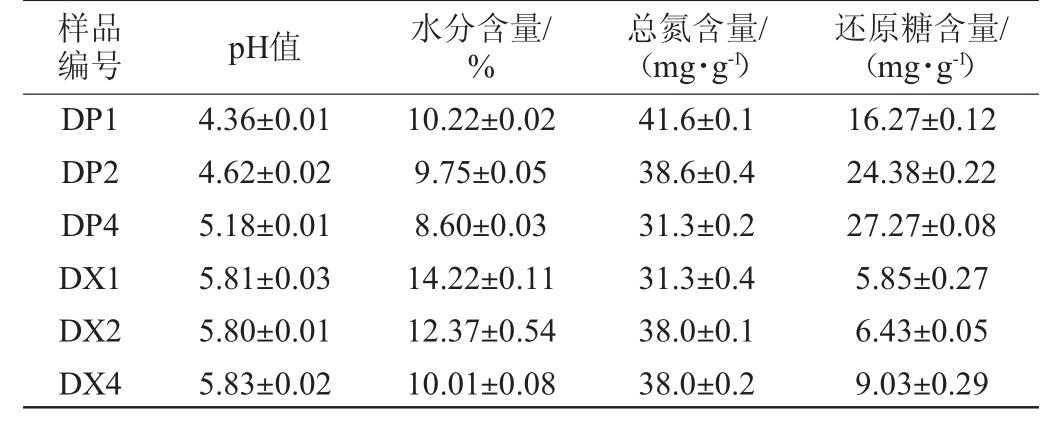
样品编号 pH值 水分含量/%总氮含量/(mg·g-1)还原糖含量/(mg·g-1)DP1 DP2 DP4 DX1 DX2 DX4 4.36±0.01 4.62±0.02 5.18±0.01 5.81±0.03 5.80±0.01 5.83±0.02 10.22±0.02 9.75±0.05 8.60±0.03 14.22±0.11 12.37±0.54 10.01±0.08 41.6±0.1 38.6±0.4 31.3±0.2 31.3±0.4 38.0±0.1 38.0±0.2 16.27±0.12 24.38±0.22 27.27±0.08 5.85±0.27 6.43±0.05 9.03±0.29
2.8 微生物与理化性质相关性分析
判别分析显示第一轴数值>4.0,因此使用CCA对微生物与理化性质相关性进行分析,结果见图6。
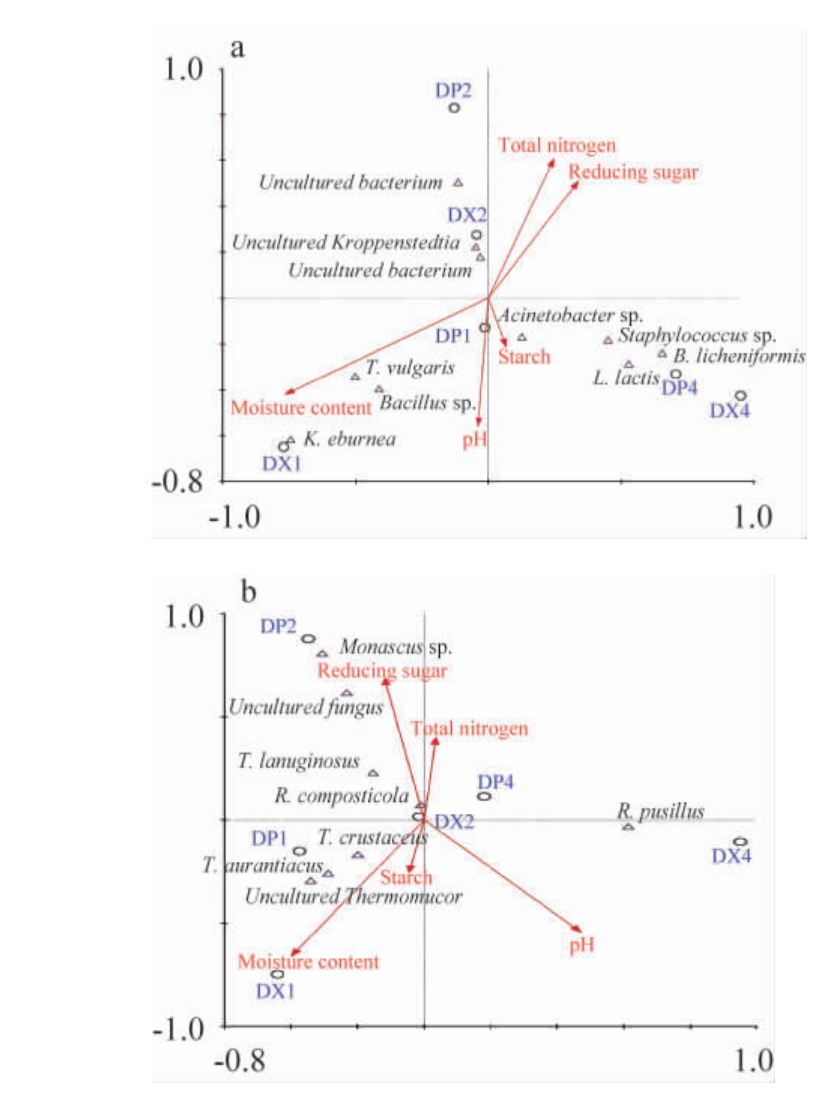
图6 不同贮存期大曲曲皮曲心原核(a)及真核(b)微生物与理化指标典型相关性分析
Fig.6 Canonical correlation analysis of prokaryotic (a) and eukaryotic (b) microorganisms and physicochemical properties of Daqu surface and central part in different storage period
由图6可知,理化性质中总氮和还原糖夹角较小,呈正相关,与其他理化性质呈负相关。由图6A可知,原核微生物中,Kroppenstedtia eburnea、芽孢杆菌属(Bacillus)、高温放线菌属(Thermoactinomyces)与水分含量和pH值夹角较小,为正相关。Uncultured bacterium和Uncultured Kroppenstedtia与pH值呈负相关,而乳酸菌属、不动杆菌属和葡萄球菌属相对集中,与未培养微生物属呈负相关关系。由图6B可知,真核微生物中,未培养真菌属(Uncultured fungus)、红曲霉属(Monascus)与还原糖和总氮呈负相关,而与水分呈正相关;Uncultured Thermomucor、嗜热子囊菌(Thermoascus)对水分较为敏感,呈正相关;微小根毛霉(R.pusillus)与还原糖含量呈正相关,与水分呈负相关。
3 讨论
3.1 大曲贮存过程中微生物群落演替规律及其发酵功能
高温大曲曲块在曲房中经过约30 d的发酵后被移至曲库中存放,一般需贮存3~4个月左右后才能用于生产。梁丽文等[11]研究表明,储存120 d的大曲在出酒率及产酯率等方面均优于储存30 d的大曲。本研究结果表明,高温大曲在贮存过程中微生物群落结构发生了显著的变化,从早期时的以嗜热子囊菌(Thermoascus)和高温放线菌(Thermoactinomyces)等嗜热菌为主演变为贮存后期时的以芽孢杆菌(Bacillus)、乳酸菌和微小根毛霉(R.pusillus)等中高温型微生物为主。在120 d的贮存期内,随着贮存时间的延长,大曲中的原核和真核微生物数量均有明显增加。这表明高温大曲的贮存并不是一个简单的物理存放过程。从微生物群落的演替结果看,可以认为大曲的贮存相当于大曲制作的后熟过程。
高温大曲曲皮中地衣芽孢杆菌占主导,曲心中则是解淀粉芽孢杆菌(B.amyloliquefaciens)为主。芽孢杆菌生长代谢能产生大量蛋白酶,是白酒酿造过程中的重要功能菌种。有研究表明大曲中细菌在贮存前期不断积累酸醇类物质,后期产生酯类和含氮类风味物质及提供丰富的酶系辅助发酵[30]。贮存期间高温大曲曲心中的乳酸菌数量增长了近20倍,这与曲心中的微好氧环境有关。白酒酿造过程中存在适量的乳酸菌有利于维护酿酒环境、促进发酵、促进美拉德反应等作用[31]。清香型汾酒大曲中乳酸菌在贮存期后期呈增长趋势,这与本研究结果一致[32]。从白云边高温大曲[33]和茅台地区酱香型酒糟中均分离到微小根毛霉(R.pusillus),该菌株具有较强的降解淀粉的能力[34]。本研究结果进一步表明微小根毛霉(R.pusillus)是贮存后期的白云边高温大曲中的优势真菌,大曲贮存过程中的还原糖含量呈增加趋势,可能与此菌有关。
3.2 微生物菌群结构与大曲理化性质的相关性
通常,食品随着贮存期内大曲水分逐渐降低,微生物的数量呈下降趋势。但本研究结果显示,高温大曲经过120 d贮存后微生物数量大幅度增加,其中曲皮和曲心的细菌总数分别增加了89.5倍和21.7倍,真菌数量分别增加了82.7和13.9倍。由于贮存30 d的大曲曲心水分仍达到14%以上,在大曲内部局部微环境中的水分可能更高,使得贮存期间大曲中的微生物能够继续生长繁殖从而出现微生物数量显著增长的现象。随着大曲贮存时间的增加和水分的逐渐降低,有利于耐干燥的微生物如芽孢杆菌和某些霉菌的生长和生存,而不耐干燥的只适合高温生长的微生物如高温放线菌(Thermoactinomyces)等菌数比例将显著下降。微小根毛霉(R.pusillus)能够降解淀粉、纤维素和蛋白质,在低水分下还具有一定生物活性,逐渐成为大曲贮存后期的优势菌种[35]。
4 结论
储存过程是制备成熟大曲必不可少的步骤,随着还原糖和水分等理化因子的变化,曲皮曲心中的微生物数量均有显著增加,主要的微生物群落也由前期的嗜热微生物向后期的中高温微生物转变。储存120 d后,大曲曲皮中主要细菌种类为地衣芽孢杆菌,曲心中的优势细菌为解淀粉芽孢杆菌。此外,曲心中乳酸菌的数量也有显著增加。微小根毛霉在成熟大曲的曲皮与曲心中均占优势。大曲的贮存过程起到了优化大曲中微生物菌群结构的作用,使大曲中微生物种群结构向更有利于酿制优良白酒方向演替。
[1] ZHENG X W, HAN B Z. Baijiu, Chinese liquor: History, classification and manufacture[J].J Ethn Food,2016,3(1):19-25.
[2]ZHENG X W,TABRIZI M R,NOUT M J,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2012,117(1):82-90.
[3]高传强,阳飞,张华山.芝麻香型白酒微生物菌群及风味物质研究进展[J].微生物学通报,2017,44(4):940-948.
[4]曹宇,翟磊,信春晖,等.芝麻香型白酒高温大曲制曲过程中微生物群落结构特征的磷脂脂肪酸(PLFA)分析[J].酿酒科技,2016(3):33-36.
[5]王晓丹,班世栋,周鸿翔,等.贵州省遵义地区3个酱香型大曲细菌群落的比较分析[J].食品科学,2016,37(7):110-116.
[6]LIU X,GUO K L,ZHANG H X.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCRdenaturing gradient gel electrophoresis[J].World J Microbiol Biotechnol,2012,28(6):2375-2381.
[7]孙利林,李立郎,胡萍,等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技,2020,36(8):1-10.
[8]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[9]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu),revealed by culture-dependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[10]施思,彭智辅,乔宗伟,等.浓香型大曲贮存过程中糖化力发酵力变化及真菌多样性分析[J].食品与发酵工业,2017,43(5):76-79.
[11]梁丽文,缪礼鸿,杨团元,等.浓酱兼香型白酒不同储存期的高温大曲微生物群落结构与发酵特征分析[J].酿酒科技,2016(7):37-41.
[12]李丹宇.浓香型大曲制备过程中理化指标及微生物群落演替规律的研究[D].自贡:四川理工学院,2013.
[13]陈蒙恩,韩素娜,侯建光,等.陶融型大曲培养贮存过程生化指标变化规律及相关性研究[J].食品与发酵工业,2020,46(13):146-151.
[14]罗惠波,黄治国,李浩,等.浓香型大曲原核微生物群落的PCR-SSCP解析[J].微生物学通报,2009,36(9):1363-1367.
[15]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[16]施思,彭智辅,乔宗伟,等.浓香型大曲储藏过程中细菌菌群差异性分析[J].食品工业科技,2017,38(18):151-159.
[17]唐小丽,翟磊,信春晖,等.利用Biolog技术分析芝麻香型白酒高温大曲微生物群落结构及多样性[J].酿酒科技,2015(12):7-11.
[18] MAGOC T,STEVEN L.FLASH: fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[19]BOKULICH N A,SUBRAMANIA S,FAITH J J,et al.Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J].Nature Meth,2013,10(1):57-59.
[20]CAPORASO C,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Meth,2010,7(5):335-336.
[21]ROBERT C,BRIAN J,JOSE C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[22]HAAS B J,GEVERS D,EARL A M,et al.Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J].Genome Res,2011,21(3):494-504.
[23]XIONG X,HU Y,YAN N,et al.PCR-DGGE analysis of the microbial communities in three different Chinese "Baiyunbian" liquor fermentation starters[J].J Microbiol Biotechn,2014,24(8):1088-1095.
[24] ZHENG J, LIANG R, ZHANG L, et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J].Food Res Int,2013,54(1):660-666.
[25] LI P, LIN W, LIU X, et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus, Pediococcus, Wickerhamomyces and Saccharomycopsis[J].Food Microbiol,2017,61(1):83-92.
[26]中华人民共和国国家卫生和计划生育委员会.GB 5009.237—2016食品pH值的测定[S].北京:中国标准出版社,2016.
[27]中华人民共和国国家卫生和计划生育委员会.GB 5009.5—2016 食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[28]中华人民共和国国家卫生和计划生育委员会.GB 5009.9—2016 食品中淀粉的测定[S].北京:中国标准出版社,2016.
[29]中华人民共和国国家卫生和计划生育委员会.GB 5009.3—2016 食品中水分的测定[S].北京:中国标准出版社,2016.
[30]梁晨,杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报,2017,44(2):384-393.
[31]刘雪,曹建全,李霞,等.景芝浓香大曲随储存期延长的变化规律[J].酿酒科技,2018(3):65-71.
[32] LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,51(4):430-438.
[33]刘婷婷,张明春,曾驰,等.白云边酒大曲及小麦原料中主要微生物的分析[J].中国酿造,2010,29(11):32-35.
[34]任勰珂,陈莉,卢红梅,等.茅台地区酱香型酒糟中高温真菌的分离鉴定[J].中国酿造,2017,36(2):69-74.
[35]STERGIOU P Y,FOUKIS A,GKINI O A,et al.Novel FRET-substrates of Rhizomucor pusillus, Rennin: Activity and mechanistic studies[J].Food Chem,2017,245:926-933.