酒在人类生活中扮演着不可或缺的角色,有研究表明,酒精可通过产生毒性代谢产物、引起代谢相关酶及辅酶的变化、引起微循环障碍及肝内低氧血症、肝纤维化、产生大量活性氧基团以及引起细胞免疫异常等机制导致肝脏损伤[1-2]。酒精性肝损伤是较为常见的一种肝脏疾病,主要表现为酒精性肝炎、肝硬化等,严重可造成肝癌危及生命[3]。目前临床上治疗酒精性肝脏损伤的方法主要有戒断饮酒和药物治疗等,而戒酒很难实现,长期服药对机体产生副作用[4],因此研发一款解酒效果良好、无副作用的解酒护肝产品具备广阔的前景。
酵素是植物或植物果实通过微生物发酵制得含有生物活性物质的产品,主要成分包括酶、菌催化类物质以及抗氧化活性物质,这些物质的次生代谢产物在调节生理机能方面和药物中所发挥的调节功能类似,但含量不高,长期服用无毒副作用[5]。葛根(Puerariae lobatae Radix)是药食同源物质,为豆科植物野葛的成熟干燥块根,葛根中含有三萜类、异黄酮类、皂苷类及多糖类等多种成分,具有解肌退热、生津止渴、透疹、通经活络、解酒毒等功效,对于肝损伤也有保护作用,葛根酵素中含有的γ-氨基丁酸(γ-aminobutyric acid,GABA),可以减缓胃肠道对酒精的吸收速度并加速酒精代谢,起到解酒、防醉的功效[6]。葛根提取物对慢性和急性酒精中毒小鼠具有保护作用,研究发现葛根提取物可以使小鼠醉酒时间缩短,同时缩短醒酒时间,降低血液中的乙醇浓度。枳椇子(Hoveniae dulcis Semen)同样为药食同源物质,是鼠李科植物枳椇的干燥果柄和种子,枳椇子含有生物碱类、黄酮类、脂肪酸类、皂苷、糖苷、葡萄糖等成分,具有利水消肿、解酒毒等功效,对肝损伤也有保护作用[7]。洛神花(Hibiscus sabdariffa)又名玫瑰茄,是锦葵科木槿属的草本植物,其花萼中含有多种氨基酸、还原糖及有机酸等,并含有花青素、果胶可作药物的配料[8]。根据文献记载,黄酮类化合物为解酒护肝的主要成分,葛根、枳椇子、洛神花中均含有丰富的黄酮类化合物,如葛根素、槲皮素、二氢杨梅素等活性成分[9]。3种原料中的黄酮类化合物能使乙醇脱氢酶和乙醛脱氢酶活性提高,加速分解乙醇及代谢物,起到解酒护肝的作用[10]。
葛根、枳椇子作为药食同源食品,具有解酒功能的酵素多以葛根、枳椇子为原料,经发酵的产品解酒功能良好[11]。本研究在选取葛根、枳椇子为原料的基础上,辅以洛神花经益生菌(植物乳植杆菌(Lactobacillus plantarum)、罗伊氏粘液乳杆菌(Lactobacillus reuteri)、鼠李糖乳酪杆菌(Lactobacillus rhamnosus))共同发酵制备草本酵素,分析酵素营养成分。通过酒精灌胃方法建立小鼠醉酒模型,初步探究以葛根、枳椇子、洛神花为原料制备的草本酵素对小鼠解酒护肝的作用。旨在设计一种安全、有效的解酒护肝产品,为葛根枳椇子洛神花本草酵素在解酒护肝方面的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
清洁级雄性昆明小鼠(18~20 g,6~8周龄):辽宁长生生物有限公司;葛根(无硫):樟树市仁德中药饮片有限公司;枳椇子(无硫):河北金叶子药业有限公司;玫瑰茄:桐乡市海泰菊业有限公司;植物乳植杆菌(Lactobacillus plantarum)HCS03-001、罗伊氏粘液乳杆菌(Lactobacillus reuteri)HCS02-001、鼠李糖乳酪杆菌(Lactobacillus rhamnosus)HCS01-013:江西仁仁健康产业有限公司;白酒(56%vol):市售。
1.1.2 化学试剂
无水葡萄糖(分析纯):石药集团圣雪葡萄糖有限责任公司;酵母浸出物、酵母蛋白胨(均为生化试剂):安琪酵母股份有限公司;L-苹果酸(分析纯):常茂生物化学工程股份有限公司;一水柠檬酸(分析纯):潍坊英轩实业有限公司;磷酸二氢钾、硫酸镁、硫酸锰(均为分析纯):江苏科伦多食品配料有限公司;无水氯化钙(分析纯):焦作市冠通化工有限公司;低聚异麦芽糖:保龄宝生物股份有限公司;氢氧化钠(分析纯):滨化集团股份有限公司;还原型谷胱甘肽(glutathione reduced,GSH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、乙醇脱氢酶(alcohol dehydrogenase,ADH)测定试剂盒:西格玛奥德里奇(上海)贸易有限公司。
1.1.3 培养基
菌株活化培养基:无水葡萄糖4.0%,酵母浸出物1.5%,酵母蛋白胨1.0%,L-苹果酸0.3%,一水柠檬酸0.2%,磷酸二氢钾0.2%,无水氯化钙0.05%,硫酸镁0.006%,硫酸锰0.001%。pH值5.0~7.0。115 ℃灭菌30 min。
1.2 仪器与设备
LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;DNP-420恒温培养箱、101A-3电热恒温干燥箱:北京市永久光明医疗器械有限公司;UPTB-10超纯水机:上海申分分析仪器有限公司;JA2003N精密千分之一电子天平:上海佑科仪器仪表有限公司;pHS-25B酸度计:上海大普仪器有限公司;SW-CJ-2D超净工作台:沈阳鑫科之杰仪器化玻有限公司;TG1650-WS台式高速离心机:上海卢湘仪离心机仪器有限公司;CS-2000高速多功能粉碎机:永康市天祺盛世工贸有限公司;UV-2000型可见紫外分光光度计:尤尼柯(上海)仪器有限公司产品。
1.3 试验方法
1.3.1 葛根枳椇子洛神花本草酵素加工工艺流程及操作要点

操作要点:用粉碎机对葛根、枳椇子等原料进行粉碎至100目,称取粉碎后的葛根、枳椇子及洛神花,三种原料配比为2∶2∶1,直接投入多功能提取罐以常温水浸泡3 h,料液比为1∶35(g∶mL)。蒸煮混合物料45 min,蒸煮过程中搅拌速度60~100 r/min。以5%的接种量将植物乳植杆菌HCS03-001、罗伊氏粘液乳杆菌HCS02-001、鼠李糖乳酪杆菌HCS01-013(配比为10∶9∶1)经过活化后接种于上述蒸煮混合物料中。接种后置于发酵罐中,装液量70%,搅拌速度为55 r/min,发酵温度为40 ℃,发酵时间为66 h,每小时检测pH值,当两次pH<0.15时,即发酵结束。得到发酵液在13 000 r/min条件下离心。上清液经过95 ℃灭菌30 min,得到葛根枳椇子洛神花草本酵素。
1.3.2 菌种配比的确定
以葛根、枳椇子、洛神花为原料,以植物乳植杆菌(Lactobacillus plantarum)HCS03-001、罗伊氏粘液乳杆菌(Lactobacillus reuteri)HCS02-001、鼠李糖乳酪杆菌(Lactobacillus rhamnosus)HCS01-013为发酵菌株,将3种菌株按照不同比例按照1.3.1的方式进行发酵,植物乳植杆菌(Lactobacillus plantarum)HCS03-001、罗伊氏粘液乳杆菌(Lactobacillus reuteri)HCS02-001、鼠李糖乳酪杆菌(Lactobacillus rhamnosus)HCS01-013比例分别为10∶0∶0、0∶10∶0、0∶0∶10、5∶5∶0、5∶0∶5、0∶5∶5、5∶1∶4、5∶4∶1,按照1.3.1节方法进行葛根枳椇子洛神花本草酵素的制备,并测定发酵液中总酸含量。
1.3.3 基本理化指标测定
乳酸的测定:参照国标GB 5009.157—2016《食品中有机酸的测定》;GABA的测定:参照轻工行业标准QB/T 5633.7—2022《氨基酸、氨基酸盐及其类似物第7部分:γ-氨基丁酸》;总酸的测定:参照国标GB/T 12456—2008《食品中总酸的测定》;粗多糖的测定:参照出入境检验检疫行业标准SN/T 4260—2015《出口植物源食品中粗多糖的测定》中的硫酸-苯酚法;多酚的测定:参照国标GB/T 31740.2—2015《茶制品第2部分:茶多酚》;游离氨基酸的测定:参照GB 5009.124—2016《食品中氨基酸的测定》;总黄酮的测定:参照出入境检验检疫行业标准SN/T 4592—2016《出口食品中总黄酮的测定》。
1.3.4 小鼠醉酒模型的建立
取清洁级雄性昆明小鼠70只,体质量18~20 g,随机分为7组,每10只一组,用酒精度56%vol白酒灌胃,每组设置不同的灌胃剂量,灌胃后小鼠立即放在垂直的铁丝网上,记录攀附时间、耐受时间、醉酒时间、醉酒率及死亡率来判断小鼠醉酒模型是否建立成功[12]。
1.3.5 醒酒实验
150只清洁级雄性昆明小鼠,体质量18~20 g,随机分为5组,每组30只,分别为①空白对照组;②酒精损伤模型组;③葛根枳椇子洛神花未发酵提取液组;④葛根枳椇子洛神花酵素低剂量组;⑤葛根枳椇子洛神花酵素中剂量组;⑥葛根枳椇子洛神花酵素高剂量组。实验组分别以2 mL/100 g体质量灌胃剂量给予不同剂量解酒配方(分别根据动物药理实验用药折算方法,70 kg人体剂量与20 g小鼠的剂量换算系数0.002 6,以人体剂量的1倍、5倍、10倍作为实验的低剂量组、中剂量组和高剂量组),每天按剂量灌胃1次,记录灌胃时间,共给药30 d,空白组和模型组每天灌胃等剂量生理盐水。末次灌胃后1 h,除空白组外按照小鼠醉酒模型选取13 mL/10 g一次性灌胃体积分数56%乙醇,禁食不禁水饲养。观察并记录小鼠的醉酒率、醉酒时间及醒酒时间[13]。
1.3.6 葛根枳椇子洛神花本草酵素对小鼠体质量的影响
将实验清洁级雄性昆明小鼠饲养在安静、清洁、通风和温暖的环境中,环境温度在(22±1)℃,相对湿度在45%~65%,保证小鼠自由饮食。将小鼠按体质量,随机分①空白对照组;②酒精损伤模型组;③葛根枳椇子洛神花酵素低剂量组;④葛根枳椇子洛神花酵素中剂量组;⑤葛根枳椇子洛神花酵素高剂量组。每组30只。各实验组连续灌胃4周,期间自由饮水、自由进食标准饲料。小鼠灌胃前和灌胃4周后每周测定小鼠体质量[14]。
1.3.7 血液乙醇浓度及肝脏代谢酶活性的测定
150只清洁级雄性昆明小鼠,随机分为5组,每组30只,分别为①空白对照组;②酒精损伤模型组;③葛根枳椇子洛神花未发酵提取液组;④葛根枳椇子洛神花酵素低剂量组;⑤葛根枳椇子洛神花酵素中剂量组;⑥葛根枳椇子洛神花酵素高剂量组。于灌酒后0.5 h、1.0 h、2.0 h、3.0 h小鼠眼眶取血。脱臼处死小鼠后取肝脏,用生理盐水浸洗,滤纸吸干后取肝脏组织备用。采用顶空气相色谱法测定血清中乙醇浓度;用试剂盒测定肝脏中乙醇脱氢酶(alcohol dehydrogenase,ADH)、超氧化物歧化酶(superoxide dismutase,SOD)酶活、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)的含量[15]。
1.3.8 数据处理
统计学方法采用SPSS 21.0软件,结果以“平均值±标准差”表示,Origin 8.5软件作图,采用单因素方差分析,P<0.05表示差异显著,P<0.01时表示差异极显著。
2 结果与分析
2.1 发酵菌种比例的确定
总酸是益生菌发酵的重要产物,菌株发酵产生的总酸越高证明益生菌发酵程度越好,因此以总酸为考察指标,确定发酵菌株的最佳比例。以5%的接种量分别接种不同比例的植物乳植杆菌、罗伊氏粘液乳杆菌、鼠李糖乳酪杆菌,经过37 ℃发酵48 h后测定总酸含量,结果见图1。
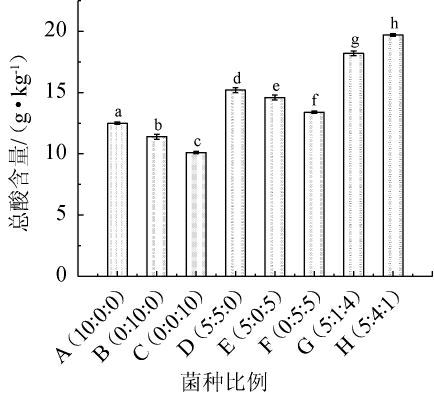
图1 不同发酵菌种的比例对发酵液总酸含量的影响(n=3)
Fig.1 Effects of ratio of different fermentation strains on total acid content in fermentation broth (n=3)
不同字母间代表组间差异显著(P<0.05)。
由图1可知,A、B、C 3组为单菌株发酵,分别只添加植物乳植杆菌、罗伊氏粘液乳杆菌、鼠李糖乳酪杆菌发酵,其中A组的总酸含量最高,为12.5 g/kg。D、E、F 3组为双菌株(比例5∶5)发酵,其中D组的总酸含量最高,为15.2 g/kg。G和H组分别添加3种菌株,G组添加植物乳植杆菌、罗伊氏粘液乳杆菌、鼠李糖乳酪杆菌发酵(5∶1∶4)共同发酵,H组添加植物乳植杆菌、罗伊氏粘液乳杆菌、鼠李糖乳酪杆菌(5∶4∶1)共同发酵。G、H两组对比,H组的总酸含量显著高于G组的活菌数(P<0.05),为19.7 g/kg。分析原因是三种不同菌种对于培养基的利用底物不同,因此生长优势不同,造成发酵液内总酸含量不同,在适宜的配比和生长条件下,可以实现高程度的发酵,产生的总酸含量较高,因此,选择植物乳植杆菌∶罗伊氏粘液乳杆菌∶鼠李糖乳酪杆菌最佳比例为5∶4∶1。
2.2 葛根枳椇子洛神花本草酵素的基本理化指标
GABA作为葛根枳椇子洛神花本草酵素内重要的基本理化指标,是由α-谷氨酸(α-aminoglutaric acid,GA)经过催化脱羧生成的非蛋白氨基酸[16]。GABA具有抗焦虑改善睡眠[17]、扩张血管降血压[18]、预防动脉硬化[19]和改善肝、肾脏功能[20]等多种生理功效。葛根总黄酮类成分具有较多生理功能,如调节免疫力、保护肝脏、改善调节肝肾功能,能明显改善酒精肝等症状,具有解酒的功能[21]。粗多糖具有降血脂、预防动脉粥样硬化、提升免疫力的功效[22]。
为探究葛根枳椇子洛神花本草酵素所含营养成分,测定葛根枳椇子洛神花本草酵素的基本理化指标。结果表明,粗多糖含量为12.95 mg/g,游离氨基酸含量3.61 mg/g,γ-氨基丁酸(GABA)含量86.66 μg/g,总酸含量21.29 g/kg,多酚含量4.32 mg/g,总黄酮含量392.45 mg/L。葛根枳椇子洛神花本草酵素内含有较为丰富的营养成分,其中的GABA和总黄酮类物质具有调节肝脏、解酒护肝的作用,为酵素发挥作用提供基础[23]。
2.3 小鼠醉酒模型的建立
建立小鼠醉酒模型,结果见表1。由表1可知,给酒量分别为0.13 mL/10 g、0.14 mL/10 g、0.15 mL/10 g、0.16 mL/10 g、0.17 mL/10 g、0.18 mL/10 g、0.19 mL/10 g,给酒量增加(≥0.16 mL/10 g)后,给酒量增加,小鼠攀附时间先缩短后增加再逐渐缩短,耐受时间缩短,醉酒时间显著延长(P<0.05),醉酒率增长,且在给酒量在0.19 mL/10 g时醉酒率达到100.00%。在低于0.17 mL/10 g小鼠未出现死亡现象,此时的醉酒率达到88.00%。0.18 mL/10 g的剂量对小鼠进行灌胃时,出现小鼠死亡的现象,死亡率达15.00%。因此,确定0.17 mL/10 g的体积分数为56%乙醇一次性灌胃。
表1 小鼠醉酒模型建立(n=30)
Table 1 Establishment of drunkenness model of mice (n=30)
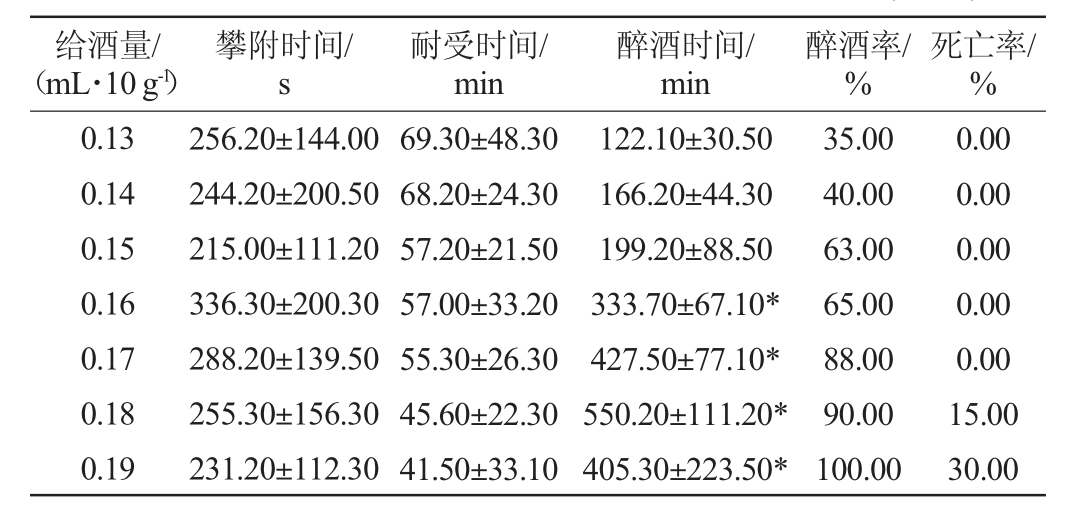
注:“*”表示与首组相比,差异显著(P<0.05)。
给酒量/(mL·10 g-1)攀附时间/s耐受时间/min醉酒时间/min醉酒率/%死亡率/%0.13 0.14 0.15 0.16 0.17 0.18 0.19 256.20±144.00 244.20±200.50 215.00±111.20 336.30±200.30 288.20±139.50 255.30±156.30 231.20±112.30 69.30±48.30 68.20±24.30 57.20±21.50 57.00±33.20 55.30±26.30 45.60±22.30 41.50±33.10 122.10±30.50 166.20±44.30 199.20±88.50 333.70±67.10*427.50±77.10*550.20±111.20*405.30±223.50*35.00 40.00 63.00 65.00 88.00 90.00 100.00 0.00 0.00 0.00 0.00 0.00 15.00 30.00
2.4 葛根枳椇子洛神花本草酵素对小鼠醒酒作用的影响
不同剂量葛根枳椇子洛神花本草酵素对小鼠醒酒作用的影响结果见表2。由表2可知,模型组醉酒率为86.70%,其余实验组的醉酒率显著低于模型组(P<0.05)。随着实验组剂量增高,小鼠醉酒时间缩短,对比模型组差异有统计学意义(P<0.05),醉酒时间分别缩短了25.82%、30.51%和33.78%。实验组醒酒时间对比模型组存在显著差异(P<0.05),醒酒时间分别缩短24.06%、24.58%和29.82%。以上结果说明,葛根枳椇子洛神花本草酵素有明显的醒酒作用,可缓解醉酒症状。
表2 不同剂量的葛根枳椇子洛神花本草酵素对小鼠醒酒的作用(n=30)
Table 2 Effects of different doses of Lactobacillus plantarum,Lactobacillus reuteri and Lactobacillus rhamnosus herbal Jiaosu on sobriety of mice (n=30)
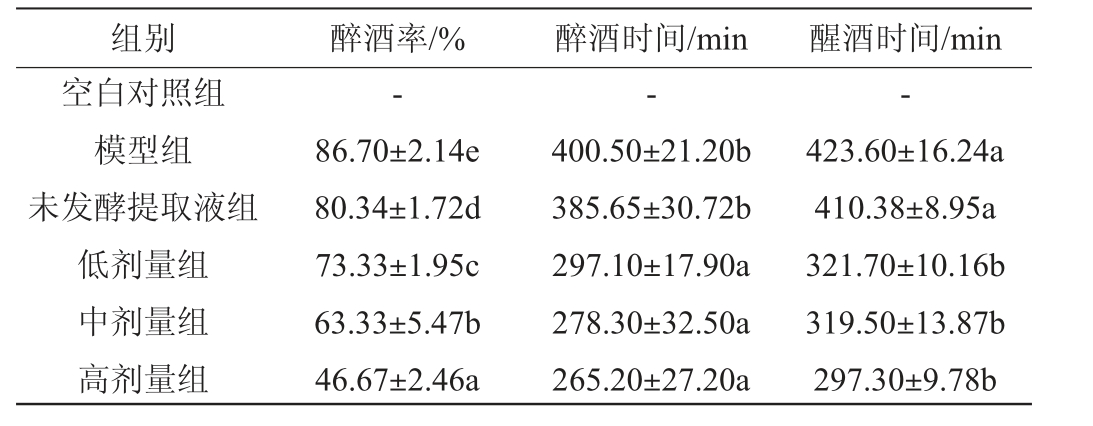
注:不同字母表示两组间有显著差异(P<0.05);“-”表示未饮用酒。下同。
组别 醉酒率/% 醉酒时间/min 醒酒时间/min空白对照组模型组未发酵提取液组低剂量组中剂量组高剂量组---423.60±16.24a 410.38±8.95a 321.70±10.16b 319.50±13.87b 297.30±9.78b 86.70±2.14e 80.34±1.72d 73.33±1.95c 63.33±5.47b 46.67±2.46a 400.50±21.20b 385.65±30.72b 297.10±17.90a 278.30±32.50a 265.20±27.20a
2.5 葛根枳椇子洛神花本草酵素对小鼠体质量的影响
对各组间小鼠体质量进行比较,结果见图2。由图2可知,随着时间的延长,各组间小鼠体质量有所提升。组间各剂量实验组与模型组相比,体质量无显著变化(P>0.05),说明服用葛根枳椇子洛神花本草酵素对于小鼠体质量无显著影响。
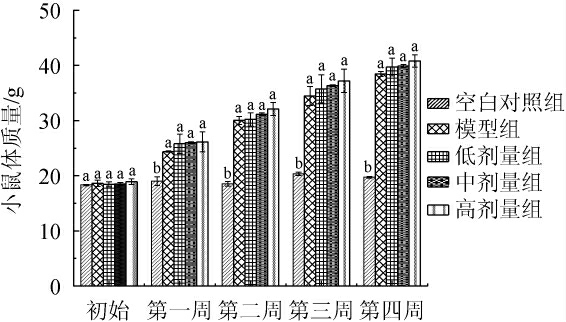
图2 不同剂量葛根枳椇子洛神花本草酵素对小鼠体质量的影响(n=30)
Fig.2 Effects of different doses of Lactobacillus plantarum,Lactobacillus reuteri and Lactobacillus rhamnosus herbal Jiaosu on body mass of mice (n=30)
不同字母表示组间存在显著差异(P<0.05)。下同。
2.6 葛根枳椇子洛神花本草酵素对小鼠血液中乙醇浓度的影响
白酒灌胃小鼠后采用不同剂量葛根枳椇子洛神花本草酵素干预小鼠,测定小鼠血液中乙醇浓度,结果见图3。由图3可知,灌酒0.5 h后,模型组的血液乙醇含量为3.12 mg/mL,在0.5~3.0 h中血液中的乙醇水平保持上升趋势。未发酵提取液组中的乙醇浓度低于模型组,差异不显著(P>0.05)。0.5 h各个剂量实验组乙醇含量显著低于模型组(P<0.05),1.0 h各个剂量实验组乙醇含量显著低于模型组(P<0.05),2.0 h中剂量实验组和高剂量实验组乙醇含量显著低于模型组(P<0.05),3.0 h各剂量实验组乙醇含量显著低于模型组(P<0.05)。结果表明,葛根枳椇子洛神花本草酵素可以降低小鼠血液乙醇浓度,快速完成乙醇转化,降低血液中乙醇的含量。
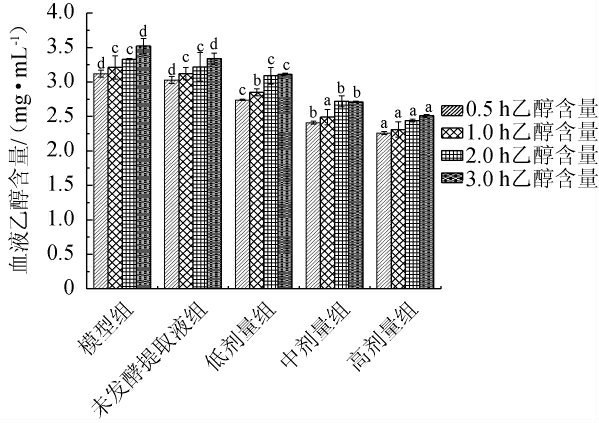
图3 不同剂量葛根枳椇子洛神花本草酵素对小鼠血液乙醇含量影响(n=30)
Fig.3 Effects of different doses of Lactobacillus plantarum,Lactobacillus reuteri and Lactobacillus rhamnosus herbal Jiaosu on blood alcohol concentration of mice(n=30)
2.7 葛根枳椇子洛神花本草酵素对小鼠肝脏代谢酶活性的影响
氧化应激是造成酒精性肝损伤的一个重要因素,出现氧化应激是因为机体摄入大量乙醇后,乙醇被氧化为乙醛,在此过程中产生大量自由基,体内的氧化还原反应平衡被破坏,出现氧化应激造成肝损伤[24-25]。ADH、SOD、GSH和MDA可起到协同作用,进而维持机体的氧化还原平衡,降低过氧化带来的机体损伤[26-27]。其中ADH的值可以直接反映出乙醇脱氢酶的含量,MDA为脂质过氧化的产物,其含量的高低代表肝脏受氧化的程度[28-29],通常被作为判定肝脏损伤程度的重要指标[30]。
饲喂小鼠不同剂量葛根枳椇子洛神花本草酵素,测定代谢酶活性的结果如表3所示,对比空白组小鼠的SOD、GSH水平,模型组小鼠水平显著降低(P<0.05),而MDA和ADH的水平显著升高(P<0.05),说明酒精性肝损伤模型建模成功。对比模型组和未发酵提取液组,中剂量组和高剂量组的MDA水平显著降低,中剂量组和高剂量组的ADH、SOD、GSH水平显著升高(P<0.05)。结果表明,中、高剂量的葛根枳椇子洛神花本草酵素具有缓解氧化应激的作用,可减缓酒精性肝损伤。
表3 不同剂量葛根枳椇子洛神花本草酵素对小鼠肝脏ADH、SOD活力及GSH、MDA含量的影响(n=30)
Table 3 Effects of different doses of Lactobacillus plantarum,Lactobacillus reuteri and Lactobacillus rhamnosus herbal Jiaosu on ADH and SOD activities, GSH and MDA contents of mice liver (n=30)
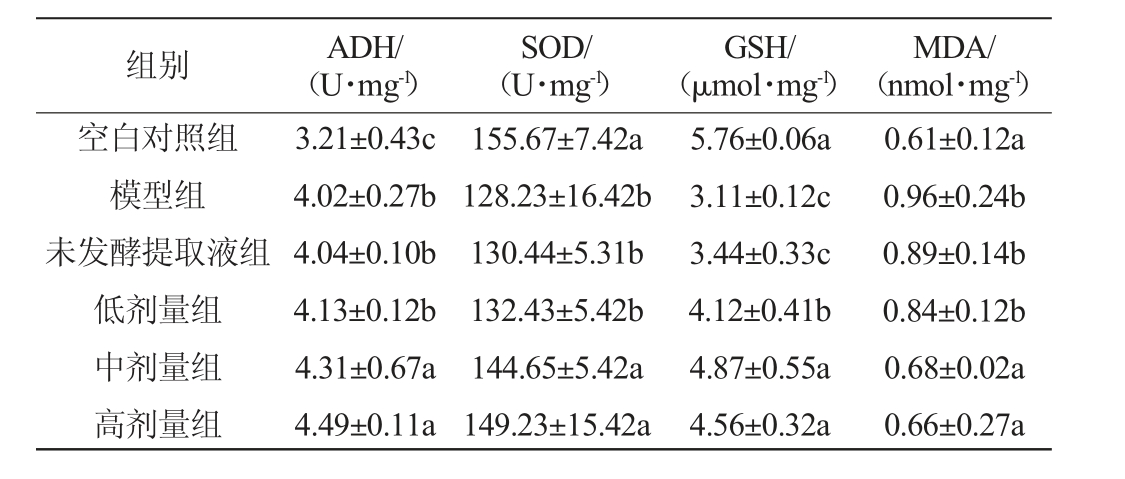
组别 ADH/(U·mg-1)SOD/(U·mg-1)GSH/(μmol·mg-1)MDA/(nmol·mg-1)空白对照组模型组未发酵提取液组低剂量组中剂量组高剂量组3.21±0.43c 4.02±0.27b 4.04±0.10b 4.13±0.12b 4.31±0.67a 4.49±0.11a 155.67±7.42a 128.23±16.42b 130.44±5.31b 132.43±5.42b 144.65±5.42a 149.23±15.42a 5.76±0.06a 3.11±0.12c 3.44±0.33c 4.12±0.41b 4.87±0.55a 4.56±0.32a 0.61±0.12a 0.96±0.24b 0.89±0.14b 0.84±0.12b 0.68±0.02a 0.66±0.27a
3 讨论
现代社会饮酒成为习惯,随之暴露出饮酒危害,研究醒酒的产品更是层出不穷。本研究提供一款以葛根、枳椇子、洛神花为原料,经复合益生菌发酵生产的产品,探究其醒酒护肝的功效。在大量前期实验的基础上选取8组活菌数较高的不同菌株配比,经过实验确定发酵菌株的比例,以期获得较高的总酸含量用于发酵产品。在对小鼠的醉酒醒酒实验探究中,小鼠体质量组间无显著差异。在给予小鼠酒精后不同时间段小鼠血液乙醇浓度的探究结果发现,各剂量实验组的乙醇浓度均低于模型组,说明葛根枳椇子洛神花本草酵素具有降低血液中乙醇含量的作用。可能的原因是酵素产品中含有经发酵产生的总黄酮等活性成分,可提升乙醇脱氢酶和乙醛脱氢酶的活性,维持氧化还原平衡,促进血液循环,从而降低小鼠血液的乙醇浓度[6],缩短小鼠的醉酒时间,快速解酒进而降低血液中乙醇滞留时间,减少乙醇对机体的伤害。
为探究葛根枳椇子洛神花本草酵素的醒酒和醉酒作用和小鼠最佳灌胃酒精浓度,通过大量实验探究确定0.17 mL/10 g为灌胃剂量。醒酒时间和醉酒时间研究表明,小鼠在无死亡率的基础上其醉酒时间分别缩短25.82%、30.51%和33.78%,醒酒时间分别缩短24.06%、24.58%和29.82%,各个剂量的实验组对比模型组均具有显著差异。中剂量和高剂量的酵素醒酒时间对比陈醇等[13]的研究中缩短11.32%、10.25%。经过对葛根枳椇子洛神花本草酵素特征性成分的检测,结果表明酵素内部含有一定含量的粗多糖、游离氨基酸、GABA、总酸、多酚、总黄酮等成分,为发挥解酒醒酒作用提供依据。
探究葛根枳椇子洛神花本草酵素对于肝脏的保护作用,测量小鼠肝脏内部的代谢酶活性,各剂量实验组的MDA、ADH、GSH、SOD含量与模型组、未发酵提取液组对比,均有显著变化,说明酵素产品具有一定的护肝作用。可能是因为机体摄入乙醇后,在肝脏部位进行代谢,乙醇在乙醇脱氢酶的作用下产生大量的超氧化物,进而破坏了机体的氧化还原平衡,减缓三羧酸循环使得MDA增多、GSH减少[13],服用酵素后小鼠各项指标有所缓解,进而验证了酵素产品的护肝作用。
4 结论
以葛根、枳椇子、洛神花为原料,通过益生菌发酵制备本草酵素。结果表明,植物乳植杆菌(HCS03-001):罗伊氏粘液乳杆菌(HCS02-001):鼠李糖乳酪杆菌(HCS01-013)最佳比例为5∶4∶1。葛根枳椇子洛神花本草酵素中粗多糖含量为12.95 mg/g,游离氨基酸含量3.61 mg/g,γ-氨基丁酸含量86.66 μg/g,总酸含量21.29 g/kg,多酚含量4.32 mg/g,总黄酮含量392.45 mg/L;与对照组相比,葛根枳椇子洛神花本草酵素低中高剂量实验组小鼠醉酒时间和醒酒时间显著缩短(P<0.05);酒后1~3 h小鼠血液乙醇浓度均显著降低(P<0.05);小鼠肝组织匀浆中乙醇脱氢酶活力、超氧化物歧化酶活力、谷胱甘肽含量均升高,丙二醛含量降低,且中高剂量实验组升高、下降显著(P<0.05)。结果显示,葛根枳椇子洛神花本草酵素可实现解酒护肝作用,长时间服用可缓解酒精性肝损伤症状,具有广阔的应用前景,可为研发一款解酒护肝的产品提供理论依据。
[1]CORRAO G,BAGNARDI V,ZAMBON A,et al.A meta-analysis of alcohol consumption and the risk of 15 diseases[J].Prev Med,2004;38(5):613-619.
[2]RAMSTEDT M.Per capita alcohol consumption and liver cirrhosis mortality in 14 European countries[J].Addiction,2001,96(1s1):S19-S34.
[3] GÜNZEL D, YU A.Claudins and the modulation of tight junction permeability[J].Physiol Rev,2013,93(2):525-569.
[4] CECCARELLI S, NOBILI V, ALISI A.Toll-like receptor-mediated signaling cascade as a regulator of the inflammation network during alcoholic liver disease[J].World J Gastroenterol,2014,20(44):16443-16451.
[5]杨志鹏,周宝琳,刘新利,等.一种具有潜在解酒护肝功能酵素的开发及其生物活性评价[J].食品科技,2019,44(1):154-159.
[6]ZHANG X,COKER O O,CHU E S H,et al.Dietary cholesterol drives fatty liver-associated liver cancer by modulating gut microbiota and metabolites[J].Gut,2020,70(4):761-774.
[7]SONG G,KIM H L,JUNG Y N,et al.Fruit of Hovenia dulcis thunb.Induces nonshivering thermogenesis through mitochondrial biogenesis and activation by SIRT1 in high-fat diet-fed obese mice and primary cultured brown adipocytes[J].J Agr Food Chem,2020,68(24):6715-6725.
[8]WU W W,ZU Y G,WANG L,et al.Preparation,characterization and antitumor activity evaluation of apigenin nanoparticles by the liquid antisolvent precipitation technique[J].Drug Deliv,2017,24(1),1713-1720.
[10]蔡建峰,蓝文明,魏亮龙,等.显齿蛇葡萄总黄酮对急性酒精中毒小鼠的解酒及肝损伤的保护作用[J].福建中医药,2016,47(3):16-17.
[11]倪以宇,赵大庆,倪伟锋,等.葛根-枳椇子药对发酵工艺及解酒功效评价研究[J].食品与发酵工业,2022,48(16):209-215.
[12]张明昊,赵珍珍,潘晓丽.葛花解酲汤对小鼠醉酒模型解酒护肝作用研究[J].中医药导报,2018,24(5):42-44.
[13] 陈醇,郝靖宇,冯昊天,等.一种枳椇子、葛根、益生菌配方产品醒酒及肝损伤保护作用研究[J].食品科技,2020,45(2):91-97.
[14] WANG Y, YU M, SHI Y W, et al.Effects of a fermented beverage of Changbai Mountain fruit and vegetables on the composition of gut microbiota in mice[J].Plant Foods Human Nutr,2019,74(4):468-473.
[15]隋玉杰.玉米肽的制备条件及其醒酒护肝机理研究[D].武汉:华中农业大学,2006.
[16]韩昱姝,李永转,胡凤山,等.一株高产γ-氨基丁酸乳酸菌的筛选及应用[J].中国酿造,2017,36(12):72-75.
[17] CARRENO F R.From ketamine to drugs targeting subtype-selective benzodiazepine site-containing gamma-aminobutyric acid areceptors as novel rapid-acting antidepressants[J].Biol Psychiat,2022, 92(3): 175-176.
[18] KILARI B P,MUDGIL P,AZIMULLAH S,et al.Effect of camel milk protein hydrolysates against hyperglycemia,hyperlipidemia,and associated oxidative stress in streptozotocin (STZ)-induced diabetic rats[J].J Dairy Sci,2020,104(2):1304-1317.
[19]王琦玉,张洪艳,王雪,等.主动饮酒对中脑腹侧被盖区GABA神经元形态学特征的影响[J].牡丹江医学院学报,2022,43(4):16-19.
[20] ZHANG X, MA L, ZHAI L, et al.Construction and validation of a three-microRNA signature as prognostic biomarker in patients with hepatocellular carcinoma[J].Int J Med Sci,2021,18(4):984-999.
[21]ZHANG Q Y,ZHENG W,SHAHZOR G K,et al.In vivo evaluation of tectoridin from puerariaeflos on anti-alcoholism property in rats[J].J Food Nutr Res,2019,7(6):458-464.
[22]刘琳,图力古尔.金毛鳞伞子实体粗多糖对小鼠酒精性肝损伤的保护作用[J].食用菌学报,2022,29(3):50-57.
[23]刘加友.富含γ-氨基丁酸葛根酵素发酵及其解酒功能的研究[D].镇江:江苏大学,2016.
[24]胡盼盼.副干酪乳杆菌对酒精致肝损伤小鼠生长性能和肝脏的影响[J].中国酿造,2021,40(10):108-111.
[25]吴敬涛.酒精肝的致病机理及其相关细胞信号通路[J].济南大学学报(自然科学版),2017,31(6):513-518.
[26]谢佳,彭斌,何松贵,等.白酒关键微量成分对醉度及小鼠乙醇代谢和急性酒精性肝损伤的影响[J].中国酿造,2018,37(6):155-160.
[27]李超兰,王晓栋,李波,等.枳葛口服液含药血清对L-02肝细胞酒精性损伤乙醇代谢酶活性的影响[J].中药材,2019,42(2):422-425.
[28]GAO N,CHEN J J,QI B,et al.Effects of gene polymorphisms,metabolic activity, and content of alcohol dehydrogenase and acetaldehyde dehydrogenases on prognosis of hepatocellular carcinoma patients[J].Turk J Gastroenterol,2022,33(7):606-614.
[29] FARID M M, ABOUL NASER A F, SALEM M M, et al.Chemical compositions of Commiphora opobalsamum stem bark to alleviate liver complications in streptozotocin-induced diabetes in rats:Role of oxidative stress and DNA damage[J].Biomarkers,2022,27(7):671-683.
[30]KANDI V,PINNELLI V B,et al.Effect of alcohol consumption on oxidative stress markers and its role in the pathogenesis and progression of liver cirrhosis[J].Am J Med Biol Res,2013,1(4):99-102.