糍粑辣椒作为独具一格的地方特色辣椒制品,是火锅、辣子鸡等川渝特色菜肴的重要佐料,以工艺简单,风味独特,营养丰富等特点而深受大众喜爱[1]。随着消费观念和健康意识的逐步提高,火锅底料等辛辣菜肴所造成的健康危害也愈发受到人们的关注。研究表明,辣椒素类物质是辣椒中主要的辣味物质[2],摄入后可引发人体发汗、流泪、腹泻、唾液分泌等生理反应,并促进人体炎症因子的分泌[3];人群流行病学研究结果同样表明,辛燥饮食、烟酒是诸多燥证(如口喉干燥、眼涩鼻干、口疮鼻塞等为症状的亚健康状态)的危险因素[4-5]。糍粑辣椒作为火锅等典型辛辣菜肴辣味物质的主要来源,实现其辣味物质的控制,进而降低火锅等辛辣菜肴中辣味物质总量。但目前针对糍粑辣椒的研究多集中于生产工艺优化[6]及品质控制[7-8]等方面,鲜见针对糍粑辣椒中辣味物质进行减控的相关研究报导。
对此,本研究基于可培养的手段进行糍粑辣椒中辣椒素降解微生物的筛选,并将筛选菌株回接至糍粑辣椒中进行发酵应用,考察筛选菌株接种发酵对糍粑辣椒中辣椒素类物质含量及风味物质的影响,以期为糍粑辣椒中辣味物质的减控提供科学依据,对促进川渝特色辣椒产业发展、保障消费者健康有着重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
干辣椒(满天星、石柱红、新一代三个品种):广汉市迈德乐食品有限公司;泡椒、辣椒醅、糍粑辣椒、豆瓣等样品:实验室自制。
1.1.2 化学试剂
三羟甲基甘氨酸、3-(N-吗啡啉)丙磺酸(3-(N-morpholino)propane sulfonic acid,MOPS)、NaCl、NH4Cl、KOH、K2SO4、MgCl2、K2HPO4、葡萄糖、磷酸二氢钾、二甲基亚砜(dimethyl sulfoxide,DMSO)(均为分析纯);辣椒素标准品、二氢辣椒素标准品(均为色谱纯):上海源叶生物科技有限公司。
1.1.3 培养基
MRS培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、LB培养基:广东环凯微生物科技有限公司。
降解辣椒素菌株筛选培养基[9]:MOPS粉8.37 g/L,三羟甲基甘氨酸0.07 g/L,NaCl 0.3 g/L,NH4Cl 0.05 g/L,KOH 0.16 g/L,K2SO4 0.049 g/L,MgCl2 0.05 g/L,K2HPO4 0.27 g/L,50 mmol/L的辣椒素-DMSO溶液。固体筛选培养基在此基础上添加15 g/L琼脂,121 ℃灭菌15 min。
1.2 仪器与设备
1260型高效液相色谱仪(配有C18色谱分析柱(250 mm×4.6 mm×5 μm)、DB-WAX色谱柱(60 m×0.25 mm×0.25 μm)):美国安捷伦科技有限公司;GCMS-QP2010气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪:岛津(上海)实验器材有限公司;SPX-150B-4 生化培养箱:上海博讯实业有限公司医疗设备厂;SW-CJ-1F无菌工作台:苏州安泰空气技术有限公司;H2050R-1离心机:长沙湘仪离心机仪器有限公司;ESJ200-4A型分析天平:沈阳龙腾电子有限公司。
1.3 实验方法
1.3.1 糍粑辣椒的制备
将4 kg纯净水加入锅中加热至沸腾,放入1 kg混合干辣椒(满天星、石柱红、新一代三个品种的质量比为3∶1∶1),煮制15 min捞出沥干水分(水分含量约75%),用破碎机将煮好的辣椒破碎,即获得糍粑辣椒。
1.3.2 降解辣椒素菌株的筛选
(1)菌株的初筛
分别将干辣椒、泡椒、辣椒醅、糍粑辣椒、豆瓣等样品粉碎后使用无菌水稀释至合适梯度,取100 μL稀释液涂布至固体筛选培养基上于37 ℃培养72 h,挑取菌落周围存在透明圈且形态、大小不一致的菌株进行分离纯化。将纯化后的菌株接种于液体培养基培养过夜后,采用牛津杯法向牛津杯中注入10 μL培养液后放至辣椒素固体筛选培养基上,37 ℃培养72 h观察其透明圈情况,进而初步筛选出具有辣椒素降解能力的菌株。
该培养基原理为辣椒素溶液在培养基中呈乳白色,具有辣椒素降解能力的菌株可利用辣椒素作为唯一的碳源、氮源进行生长,进而在培养基上呈现出透明圈。
(2)菌株的复筛
将初筛菌株接种至液体筛选培养基37 ℃培养7 d后测定其辣椒素含量,以未接种培养基为对照,若培养基中辣椒素含量出现明显下降,则说明该菌株具有辣椒素降解能力,进而确定具有辣椒素降解能力的菌株。
1.3.3 降解辣椒素菌株的分子生物学鉴定
使用细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取目的菌株基因组DNA,并采用27F(5'-TACGGYTACCTTGTTACGACTT-3')和1492R(5'-AGAGTTTGATCMTGGCTCAG-3')通用引物对细菌16S rDNA基因的V3-V4区域进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系(30 μL):27F引物1 μL,1492R引物1 μL,双蒸水(ddH2O)12.5 μL,Mix酶12.5 μL,DNA提取液3 μL;PCR扩增程序为:94 ℃保持4 min预变性;94 ℃保持1 min变性,60 ℃保持45 s退火,72 ℃保持90 s延伸,共循环30次;72 ℃保持10 min进行末端延伸。完成PCR扩增后,取5 μL PCR扩增产物在1%琼脂糖凝胶上进行电泳,凝胶成像系统观察结果并成像。PCR产物送至北京擎科新业生物技术有限公司进行测序,将测序结果登录美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站用GenBank数据库通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行序列比对鉴定,筛选同源性高的模式菌株序列,使用MEGA5.0 软件邻接(neighbor joining,NJ)法构建系统发育树,进行1 000次的相似度重复计算,确定其系统发育树地位。
1.3.4 降解辣椒素菌株的应用
将具有较强辣椒素降解能力的菌株分别接种至1 L LB液体培养基于37 ℃恒温培养2 d后采用平板计数法计算培养液中菌落总数,于4 000 r/min低温离心15 min后加入无菌水调整菌液浓度为106 CFU/g,接种至灭菌糍粑辣椒体系中(含300 g糍粑辣椒和150 g水),以加入等量无菌水作为对照,37 ℃恒温发酵7 d后测定其辣椒素类物质及挥发性风味物质含量,考察菌株降解辣椒素能力及对糍粑辣椒挥发性风味物质的影响。
1.3.5 糍粑辣椒中辣椒素类物质含量的测定
参考国标GB/T 30388—2013《辣椒及其油树脂总辣椒碱含量的测定高效液相色谱法》[10]方法略作修改。具体操作如下:准确称取4 g待测定样品,于50 mL离心管中,加入15 mL甲醇,充分混合均匀后于60 ℃超声提取30 min,10 000r/min离心5min。离心结束后将上清液缓慢倒入50mL容量瓶中,重复上述操作步骤两次,合并上清液,用甲醇定容至50 mL。
将待测液使用0.22 μm有机系滤膜过滤后,使用高效液相色谱仪对样品提取液中的辣椒素类物质含量进行测定,高效液相色谱条件:进样量10 μL,流动相为甲醇∶水75∶25(V/V),流速0.8 mL/min,柱温箱温度30 ℃,波长280 nm,采集时间20 min。样品中辣椒素和二氢辣椒素的含量通过外标法建立标准曲线回归方程求出,每个样品测定3次取平均值。辣椒素降解率计算公式如下:
式中:X表示辣椒素降解率,%;C1表示空白组培养液中辣椒素含量,mg/L;C2接种菌株培养液中辣椒素含量,mg/L。
1.3.6 糍粑辣椒挥发性风味物质含量的测定
参考王泽亮等[11]方法,略做修改。具体操作如下:称取样品2.0 g于15 mL顶空进样瓶中,加入1 mL的饱和氯化钠溶液,同时加入2 μL内标溶液(质量浓度为0.5 μg/mL 4-甲基-2-戊醇),将进样品瓶置于60 ℃水浴中平衡2 min,然后将固相微萃取(solid phase micro extraction,SPME)萃取纤维插入样品瓶中,60 ℃恒温顶空萃取50 min,插入GC-MS气相色谱进样口,于250 ℃条件下解吸5 min。
气相色谱条件:以氦气(He)为载气,流速1 mL/min,进样口温度250 ℃,不分流;起始温度50 ℃,以10 ℃/min 升至85 ℃(保持1.5 min),再以5 ℃/min 升至100 ℃(保持1 min),以2.5 ℃/min 升至175 ℃(保持1.5 min),最后以10 ℃/min升至250 ℃/min。质谱条件:电子电离(electronic ionization,EI)源,电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;质量扫描范围35~350 amu;检测器电压0.1 kV,扫描模式为全扫描模式。
定性和定量方法:GC-MS分析结果经计算机在标准谱库美国国家标准技术研究所(national institute of standards and technology,NIST)11.0中比对检索,选取相似度指数(similarity index,SI)>80(最大值为100)的物质进行定性分析,同时采用4-甲基-2-戊醇(0.5 μg/mL)为内标进行半定量分析,得到各组分的质量浓度,每个样品独立测定3次并取平均值。挥发性物质相对含量计算公式如下:
式中:RC表示各组分的含量,mg/kg;A1表示目的物质峰面积;C表示内标物质质量浓度,μg/mL;L表示内标物质添加量,μL;A2表示内标物质峰面积。
1.3.7 数据处理
使用SPSS 25.0进行单因素方差分析,柱状图及聚类热图使用Origin2022进行绘制,偏最小二乘法-判别分析(partial least quares-discriminant analysis,PLS-DA)分析通过SIMCA 14.1实现。
2 结果与分析
2.1 降解辣椒素菌株筛选
2.1.1 降解辣椒素菌株初筛部分菌株在筛选培养基上生长且呈现出了较明显的透明圈,部分菌株则不能生长,也未出现透明圈。因此,以出现透明圈为判断标准,初步筛选出可能具有辣椒素降解能力的菌株共44株。
2.1.2 降解辣椒素菌株复筛结果
将初筛得到的44株菌株接种至液体筛选培养置于37 ℃恒温培养3 d后使用高效液相色谱法测定其辣椒素含量,计算其辣椒素降解率进而筛选出具有辣椒素降解能力的菌株,结果见图1。由图1可知,共筛选出6株具有辣椒素降解能力的菌株,分别为菌株GJ02、GJ03、JP01、28L-C、7B-5和B10,不同菌株辣椒素降解能力存在较大差异,筛选菌株对辣椒素的降解率为3.13%~28.34%。从豆瓣中所筛选出菌株28L-C、7B-5和B10的辣椒素降解率均显著高于其余菌株(P<0.05),尤其是菌株28L-C和7B-5,其降解率分别达到了28.34%和28.15%。
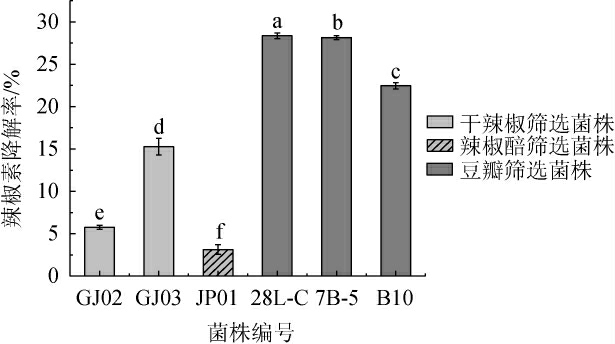
图1 降解辣椒素菌株复筛结果
Fig.1 Re-screening results of capsaicin-degrading strains
不同字母表示样品间辣椒素降解率的差异显著(P<0.05)。
2.2 筛选降解辣椒素菌株鉴定
2.2.1 筛选降解辣椒素菌株的形态学观察
对具有辣椒素降解能力的6株筛选菌株进行形态学观察,结果见图2。由图2a可知,6株筛选菌株菌落形态均呈乳白色,除菌株7B-5和B10菌落表面较为粗糙外,其余菌株表面均相对光滑。由图2b可知,6株筛选菌株细胞形态都为短杆状,且均为革兰氏阳性菌。
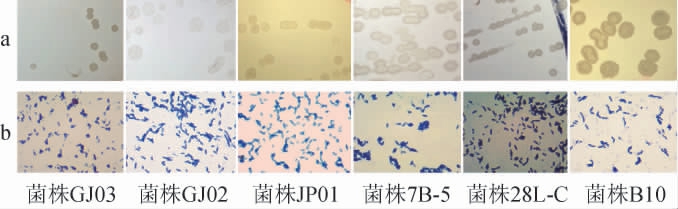
图2 筛选降解辣椒素菌株的菌落(a)和细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of screened capsaicindegrading strains
2.2.2 筛选降解辣椒素菌株分子生物学鉴定
6株降解辣椒素菌株分子生物学鉴定结果见图3。由图3可知,菌株B10、JP01、GJ02、GJ03分别为短小芽孢杆菌(Bacillus pumilus)、枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和贝莱斯芽孢杆菌(Bacillus velezensis),菌株7B-5和28L-C分别为甲基营养芽孢杆菌(Bacillus methylotrophicus)和澄清状芽孢杆菌(Clostridium clariflavum)。所筛选出6株菌均为芽孢杆菌,这与CHO S等[12-13]研究结果一致。甲基营养芽孢杆菌在郫县豆瓣[14]、陈醋[15]、韩国大酱[16]等发酵食品中均有发现,而澄清梭状杆菌在食品中的报道较少。现有研究表明,某些特定的甲基营养芽孢杆菌菌株具有产生抗菌肽[17]、水解酶[18]、3-羟基丁酮[19]等食品活性成分的能力,是极具应用潜力的功能微生物,而澄清梭状杆菌则具有分泌纤维素酶、木聚糖酶等多种水解酶的能力[20]。在本研究中,发现了甲基营养芽孢杆菌和澄清状芽孢杆菌均具有较强的辣椒素降解能力,进一步丰富了对上述两株菌株的功能性认识,为其在食品中的生产应用奠定了良好基础。

图3 基于16S rDNA基因序列筛选降解辣椒素菌株的系统发育树
Fig.3 Phylogenetic tree of screened capsaicin-degrading strains based on 16S rDNA gene sequence
2.3 糍粑辣椒中辣椒素类物质的降解应用
将所筛选出具有较强辣椒素降解能力的菌株28L-C和7B-5回接至糍粑辣椒中后,于37 ℃恒温发酵7 d,以验证其辣椒素类物质降解能力。强化发酵结果见图4。由图4可知,相比于未接种的糍粑辣椒,经菌株28L-C和7B-5强化发酵后的糍粑辣椒中辣椒素及二氢辣椒素含量均出现了显著下降(P<0.05),表明所筛选出的菌株对糍粑辣椒中辣椒素等辣味物质有着良好的降解效果。其中,经菌株28L-C强化发酵后糍粑辣椒中辣椒素和二氢辣椒素含量分别由(64.79±2.42)mg/100 g和(34.23±3.20)mg/100 g下降至(47.86±1.08)mg/100 g和(25.64±0.86)mg/100 g;而菌株7B-5强化发酵糍粑辣椒中,辣椒素和二氢辣椒素则分别下降至(44.12±1.12)mg/100 g和(22.81±1.42)mg/100 g。研究表明,辣椒素等辛辣物质的过度摄入将增加患慢性胃炎等疾病的风险[21],而通过降解菌株强化发酵可显著降低糍粑辣椒中辣椒素类物质含量,减少以糍粑辣椒为原辅料的辛辣食品中辣味物质的总量,进而有效避免辛辣饮食所带来的弊端。
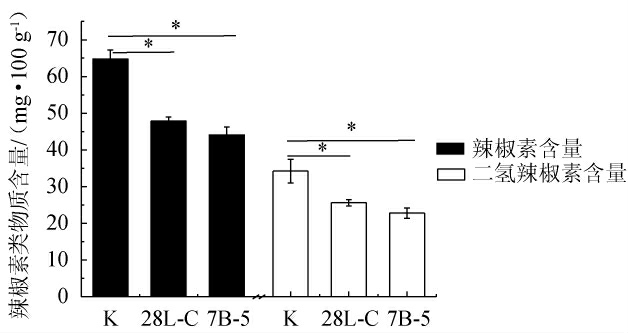
图4 菌株28L-C和7B-5强化发酵糍粑辣椒结果
Fig.4 Results of enhancement fermentation of Ciba peppers by strains 28L-C and 7B-5
2.4 降解辣椒素菌株强化发酵对糍粑辣椒风味的影响
为探究菌株7B-5和28L-C强化发酵对糍粑辣椒挥发性风味的影响,采用GC-MS法测定糍粑辣椒中挥发性风味物质含量,结果见表1。由表1可知,空白组(CK)和强化发酵糍粑辣椒样品(28L-C和7B-5)中共检测出挥发性风味物质38种,包括酯类5种,醇类10种,酸类2种,烷烃类11种,醛酮类2种,酚类3种及其他类5种。
表1 菌株28L-C和7B-5强化发酵糍粑辣椒中挥发性风味物质GC-MS分析结果
Table 1 Results of volatile flavor components in enhancement fermentation of Ciba peppers with strains 28L-C and 7B-5 analyzed by GC-MS
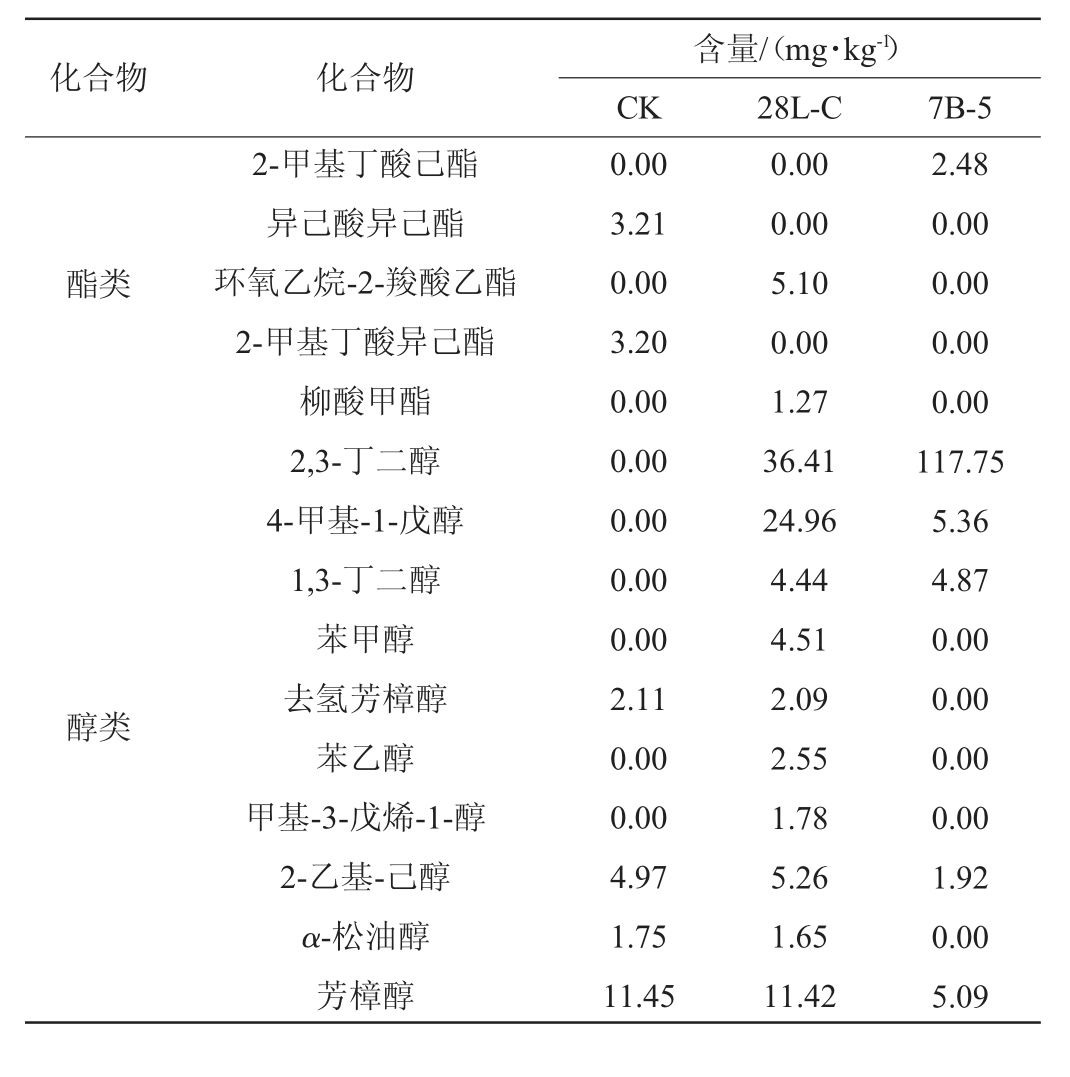
化合物 化合物2-甲基丁酸己酯异己酸异己酯环氧乙烷-2-羧酸乙酯2-甲基丁酸异己酯柳酸甲酯2,3-丁二醇4-甲基-1-戊醇1,3-丁二醇苯甲醇去氢芳樟醇苯乙醇甲基-3-戊烯-1-醇2-乙基-己醇α-松油醇芳樟醇含量/(mg·kg-1)CK 28L-C 7B-5酯类醇类0.00 3.21 0.00 3.20 0.00 0.00 0.00 0.00 0.00 2.11 0.00 0.00 4.97 1.75 11.45 0.00 0.00 5.10 0.00 1.27 36.41 24.96 4.44 4.51 2.09 2.55 1.78 5.26 1.65 11.42 2.48 0.00 0.00 0.00 0.00 117.75 5.36 4.87 0.00 0.00 0.00 0.00 1.92 0.00 5.09
续表
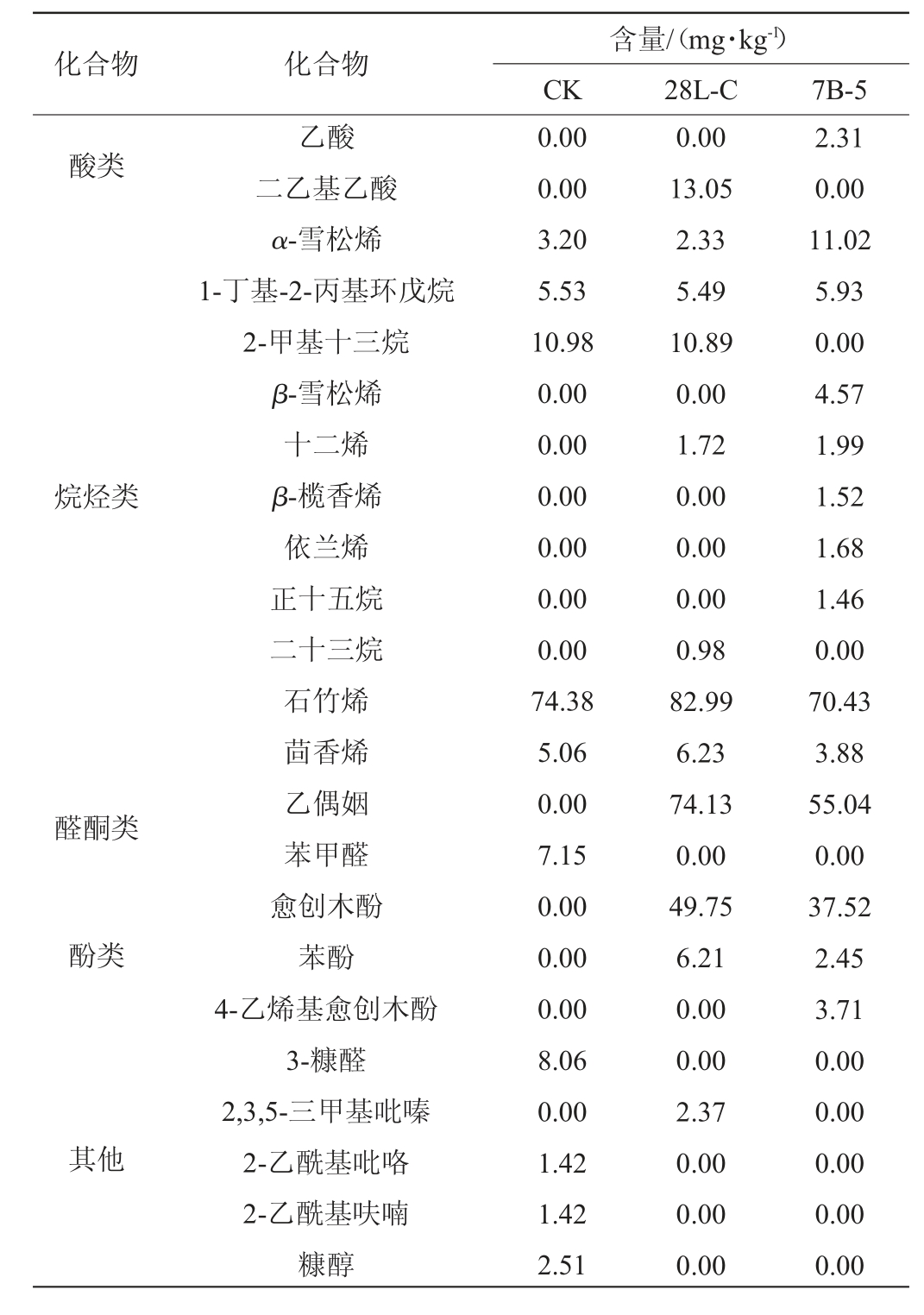
含量/(mg·kg-1)CK 28L-C 7B-5酸类化合物 化合物乙酸二乙基乙酸α-雪松烯1-丁基-2-丙基环戊烷2-甲基十三烷β-雪松烯十二烯β-榄香烯依兰烯正十五烷二十三烷石竹烯茴香烯乙偶姻苯甲醛愈创木酚苯酚4-乙烯基愈创木酚3-糠醛2,3,5-三甲基吡嗪2-乙酰基吡咯2-乙酰基呋喃糠醇烷烃类醛酮类酚类其他0.00 0.00 3.20 5.53 10.98 0.00 0.00 0.00 0.00 0.00 0.00 74.38 5.06 0.00 7.15 0.00 0.00 0.00 8.06 0.00 1.42 1.42 2.51 0.00 13.05 2.33 5.49 10.89 0.00 1.72 0.00 0.00 0.00 0.98 82.99 6.23 74.13 0.00 49.75 6.21 0.00 0.00 2.37 0.00 0.00 0.00 2.31 0.00 11.02 5.93 0.00 4.57 1.99 1.52 1.68 1.46 0.00 70.43 3.88 55.04 0.00 37.52 2.45 3.71 0.00 0.00 0.00 0.00 0.00
由图5可知,相比于CK组,菌株28L-C和7B-5强化发酵糍粑辣椒中醛酮类及酚类化合物含量均出现了明显上升,分别达到了(74.13±5.68)mg/kg、(55.05±10.68)mg/kg和(55.96±15.66)mg/kg、(43.69±2.81)mg/kg。醛酮类通常呈现出令人满意的甜香及花果香,多存在于糖果、水果及坚果中,被认为可以增强食品的风味品质[22];而愈创木酚作为强化发酵糍粑辣椒中最主要的酚类物质,在菌株28L-C和7B-5组中含量分别高达(49.75±19.20)mg/kg和(37.52±9.77)mg/kg,其突出的烟熏味和草木香气同样对食品风味品质的形成具有重要贡献作用[23]。因此,认为经降解辣椒素菌株强化发酵后的糍粑辣椒将具有更为丰富的风味品质。但值得注意的是,经菌株7B-5发酵后的糍粑辣椒中醇类物质含量出现明显下降,醇类通常具有令人愉快的香味,可被氧化成醛类、酸类等,同时还是酯化反应的重要前体物质[24],因此,菌株7B-5进行糍粑辣椒强化发酵对糍粑辣椒风味的影响还需进一步深入研究。
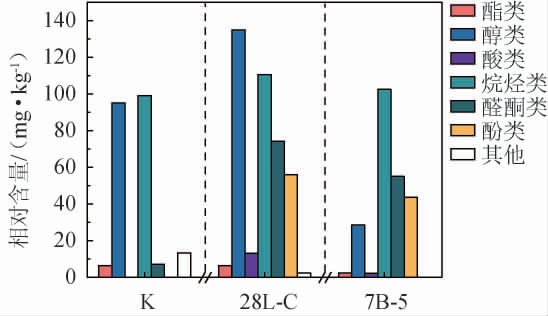
图5 菌株28L-C和7B-5强化发酵糍粑辣椒样品中挥发性风味化合物含量
Fig.5 Contents of volatile flavor components in enhancement fermentation of Ciba peppers samples by strains 28L-C and 7B-5
2.5 降解辣椒素菌株强化发酵糍粑辣椒中重要香气化合物
为进一步明确各挥发性物质对糍粑辣椒风味形成的贡献作用,选取气味活度值(odor activity value,OAV)>1的物质作为重要香气化合物,结果见表2。由表2可知,共筛选出重要香气化合物18种,包括酯类2种,醇类7种,酸类1种,烷烃类1种,醛酮类2种,酚类3种及其他种类2种。结果表明,经降解菌株强化发酵后糍粑辣椒中重要香气化合物种类数明显多于CK组,进一步验证了使用降解辣椒素菌株28L-C和7B-5强化发酵糍粑辣椒将赋予糍粑辣椒更为丰富的风味。
表2 菌株28L-C和7B-5强化发酵糍粑辣椒样品中重要香气化合物含量及OAV
Table 2 Contents of important aroma compounds and OAV in enhancement fermentation of Ciba peppers samples by strains 28L-C and 7B-5
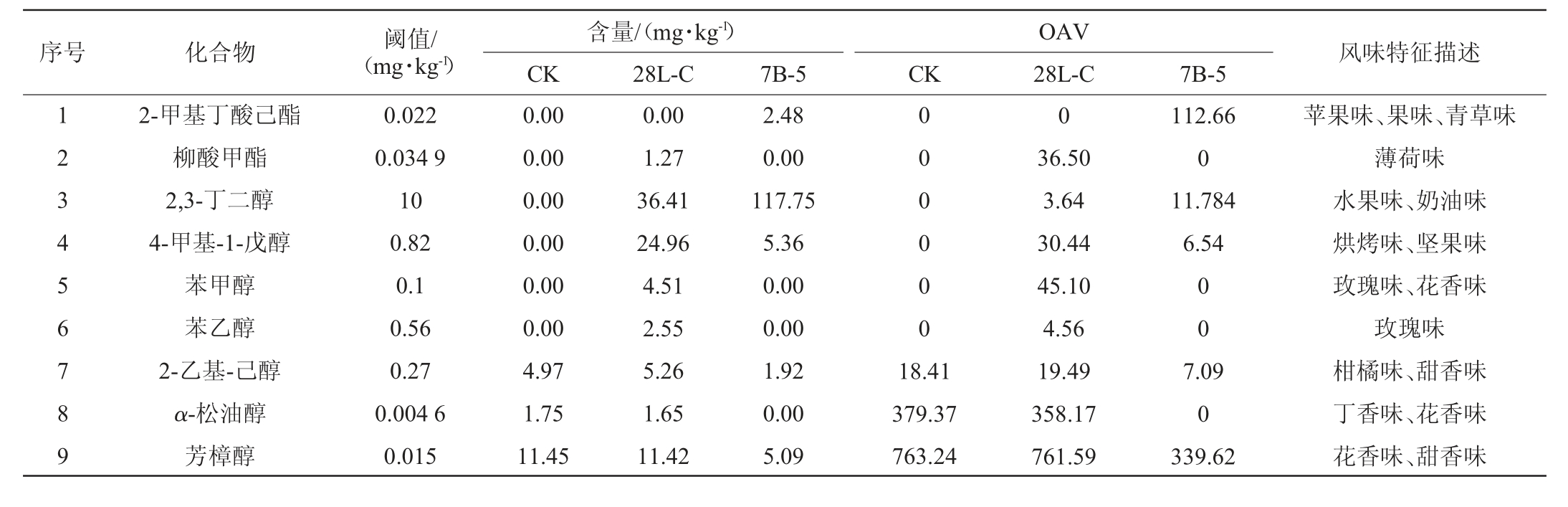
含量/(mg·kg-1)CK 28L-C CK序号 化合物 阈值/(mg·kg-1)风味特征描述7B-5 OAV 28L-C 7B-5 1 2 3 4 5 6 7 8 9 2-甲基丁酸己酯柳酸甲酯2,3-丁二醇4-甲基-1-戊醇苯甲醇苯乙醇2-乙基-己醇α-松油醇芳樟醇0.022 0.034 9 10 0.82 0.1 0.56 0.27 0.004 6 0.015 0.00 0.00 0.00 0.00 0.00 0.00 4.97 1.75 11.45 0.00 1.27 36.41 24.96 4.51 2.55 5.26 1.65 11.42 2.48 0.00 117.75 5.36 0.00 0.00 1.92 0.00 5.09 0 0 0 0 0 0 18.41 379.37 763.24 0 36.50 3.64 30.44 45.10 4.56 19.49 358.17 761.59 112.66 0 11.784 6.54 0 0 7.09 0 339.62苹果味、果味、青草味薄荷味水果味、奶油味烘烤味、坚果味玫瑰味、花香味玫瑰味柑橘味、甜香味丁香味、花香味花香味、甜香味
续表
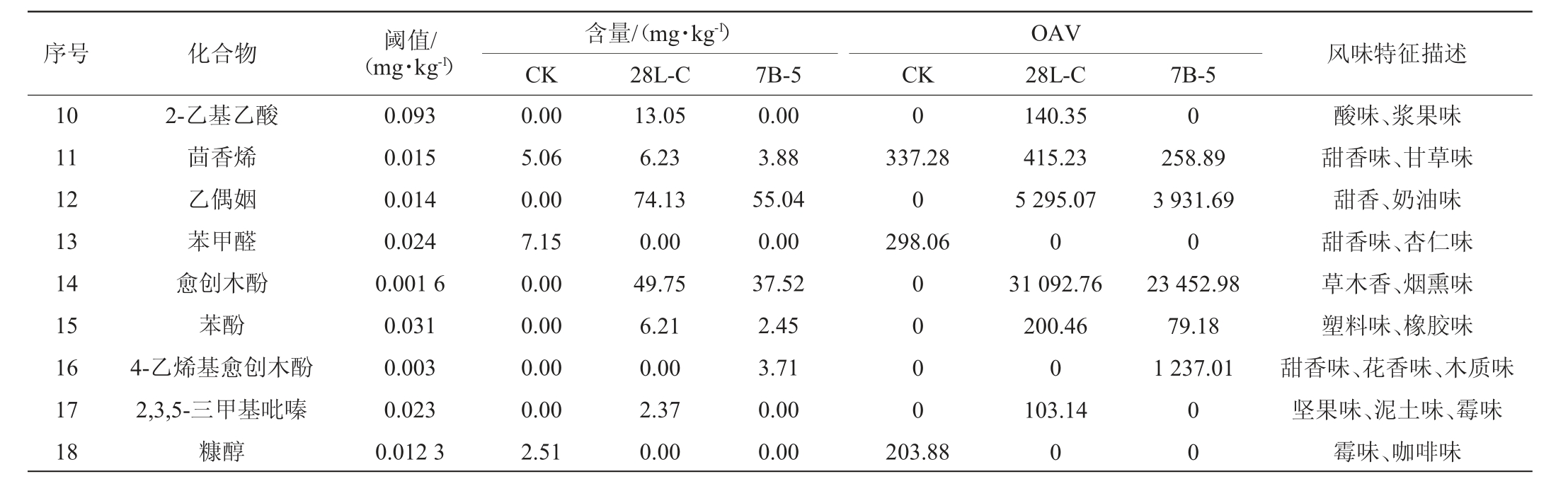
序号 化合物 阈值/(mg·kg-1)风味特征描述含量/(mg·kg-1)CK 28L-C CK 7B-5 OAV 28L-C 7B-5 10 11 12 13 14 15 16 17 18 2-乙基乙酸茴香烯乙偶姻苯甲醛愈创木酚苯酚4-乙烯基愈创木酚2,3,5-三甲基吡嗪糠醇0.093 0.015 0.014 0.024 0.001 6 0.031 0.003 0.023 0.012 3 0.00 5.06 0.00 7.15 0.00 0.00 0.00 0.00 2.51 13.05 6.23 74.13 0.00 49.75 6.21 0.00 2.37 0.00 0.00 3.88 55.04 0.00 37.52 2.45 3.71 0.00 0.00 0 0 337.28 0 298.06 0 0 0 0 258.89 3 931.69 0 23 452.98 79.18 1 237.01 203.88 140.35 415.23 5 295.07 0 31 092.76 200.46 0 103.14 0 0 0酸味、浆果味甜香味、甘草味甜香、奶油味甜香味、杏仁味草木香、烟熏味塑料味、橡胶味甜香味、花香味、木质味坚果味、泥土味、霉味霉味、咖啡味
2.6 降解辣椒素菌株强化发酵糍粑辣椒中重要差异化合物
偏最小二乘判别分析(PLS-DA)为一种监督性分析方法[25],可对不同样品的组间差异进行具体分析。通过PLSDA进行样品组间差异分析,以变量重要性投影(variable importance in the projection,VIP)值>1为条件筛选样品组间重要差异性化合物并绘制聚类热图,结果见图6。由图6A可知,2,3-丁二醇、苯甲醛、糠醇、α-松油醇、愈创木酚、乙偶姻、芳樟醇、2-甲基丁酸己酯、4-乙烯基愈创木酚及2-乙基己醇10种化合物是导致糍粑辣椒样品间出现差异的重要差异性化合物(VIP值>1)。由图6B可知,2,3-丁二醇、2-甲基丁酸己酯及4乙烯基愈创木酚在菌株7B-5强化发酵后糍粑辣椒样品中含量相对较高,其分别具有突出的水果味、青草味及甜香味,将赋予菌株7B-5强化发酵后糍粑辣椒样品较为突出的花果香气及草木香气,但其2-乙基己醇(柑橘味、甜香味)、α-松油醇(丁香味、花香)及芳樟醇(花果香、甜香)含量较空白组出现明显下降,表明经菌株7B-5强化发酵后糍粑辣椒样品中花果香气等气味强度将出现降低;空白组样品中苯甲醛及糠醇含量相对较高,其分别具有杏仁味、甜香味及咖啡味;而菌株28L-C强化发酵后糍粑辣椒样品中,乙偶姻及愈创木酚含量相对较高,将赋予糍粑辣椒较为突出的甜香香气及烟熏、坚果香气。整体而言,经菌株强化发酵后的糍粑辣椒将具有更为丰富的风味特点,但其苯甲醛及糠醇等物质含量将出现明显降低,进而对糍粑辣椒中坚果香气及焦香香气造成一定影响。
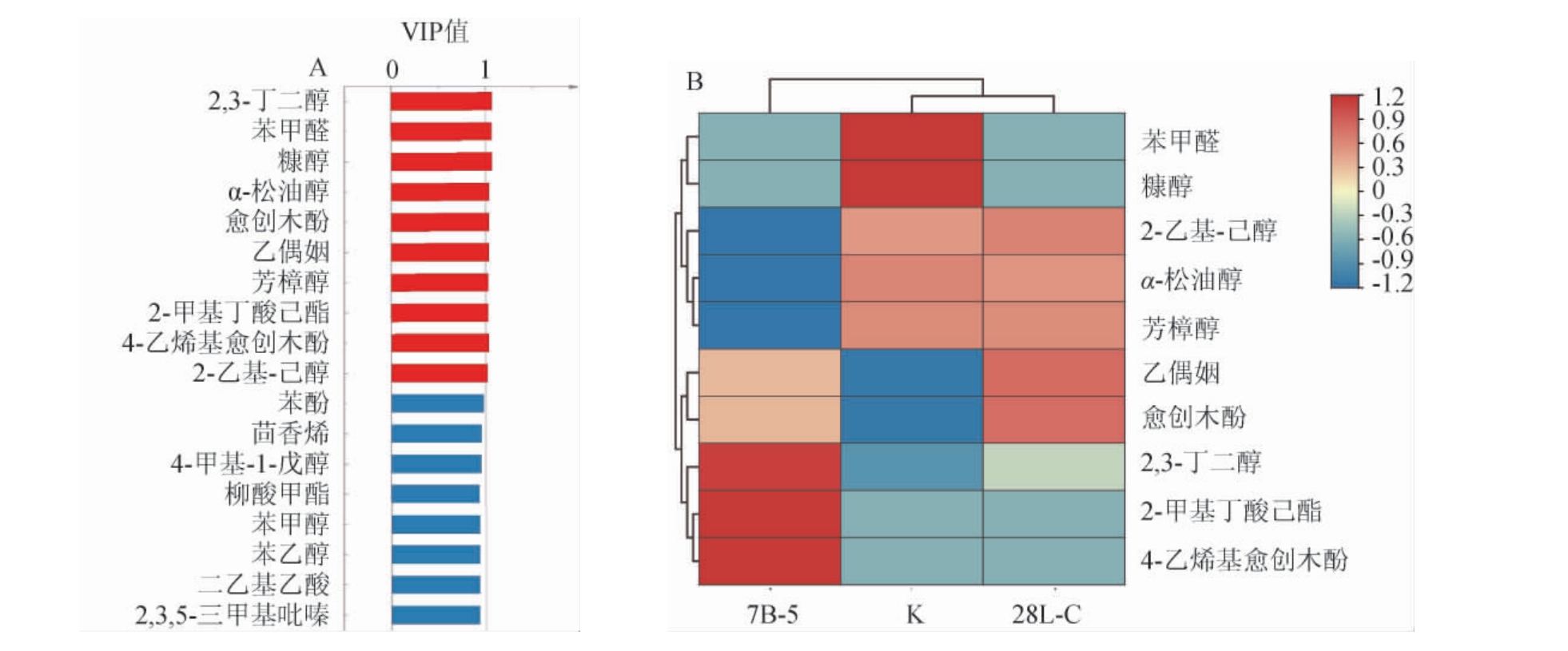
图6 菌株28L-C和7B-5强化发酵糍粑辣椒样品重要差异性化合物VIP值(A)及聚类分析热图(B)
Fig.6 VIP values (A) and heat map (B) of clustering analysis of important differential compounds in enhancement fermentation of Ciba peppers samples by strains 28L-C and 7B-5
3 结论
通过降解辣椒素筛选培养基共筛选出具有辣椒素降解能力的菌株共计6株,其辣椒素降解率为3.13%~28.34%,鉴定结果显示,筛选菌株B10、JP01、GJ02、GJ03、7B-5和28L-C分别被鉴定为短小芽孢杆菌(Bacillus pumilus)、枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、贝莱斯芽孢杆菌(Bacillus velezensis)、甲基营养芽孢杆菌(Bacillus methylotrophicus)、澄清状芽孢杆菌(Clostridium clariflavum)。其中,澄清状芽孢杆菌28L-C和甲基营养芽孢杆菌7B-5辣椒素降解能力较强,液体筛选培养基中辣椒素降解率分别可达28.34%和28.15%。使用菌株28L-C和7B-5进行糍粑辣椒强化可显著降低糍粑辣椒中辣椒素和二氢辣椒素含量(P<0.05),并明显增加糍粑辣椒中愈创木酚、4-乙烯基愈创木酚等物质含量,进而丰富糍粑辣椒风味组成。菌株28L-C和7B-5强化发酵糍粑辣椒样品中重要香气化合物18种、重要差异化合物10种。本研究可为糍粑辣椒中辣味物质的生物减控提供一定数据参考。
[1]吴昭庆,黄秋红,杨欣,等.贵州糍粑辣椒的制作工艺[J].现代食品科技,2020,36(1):235-241.
[2]陈夏宁,黄菊青,谢正露.辣椒素的生物活性及应用研究进展[J].畜牧与兽医,2022,54(7):133-139.
[3]蒋能,汤春丽,吴慧娴,等.辣椒素药理活性及其药物代谢动力学的研究进展[J].天然产物研究与开发,2022,34(9):1597-1606.
[4]于芳,高娜,王玮.西北地区饮食结构对“西北诸燥证”的影响[J].中西医结合心血管病电子杂志,2018,6(20):197-198.
[5]周雪梅,胡建鹏.中医燥湿认识源流及“燥湿论”首倡者辨[J].中华医史杂志,2016,46(4):4.
[6]吴昭庆,黄秋红,杨欣,等.贵州糍粑辣椒的制作工艺[J].现代食品科技,2020,36(1):235-241,149.
[7]吴昭庆.糍粑辣椒加工工艺优化与质量稳定性研究[D].贵阳:贵州大学,2021.
[8]李春宇.《贵州糍粑辣椒》食品安全地方标准制定工作的研究[J].食品安全导刊,2017(11):64-65.
[9] FLAGAN S F,LEADBETTER J R.Utilization of capsaicin and vanillylamine as growth substrates by Capsicum(hot pepper)-associated bacteria[J].Environ Microbiol,2006,8(3):560-565.
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 30388—2013 辣椒及其油树脂总辣椒碱含量的测定高效液相色谱法[S].北京:中国标准出版社,2013.
[11]王泽亮,范智义,邓维琴,等.川渝地区市售成品包装榨菜与工厂半成品榨菜风味物质的解析[J].中国调味品,2022,47(6):171-174,187.
[12]CHO S,MOON H I,HONG G E,et al.Biodegradation of capsaicin by Bacillus licheniformis SK1230[J].J Korean Soc Appl Bi,2014,57:335-339.
[13]LEE S M,LEE H S,LEE J,et al.Non-pungent Capsicum fermentation by Bacillus subtilis P3-3 and its swimming endurance capacity in mice[J].Enzyme Microb Tech,2010,47(5):200-205.
[14]LU Y H,TAN X Y,LV Y P,et al.Physicochemical properties and microbial community dynamics during Chinese horse bean-chili-paste fermentation, revealed by culture-dependent and culture-independent approaches[J].Food Microbiol,2020,85:103309.
[15]贾瑞娟,陈旭峰,梁楷,等.山西老陈醋中芽孢杆菌的RAPD分型及其与性状之间的关系[J].中国酿造,2019,38(4):144-148.
[16]JUNG J Y,CHUN B H,MOON J Y,et al.Complete genome sequence of Bacillus methylotrophicus JJ-D34 isolated from deonjang, a Korean traditional fermented soybean paste[J].J Biotechnol,2016,219:36-37.
[17]吴燕燕,张岩,李来好,等.甲基营养型芽孢杆菌抗菌肽对罗非鱼片保鲜效果的研究[J].食品工业科技,2013,34(2):315-318.
[18]XIE F H,QUAN S J,LIU D H,et al.Purification and characterization of a novel α-amylase from a newly isolated Bacillus methylotrophicus strain P11-2[J].Process Biochem,2014,49(1):47-53.
[19]吴博华,蒋雪薇,张金玉,等.促酱醪发酵芽孢杆菌的筛选及应用[J].食品科学,2021,42(6):134-141.
[20]ROONEY E A,ROWE K T,GUSEVA A,et al.Draft genome sequence of the cellulolytic and xylanolytic thermophile Clostridium clariflavum strain 4-2a[J].Genome Announc,2015,3(4):15.
[21]STEINHAUS M,SINUCO D,POLSTER J,et al.Characterization of the aroma-active compounds in pink guava(Psidium guajava L.)by application of the aroma extract dilution analysis[J].J Agr Food Chem,2008,56(11):4120-4127.
[22] FORS S.Sensory properties of volatile Maillard reaction products and related compounds[J].Comput Method Appl M,1983,74(3):307-326.
[23]罗静,赵红宇,徐炜桢,等.郫县豆瓣后发酵过程中挥发性呈香物质测定及主成分分析[J].食品科学,2018,39(18):209-216.
[24]王泽亮,张敏,邱道富,等.不同产地肉桂的挥发性成分差异分析[J].现代食品科技,2022,38(4):201-207.
[25]吴昭庆,胡萍,王晓宇,等.糍粑辣椒关键工艺对其品质的影响[J].中国食品学报,2022,22(6):209-219.