葡萄酒发酵主要包括由酵母菌完成的乙醇发酵和由乳酸菌完成的苹果酸-乳酸发酵(malolactic fermentation,MLF)[1-2]。苹果酸乳酸发酵是继乙醇发酵后重要的二次发酵,主要是在酿酒乳酸菌的作用下将苹果酸转化为乳酸和二氧化碳[3-4]。苹果酸乳酸发酵不仅降低了葡萄酒酸度,还具有提高葡萄酒生物稳定性、增加葡萄酒中香气物质种类和改善葡萄酒风味等多种作用[5-6]。苹果酸-乳酸发酵是葡萄酒生物增香的重要途径,对葡萄酒口感、风味和典型性具有重要影响[7-8]。苹果酸乳酸发酵中糖苷酶降解糖苷产生挥发性香气物质,是生物增香的重要手段[6,8]。
乳酸菌是葡萄酒苹果酸乳酸发酵的主要微生物,发酵的效果很大程度上取决于乳酸菌的种类[9-11],不同种类的葡萄酒酿造乳酸菌分离及其在葡萄酒酿造中的应用研究已被报道[12-14]。优良的酿酒乳酸菌应当对葡萄酒发酵的环境条件具有较好的耐受性,良好的苹果酸降解性能、产香性能和生物安全性[15-16]。张煜晨等[14]从新疆产区赤霞珠葡萄酒中筛选乳酸菌,并研究其降解苹果酸能力和产香能力。结果表明,植物乳杆菌(Lactobacillus plantarum)ZN3具有较强的降酸能力,并且能显著增加香气物质的种类和含量。李建芳等[17]从自然启动苹果酸-乳酸发酵的野生猕猴桃酒中筛选出的MLF菌株R6、R7和R15具有较强的SO2、酒精及pH耐受能力。潘超等[18]从自然发酵葡萄酒中分离出的1株短乳杆菌(Lactobacillus brevis),具有α-L-阿拉伯糖苷酶活、α-L-鼠李糖苷酶活和β-D-葡萄糖苷酶活。
本研究以从夏黑葡萄自然发酵中分离出的乳酸菌XHR-2为研究对象,研究其发酵特性和糖苷酶活性,以期筛选具有良好发酵性能的葡萄酒酿造乳酸菌,这对提高葡萄酒品质和开发新的酿酒微生物资源具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株乳酸菌XHR-2:本实验室从夏黑葡萄自然发酵中分离。
1.1.2 试剂
L-苹果酸、L-苹果酸测试试剂盒:阿拉丁试剂(上海)有限公司;偏重亚硫酸钾:上海杰兔工贸有限公司;对硝基苯基-β-D-葡萄糖苷:北京威知生物科技有限公司;对硝基苯基-α-L-阿拉伯糖苷、对硝基苯基-α-L-鼠李糖苷:北京中成谨念科技有限公司;所用试剂均为分析纯。
1.1.3 培养基
酸性番茄(acid tomato juice,ATB)液体培养基[12]:葡萄糖10 g/L、酵母浸粉5 g/L、蛋白胨10 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、盐酸半胱氨酸0.5 g/L、番茄汁250 mL/L,用1 mol/L NaOH调节pH值至4.8,121 ℃灭菌20 min。
ATB固体培养基:ATB液体培养基中加入2%琼脂。
模拟葡萄酒培养基:参照浩楠等[19]所述方法配制。苹果酸3.0 g/L,酒石酸3.0 g/L,柠檬酸0.5 g/L,无水葡萄糖4.0 g/L,NaCl 0.2 g/L,(NH4)2SO4 1.0 g/L,KH2PO4 2.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO4 0.05 g/L,酵母浸粉4.0 g/L;用10 mol/L NaOH 调节模拟酒pH至3.4,蒸馏水配制,121 ℃灭菌20 min。灭菌后加入SO2(以偏重亚硫酸钾计)20 mg/L,乙醇的体积分数为10%。
1.2 仪器与设备
DSX-280B型式压力蒸汽灭菌器:上海申安医疗器械厂;JBCJ-V超净工作台:苏州佳宝净化工程设备有限公司;PSH-300生化培养箱:中科生命科技股份有限公司;UH5300紫外可见分光光度计:日本日立公司;XO-400S超声波细胞破碎仪:南京先欧仪器厂;S400-B pH仪:梅特勒-托利多仪器(上海)股份有限公司。
1.3 试验方法
1.3.1 乳酸菌XHR-2生长曲线的测定
将实验室-80 ℃保存的乳酸菌XHR-2划线接种至ATB固体培养基上,37 ℃培养48 h。然后挑取单菌落接种至ATB液体培养基中,37 ℃培养35 h后,按1%(V/V)接种量再次转接到ATB液体培养基中,对菌种进行活化。活化后按0.1%接种量(V/V)接入100 mL ATB液体培养基中,37 ℃条件下静置培养70 h,每隔5 h取样测定其OD600 nm值,绘制乳酸菌XHR-2生长曲线。
1.3.2 苹果酸降解性能测定
取对数生长后期的乳酸菌XHR-2按照1%接种量接入模拟葡萄酒培养基中,25 ℃静置培养240 h[19],每隔24 h取样一次,然后利用L-苹果酸测试试剂盒测定模拟葡萄酒中L-苹果酸含量,绘制L-苹果酸含量变化曲线。
1.3.3 耐受性能测定
酒精耐受性测定:参照邹静等[20]所述方法进行测定。将乳酸菌XHR-2按0.1%接种量接入ATB液体培养基中,以不添加乙醇的培养基为对照,用无水乙醇调整ATB液体培养基的酒精度分别为6%vol、8%vol、10%vol、12%vol、14%vol、16%vol,37 ℃培养48 h后取样测量OD600nm值。
pH耐受性测定:参照浩楠等[19]所述方法进行测定。将乳酸菌XHR-2按0.1%接种量接入ATB液体培养基中,以pH4.8的培养基为对照,用盐酸调整ATB液体培养基的pH值分别为3.0、3.3、3.6、3.9、4.2、4.5,37 ℃培养48 h后取样测量OD600nm值。
SO2耐受性测定:参照徐佳敏[21]所述方法进行测定。将乳酸菌XHR-2按0.1%接种量接入ATB液体培养基中,以不添加偏重亚硫酸钾的培养基为对照,用偏重亚硫酸钾调整ATB液体培养基中SO2含量分别为20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L,37 ℃培养48 h后取样测量OD600nm值。
温度耐受性测定:参照浩楠等[19]所述方法进行测定。将乳酸菌XHR-2按0.1%接种量接入ATB培养基,以在37 ℃培养为对照,分别在10 ℃、13 ℃、16 ℃、19 ℃、22 ℃、25 ℃培养48 h后取样测量OD600nm值。
1.3.4 糖苷酶活性测定
样品的处理:将乳酸菌XHR-2按0.1%接种量接入100 mL ATB液体培养基中,37 ℃静置培养至对数生长中期35 h取样。参照LI Y H等[22]所述方法,取1 mL菌液,5 000×g离心15 min(4 ℃),得上清液和菌体完整细胞。上清液直接用作酶活测定,完整细胞悬浮于1 mL蒸馏水中用作酶活测定。另取1 mL菌液中完整细胞,悬浮于1 mL 磷酸盐缓冲液(phosphate buffer solution,PBS)(NaCl 140 mmol/L,KCl 2.7 mmol/L,Na2HPO4 10 mmol/L,KH2PO4 1.8 mmol/L,pH7.4)中,将菌体悬浮液在冰浴条件下超声波破碎(100 W,间隔2 s)20 min得细胞破碎液,然后用作酶活测定。
糖苷酶活的测定:参照李亚辉等[23]所述方法分别对上清液、完整细胞和细胞破碎液进行β-D-葡萄糖苷酶活、α-L-阿拉伯糖苷酶活和α-L-鼠李糖苷酶活测定。具体方法:取50μL待测样品于试管中,然后添加含有底物(对硝基苯-β-D-葡萄糖苷、对硝基苯基-α-L-鼠李糖苷或对硝基苯基-α-L-阿拉伯糖苷,浓度为10 mmol/L)的柠檬酸磷酸缓冲液(pH 5.0)50 μL混合均匀,37 ℃反应1 h后10 000×g离心15 min(4 ℃),加入200 μL的1 mol/L Na2CO3溶液终止反应,然后在波长400 nm处测定吸光度值。用蒸馏水代替样品作为对照。糖苷酶酶活定义为:在每克干质量乳酸菌作用下每分钟生成对硝基苯酚的量为一个酶活单位(μmol/(g·min))。每个样品重复测定3次。
1.3.5 分析检测乳酸菌XHR-2活菌数的测定:采用平板计数法。OD600nm值的测定:采用紫外分光光度计。
1.3.6 数据分析
利用SPSS18.0数据处理软件进行数据处理及统计分析。
2 结果与分析
2.1 乳酸菌XHR-2的生长曲线
乳酸菌XHR-2在ATB液体培养基中的生长曲线见图1。由图1可知,乳酸菌XHR-2在ATB液体培养基中生长良好,0~15 h为生长延滞期,15~55 h为对数生长期,55 h后进入生长稳定期。
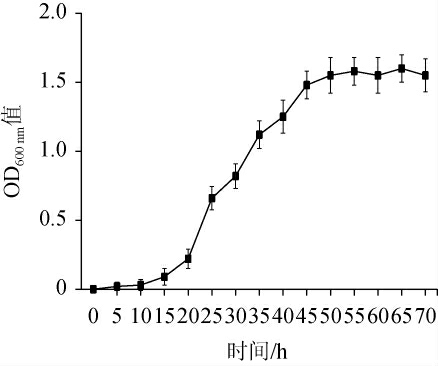
图1 乳酸菌XHR-2的生长曲线
Fig.1 Growth curve of lactic acid bacteria XHR-2
2.2 乳酸菌XHR-2的苹果酸降解性能
在模拟葡萄酒发酵过程中的L-苹果酸含量和乳酸菌XHR-2活菌数的变化见图2。由图2可知,发酵时间为0~48 h时,乳酸菌XHR-2活菌数快速下降,这可能是因为不适应模拟酒环境条件造成活菌大量死亡;发酵时间为48~72 h时,乳酸菌XHR-2活菌数回升;发酵时间为72~120 h时,活菌数变化基本处于稳定;发酵时间>120 h后,活菌数缓慢下降。发酵时间为0~24 h时,L-苹果酸含量变化较小,这可能是乳酸菌XHR-2未适应模拟葡萄酒培养基的环境条件;发酵时间为24~120 h时,L-苹果酸含量从2.97 g/L快速下降至0.53 g/L,其降解率达81.33%,这可能是因为在此期间乳酸菌XHR-2已适应模拟酒中环境条件,处于繁殖旺盛期,可降解大量苹果酸;发酵时间为120~192 h时,L-苹果酸降解速度逐渐下降;发酵时间为192 h时,L-苹果酸被完全降解,苹果酸乳酸发酵结束。乳酸菌XHR-2在第8天(192 h)完成苹果酸乳酸发酵,这和浩楠等[19]报道的研究结果基本一致,但乳酸菌XHR-2降解苹果酸的含量却高于张煜晨等[14,19]报道的研究结果。因此,乳酸菌XHR-2具有较好的苹果酸降解能力,在葡萄酒发酵中可顺利完成苹果酸乳酸发酵。
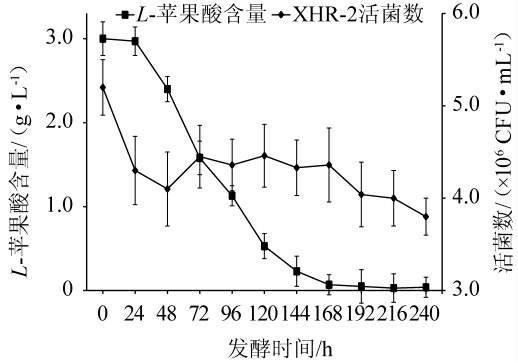
图2 模拟葡萄酒发酵过程中L-苹果酸含量和乳酸菌XHR-2活菌数的变化
Fig.2 Changes of L-malic acid contents and viable bacteria number of lactic acid bacteria XHR-2 during simulated wine fermentation process
2.3 乳酸菌XHR-2的耐受性能
乳酸菌XHR-2对酒精、pH、SO2和温度的耐受性测定结果见图3。
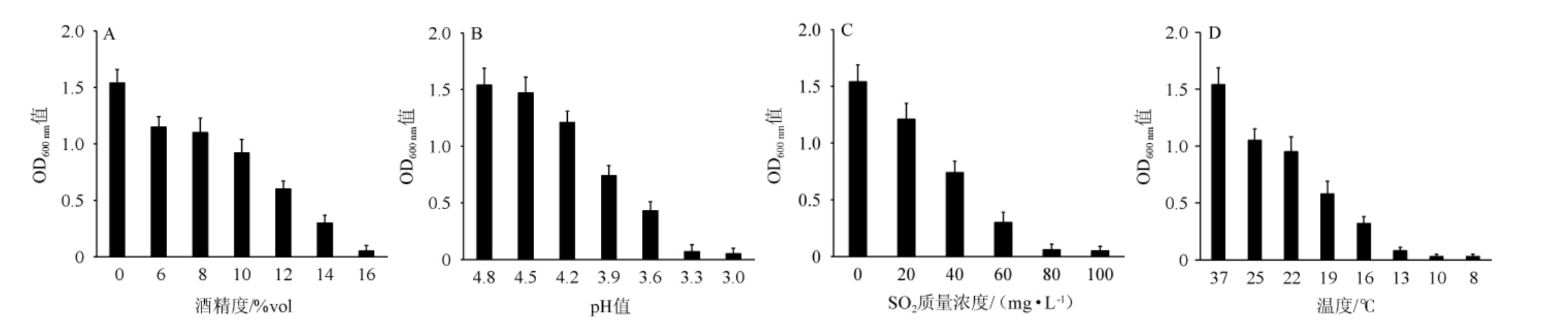
图3 乳酸菌XHR-2的耐受性测定结果
Fig.3 Determination results of tolerance of lactic acid bacteria XHR-2
不同字母代表差异显著(P<0.05)。下同。
由图3A可看出,随酒精度在0~16%vol范围内的增加,乳酸菌XHR-2的OD600 nm值逐渐降低,酒精度为0~10%vol时,乳酸菌XHR-2的OD600nm值逐渐降低,但对乳酸菌XHR-2的生长影响不大;当酒精度为12%vol时,对其生长有抑制作用;当酒精度为14%vol时,对其生长有明显抑制作用,但菌株仍可生长;当酒精度为16%vol时,乳酸菌XHR-2的生长完全受到抑制。因此,乳酸菌XHR-2可耐受酒精度为14%vol。由图3B可知,随着pH值在4.8~3.0范围内的降低,乳酸菌XHR-2的OD600 nm值逐渐降低,和pH值为4.8时相比,pH值下降至4.2时,对乳酸菌XHR-2的生长影响不大;当pH值下降至3.6时,对其生长有明显抑制作用,但菌株仍可生长;pH值降至3.3时,几乎完全抑制了乳酸菌XHR-2的生长。因此,乳酸菌XHR-2可耐受pH值为3.6。由图3C可看出,随着SO2质量浓度在0~100 mg/L范围内的增加,乳酸菌XHR-2的OD600nm值逐渐降低,SO2质量浓度为0~40 mg/L时,SO2对乳酸菌XHR-2的生长有一定抑制作用;SO2质量浓度为60 mg/L时,SO2可明显抑制乳酸菌XHR-2的生长;SO2质量浓度>60 mg/L时,可完全抑制其生长。因此,乳酸菌XHR-2可耐受SO2的质量浓度为60 mg/L。由图3D可知,随着温度在37~8 ℃的降低,乳酸菌XHR-2的OD600 nm值逐渐降低,当温度降低至19 ℃时,对乳酸菌XHR-2的生长有一定影响;当温度降低至16 ℃时,可明显抑制其生长;当将温度降低至8 ℃时,可完全抑制其生长。因此,乳酸菌XHR-2可耐受的温度为16 ℃。结果表明,乳酸菌XHR-2对精度、pH、SO2和温度具有较好的耐受性,可耐受最高酒精度、SO2质量浓度分别为14%vol、60 mg/L,可耐受pH值和温度分别为3.6和16 ℃。
2.4 乳酸菌XHR-2的糖苷酶活性
乳酸菌XHR-2糖苷酶活性测定结果见图4。
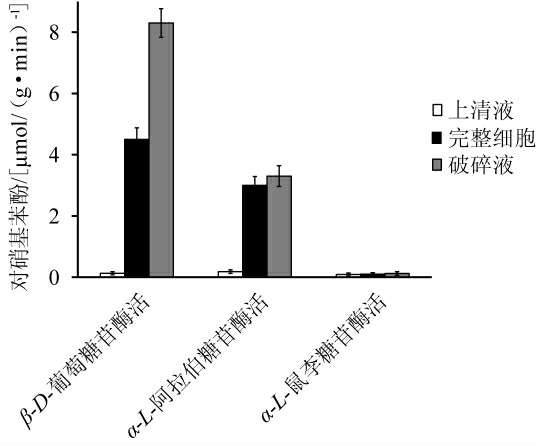
图4 乳酸菌XHR-2糖苷酶活性
Fig.4 Glycosidase activity of lactic acid bacteria XHR-2
由图4可知,乳酸菌XHR-2具有一定的β-D-葡萄糖苷酶活和α-L-阿拉伯糖苷酶活,无α-L-鼠李糖苷酶活,β-D-葡萄糖苷酶活和α-L-阿拉伯糖苷酶活主要存在细胞破碎液和完整细胞中,上清液中无酶活,乳酸菌XHR-2完整细胞和细胞破碎液的β-D-葡萄糖苷酶活分别为4.52 μmol/(g·min)和8.31 μmol/(g·min),其完整细胞和细胞破碎液的α-L-阿拉伯糖苷酶活分别为3.01 μmol/(g·min)和3.30 μmol/(g·min)。对于乳酸菌XHR-2的β-D-葡萄糖苷酶活,其在细胞破碎液的酶活显著高于其完整细胞(P<0.05),而对于α-L-阿拉伯糖苷酶活,其在细胞破碎液的酶活及完整细胞的酶活无显著差异(P>0.05)。葡萄酒中香气前体物主要以单糖苷和双糖苷形式存在,单糖苷由萜烯类、芳香烃类和脂肪醇等香气物质和葡萄糖糖基以1-4糖苷键结合形成,可直接在β-D-葡萄糖苷酶作用下水解释放出香气物质[24]。双糖苷是在单糖苷基础上再连接一个其他糖形成,其首先在α-L-阿拉伯糖苷酶或α-L-鼠李糖苷酶作用下释放出单糖苷,然后在β-D-葡萄糖苷酶作用下水解释放出香气物质[25]。结果表明,乳酸菌XHR-2不仅可以在β-D-葡萄糖苷酶活作用下降解单糖苷,还可以在α-L-阿拉伯糖苷酶活作用下降解双糖苷;乳酸菌XHR-2中β-D-葡萄糖苷酶和α-L-阿拉伯糖苷酶是非分泌型蛋白,为胞内酶,非胞外酶;乳酸菌XHR-2完整细胞可降解单糖苷和双糖苷、在实际生产中具有重要意义。乳酸菌XHR-2的β-D-葡萄糖苷酶为胞内酶,且完整细胞具有酶活,这与前人报道一致[26-27],但也有报道称酿酒乳酸菌的β-D-葡萄糖苷酶为胞外酶[28],这说明不同菌株间存在一定差异。
3 结论
本研究以夏黑葡萄自然发酵中分离出的乳酸菌XHR-2为研究对象,对其发酵特性和糖苷酶活性进行考察。结果表明,菌株XHR-2具有较好的苹果酸降解能力和较好的酒精耐受性、pH耐受性、SO2耐受性、温度耐受性,可耐受14%vol酒精度、60 mg/L SO2、pH值3.6和温度16 ℃。菌株XHR-2具有β-D-葡萄糖苷酶活和α-L-阿拉伯糖苷酶活,其在细胞破碎液中的酶活分别为8.31μmol/(g·min)、3.30μmol/(g·min),其在完整细胞中的酶活分别为4.52 μmol/(g·min)、3.01 μmol/(g·min)。本研究对开发新的酿酒微生物资源和提高葡萄酒品质具有重要意义。
[1]刘晓柱,张远林,曾爽,等.阳光玫瑰葡萄酵母菌多样性及酿造学特性分析[J].食品研究与开发,2020,41(24):212-218.
[2]SCHMIDT S A,KOLOUCHOVA R,FORGAN A H,et al.Evaluation of Saccharomyces cerevisiae wine yeast competitive fitness in enologically relevant environments by barcode sequencing[J].G3: Genes, Genom,Genet,2020,10(2):591-603.
[3]郭志君,杨磊,骆红霞,等.苹果酸—乳酸发酵对刺梨酒香气的影响[J].食品与机械,2022,38(3):197-204,233.
[4]GAMMACURTA M,LYTRA G,MARCHAL A,et al.Influence of lactic acid bacteria strains on ester concentrations in red wines:Specific impact on branched hydroxylated compounds[J].Food Chem,2018,239:252-259.
[5]李俊娥,毛亚玲,祝霞,等.苹果酸-乳酸发酵接种方式对赤霞珠干红葡萄酒香气品质的影响[J].食品与发酵工业,2021,47(19):126-132.
[6]曹颖,郑玉娟,刘龙祥,等.葡萄酒苹果酸-乳酸发酵优良菌株的筛选与发酵性能分析[J].食品研究与开发,2021,42(11):138-144.
[7] MANERA C, OLGUIN N T, BRAVO-FERRADA B M, et al.Survival and implantation of indigenous psychrotrophic Oenococcus oeni strains during malolactic fermentation in a Patagonian Pinot noir wine[J].LWTFood Sci Technol,2019,108:353-360.
[8]ZHAO H Y,LIU L X,PENG S,et al.Heterologous expression of argininosuccinate synthase from Oenococcus oeni enhances the acid resistance of Lactobacillus plantarum[J].Front Microbiol,2019,10:1393.
[9]VIGENTINI I,PRAZ A,DOMENEGHETTI D,et al.Characterization of malolactic bacteria isolated from Aosta Valley wines and evidence of psychrotrophy in some strains[J].J Appl Microbiol,2016,120:934-945.
[10] IORIZZO M, TESTA B, LOMBARDI S J, et al.Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release[J].LWT-Food Sci Technol,2016,73:557-566.
[11]潘超,高庆超,梁颖,等.酒类酒球菌β-葡萄糖苷酶研究进展[J].中国酿造,2022,41(3):24-29.
[12]李亚辉.酒类酒球菌SD-2a和31MBR的β-D-葡萄糖苷酶研究[D].杨陵:西北农林科技大学,2014.
[13]段浩云.葡萄酒MLF优良乳酸菌的筛选鉴定与特性研究[D].保定:河北农业大学,2014.
[14]张煜晨,张丹丹,林可,等.苹果酸-乳酸发酵中乳酸菌的分离及其对葡萄酒香气成分的影响[J].食品与发酵工业,2020,46(15):84-92.
[15]张焕炳.乳酸菌在葡萄酒酿造中的控制与研究[D].济南:齐鲁工业大学,2018.
[16]李莹莹,刘叶.葡萄酒乳酸菌发酵剂研究进展[J].酿酒科技,2016(11):100-103.
[17]李建芳,周枫,王爽,等.野生猕猴桃酒苹果酸-乳酸发酵优良乳酸菌的筛选与耐受性研究[J].中国酿造,2019,38(8):56-59.
[18]潘超,高庆超,梁颖,等.葡萄酒酿造乳酸菌的分离鉴定及糖苷酶活分析[J].中国食品学报,2023,23(4):345-353.
[19]浩楠,马腾臻,贠建民,等.甘肃河西走廊产区野生乳酸菌筛选及酿酒特性研究[J].食品与发酵工业,2019,45(10):142-148.
[20]邹静,孟军,张建才,等.葡萄酒用乳酸菌的分离筛选及应用性能初探[J].酿酒科技,2018(12):45-56.
[21]徐佳敏.降解生物胺的苹果酸-乳酸菌筛选及其在葡萄酒酿造中的应用研究[D].银川:宁夏大学,2022.
[22]LI Y H,MA Y H,HUANG K H,et al.Identification and localization of beta-D-glucosidase from two typical Oenococcus oeni strains[J].Pol J Microbiol,2016,65(2):209-213.
[23]李亚辉,董梅,崔禾苗,等.酒酒球菌SD-2a的β-D-葡萄糖苷酶活性研究[J].食品科技,2013,38(8):48-52.
[24]潘超,高庆超,梁颖,等.酒类酒球菌β-葡萄糖苷酶研究进展[J].中国酿造,2022,41(3):24-29.
[25]CID A G,GOLDNER M C,DAZ M,et al.The effect of endozym β-split,a commercial enzyme preparation used for aroma release,on tannat wine glycosides[J].S Afr J Enol Vitic,2012,33(1):51-57.
[26]LI Y H,WANG Y,FAN L L,et al.Assessment of β-D-glucosidase activity and bgl gene expression of Oenococcus oeni SD-2a[J].Plos One,2020,15(10):1-15.
[27]MATURANO C,RIVERO L D V,RODRIGUEZ VAQUERO M J,et al.The effect of organic acids and sulfur dioxide on C4 compound production and β-glucosidase activity of Oenococcus oeni from wines under acidic conditions[J].Int J Wine Res,2016,8:19-28.
[28] MANSFIELD A K, ZOECKLEIN B W, WHITON R S.Quantification of glycosidase activity in selected strains of Brettanomyces bruxellensis and Oenococcus oeni[J].Am J Enol Vitic,2002,53(4):303-307.