糖尿病(diabetes mellitus,DM)已逐渐成为继肿瘤、心血管疾病之后的第三大严重慢性非传染病。国际糖尿病联盟(international diabetes federation,IDF)第十版糖尿病地图显示,2021年,全球20~79岁糖尿病患者约为5.366亿,到2045年将上升至7.832亿,这意味着目前全球超过10.5%的成年人口患糖尿病[1]。其中2型糖尿病(type 2 diabetes mellitus,T2DM)患者占患者总数的95%左右[2]。T2DM机制主要涉及胰岛β细胞功能紊乱、胰岛素抵抗、炎症反应和氧化应激反应[3]。氧化还原状态受损在DM临床症状出现之前就可检测到,因此,氧化应激增加被认为是糖尿病及其并发症的发生和进展的重要参与者。
机体摄入的氧90%在线粒体内进行氧化磷酸化,该过程会产生大量氧自由基,因此,有1%~2%的氧从线粒体呼吸链逸出形成了活性氧簇(reactive oxygen species,ROS)[4],当超出内源性抗氧化防御系统对ROS的消除能力时,过多的ROS会激活体内c-Jun氨基末端激酶通路、氨基己糖通路、核因子κB及p38丝裂原活化蛋白激酶通路等,从而损伤胰岛β细胞并产生体内胰岛素抵抗反应,最终引起T2DM[5]。因此,抗氧化是治疗T2DM的一种重要手段。大量研究发现,多种中药及其提取物和中药复方具有抗氧化功能[6-8],并且经过益生菌发酵而成的酵素产品可在改善风味的同时产生大量生物活性物质,增加功能特性,具有良好的抗氧化、调节肠道菌群、降糖、调脂等功效,对T2DM的防治具有积极作用[9-10]。目前,以中医药理论为指导,开发既能降低血糖,又安全、高效的功能性食品逐渐成为了新的发展趋势。
本研究以中药复方益糖康[11]为对照,以蔬菜、水果并添加复合乳酸菌发酵制备的混合植物果蔬酵素[12]为研究对象,通过体外测定自由基的清除能力研究混合植物果蔬酵素的体外抗氧化特性,并通过大鼠实验来探究其降血糖活性,为开发具有血糖调节功效的功能性食品提供理论依据。
1 材料与方法
1.1 材料与试剂
40只6周龄符合无特殊病原体(specific pathogens free,SPF)级别的健康雄性Wistar大鼠(体质量:(250±20)g,许可证号:SCXK(辽)2015-0001,实验大鼠均受人道对待,通过辽宁中医药大学动物实验伦理审查):辽宁长生生物技术有限公司;链脲佐菌素(streptozotocin,STZ):美国Sigma公司;混合植物果蔬酵素(玉竹、马齿苋、柚子、南瓜、芹菜、山药各80 g,红参、生姜、枸杞各60 g)[12]:辽宁省糖尿病中医病证结合重点实验室;中药复方益糖康(红参、黄芪、黄精、甘草、白术、丹参、枸杞子、葛根、三七、茯苓、五味子、黄连(10∶10∶13∶4∶3∶3∶3∶3∶3∶3∶3∶3)[11]浸泡30~60 min,水煎3次,每次30 min,取煎液浓缩至含药质量浓度2 g/mL):辽宁中医药大学附属医院;高脂饲料(批号:88001174,成分:基础饲料67%、猪油10%、蔗糖20%、胆固醇2.5%、胆酸钠0.5%):茂华生物科技公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)测定试剂盒:南京建成生物工程研究所;柠檬酸(分析纯):中国生物技术股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenyl,DPPH)(分析纯):美国Sigma公司;邻二氮菲(分析纯):国药集团化学试剂有限公司;硫酸亚铁(分析纯):天津市北联精细化学品开发有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
ACCU-CHEK血糖仪:中国罗氏制药有限公司;Fresco17高速冷冻离心机:美国Thermo Scientific公司;pE酶标仪:美国Victor公司;BioSpec-nano型紫外分光光度计:日本岛津公司。
1.3 方法
1.3.1 体外抗氧化活性的测定
DPPH自由基清除率的测定:参考KAZUKO S等[13]的方法,将2 mL酵素溶液和2 mL质量浓度为0.04 g/L的DPPH溶液混匀,室温避光反应30 min,于4 500 r/min条件下离心10 min,于波长517 nm处测定吸光度值Ax,用无水乙醇代替酵素溶液作为空白对照测定吸光度值A0,用无水乙醇代替DPPH溶液作为样品对照测定吸光度值Ax0,计算DPPH自由基清除率,其计算公式如下:
羟自由基清除率的测定:参考LI B等[14]的方法,将1 mL酵素溶液、FeSO4溶液、乙醇-水杨酸溶液、H2O2充分混匀,37 ℃水浴15 min后,4 500 r/min离心10 min,于波长510 nm处测定吸光度值Ax,用蒸馏水代替酵素溶液作为空白对照测定吸光度值A0,用蒸馏水代替H2O2溶液作为样品对照测定吸光度值Ax0,计算羟自由基清除率,其计算公式如下:
1.3.2 T2DM大鼠造模方法
健康SPF级Wistar大鼠40只,随机选取10只大鼠作为正常组,普通饲料喂养,其余30只大鼠连续喂养高脂饲料。维持上述喂养方法4周后,禁食16 h,称质量。正常组大鼠根据体质量注射同等体积的0.1 mmol/L柠檬酸钠缓冲液,其余30只大鼠腹腔注射STZ,剂量为45 mg/kg,建立2型糖尿病大鼠模型。注射STZ 72 h后测其空腹血糖值(fasting blood glucose,FBG),考察造模情况。
1.3.3 实验分组和给药
造模成功后的大鼠随机分为模型组、中药组(中药复方益糖康)、酵素组(混合植物果蔬酵素),每组10只。各组大鼠采用每日经口灌胃方式给药1次,连续给药干预8周。正常组和模型组灌胃10 mL/(kg·d)的生理盐水,中药组灌胃10 mL/(kg·d)的中药复方益糖康,酵素组灌胃10 mL/(kg·d)的混合植物果蔬酵素。
1.3.4 体质量、饮水量、空腹血糖值的测定及口服葡萄糖耐受试验
灌胃期间,每2周测定各组大鼠的饮水量和体质量;从大鼠尾尖取血,采用罗氏血糖仪测定FBG,测定前禁食16 h;最后一周测定FBG后,经口灌胃2 g/kg葡萄糖溶液,分别测定大鼠服糖后0、30 min、60 min、120 min的血糖值,计算曲线下面积(area under curve,AUC),其计算公式如下:
曲线下面积=1/4(A+4B+3C)
式中:A、B、C分别为给药后0 min、30 min、120 min的血糖值。
1.3.5 氧化应激指标的测定
按照超氧化物歧化酶、过氧化氢酶、还原性谷胱甘肽和丙二醛的检测试剂盒说明书分别测定超氧化物歧化酶、过氧化氢酶活力及还原性谷胱甘肽和丙二醛的含量,比较各组大鼠血清中抗氧化因子的差异。
1.3.6 数据处理及统计分析
使用Origin 2019b软件对实验数据进行处理,结果以“平均值±标准差”表示;使用SPSS 22.0软件进行统计分析;采用Graphpadprism 8软件制图。
2 结果与分析
2.1 体外抗氧化能力的测定
2.1.1 DPPH自由基清除能力的测定
DPPH自由基清除能力可在短时间内评判酵素的抗氧化特性,是体外检测物质抗氧化效果最常用的方法之一[15]。发酵前后不同添加量混合植物果蔬酵素对DPPH自由基的清除率见图1。
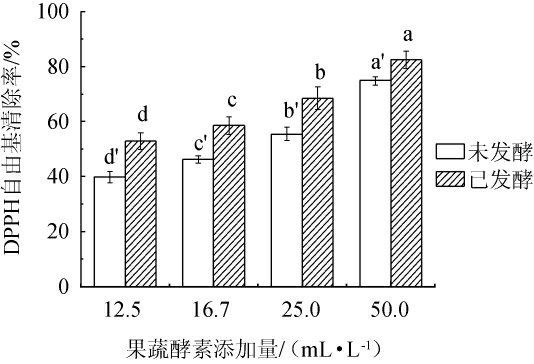
图1 发酵前后不同添加量混合植物果蔬酵素的DPPH自由基清除率
Fig.1 DPPH free radical scavenging rates of mixed fruit and vegetable Jiaosu with different addition before and after fermentation
不同小写字母表示差异显著(P<0.05)。下同。
由图1可知,植物果蔬经益生菌发酵后,DPPH自由基清除率升高,且混合植物果蔬酵素的添加量与DPPH自由基清除能力呈现浓度依赖性特征,当混合植物果蔬酵素添加量为50.0 mL/L时,DPPH自由基清除率达到82.5%。
2.1.2 羟自由基清除能力的测定
羟自由基清除能力是评判抗氧化能力指标之一[16]。发酵前后不同添加量混合植物果蔬酵素对羟自由基的清除率见图2。
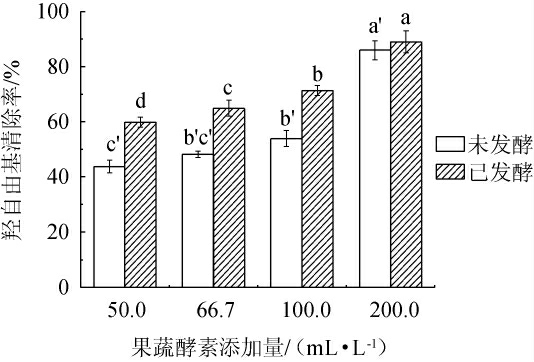
图2 发酵前后不同添加量混合植物果蔬酵素的羟自由基清除率
Fig.2 Hydroxyl radical scavenging rates of mixed fruit and vegetable Jiaosu with different addition before and after fermentation
由图2可知,植物果蔬经益生菌发酵后,羟自由基清除率升高,表明发酵产生了大量能够清除羟自由基的有益成分。混合植物果蔬酵素的添加量与羟自由基清除能力呈现浓度依赖性特征,当混合植物果蔬酵素添加量为200.0 mL/L时,羟自由基清除率达到89%。
2.2 降血糖活性的测定
2.2.1 试验大鼠造模情况
本试验选用40只6周龄SPF级Wistar大鼠进行研究,对其中30只大鼠进行高脂饲料喂养,并以腹腔注射STZ的方式对其进行造模。注射STZ 72 h后测其空腹血糖,结果发现,30只大鼠的FBG值均大于16.7 mmol/L,视为造模成功。
2.2.2 混合植物果蔬酵素对T2DM大鼠体质量的影响
混合植物果蔬酵素对T2DM大鼠体质量的影响见表1。由表1可知,造模成功后药物干预前,与正常组相比,其余3组大鼠因喂食高脂饲料,体质量均极显著升高(P<0.01)。干预过程中,正常组大鼠体质量逐渐增加,模型组大鼠体质量持续快速下降,中药组及酵素组大鼠体质量下降,但下降速度较慢,对质量控制较好,且酵素组对大鼠体质量控制结果稍差于中药组(P>0.05),说明其对糖尿病大鼠消瘦症状有一定改善作用,且效果接近中药的作用。
表1 各组大鼠体质量的变化
Table 1 Changes in body mass of rats in each group
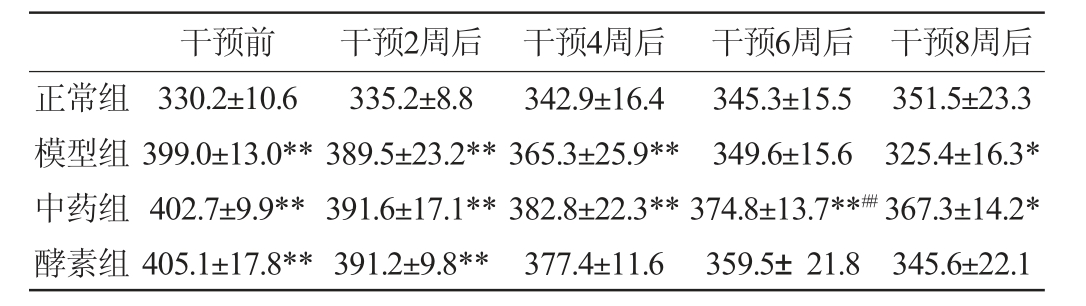
注:与正常组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);与模型组比较,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01)。下同。
干预前 干预2周后 干预4周后 干预6周后 干预8周后正常组模型组中药组酵素组351.5±23.3 325.4±16.3*367.3±14.2*345.6±22.1 330.2±10.6 399.0±13.0**402.7±9.9**405.1±17.8**335.2±8.8 389.5±23.2**391.6±17.1**391.2±9.8**342.9±16.4 365.3±25.9**382.8±22.3**377.4±11.6 345.3±15.5 349.6±15.6 374.8±13.7**##359.5±21.8
2.2.3 混合植物果蔬酵素对T2DM大鼠饮水量的影响
各组大鼠的饮水量情况见表2。由表2可知,造模成功后药物干预前,与正常组相比,其余3组大鼠饮水量有极显著的升高(P<0.01)。干预过程中,模型组的饮水量始终持续升高,且极显著高于正常组(P<0.01);中药组和酵素组的饮水量持续下降,且干预4周后极显著或显著低于模型组(P<0.01或P<0.05)。结果表明,T2DM大鼠会出现典型的多饮症状,而混合植物果蔬酵素可以明显改善T2DM大鼠的多饮症状。
表2 各组大鼠饮水量的变化
Table 2 Changes in water intake of rats in each group
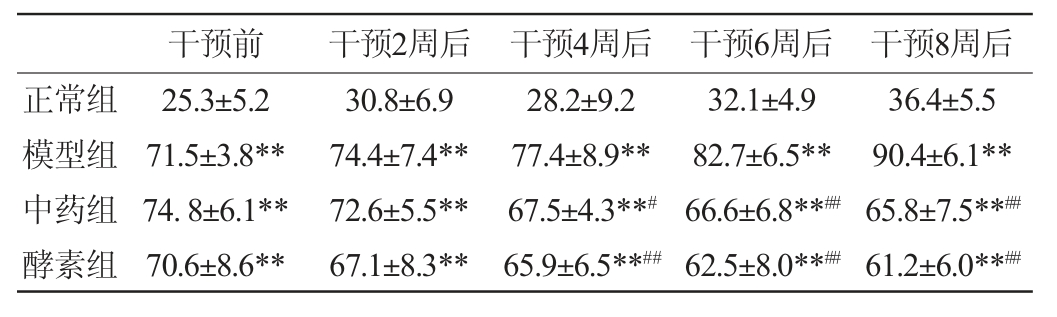
干预前 干预2周后 干预4周后 干预6周后 干预8周后正常组模型组中药组酵素组25.3±5.2 71.5±3.8**74.8±6.1**70.6±8.6**30.8±6.9 74.4±7.4**72.6±5.5**67.1±8.3**28.2±9.2 77.4±8.9**67.5±4.3**#65.9±6.5**##32.1±4.9 82.7±6.5**66.6±6.8**##62.5±8.0**##36.4±5.5 90.4±6.1**65.8±7.5**##61.2±6.0**##
2.2.4 混合植物果蔬酵素对T2DM大鼠空腹血糖值的影响
混合植物果蔬酵素对大鼠空腹血糖值的影响见表3。由表3可知,造模成功后药物干预前,与正常组相比,其余3组大鼠的FBG极显著升高(P<0.01)。干预过程中,模型组的FBG极显著高于正常组(P<0.01);中药组和酵素组的FBG逐渐降低,干预2周后极显著低于模型组(P<0.01),且中药组的FBG更低,说明中药和混合植物果蔬酵素均能明显改善大鼠的FBG,且中药组改善效果更好。
表3 各组大鼠空腹血糖值的变化
Table 3 Changes in fasting blood glucose values of rats in each group
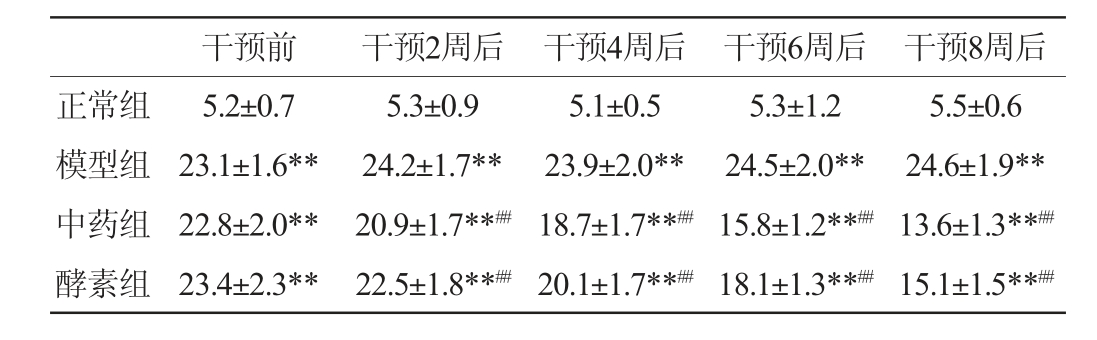
干预前 干预2周后 干预4周后 干预6周后 干预8周后正常组模型组中药组酵素组5.2±0.7 23.1±1.6**22.8±2.0**23.4±2.3**5.3±0.9 24.2±1.7**20.9±1.7**##22.5±1.8**##5.1±0.5 23.9±2.0**18.7±1.7**##20.1±1.7**##5.3±1.2 24.5±2.0**15.8±1.2**##18.1±1.3**##5.5±0.6 24.6±1.9**13.6±1.3**##15.1±1.5**##
2.2.5 混合植物果蔬酵素对T2DM大鼠口服葡萄糖耐量的影响
口服葡萄糖耐量试验是一种葡萄糖负荷试验,用以评估胰岛β细胞功能和机体调节血糖的能力,广泛应用于临床糖尿病的确诊试验[17]。各组大鼠喂食葡萄糖溶液后,血糖水平变化情况见图3,AUC变化情况见表4。由图3可知,喂食葡萄糖溶液30 min时,各组大鼠血糖浓度达到峰值,模型组大鼠血糖浓度最高,极显著高于其他组大鼠血糖浓度(P<0.01),表明其口服葡萄糖耐量异常;酵素组与中药组和正常组血糖浓度相近,无显著差异(P>0.05),且喂食葡萄糖溶液120 min后接近正常血糖值。结果表明,混合植物果蔬酵素可极显著抑制大鼠口服葡萄糖负荷后的血糖升高(P<0.01)。由表4可知,酵素组和中药组血糖曲线下面积与正常组无显著差异(P>0.05),但极显著低于模型组(P<0.01),表明混合植物果蔬酵素可以有效改善T2DM大鼠糖耐量。
表4 各组大鼠血糖曲线下面积的测定结果
Table 4 Determination results of area under curve of glucose of rats in each group

组别 血糖曲线下面积/(mmol·(L·h)-1)正常组模型组中药组酵素组21.7±1.6 58.1±2.7**20.4±2.3##22.4±2.6##

图3 各组大鼠口服葡萄糖耐量的测定结果
Fig.3 Determination results of oral glucose tolerance of rats in each group
2.2.6 混合植物果蔬酵素对T2DM大鼠血清氧化应激水平的影响
各组大鼠血清氧化应激指标结果见图4。由图4可知,与正常组比较,模型组大鼠SOD、CAT活性及GSH含量极显著下降(P<0.01),MDA含量极显著升高(P<0.01),说明T2DM大鼠出现氧化应激反应。与模型组相比,中药组SOD、CAT活性及GSH含量提高,其中SOD活性显著提高(P<0.05),MDA含量极显著下降(P<0.01);酵素组SOD、CAT活性及GSH含量提高,其中SOD活性及GSH含量显著或极显著提高(P<0.01或P<0.05),MDA含量极显著下降(P<0.01)。除MDA含量外,酵素组的其他3个指标升高效果优于中药组,结果说明,混合植物果蔬酵素干预后,一定程度上改善了其氧化应激反应,且改善效果优于中药组。
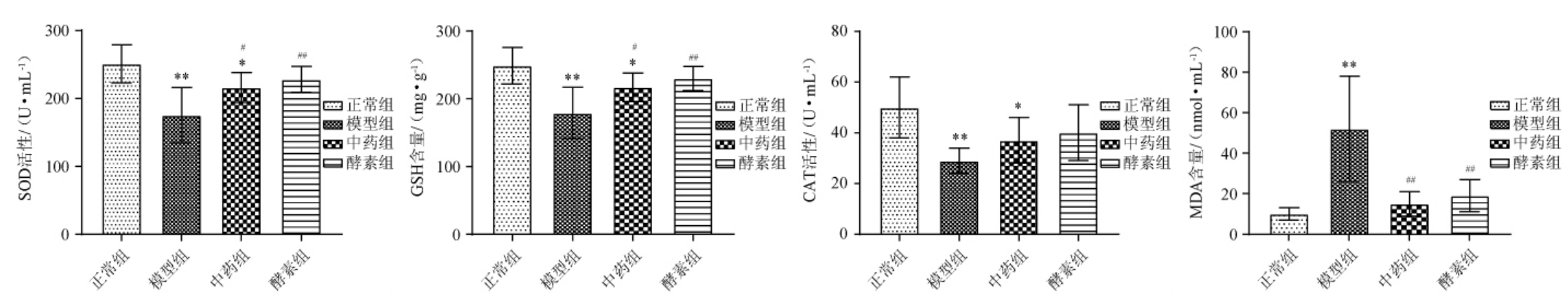
图4 不同处理组大鼠血清的氧化应激指标
Fig.4 Oxidative stress indexes of serum of rats of different treatment groups
3 讨论
糖尿病作为一种代谢性疾病,主要表现为血糖的升高,而长期的高血糖状态会引起机体糖脂代谢异常,从而引发全身多器官、多系统的损害[18]。氧化应激是由于机体抗氧化功能与氧化功能失衡导致,与糖尿病的发生密切相关[19]。研究表明,食用具有抗氧化功能的食品可以有效改善氧化应激,预防或改善2型糖尿病及其并发症症状[20]。新型食品酵素被认为具有抗氧化、保护心血管、降糖等功效[21]。
本研究中的混合植物果蔬酵素体外抗氧化试验结果表明,混合植物果蔬酵素对DPPH自由基和羟自由基的清除能力强于发酵前,由此说明发酵产生了大量能够清除自由基的有益成分。在大鼠试验中,与模型组相比,喂食混合植物果蔬酵素后大鼠的体质量和饮水量情况明显得到改善,且酵素组的结果与中药组效果接近;经混合植物果蔬酵素干预后,酵素组大鼠的FBG明显低于模型组,OGT明显高于模型组,酵素组也与中药组和正常组结果相似,120 min后血糖趋近于正常值。这些结果均表明混合植物果蔬酵素对T2DM大鼠有良好的降血糖活性。氧化应激与多种糖尿病并发症有关,在胰岛β细胞受损、肝脏胰岛素抵抗和外周胰岛素抵抗等糖尿病发展过程中起重要作用,同时会带来抗氧化酶活性和数目的下降[22]。喂食混合植物果蔬酵素后的大鼠血清中SOD、GSH、CAT水平较模型组均升高,MDA水平下降,且酵素组SOD、GSH、CAT水平优于中药组,T2DM大鼠抗氧化能力显著提高,能有效控制氧化损伤导致的胰岛β细胞损伤,从而防止糖尿病发生。这可能是因为混合植物果蔬酵素中红参的人参皂苷Rg1[23]、玉竹[24]、山药[25]、南瓜[26]、枸杞[27]中的多糖,芹菜中的芹菜素[28]等本身具有调节糖尿病大鼠糖脂代谢异常的功效,且经发酵后可能生成了一些活性成分能够抑制糖尿病鼠体内的氧化应激水平。本研究中的混合植物果蔬酵素有利于控制血糖,缓解氧化应激,有效控制各类系统器官损伤,对T2DM及并发症的防控具有积极作用。
4 结论
通过体外抗氧化活性测定发现,发酵后,混合植物果蔬酵素的自由基清除率提高,当添加量为50 mL/L时,DPPH自由基清除率达到82.5%;当添加量为200 mL/L时,羟自由基清除率达到89%。通过STZ诱导大鼠建立T2DM模型,对混合植物果蔬酵素的血糖干预作用进行评价发现,混合植物果蔬酵素可以控制T2DM大鼠体质量迅速下降,饮水量的增高,降低FBG、AUC,提高OGT,提高血清中SOD、GSH、CAT水平,降低MDA水平。综上,结果表明,混合植物果蔬酵素具有抗氧化性,并可以改善T2DM大鼠血糖及氧化应激水平,具有预防或改善2型糖尿病的作用。
[1]SUN H,SAEEDI P,KARURANGA S,et al.IDF Diabetes Atlas:Global,regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Res Clin Pr,2022,183:109-119.
[2]THOMAS C C, PHILIPSON L H.Update on diabetes classification[J].Med Clin North Am,2015,99(1):1-16.
[3]张昌林,吴荣焕,盛泓沁,等.基于网络药理学的葛根芩连汤治疗2型糖尿病的效应机制[J].中国实验方剂学杂志,2018,24(19):179-188.
[4]赵彦,孙桂香.氧化应激与单纯性肥胖及2型糖尿病的关系[J].天津医药,2010,38(5):442-443.
[5]史凌燕.氧化应激水平与肥胖和2型糖尿病的关系[J].糖尿病新世界,2015(8):237-238.
[6]陈冉,杨金月,于国泳.中药基于抗氧化应激及其下游相关因子延缓糖尿病肾病的研究进展[J].环球中医药,2022,15(8):1477-1485.
[7]蒋兰兰,鲁敏,安华明.刺梨与无籽刺梨果实中药化学成分及抗氧化物质的比较分析[J].果树学报,2023,40(1):111-125.
[8]张建明,张德志,舒德斌,等.4种中药复方对长江鲟幼鱼抗氧化和抗应激指标的影响[J].南方农业学报,2022,53(2):568-576.
[9]索婧怡,朱雨婕,陈磊,等.食用酵素的研究及发展前景分析[J].食品与发酵工业,2020,46(19):271-283.
[10]田文静,武亚帅,王俊山,等.果蔬酵素的研究进展[J].食品科技,2021,46(12):116-122.
[11]张冰冰,朱爱松,石岩.从Toll受体3介导的信号传导通路探讨中药益糖康对糖尿病小鼠动脉粥样硬化的影响[J].中华中医药杂志,2019,34(10):4885-4888.
[12]陈青青,董墨思,石岩,等.具有调节血糖功效的复合植物酵素的研究[J/OL].食品与发酵工业:1-9[2023-02-27].DOI:10.13995/j.cnki.11-1802/ts.034073.
[13] KAZUKO S, KUNIKO F, KEIKO Y, et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].J Agr Food Chem,2002,40(6):945-948.
[14] LI B, CHEN F, WANG X, et al.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chem,2006,102(4):1135-1143.
[15] CARMELINA S, FERNANDO C R, JOSEPHINE M, et al.Effect of roasting on the radical scavenging activity of cocoa beans[J].Eur Food Res Technol,2006,222(3-4):368-375.
[16]谢倩倩.外来入侵植物黄顶菊中活性成分的分离分析、结构鉴定及活性研究[D].北京:北京化工大学,2023.
[17]蒋燕秋,王鑫蕾,顾云娟.口服葡萄糖耐量试验中血糖曲线形态与胰岛功能关系的研究进展[J].中华糖尿病杂志,2022,14(5):517-520.
[18] JO Y H, LEE S, YEON S W, et al.Anti-diabetic potential of Maclura tricuspidata leaves:Prenylated isoflavonoids with α-glucosidase inhibitory and anti-glycation activity[J].Bioorg Chem,2021,114:105098-105098.
[19]周莹,刘军彤,宁顺宇,等.益糖康治疗2型糖尿病研究进展[J].辽宁中医药大学学报,2023,25(2):214-220.
[20]唐超,江惠娟,苏二正.食用酵素的研究进展[J].生物加工过程,2018,16(3):84-90.
[21]梁红敏,刘洁,史红梅.食用植物酵素研究进展[J].食品工业,2020,41(7):193-197.
[22]李飞翔.“痰瘀同治”对糖尿病大鼠心肌氧化应激反应的作用研究[D].合肥:安徽中医药大学,2022.
[23]陈羡人,高雅文,邓小梅.人参皂苷Rg1对糖尿病大鼠肝损伤、氧化应激及肝组织Toll样受体4表达的影响[J].中国临床药理学杂志,2020,36(2):146-149.
[24] 刘月新,刘倩倩,廖颖妍,等.玉竹多糖结构特征及其降糖生物活性研究进展[J].现代中药研究与实践,2022,36(1):98-102.
[25]梁杉,王琨,刘佩瑶,等.山药多糖结构、生物活性及其机制研究进展[J].食品科学,2022,43(23):296-304.
[26]李雪晖,罗心雨,王莹.羧甲基化南瓜多糖的制备及抗氧化、降血糖活性研究[J].食品与机械,2022,38(3):178-183,246.
[27]万凤奇.枸杞多糖调节肝脏葡萄糖产生和抗糖尿病肾炎的作用研究[D].北京:中国科学院大学,2022.
[28]潘俊坤,张强,焦中高.芹菜素对二肽基肽酶Ⅳ的抑制作用及其机制[J].中国食物与营养,2023,29(4):48-52,61.