中国传统白酒具有种类繁多和风味多样的特点,其中浓香型白酒销售量约占市场70%以上[1],具有窖香浓郁、清冽甘爽、绵柔醇厚、香味协调且尾净余长的特点[2]。浓香型白酒的产区主要分布在长江宜泸、成都平原、淮河流域和黄河下游,不同产区酿造的白酒其风味品质不同,究其原因可能与白酒酿造工艺和酿造环境有关[3]。浓香型大曲以软质小麦为原料,既蕴含了丰富的菌系和酶系,亦为白酒的发酵生香提供了动力,因而有“曲是酒之骨”的说法[4]。程伟等[5]对淮河流域产区中皖北地区浓香型大曲的真菌群落结构进行解析,发现丰度较高的真菌类群为根霉属(Rhizopus)、布氏白粉菌属(Blumeria)、散子囊菌属(Eurotium)和嗜热子囊属(Thermoascus);吴树坤等[6]对长江宜泸产区中宜宾和泸州等地浓香型大曲的微生物群落结构进行研究,发现该产区大曲中优势细菌属以葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)和高温放线菌属(Thermoactinomyces)为主;杨旭等[7]对淮河流域产区中河南地区浓香大曲发酵过程中细菌菌群的动态变化进行研究,发现Lactobacillus为大曲整个发酵过程中的优势菌属。
Illumina MiSeq高通量测序技术因其通量高、成本低和一次运行反应能完成几十万条至几百万条核酸[8],近年来被广泛应用于酸奶[9]、鲊广椒[10]、豆豉[11]和米酒[12]等发酵食品微生物多样性解析中,打破了纯培养技术的局限性,实现了对发酵食品中优势物种、稀有物种及一些未知物种的全面解析[13]。位于黄河下游产区的山东省亦是浓香型白酒生产大省,兰陵、景芝、扳倒井、泰山和花冠等均产自该地区,因而采用Illumina MiSeq高通量测序技术对该地区浓香大曲的微生物群落结构进行解析,明确该地区的酿造微生物资源构成,是极为必要的。
本研究根据QB/T 4257—2011《酿酒大曲通用分析方法》对山东兰陵2份浓香大曲样品的理化指标进行测定,采用Illumina MiSeq高通量测序技术对其细菌群落结构进行解析,并使用传统纯培养技术对其蕴含的细菌资源进行挖掘和保藏,通过本研究的开展对山东地区浓香型白酒酿造微生物资源的解析和高效利用具有积极意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
从山东省临沂市兰陵县(E117°41'~118°18',N34°37'~35°06')随机选取同一批次中的2份浓香大曲样品,编号分别为LL1和LL2,及时粉碎成粉后于-20 ℃保存备用。
1.1.2 试剂
QIAGEN DNeasy mericon Food Kit:德国QIAGEN公司;5×TransStartTM FastPfu Buffer、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)Mix、FastPfu Fly DNA Polymerase:北京全式金生物技术有限公司;引物338F/806R、27F/1495R、M13F(-47)/M13R(-48):上海桑尼生物科技有限公司;克隆载体pMD18-T:大连宝生物工程有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
营养琼脂(nutrient agar,NA)培养基、MRS培养基:青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
2500Y高速多功能粉碎机:永康市铂欧五金制品有限公司;LRH-250生化恒温培养箱:上海力辰仪器科技有限公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;DYY-12电泳仪:北京六一仪器厂;UVPCDS8000凝胶成像分析系统:美国Protein-Simple公司;Illunima MiSeq PE300高通量测序平台:美国Illumina公司;R920机架式服务器:美国DELL公司。
1.3 实验方法
1.3.1 浓香大曲样品理化指标的测定
含水量、可滴定酸度、糖化力、酯化力和发酵力的测定:根据行业标准QB/T 4257—2011《酿酒大曲通用分析方法》;水分活度的测定:使用水分活度测定仪;淀粉含量的测定:采用Fehling滴定法[14];蛋白质含量的测定:采用凯氏定氮法[15]。每项指标均重复测定三次。
1.3.2 宏基因组DNA的提取、PCR扩增和Illumina MiSeq高通量测序
按照试剂盒的说明,使用QIAGEN DNeasy mericon Food Kit从兰陵浓香大曲样品(2 g)中提取宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),采用分光光度法和1%琼脂糖凝胶电泳法检测提取DNA的纯度、浓度和完整性。以提取的DNA为模板,使用引物338F(5'-ACTCCTACGGGAG GCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rRNA V3-V4区基因序列进行PCR扩增,PCR扩增体系及参数参照GUO Z等[16]的方法,将扩增子浓度稀释至100 nmol/L,使用Illumina MiSeq测序仪进行2×300 bp的双末端测序。
1.3.3 生物信息学分析
根据CAI W等[17]的质控条件对下机数据的序列进行质量控制,再参照WANG Y等[18]的分析方法,利用QIIME(v1.90)平台对保留序列依次使用PyNAST、UCLUST和ChimeraSlayer进行校准、比对、聚类和嵌合体的去除,再通过RDP、Greengenes和SILVA数据库进行同源性比对,采用两步UCLUST法在97%的序列相似性水平下进行操作分类单元(operational taxonomic unit,OTU)划分。基于发现物种数和香农指数等α多样性指数,评价各样品细菌丰度和多样性。利用发现物种数曲线和香农指数曲线,评价测序深度是否满足后续生物信息学分析要求,继而进行物种分析和多样性评价。
1.3.4 细菌菌株的分离鉴定
称取10 g曲粉,使用倍比稀释涂布法对样品中细菌进行稀释分离,再分别于NA固体培养基和含有1.0%碳酸钙的MRS固体培养基上划线纯化,于生化培养箱中37 ℃培养48 h,最后使用甘油保藏法将细菌菌株和疑似乳酸菌菌株保藏于-80℃,备用。使用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)法对分离菌株的DNA进行提取[19],以其为模板,参照葛东颖等[20]的方法进行PCR扩增、清洁、连接和转化,并挑选阳性克隆子送往上海桑尼生物科技有限公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行同源性比对分析,使用MAGE7.0中的邻接(neighborjoining,NJ)法构建系统发育树。
1.3.5 数据处理
使用Origin 2017软件绘制稀疏曲线、香农指数曲线和柱形图,使用MEGA 7.0绘制分离株和核心OTU的系统发育树,基于网站(http://jvenn.toulouse.inra.fr/app/example.html)绘制Venn图,使用R软件绘制核心OTU相对含量的热图。
2 结果与分析
2.1 兰陵浓香大曲样品理化指标的分析
通过测定理化指标可对酒曲的质量进行直接的评价,兰陵浓香大曲样品LL1和LL2的可滴定酸度均为0.5mmol/10g;水分含量分别为7.42%和7.41%;水分活度分别为0.604和0.642;氨基酸态氮含量分别为2.89 g/kg和1.74 g/kg;灰分分别为2.15 g/100 g和2.06 g/100 g;淀粉含量分别为50.9%和51.6%;蛋白质含量分别为17.323%和16.628%;糖化力分别为749 U和630 U;酯化力分别为727 U和685 U;发酵力均为0.5 U;酒化力分别为8.8 U和4.7 U;液化力分别为0.63 U和1.85 U,2份兰陵浓香大曲样品的理化指标均符合QB/T 4259—2011《浓香大曲》要求。
2.2 兰陵浓香大曲样品高通量测序结果和α多样性分析
基于高通量测序技术,2份兰陵浓香大曲样品共产生72 414条高质量的16S rRNA基因序列,每份样品平均36 207条。本研究进一步采用两步UCLUST法进行OTU划分,在97%的序列相似性水平下,共划分出3 405个OTU,剔除单序列OTU后,最后获得813个OTU。为评估该样品目前的测序深度是否满足后续的生物信息学分析,绘制样品的稀疏曲线和香农指数曲线,结果见图1。
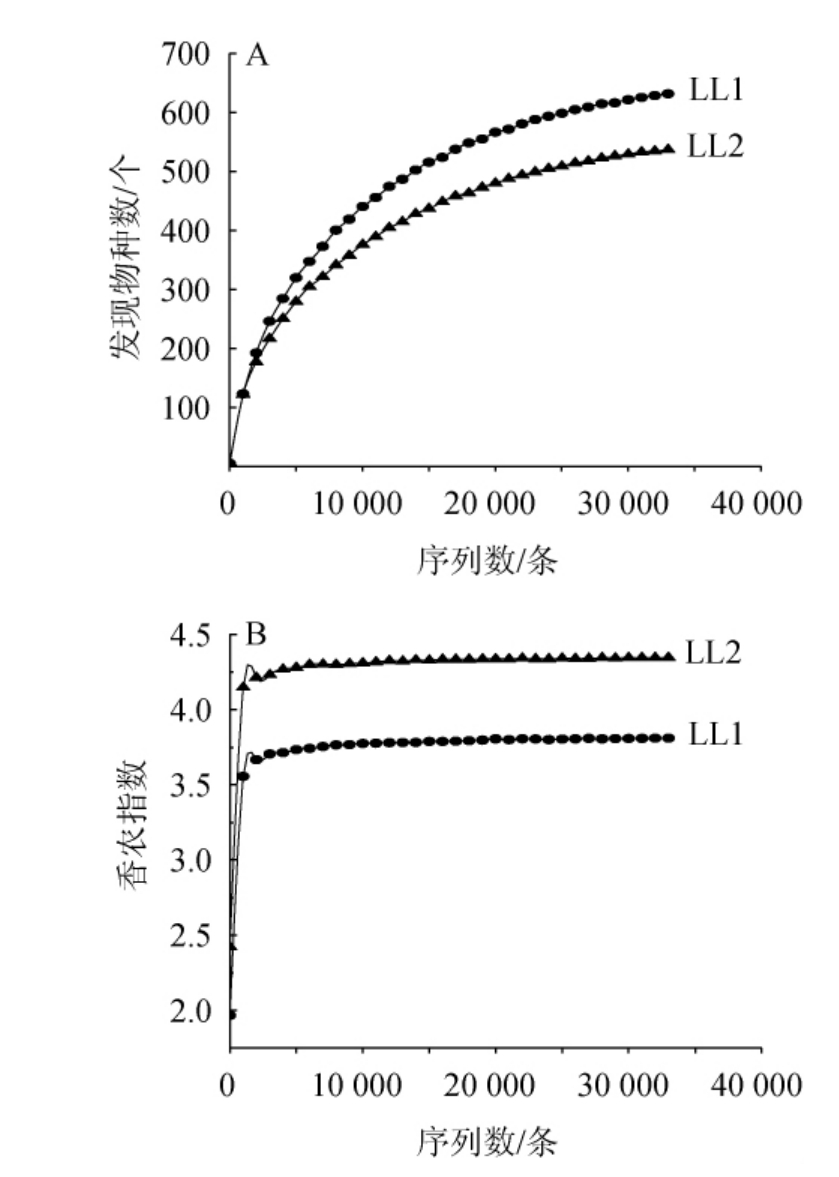
图1 兰陵浓香大曲样品的稀疏曲线(A)和香农指数曲线(B)
Fig.1 Rarefaction curves (A) and Shannon index curves (B) of Lanling Nongxiang Daqu sample
由图1可知,随着测序深度的增加,2份兰陵浓香大曲样品中细菌类群的发现物种数一直处于上升的趋势,而其香农指数在测序深度尚未达到5 000条时就已进入平稳状态。由此可见,随着测序深度的增加,尽管有新的细菌物种可能被发现,但2份浓香大曲样品中细菌类群的多样性均已被捕捉,因此,本研究的测序深度符合后续分析的要求。通过α多样性分析可知,当测序深度达到33 010条时,兰陵浓香大曲样品LL1和LL2的发现物种数分别为631和536,香农指数分别为3.81和4.35。有研究指出,发现物种数指数的大小代表了样品中所含物种丰富度的高低[21],香农指数的大小代表了样品中群落物种多样性的高低。由此可见,浓香大曲样品LL1的物种丰富度最高,浓香大曲样品LL2的菌群多样性最高。
2.3 兰陵浓香大曲样品细菌群落结构分析
经序列比对分析发现,从2份兰陵浓香大曲样品中共鉴定到10个门和162个属,基于门和属水平2份浓香大曲样品的细菌菌群结构见图2。

图2 基于门(A)和属(B)水平兰陵浓香大曲样品细菌菌群结构分析结果
Fig.2 Bacterial flora structure analysis results of Lanling Nongxiang Daqu samples at phylum (A) and genus (B) levels
Others:平均相对含量<1%和unclassified的细菌门和属的总和。
由图2可知,2份兰陵浓香大曲样品的优势细菌门(平均相对含量>1.0%)均为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),其平均相对含量分别为86.69%和11.99%;优势细菌属均为芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)和高温放线菌属(Thermoactinomyces),其平均相对含量分别为79.86%、9.71%和3.97%。
早期研究报道,Bacillus是大曲中普遍存在的细菌菌群,且在浓香大曲发酵后期,该菌群在整个微生物类群中占优势[22],具有较高的水解淀粉和水解蛋白质的能力,可以将小麦等原料中的蛋白质类物质分解成小分子的氨基酸为其他微生物所用[23]。Thermoactinomyces亦广泛存在于大曲中,该菌属属于耐高温类群,能够在50 ℃以上的高温环境下生长,且具有产多种酯酶、碱性磷酸酶和脂肪酸酶的能力[24]。同时,Bacillus和Thermoactinomyces在发酵过程中会产生愈创木酚类物质和吡嗪类物质等,对白酒风味的产生可能发挥着重要的作用[25]。
进一步在OTU水平上对兰陵浓香大曲样品的细菌群落结构进行分析,并统计2份浓香大曲样品中平均相对含量>1.0%的核心OTU构成[26],其中,若某个OTU在2份兰陵浓香大曲样品中均存在,则将其定义为核心OTU。结果见图3。
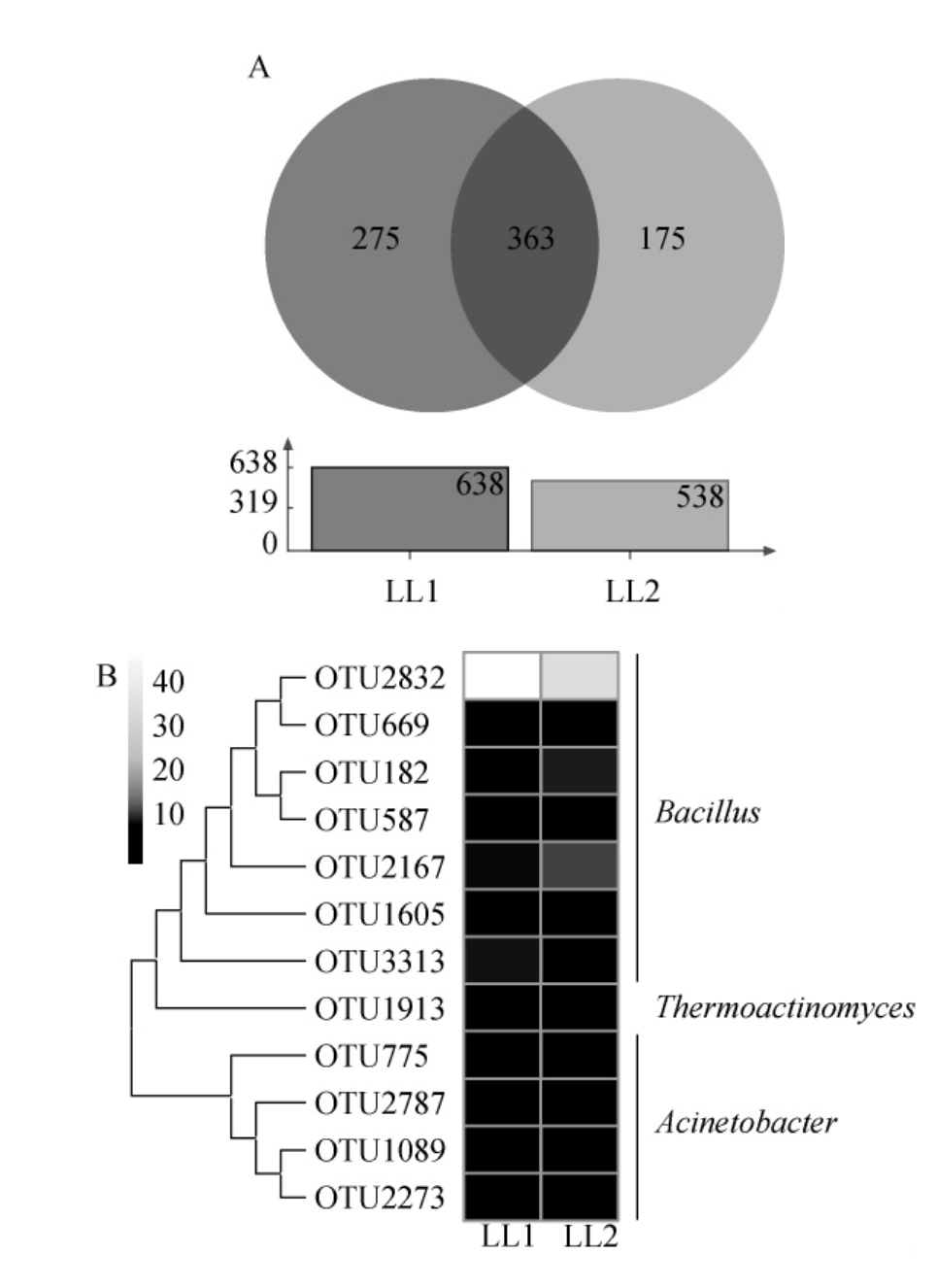
图3 兰陵浓香大曲样品中细菌OTU的分布(A)及平均相对含量>1.0%的核心OTU分析结果(B)
Fig.3 Distribution of bacterial OTU (A) in Lanling Nongxiang Daqu and analysis results of the core OTU with mean relative contents>1.0% (B)
由图3A可知,从2份兰陵浓香大曲样品中共划分得到813个细菌OTU,其中275个OTU为浓香大曲样品LL1特有,175个OTU为浓香大曲样品LL2特有,363个OTU为浓香大曲样品LL1和LL2共有。由图3B可知,平均相对含量>1.0%的核心OTU共有12个,其中有7个隶属于Bacillus,分别为OTU2832、OTU669、OTU182、OTU587、OTU2167、OTU1605和OTU3313,其平均相对含量分别为41.67%、1.01%、6.33%、3.91%、10.50%、1.79%和4.96%;有1个隶属于Thermoactinomyces,为OTU1913,其平均相对含量为2.41%;有4个隶属于Acinetobacter,分别为OTU775、OTU2787、OTU1089和OTU2273,其平均相对含量分别为1.34%、2.06%、2.53%和1.38%,这12个核心OTU累积平均相对含量高达79.90%。由此可见,2份兰陵浓香大曲样品中存在大量的核心细菌类群。
2.4 兰陵浓香大曲样品中细菌菌株的分离鉴定
进一步对2份兰陵浓香大曲样品中的细菌菌株进行分离鉴定,共分离得到19株细菌菌株,部分菌株的菌落形态和显微镜形态见图4。
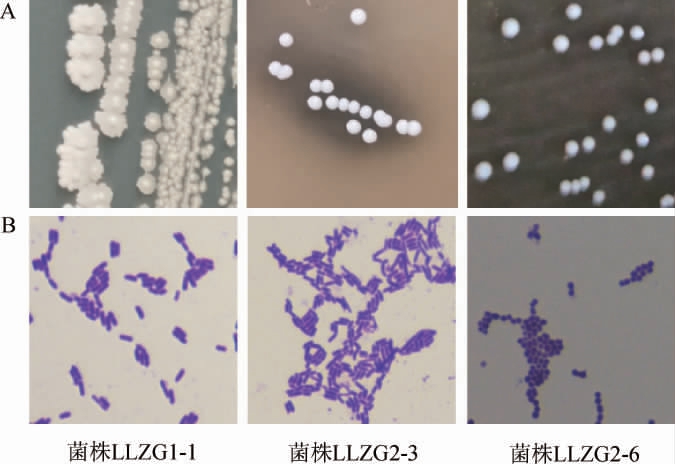
图4 部分分离细菌菌株的菌落(A)和细胞(B)形态
Fig.4 Colony (A) and cell (A) morphology of some isolated strains
由图4可知,一部分细菌菌株的菌落形态为表面粗糙,边缘锯齿状,中间有白色凸起,小菌落,颜色为不透明的白色,在电子显微镜下呈现为短杆状;另一部分细菌菌株的菌落形态为圆形,表面光滑隆起,边缘规整,小菌落,颜色为不透明的白色,在显微镜下呈现为杆状或短杆状;还有一部分菌株的菌落形态为圆形,表面光滑隆起,边缘规整,小菌落,颜色为不透明的白色,在显微镜下呈现为球状。继而基于16S rRNA基因序列构建分离菌株的系统发育树,结果见图5。

图5 基于16S rDNA基因序列分离细菌菌株的系统发育树
Fig.5 Phylogenetic tree of isolated bacterial strains based on 16S rDNA gene sequence
由图5可知,分离到的19株细菌菌株可鉴定为隶属于Bacillus、Pediococcus和Lactiplantibacillus这3个属下的地衣芽孢杆菌(Bacillus licheniformis)、副地衣芽孢杆菌(Bacillus paralicheniformis)、西姆芽孢杆菌(Bacillus siamensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、澳洲芽孢杆菌(Bacillus australimaris)、乳酸片球菌(Pediococcus acidilactici)和戊糖乳杆菌(Lactiplantibacillus pentosus)7个种。进一步对2份兰陵浓香大曲样品中细菌分离株的分离鉴定情况进行统计,结果见表1。
表1 兰陵浓香大曲样品细菌分离鉴定统计结果
Table 1 Statistical results of isolation and identification of bacteria in Lanling Nongxiang Daqu samples
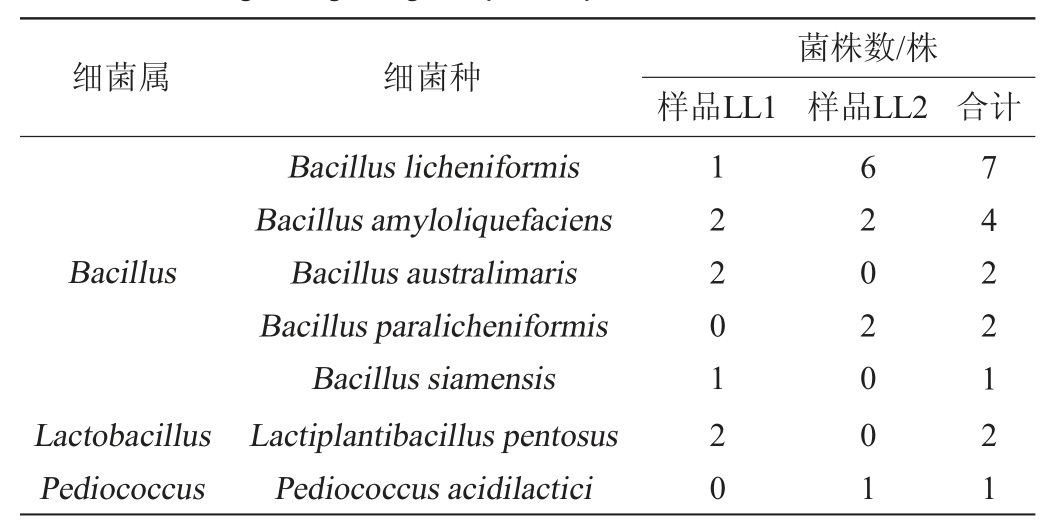
细菌属 细菌种 样品LL1菌株数/株样品LL2 合计Bacillus Lactobacillus Pediococcus Bacillus licheniformis Bacillus amyloliquefaciens Bacillus australimaris Bacillus paralicheniformis Bacillus siamensis Lactiplantibacillus pentosus Pediococcus acidilactici 1220120 6202001 7422121
由表1可知,从浓香大曲样品LL1和LL2中分别分离出8株和11株细菌,分别被鉴定到5个和4个种,B.licheniformis和B.amyloliquefaciens在两份样品中均存在,共11株,占总分离株数的57.89%。其中,B.australimaris、B.siamensis和L.pentosus这3个种仅在浓香大曲样品LL1中存在,累计5株,占总分离株数的26.32%;B.paralicheniformis和P.acidilactici这2个种仅在浓香大曲样品LL2中存在,累计3株,占总分离株数的15.79%。由此可见,B.licheniformis和B.amyloliquefaciens为兰陵浓香大曲中可培养的优势细菌。
2份兰陵浓香大曲样品中共分离鉴定到3株乳酸菌,有2株隶属于Lactobacillus,占总分离株数的10.53%,且Illumina MiSeq高通量测序结果显示,Lactobacillus的平均相对含量为0.17%。Lactobacillus是大曲在发酵过程中的重要功能菌群,该菌群在大曲发酵过程中会产生乳酸,并与其他微生物相互作用产生乙醇,最后被酯化成乳酸乙酯,对酒体的香味起到一定的积极作用[27]。
3 结论
本研究通过对山东兰陵浓香大曲样品理化品质的分析得出,2份浓香大曲淀粉含量、蛋白质含量、糖化力、酯化力、酒化力和液化力均符合QB/T 4259—2011《浓香大曲》要求;通过Illumina MiSeq高通量测序技术对浓香大曲样品细菌群落结构进行分析发现,兰陵浓香大曲优势细菌门(平均相对含量>1.0%)为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),优势细菌属(平均相对含量>1.0%)为芽孢杆菌属(Bacillus)(79.86%)、不动杆菌属(Acinetobacter)(9.71%)和高温放线菌属(Thermoactinomyces)(3.97%);采用传统纯培养技术从浓香大曲样品中共分离鉴定出16株芽孢杆菌和3株乳酸菌,包括7株地衣芽孢杆菌(Bacillus licheniformis)、4株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、2株澳洲芽孢杆菌(Bacillus australimaris)、2株副地衣芽孢杆菌(Bacillus paralicheniformis)、1株西姆芽孢杆菌(Bacillus siamensis)、2 株戊糖乳杆菌(Lactiplantibacillus pentosus)和1株乳酸片球菌(Pediococcus acidilactici),其中B.licheniformis和B.amyloliquefaciens为浓香大曲中可培养的优势细菌。
[1]胡景辉,陈禹锜,薛新新,等.浓香型白酒发展概述[J].中国酿造,2022,41(6):24-30.
[2] YAN S, WANG S, WEI G, et al.Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J].J I Brewing,2015,121(1):145-154.
[3]MA S,SHANG Z,CHEN J,et al.Differences in structure,volatile metabolites, and functions of microbial communities in Nongxiangxing daqu from different production areas[J].LWT-Food Sci Technol,2022,166(8):113784.
[4]万自然.大曲培养过程中微生物及酶的变化[J].酿酒科技,2004(4):25-26.
[5]程伟,陈雪峰,陈兴杰,等.基于高通量测序技术解析皖北地区浓香型大曲的真菌群落结构[J].酿酒科技,2022(8):17-23.
[6]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[7]杨旭,马歌丽,王光路,等.高通量测序解析白酒浓香大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[8]VILLAMOR D E V,HO T,Al RWAHNIH M,et al.High throughput sequencing for plant virus detection and discovery[J].Phytopathology,2019,109(5):716-725.
[9] DING R, LIU Y, YANG S, et al.High-throughput sequencing provides new insights into the roles and implications of core microbiota present in pasteurized milk[J].Food Res Int,2020,137(11):109586.
[10]GUO Z,WANG Y,XIANG F,et al.Evaluating the flavor and divergent bacterial communities in corn-based zha-chili[J].Food Biosci,2022,46(4):101563.
[11] WANG Y, XIANG F, ZHANG Z, et al.Characterization of bacterial community and flavor differences of different types of Douchi[J].Food Sci Nutr,2021,9(7):3460-3469.
[12]杨甜甜,杨少勇,侯强川,等.基于高通量测序技术分析比较南宁和孝感地区米酒曲中真菌多样性[J].中国酿造,2021,40(9):110-114.
[13] ZHONG X Z, LI X X, ZENG Y, et al.Dynamic change of bacterial community during dairy manure composting process revealed by highthroughput sequencing and advanced bioinformatics tools[J].Bioresource Technol,2020,306(6):123091.
[14]张越,付莉.酸水解-斐林试剂滴定法测定大米淀粉含量的研究[J].食品工业科技,2017,38(20):256-259.
[15] RIZVI N B, ALEEM S, KHAN M R, et al.Quantitative estimation of protein in sprouts of Vigna radiate(Mung Beans),Lens culinaris(Lentils),and Cicer arietinum (Chickpeas) by Kjeldahl and lowry methods[J].Molecules,2022,27(3):814.
[16]GUO Z,WANG Y,XIANG F,et al.Bacterial diversity in pickled cowpea(Vigna unguiculata[Linn.]Walp)as determined by illumina MiSeq sequencing and culture-dependent methods[J].Curr Microbiol, 2021,78(4):1286-1297.
[17]CAI W,WANG Y,NI H,et al.Diversity of microbiota,microbial functions, and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[18]WANG Y,CAI W,WANG W,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[19]MAVRODIEV E V,DERVINIS C,WHITTEN W M,et al.A new,simple,highly scalable,and efficient protocol for genomic DNA extraction from diverse plant taxa[J].Appl Plant Sci,2021,9(3):e11413.
[20]葛东颖,王玉荣,向凡舒,等.荆州地区鲊广椒乳酸菌多样性解析及其分离株发酵特性的评价[J].中国食品添加剂,2019,30(4):72-79.
[21]何梦雪,张彦,崔梦君,等.南宁地区酸柠檬细菌多样性及潜在功能分析[J].中国酿造,2021,40(11):71-75.
[22]张新红,张源,崔磊.浓香型白酒酿造过程中微生态群落的研究进展[J].科技创新导报,2020,17(23):66-70.
[23]FARIAS T C,KAWAGUTI H Y,KOBLITZ M G B.Microbial amylolytic enzymes in foods: technological importance of the Bacillus genus[J].Biocatal Agr Biotechnol,2021,35(8):102054.
[24]刘青阳,黄晓宁,陆玮,等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造,2022,41(7):26-31.
[25] SAKANDAR H A, HUSSAIN R, KHAN Q F, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu (starters): a review[J].Food Res Int,2020,138(12B):109830.
[26]席啦,孔祥聪,杨少勇,等.基于Illunima MiSeq测序技术的黄酒麦曲真菌多样性分析[J].食品研究与开发,2022,43(12):185-190.
[27]GUAN T,YANG H,OU M,et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT-Food Sci Technol,2021,139(3):110544.