2020年中式手工雪茄销量超过1 200万支[1],但国产雪茄烟叶香气品质与古巴、厄瓜多尔等国进口原料之间仍有差距[2]。雪茄烟叶发酵是改善烟叶品质的重要途径[3-4],烟叶表面微生物[5]、施加的功能微生物[6-7]或营养剂[8-9]在一定条件下促使烟叶有机质转化、分解[10],是烟叶糖、氮、碱等化学成分比例协调、烟叶香气和吸味品质明显改善的过程[11]。晾制后的烟叶的含水率较低,无法满足发酵需要,因此需对烟叶进行加水回潮,回潮水施用后使烟叶的含水量达到设定含水率[12]。李志豪等[13]利用烟叶表面的蜡样芽孢杆菌(Bacillus cereus)进行烟叶发酵使纤维素与木质素显著降低,同时提升叶绿醇香气物质的含量。汪长国等[14]使用地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和蜡样芽孢杆菌制备的粉剂进行烟叶发酵,显著降低了蛋白质含量、缩短了发酵周期、提升了评吸评价等级。
磷素在生态系统中大量存在[15],晾晒后雪茄叶片总磷含量虽然高达2.1~2.8 mg/g[16],但叶片中钙、镁、铁等离子会使PO43-溶解性降低[17];此外,植株细胞中有机磷化合物中的PO43-在降解释放之前的可获得性不高[18]。但雪茄发酵过程中微生物生长代谢需要PO43-的参与[19],因而该过程可能存在水溶性PO43-限制的问题。具有解磷功能的细菌可以持续分解烟叶中不溶性含磷有机物为水溶性磷酸盐,进而可能改善、增强烟叶发酵过程效能、提高发酵后烟叶品质,而有关具有解磷功能细菌对烟叶发酵的影响鲜见报道。
为研究PO43-的供应效率对烟叶发酵产香的影响,本研究运用菌落形态学观察与分子生物学鉴定技术从雪茄CX-14烟叶表面菌株中筛选具有显著解磷作用的菌株,并研究其对雪茄烟叶发酵的影响。以期为中式雪茄烟叶发酵提供优良菌株,为雪茄烟叶微生物发酵提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
供试烟叶:晾制后的雪茄CX-14茄芯,由湖北省恩施州雪茄烟叶种植基地提供。
DP302-02细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;蛋白胨、酵母浸粉(均为生化试剂):安琪酵母股份有限公司;氯化钠、七水硫酸镁、硫酸亚铁、一水硫酸锰、植酸钙、碳酸钙、磷酸三钙、谷氨酸钠(均为分析纯):国药集团化学试剂有限公司。
1.1.2 培养基
LB液体培养基:蛋白胨10 g/L,氯化钠10 g/L,酵母粉5 g/L,pH7.2~7.4。LB固体培养基添加20 g/L琼脂。
有机解磷培养基[20]:葡萄糖10.0 g/L,硫酸铵0.5 g/L、酵母浸粉0.5 g/L、氯化钠0.3 g/L、氯化钾0.3 g/L、七水硫酸镁0.3 g/L、硫酸亚铁0.03 g/L、一水硫酸锰0.03 g/L、植酸钙0.4 g/L、碳酸钙5.0 g/L,琼脂15 g/L,pH7.0~7.5。
无机解磷培养基[21]:葡萄糖10.0 g/L,硫酸铵0.5 g/L、酵母浸粉0.5 g/L、氯化钠0.3 g/L、氯化钾0.3 g/L、七水硫酸镁0.3 g/L、硫酸亚铁0.03 g/L、一水硫酸锰0.03 g/L、磷酸三钙0.4 g/L、碳酸钙5.0 g/L,琼脂15 g/L,pH7.0~7.5。
以上培养基均于121 ℃灭菌20 min。
1.2 仪器与设备
YXQ-75SII立式压力蒸汽灭菌器、SPX-150D恒温生化培养箱:上海博讯实业有限公司医疗设备厂;V-1300可见分光光度计:上海美析仪器有限公司;HNV-211B恒温培养振荡器:天津市欧诺仪器仪表有限公司;7890C气相色谱-质谱联用仪:美国安捷伦科技有限公司;VeritiPro聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技公司。
1.3 方法
1.3.1 菌株的分离纯化
称取5 g烟叶于250 mL锥形瓶中,加入100 mL无菌水,于37 ℃、200 r/min条件下振荡2 h后,将菌悬液稀释成10-2~10-4的浓度梯度,均匀涂布在LB平板中,置于37 ℃培养箱中培养48 h,挑取菌落形态不同的菌株进一步分离纯化,并编号保存。
1.3.2 解磷菌株的筛选
用接种针将上述过程纯化出的菌株点种于有机解磷培养基和无机解磷培养基上,于37 ℃条件下培养72 h后,菌落周围有透明圈产生代表菌株具有解磷作用,筛选透明圈直径(D)与菌落直径(d)比值最大的一株菌保藏备用。
1.3.3 菌株的鉴定
(1)形态学观察
观察有机解磷培养基中菌株菌落特征,挑取菌落进行革兰氏染色,观察染色结果与菌体形态特征[22]。
(2)分子生物学鉴定
用接种环将菌株接种至LB液体培养基中,于37 ℃、200 r/min条件下活化24 h后,取1 mL活化液,10 000 r/min离心5min后,按照细菌基因组试剂盒操作说明书进行16SrDNA提取,采用通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')进行PCR扩增。扩增产物经琼脂糖凝胶电泳检测证明无杂条带,送至武汉昆泰锐生物技术有限公司双向测序。将测序序列提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中的基本局部比对搜索工具(basic local alignment search tool,BLAST)程序拼接完成后,与NCBI 16S rDNA数据库中的数据进行比对,得到与待测物种序列相似性最大的同源序列,采用MEGA 11构建系统发育树。
1.3.4 雪茄烟叶的自然发酵
按照烟叶干质量计算回潮所需水的质量并均匀喷洒至初始含水率为12%左右的烟叶表面,使烟叶含水率为35%。用塑料膜包裹烟叶,静置5 h,待烟叶表面无明显水渍后,剪去烟把,取100 g烟叶对折后用8层纱布包裹,装入敞口自封袋内,放入37 ℃、湿度80%恒温恒湿箱内发酵8 d,取样间隔为2 d。将发酵后的样品去除主脉后剪碎,取5 g烟叶加入100 mL无菌水,放5粒无菌玻璃珠,放入摇床中200 r/min振荡培养30 min,所得菌悬液用于菌体生物量、无机磷(PO43-)、总游离氨基酸及还原糖含量的测定。
1.3.5 雪茄烟叶的接种发酵
用接种环挑取3环筛选的菌株转接至LB培养基,于37℃、200 r/min摇床中活化12 h后得到种子液,10 000 r/min离心5 min,弃上清,收集菌体。以1.3.4中雪茄烟叶的自然发酵为对照组,设计菌株组和菌株+营养剂组2个组别。菌株组:回潮水中按照接种量1.0×108 CFU/g接种;菌株+营养剂组:回潮所需水中按照接种量1.0×108CFU/g接种、并加入基础营养剂(葡萄糖30 mg/g、磷酸氢二铵6 mg/g、谷氨酸钠6 mg/g,下同)。后续处理方法同1.3.4,并测定发酵过程菌体生物量、无机磷(PO43-)、总游离氨基酸及还原糖含量。
1.3.6 菌体生物量、无机磷(PO43-)、总游离氨基酸及还原糖含量的测定
菌体生物量测定:按照参考文献[23]。无机磷测定:磷钼蓝比色法[24]。总游离氨基酸测定:按照GB/T 8314—2013《茶游离氨基酸总量的测定》[25]。还原糖测定:按照GB/T 5513—2019《粮油检验粮食中还原糖和非还原糖测定》[26]。
1.3.7 发酵烟叶中致香成分的测定
前处理条件:烟叶样品去除主脉放入75 ℃烘箱烘干,经粉碎后过40目筛,采用同时蒸馏萃取方法提取致香物质[27],采用GC-MS对致香成分进行测定[1]。
气相色谱条件:HP-5-MS毛细管色谱柱(30 m×0.25 mm×0.25 μm);升温程序为40 ℃保持2 min,以2 ℃/min升至200 ℃,保持5 min,然后以10 ℃/min升至280 ℃;载气为高纯氦气(He);流速1 mL/min;进样量1 μL;分流比为10∶1。
质谱条件:电子电离(electron ionization,EI)源;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;质量扫描范围35~550 m/z。
1.3.8 筛选菌株添加量的优化
以菌株生物量、无机磷(PO43-)含量、主要香气成分(美拉德反应产物、类胡萝卜素降解产物、西柏烷类降解产物)含量及香气成分(除新植二烯外)总含量为评价指标,对筛选菌株的添加量进行优化,按照表1所述实验方案配制回潮所需水,种子液活化步骤同1.3.5,发酵方法同1.3.4,取样时间为4 d。
表1 筛选菌株添加量优化的试验设计
Table 1 Experimental design for optimal addition of screened strains

实验组 回潮所需水的成分1 2 3 4基础营养剂接种量5.0×108 CFU/g、基础营养剂接种量7.5×108 CFU/g、基础营养剂接种量1.0×109 CFU/g、基础营养剂
1.3.9 数据处理
每组实验设置3次重复,实验数据采用Excel 2016整理后用Origin 2019作图。
2 结果与分析
2.1 菌株的分离、筛选与鉴定
从雪茄样品中分离出62株菌,其中,7株菌的菌落周围有溶磷圈产生。其中,菌株Q627的解磷透明圈及细胞形态见图1。由图1可知,在有机磷解磷培养基中和无机磷解磷培养基中D/d的值分别为1.64和1.27,均为最大值,即菌株Q627的解磷作用最强。菌株Q627形成干燥、边缘不整齐乳白色菌落,其表面有褶皱。革兰氏染色阳性,显微镜下有芽孢。因此,对该菌株进行鉴定。基于16S rDNA基因序列构建系统发育树,结果见图2。
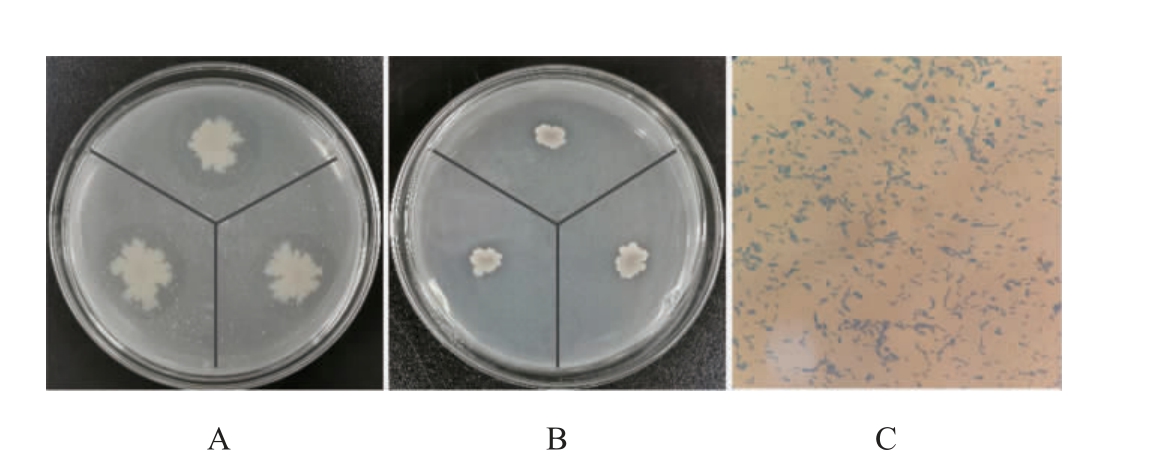
图1 菌株Q627于有机解磷培养基(A)、无机解磷培养基(B)的解磷透明圈和细胞形态(C)
Fig.1 Clear circle of phosphorus-degrading of strain Q627 in organic phosphorus-degrading medium (A) and inorganic phosphorusdegrading medium (B) and cell morphology (C)

图2 基于16S rDNA基因序列菌株Q627的系统发育树
Fig.2 Phylogenetic tree of strain Q627 based on 16S rDNA gene sequence
由图2可知,菌株Q627与高地芽孢杆菌(Bacillus altitudinis)同源性为100%。结合菌落形态与16S rDNA序列分析结果,菌株Q627被鉴定为高地芽孢杆菌(Bacillus altitudinis)。
2.2 自然发酵过程中菌体生物量、还原糖、无机磷和总游离氨基酸的变化
烟叶发酵过程中,烟叶表面微生物将烟叶有机质转化、分解,如有机化合态磷转化为无机PO43-[9]、纤维素和淀粉转化为还原糖[2]等。发酵过程中无机磷(PO43-)、还原糖和总游离氨基酸的变化见图3。
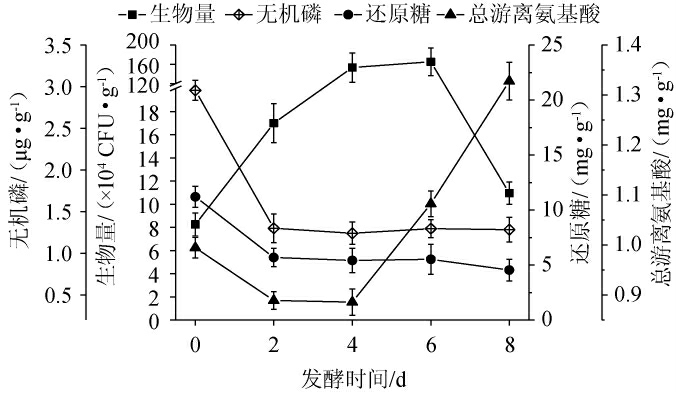
图3 自然发酵过程中菌体生物量、无机磷、还原糖和总游离氨基酸含量的变化
Fig.3 Changes of bacterial biomass,contents of inorganic phosphate,reducing sugars, and total free amino acids during natural fermentation process
由图3可知,发酵时间为0~2 d时,菌体生物量由8.25×104 CFU/g增长到1.70×105 CFU/g。在此期间,无机磷(PO43-)、还原糖和游离氨基酸迅速消耗,分别降至1.30μg/g、5.68 mg/g和0.89 mg/g;发酵时间为2~6 d时,菌体生物量逐渐增长,但无机磷(PO43-)、还原糖含量基本维持不变,其产生与利用处于平衡之中,发酵时间为6 d时,菌体生物量增长至1.65×106 CFU/g;发酵时间为6~8 d,菌体生物量迅速降低,无机磷(PO43-)及还原糖含量变化不明显,发酵结束时,其含量分别为1.10×105 CFU/g、1.28 μg/g和4.54 mg/g。总游离氨基酸在2~4 d内变化趋于平稳,第4天迅速回升,发酵结束时达到1.33 mg/g,也表明发酵体系中菌系蛋白酶作用较为强烈,这与冯志珍等[28]的研究结果一致。由于晾晒后雪茄叶片总磷(有机化磷化合物和无机磷化合物)含量在2.1~2.8 mg/g左右[16],但实测水溶性PO43-浓度(1.24~2.96 μg/g)仅为该数据的0.1%,说明烟叶中水溶性PO43-的可获得性很低,因而水溶性PO43-的缺乏可能是限制微生物生长、进而影响雪茄烟叶发酵效率的因素。因此,筛选具有解磷作用的菌株并施加于雪茄烟叶发酵会对发酵效果带来积极影响。
2.3 接种菌株Q627发酵过程中菌体生物量、无机磷、还原糖和总游离氨基酸的变化
2.3.1 菌株组发酵过程中菌体生物量、无机磷、还原糖和总游离氨基酸的变化
能被微生物直接吸收利用的无机磷多为PO43-,解磷微生物可通过产生有机酸或磷酸酶发挥其解磷功能[23]。筛选出的菌株Q627对植酸钙和磷酸钙均具有良好的降解能力,因此将菌株Q627活化后接种至雪茄烟叶进行发酵,发酵过程中生物量、无机磷(PO43-)、还原糖和总游离氨基酸的含量变化见图4。
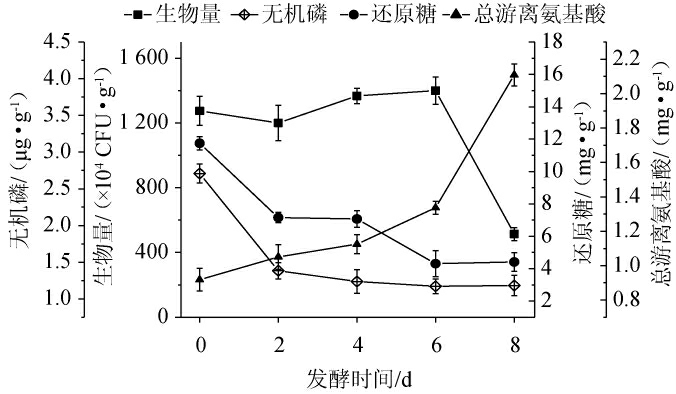
图4 菌株组生物量、无机磷、还原糖和总游离氨基酸含量的变化
Fig.4 Changes of biomass, contents of inorganic phosphorus,reducing sugar and total free amino acids in strain group
由图4可知,接种菌株Q627后,菌体生物量为1.28×107 CFU/g,发酵时间为0~2 d时,无机磷(PO43-)和还原糖含量分别迅速降低至1.38 μg/g和7.16 mg/g,菌体生物量趋于稳定。发酵时间为2~6 d时,菌体生物量逐渐增加,当发酵时间为6 d时,生物量增加至1.40×107 CFU/g。无机磷(PO43-)和还原糖含量呈逐渐下降的趋势;发酵时间为6~8 d时,生物量快速下降,无机磷(PO43-)和还原糖含量变化较稳定。发酵结束时,其含量分别为5.14×106 CFU/g、1.18 μg/g和4.41 mg/g。此外,发酵期间总游离氨基酸呈上升趋势,发酵结束时,其含量为2.11 mg/g,说明发酵体系中菌系蛋白水解体系作用较为强烈,这与李士林等[29]的报道一致。另外,由于发酵前期(0~2 d)烟叶大分子物质(蛋白质、淀粉、木质纤维素等)的降解启动以微生物的生长为前提,因而适量的营养剂可以快速启动雪茄烟叶发酵体系菌群的生长。
2.3.2 接种菌株Q627+营养剂组发酵过程中菌体生物量、无机磷(PO43-)、还原糖和游离总氨基酸的变化
添加菌株Q627和基础营养剂对发酵过程中菌体生物量、无机磷(PO43-)、还原糖和总游离氨基酸的影响见图5。
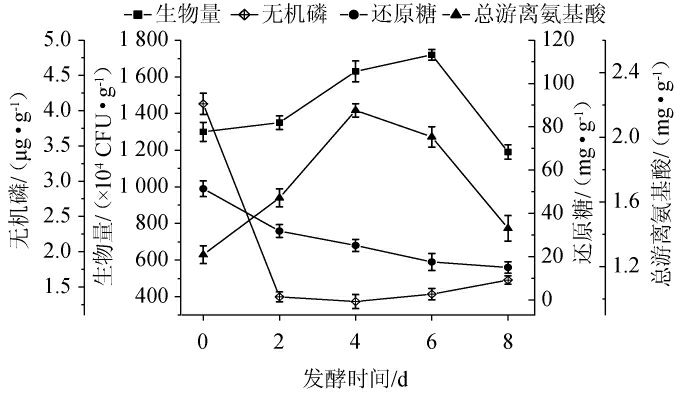
图5 菌株+营养剂组生物量、无机磷、还原糖和总游离氨基酸含量的变化
Fig.5 Changes of biomass, contents of inorganic phosphorus,reducing sugars and total free amino acids in strain+nutrient group
由图5可知,发酵开始时,菌株生物量为1.30×107CFU/g,0~2 d细胞处于适应期,菌株生物量增长到1.35×107 CFU/g,2~6 d内,生物量持续增长到最高点1.76×107 CFU/g。6~8 d细胞自溶,发酵结束时生物量下降至1.20×107 CFU/g。0~4 d时,总游离氨基酸含量从1.27 mg/g增长到2.17 mg/g,4~8 d内,总游离氨基酸含量下降,8 d时,总游离氨基酸含量为1.44 mg/g。0~2 d内,无机磷(PO43-)含量迅速从4.10 μg/g降至1.36 μg/g,2~4 d内,无机磷(PO43-)含量略下降。4~8 d时,无机磷(PO43-)含量逐渐上升至1.60 μg/g,比自然发酵组(1.28 μg/g)和接种发酵组(1.18 μg/g)分别提高了29%和37%。说明发酵体系中菌群解磷作用显著增强,其解磷效率大于其利用效率,除了满足自身快速生长对PO43-的需要以外,PO43-还出现了积累。发酵期间还原糖含量持续降低,由51.39 mg/g降至15.01 mg/g。
2.5 自然发酵、菌株组、菌株+营养剂组发酵过程中致香成分含量的变化
雪茄烟叶的品质与香气物质的含量密切相关[2],由于烟叶中叶绿素降解产物新植二烯主要功能是香气物质的载体[30],因而比较了3组实验中去除新植二烯的香气成分总含量在发酵过程中的变化,结果见图6a。由图6a可知,0~6 d内,3个组别的香气成分总含量均持续上升;发酵时间为6 d时,均达到最大值,对照组、菌株组和菌株+营养剂组分别为114.07 μg/g、138.70 μg/g和156.18 μg/g;6~8 d内呈下降趋势。相比对照组,菌株组的香气成分总量提升了22%,菌株+营养剂组的香气成分总量提升了37%。说明高地芽孢杆菌可以显著促进烟叶中致香成分的转化,且基础营养剂可以辅助高地芽孢杆菌和其他的烟叶表面微生物,使它们能够更快启动发酵,更大限度地发挥其作用,从而提高了烟叶香气成分含量、改善了烟叶品质。另外也说明实验条件下雪茄烟叶发酵过程最适发酵周期为6 d。

图6 发酵过程中挥发性香气成分含量变化
Fig.6 Changes of volatile aroma components contents during fermentation process
美拉德反应产物中具有呈焦糖香的糠醛、糠醇等物质[10],其含量在发酵过程中的变化见图6b。由图6b可知,0~6 d内,对照组、菌株组和菌株+营养剂组的美拉德反应产物总含量均持续上升;发酵时间为6 d时,均达到最大值,分别为8.8 μg/g、17.6 μg/g和20.31 μg/g;6~8 d内,呈下降趋势。相比自然发酵,菌株组和菌株+营养剂组的美拉德反应产物含量分别增加了100%和130%。
类胡萝卜素降解产物中具有呈果香的大马酮、具有花香的法尼基丙酮等物质[9],其含量在发酵过程中的变化见图6c。在0~2 d内,对照组类胡萝卜素降解产物含量从33.37 μg/g增长到35.78 μg/g,2~8 d内变化幅度不大。0~6 d内,而菌株组和菌株+营养剂组类胡萝卜素降解产物含量明显提升,分别达到41.67 μg/g和47.57 μg/g,比对照组的含量分别提高了17%和33%;6~8 d内,其含量明显下降。
西柏烷类化合物降解产物中具有呈新鲜胡萝卜香的茄酮等物质[8],0~2 d,对照组和菌株组的柏烷类化合物降解产物含量有所下降,分别降低13%和2%。2~6 d内,2个组别的西柏烷类化合物降解产物含量均持续增长,6 d时,其含量分别达到34.78 μg/g和39.51 μg/g;6~8 d,含量下降。0~6 d内,而菌株+营养组的西柏烷类化合物降解产物含量一直持续上升,6 d时,其含量达到最高值,为47.83 μg/g,菌株组、菌株营养组的含量分别比对照组提高14%和38%,6~8 d,含量下降。因此,基础营养剂和菌株Q627对发酵烟叶的产香效果具有增强作用。
2.6 雪茄烟叶发酵中菌株Q627接种量的优化
调整菌剂接种量是改善烟叶发酵后品质的有效策略,龙章德等[31]研究发现,优化酵母施用量可以使烟叶香气含量提高11%以上。由于增加接种量后雪茄烟叶香气含量达到峰值的时间会提前,因而确定取样时间为发酵第4天。
菌株Q627接种量对雪茄烟叶发酵后菌株生物量的影响见图7a。由图7a可知,发酵前的4个实验组的菌株生物量依次为9.1×104 CFU/g、5.03×107 CFU/g、9.03×107 CFU/g和1.09×108 CFU/g。发酵4 d,第3组的生物量达到最高值,为1.43×108 CFU/g,比第1组提高1.76倍;第2组和第4组分别增加88%和85%。说明在添加基础营养剂条件下,促进雪茄烟叶表面微生物生长的菌株Q627最适接种量为7.5×108CFU/g。
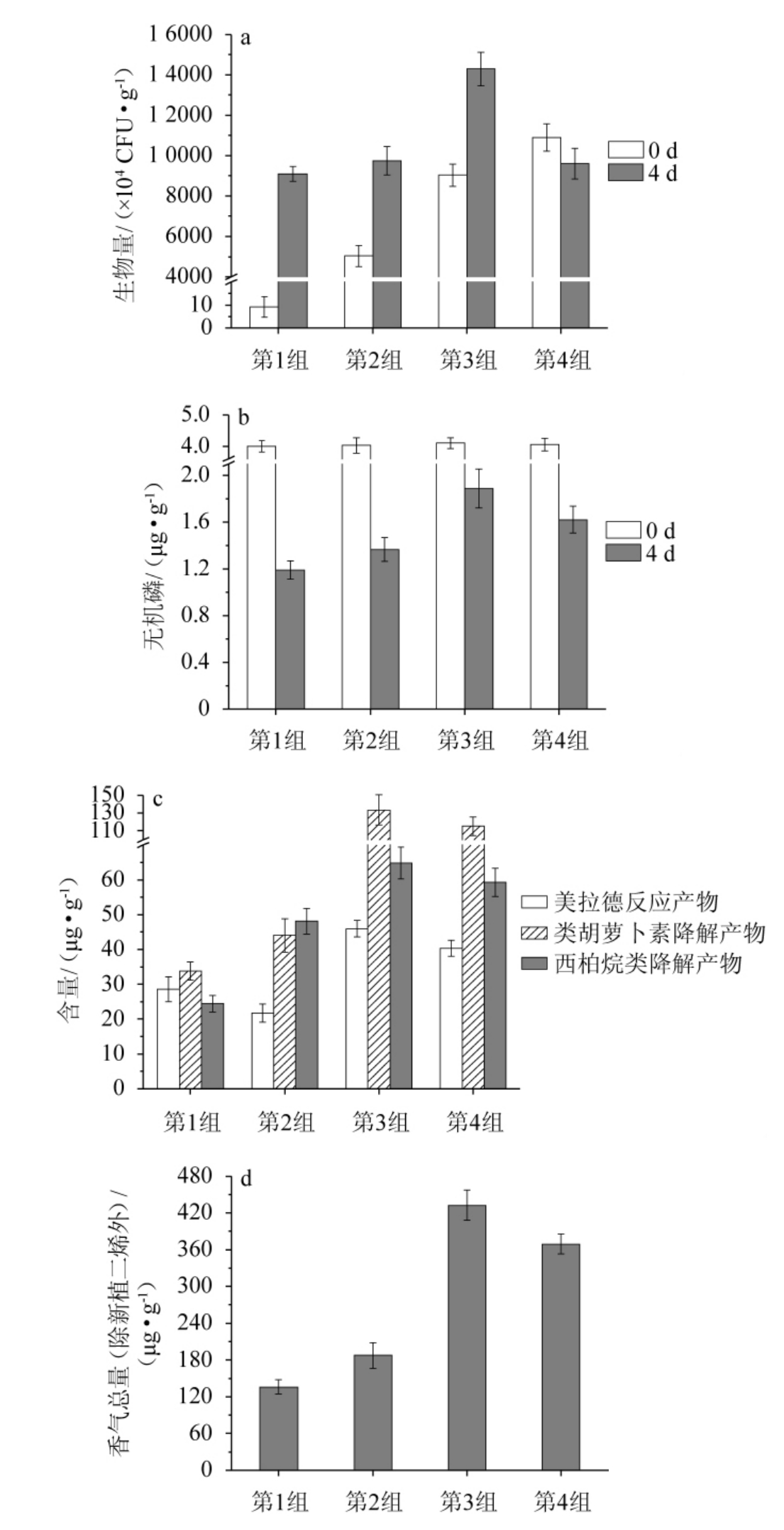
图7 菌株Q627接种量对雪茄烟叶发酵效果的影响
Fig.7 Effect of strain Q627 inoculum on fermentation effect of cigar tobacco leaves
菌株Q627接种量对雪茄烟叶发酵后无机磷(PO43-)含量的影响见图7b。由图7b可知,发酵前4组的无机磷(PO43-)含量在4 μg/g上下波动。发酵4 d时,第2组、第3组和第4组的无机磷(PO43-)含量分别为1.37 μg/g、1.89 μg/g和1.62 μg/g,分别比第1组(1.19 μg/g)增加15%、59%和16%。说明雪茄烟叶发酵过程施用菌株Q627可有效提高烟叶中无机磷(PO43-)的含量,且接种量为7.5×108CFU/g时提升效果最明显。
菌株Q627接种量对雪茄烟叶发酵后主要香气成分(美拉德反应产物、类胡萝卜素降解产物、西柏烷类降解产物)含量的影响见图7c。由图7c可知,发酵4 d时,第1组的美拉德反应产物、类胡萝卜素降解产物和西柏烷类降解产物的含量分别为28.59 μg/g、33.79 μg/g和24.43 μg/g。与第1组相比,第3组的美拉德反应产物、类胡萝卜素降解产物和西柏烷类降解产物的含量均最高,分别为45.94 μg/g、133.53 μg/g和64.87 μg/g,较第1组分别增加61%、295%、165%。
菌株Q627接种量对雪茄烟叶发酵后香气成分总含量的影响见图7d。由图7d可知,第2组、第3组和第4组的香气成分总含量分别为187.40 μg/g、432.43 μg/g和369.28 μg/g,分别比第1组(136.07 μg/g)增加38%、218%和171%。说明菌株Q627的施加可以有效提升雪茄烟叶发酵产香效率,显著提升了烟叶中香气成分的含量,具有提高烟叶品质作用,最适接种量为7.5×108 CFU/g。
3 结论
该研究从雪茄烟叶中分离出具有显著解磷功能的高地芽孢杆菌Q627用于发酵,可提高烟叶表面菌体生物量和无机磷含量,进而提高主要致香成分的含量。相对自然发酵而言,美拉德反应产物、西柏烷类降解产物和类胡萝卜素降解产物分别提高100%、14%和17%,香气物质总含量提高22%。接种量7.5×108 CFU/g与基础营养剂共同作用时的发酵效果最好,可使PO43-峰值含量相对自然发酵提高59%,美拉德反应产物、西柏烷类降解产物和类胡萝卜素降解产物分别提高61%、165%和295%,香气成分总含量增加218%。说明PO43-的供应效率可影响烟叶发酵效果,高地芽孢杆菌可提高雪茄烟叶发酵过程PO43-的供应效率,进而提高烟叶香气含量,达到为雪茄烟叶增香提质的目的。
[1]LI J J,ZHAO Y Y,QIN Y Q,et al.Influence of microbiota and metabolites on the quality of tobacco during fermentation[J].BMC Microbiol,2020,20:1-15.
[2]刘博远.雪茄烟叶风格质量评价体系构建及四川雪茄烟叶风格质量评价[D].郑州:河南农业大学,2021.
[3]刘洋.烟叶增香提质微生物的筛选及其应用[D].武汉:华中农业大学,2011.
[4] YIN Q, GUO X, ZHAO M, et al.Investigation of associations between rhizosphere microorganisms and the chemical composition of flue-cured tobacco leaves using canonical correlation analysis[J].Commun Soil Sci Plan,2013,44(10):1524-1539.
[5]DAI J C,DONG A J,XIONG G X,et al.Production of highly active extracellular amylase and cellulase from Bacillus subtilis ZIM3 and a recombinant strain with a potential application in tobacco fermentation[J].Front Microbiol,2020,11:https://doi.org/10.3389/fmicb.2020.01539.
[6]BUNTIC' A V,MILIC' M D,STAJKOVIC'-SRBINOVIC' O S,et al.Cellulase production by Sinorhizobium meliloti strain 224 using waste tobacco as substrate utilization of waste tobacco for cellulase production[J].Int J Environ Sci Technol,2019,16(10):5881-5890.
[7] YAO L, LI D Y, HUANG C Y, et al.Screening of cellulase-producing bacteria and their effect on the chemical composition and flavor quality improvement of tobacco wrapper leaves[J].Bioresources, 2022, 17(1):1566-1590.
[8]岳肖一.烟草化学成分及生物活性研究[D].贵阳:贵州师范大学,2015.
[9]VIGLIOTTA G,DI GIACOMO M,CARATA E,et al.Nitrite metabolism in Debaryomyces hansenii TOB-Y7, a yeast strain involved in tobacco fermentation[J].Appl Microbiol Biotech,2007,75:633-645.
[10]王旭锋.浙江桐乡茄衣调制和发酵过程中主要化学成分的变化及其质量特色研究[D].郑州:河南农业大学,2013.
[11]ZHENG T F,ZHANG Q Y,PENG Z,et al.Metabolite-based cell sorting workflow for identifying microbes producing carbonyls in tobacco leaves[J].Appl Microbiol Biot,2022,106:4199-4209.
[12]虞昕磊,袁跃斌,饶雄飞,等.农业发酵环节雪茄烟叶加湿回潮技术初探[J].特种经济动植物,2022,25(11):115-118.
[13]李志豪,张鸽,貊志杰,等.一株产木聚糖酶的蜡样芽孢杆菌对雪茄烟叶成分及发酵产物的影响[J].生物技术通报,2022,38(2):105-112.
[14]汪长国,李宁,戴亚,等.一种雪茄烟叶发酵用可湿性粉剂:CN2013100 46394.X[P].2013-05-08.
[15]TAHIR M,KHALID U,IJAZ M,et al.Combined application of bio-organic phosphate and phosphorus solubilizing bacteria (Bacillus strain MWT 14) improve the performance of bread wheat with low fertilizer input under an arid climate[J].Braz J Microbiol,2018,49(1):15-24.
[16]GAO L,KONG F Y,FENG C,et al.Isolation,characterization,and growth promotion of phosphate-solubilizing bacteria associated with nicotiana tabacum(tobacco)[J].Pol J Environ Stud,2016,25(3):993-1003.
[17] YI M, CHEN Y C.Enhanced phosphate adsorption on Ca-Mg-loaded biochar derived from tobacco stems[J].Water Sci Technol,2018,78(11):2427-2436.
[18]王亚麒,刘京,芶剑渝,等.长期有机无机配施下烤烟-玉米轮作优化土壤微生物活化无机磷[J].土壤学报,2022,59(3):808-818.
[19]姜雄.解磷、解钾细菌的筛选及其性能研究[D].贵阳:贵州大学,2020.
[20] RAWAT P, DAS S, SHANKHDHAR D, et al.Phosphate-solubilizing microorganisms: mechanism and their role in phosphate solubilization and uptake[J].J Soil Sci Plant Nutr,2021,21:49-68.
[21]LONG X E,YAO H Y,HUANG Y,et al.Phosphate levels influence the utilisation of rice rhizodeposition carbon and the phosphate-solubilising microbial community in a paddy soil[J].Soil Biol Biochem,2018,118:103-114.
[22]王建宇.根结线虫生防菌高地芽孢杆菌AMCC1040的筛选及杀线虫作用机理研究[D].泰安:山东农业大学,2021.
[23]张鸽,梁开朝,辛玉华,等.四个国家雪茄外包皮烟叶表面细菌分离与活性测定[J].中国烟草科学,2018,39(2):82-88.
[24]杨国燕,周坚.微波消解-抗坏血酸-钼蓝比色法测定油脂中磷含量[J].中国粮油学报,2016,31(1):117-122.
[25]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 8314—2013 茶游离氨基酸总量的测定[S].北京:中国标准出版社,2013.
[26]国家市场监督管理总局,中国国家标准化管理委员会.GB/T 5513—2019 粮油检验粮食中还原糖和非还原糖测定[S].北京:中国标准出版社,2019.
[27]景延秋.不同种植、调制条件对白肋烟重要香味成分的影响[D].郑州:河南农业大学,2006.
[28]冯志珍,陈太春,胡喜怀,等.烟叶表面高效降解蛋白质芽孢杆菌的分离筛选及其鉴定[J].中国烟草学报,2012,18(1):101-105.
[29]李士林,王宜君,汤朝起,等.耐高温菌的分离及在固态发酵上部烟叶中的应用[J].生物加工过程,2015,13(1):35-41.
[30]韩翔雨,赵高坤.烟叶烘烤过程中烘烤工艺对新植二烯含量变化规律的影响[J].安徽农业科学,2013,41(35):13729-13731.
[31]龙章德,姜宇,刘鸿,等.不同西方许旺酵母接种量对复烤后烟叶增香提质的影响研究[J].云南大学学报(自然科学版),2019,41(4):797-804.