巴氏醋酸杆菌(Acetobacter pasteurianus)由于其稳定的产酸量,常被应用于食醋的醋酸发酵[1-2]。研究巴氏醋酸杆菌的产酸性能有助于高酸食醋的生产。然而,在醋酸发酵过程中,巴氏醋酸杆菌细胞的生长和代谢会受到不同程度地阻碍[3]。同时,细胞固定化等技术在实际工业中仍不能大规模应用[4-5]。这些都是制约高酸食醋产率和生产强度难以再提高的瓶颈问题。
通过改变发酵底物,分析巴氏醋酸杆菌的产酸性能是提升高酸食醋生产效率的有效方法[6-7]。有研究发现,当酵母膏与蛋白胨形成复合氮源时,能促进醋酸发酵[8]。乙醇作为发酵底物时,体积分数过高将降低细胞体积和比生长速率;反之,由于碳源不足亦会导致产酸量低[9]。同时,在醋酸发酵中存留适量底酸,亦可有效防止醋酸菌快速生长从而导致后期动力不足的情况[10-11]。进一步分析不同底物下的生理响应可找到巴氏醋酸杆菌产酸量差异的生理机制。其中,微生物细胞结构形态变化是对底物环境最显著和可视化的表型反应[12]。微生物细胞脂质双分子层内的分子紊乱和运动的程度称为膜的流动性,适当的流动性才能使细胞保持正常的生理功能[13-14]。此外,醋酸菌在乙醇脱氢酶的作用下,将乙醇氧化成乙醛,然后在乙醛脱氢酶的催化下,再将乙醛氧化成乙酸[15]。因此,乙醇脱氢酶和乙醛脱氢酶活性也是巴氏醋酸杆菌细胞代谢产酸的关键生理因子[16]。
本研究以大红浙醋中分离出的巴氏醋酸杆菌(Acetobacter pasteurianus)为研究对象,探究其在不同氮源与酸醇因子下的生长和产酸量,并通过扫描电子显微镜(scanning electron microscopy,SEM)观察、细胞膜流动性、乙醇脱氢酶和乙醛脱氢酶活性测定来探究该巴氏醋酸杆菌在不同氮源及酸醇因子下的生理响应。这将不仅为高酸食醋的工业生产找到关键发酵底物,还为巴氏醋酸杆菌的高产酸代谢机制奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
巴氏醋酸杆菌(Acetobacter pasteurianus):分离自广州致美斋自然发酵大红浙醋,保存于中国微生物菌种保藏管理委员会普通微生物中心。
1.1.2 试剂
酵母抽提物(生化试剂):安琪酵母股份有限公司;动物蛋白胨(生化试剂):北京奥博星生物技术有限公司;氢氧化钠(分析纯):天津风船化学试剂有限公司;无水乙醇、乙酸(均为分析纯):天津市江天化工股份有限公司;2.5%戊二醛固定液:天津索罗门生物科技有限公司;1,6-二苯基-1,3,5-己三烯(1,6-diphenyl-1,3,5-hexatriene,DPH)、亚硫酸氢钠(均为分析纯):上海阿拉丁试剂有限公司;10%Triton X-100(纯度98%):北京索莱宝科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
液体发酵培养基[17-18]:酵母抽提物0.01 g/mL,葡萄糖0.01 g/mL,硫酸镁1.0×10-4 g/mL,自然pH,121 ℃高压蒸汽灭菌20 min后添加0.04 mL/mL乙醇。
1.2 仪器与设备
DY04-13-44-00高压蒸汽灭菌锅:上海东亚压力容器有限公司;MTZ18H009离心机:美国贝克曼库尔特有限公司;ZHJH-C1115C超净工作台、ZWY-100H恒温培养箱:上海智城仪器有限公司;FE28-Standard pH计:梅特勒-托利多有限公司;UV-1800紫外分光光度计:上海美谱达仪器有限公司;HH-6数显恒温水浴锅:常州智博瑞仪器制造有限公司;Delat-24LSC plus真空冷冻干燥机:德国CHRIST公司;SU1510扫描电子显微镜:株式会社日立制作所;F-7100荧光分光光度计(偏振装置):日立HITACHI公司。
1.3 方法
1.3.1 不同氮源对巴氏醋酸杆菌生长和产酸量的影响
将甘油管中冻存的巴氏醋酸杆菌直接加入液体发酵培养基(以0.01 g/mL酵母抽提物为氮源)中,30 ℃、200 r/min条件下培养24 h,然后将此培养液以4%(V/V)的接种量接种于液体发酵培养基(以0.01 g/mL酵母抽提物为氮源)中,30 ℃、200 r/min条件下培养24 h,完成活化。按4%(V/V)的接种量将巴氏醋酸杆菌分别接种于以0.01 g/mL酵母抽提物和0.01 g/mL动物蛋白胨为氮源的液体发酵培养基中,30 ℃、200 r/min条件下培养192 h,每隔24 h取样,测定菌株的生物量(OD600nm值)和总酸含量。
1.3.2 不同酸醇因子对巴氏醋酸杆菌生长和产酸量的影响
将活化的巴氏醋酸杆菌菌株按4%(V/V)的接种量分别接种于以0.04 mL/mL乙醇(E4)、0.08 mL/mL乙醇(E8)、0.12 mL/mL乙醇(E12)、0.14 mL/mL乙醇(E14)为醇因子,以0.04 mL/mL乙醇加0.01 mL/mL乙酸(E4A1)、0.04 mL/mL乙醇加0.02mL/mL乙酸(E4A2)、0.04mL/mL乙醇加0.03mL/mL乙酸(E4A3)、0.08 mL/mL乙醇加0.01 mL/mL乙酸(E8A1)、0.08 mL/mL乙醇加0.02 mL/mL乙酸(E8A2)为酸醇因子的液体发酵培养基中,30 ℃、200 r/min条件下培养192 h,每隔24 h取样,测定菌株的生物量和总酸含量。
1.3.3 不同氮源及酸醇因子条件下巴氏醋酸杆菌的生理响应
将活化的巴氏醋杆菌菌株按4%(V/V)的接种量分别接种于含不同氮源及酸醇因子的液体发酵培养基中,具体条件如下:0.04 mL/mL乙醇、0.01 g/mL酵母抽提物(A);0.08 mL/mL乙醇、0.01 g/mL酵母抽提物(B);0.08 mL/mL乙醇、0.01mL/mL乙酸、0.01g/mL酵母抽提物(C);0.12mL/mL乙醇、0.01 g/mL酵母抽提物(D);0.04 mL/mL乙醇、0.01 g/mL动物蛋白胨(E);0.08 mL/mL乙醇、0.01 g/mL动物蛋白胨(F);0.08 mL/mL乙醇、0.01 mL/mL乙酸、0.01 g/mL动物蛋白胨(G);0.12 mL/mL乙醇、0.01 g/mL动物蛋白胨(H),分别进行菌株细胞膜结构分析、细胞膜流动性检测、乙醇脱氢酶和乙醛脱氢酶活性检测。
1.3.4 巴氏醋酸杆菌细胞膜结构分析
将活化的巴氏醋杆菌菌株按4%(V/V)的接种量接种于不同氮源及酸醇因子的液体发酵培养基中,30 ℃、200 r/min条件下培养至对数生长期(OD600 nm值=0.8~1.0),分别取2 mL菌液,5 000 r/min离心3 min后收集菌体,用无菌水清洗一次。然后将菌体用0.025 mL/mL的戊二醛溶液进行固定(4 ℃过夜),之后再用戊二醛清洗2次菌体。采用不同体积分数(0.3 mL/mL、0.5 mL/mL、0.7 mL/mL、0.8 mL/mL、0.9 mL/mL、1.0 mL/mL)的乙醇溶液对菌体进行脱水处理,每次脱水10 min,其中采用体积分数1.0 mL/mL的乙醇脱水两次,脱水后进行冷冻干燥。取适量菌体粘于样品台上,使用离子溅射仪为样品镀导电金膜,采用扫描电子显微镜在20 000×的放大倍数下观察细胞结构。
1.3.5 巴氏醋酸杆菌细胞膜流动性检测
按1.3.3设计方法对巴氏醋杆菌菌株进行培养,取培养至对数期(OD600nm值=0.8~1.0)的菌液,5 000 r/min离心3 min后收集菌体,采用磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH7.0)洗涤菌体2次,然后加入5 mol/L DPH试剂,混合均匀,30 ℃摇床培养,5 000 r/min离心3 min,去上清,沉淀重悬于PBS,采用荧光分光光度计(偏振装置)测定荧光强度。激发波长360 nm,发射波长430 nm,狭缝均为5 nm。计算荧光的各向异性(r),其计算数学式如下[19]:
式中:IVV:起偏器和检偏器光轴同为垂直方向时的荧光强度;IVH:起偏器和检偏器光轴分别为垂直和水平方向时的荧光强度;IHV:起偏器和检偏器光轴分别为水平和垂直方向时的荧光强度;IHH:起偏器和检偏器光轴同为水平方向时的荧光强度。
1.3.6 巴氏醋酸杆菌乙醇脱氢酶和乙醛脱氢酶活性检测
按1.3.3设计方法对巴氏醋杆菌菌株进行培养,培养至144 h,每隔24 h进行取样,采用Wood式法测定乙醇脱氢酶和乙醛脱氢酶活性[20]。酶活定义:在25 ℃、pH 4.0条件下,1 min氧化1 μmol乙醇或乙醛的酶量为1个酶活力单位[21]。
1.3.7 生物量及总酸含量的测定方法
生物量的测定:采用分光光度计在波长600 nm处测定吸光度值(OD600nm)。
总酸含量的测定:采用酸碱滴定法测定总酸含量[13]。
1.3.8 数理处理
在实验过程中每组实验做3次平行,结果以“平均值±标准”表示,所有实验数据结果采用Origin 2021软件绘图。
2 结果与分析
2.1 不同种类氮源对巴氏醋酸杆菌生长和产酸量的影响
作为微生物生长和产物生成的必要条件,氮源通常可以促进菌体细胞物质(氨基酸、蛋白质、核酸等)和含氮代谢物的生成[8]。不同种类氮源对巴氏醋酸杆菌生长和产酸量的影响见图1。由图1可知,相比于动物蛋白胨,酵母抽提物明显对巴氏醋酸杆菌的生长和产酸代谢更具优势。当酵母抽提物为氮源时,发酵192 h时的OD600 nm值达到了1.505,总酸含量为34.5 g/L;而当动物蛋白胨为氮源时,发酵192 h的OD600nm值则为0.819,总酸含量仅为8.8 g/L。

图1 不同氮源对巴氏醋酸杆菌生物量(a)和总酸含量(b)的影响
Fig.1 Effect of different nitrogen sources on biomass (a) and total acid content (b) of Acetobacter pasteurianus
2.2 不同酸醇因子对巴氏醋酸杆菌生长和产酸量的影响
乙醇和乙酸作为醋酸菌的发酵底物和产物,对最终产酸量及醋酸菌自身的生长都具有重要意义[22-23]。不同醇酸因子对巴氏醋杆菌生长及产酸量的影响见图2。由图2a可知,随着乙醇体积分数从0.04 mL/mL提升至0.14 mL/mL时,菌株的OD600 nm值逐渐下降。当乙醇体积分数分别为0.04 mL/mL、0.08 mL/mL、0.12 mL/mL、0.14 mL/mL时,发酵192 h后菌株的OD600nm值分别为1.505、1.234、1.215、0.720。此外,当固定乙醇体积分数为0.04 mL/mL,乙酸体积分数分别为0.01 mL/mL、0.02 mL/mL、0.03 mL/mL时,发酵192 h后菌株的OD600 nm值分别为1.280、0.900、0.501;当固定乙醇体积分数为0.08 mL/mL,乙酸体积分数分别为0.01 mL/mL、0.02 mL/mL时,发酵192 h后菌株的OD600nm值分别为0.975和0.501。说明乙醇和乙酸的体积分数越高,越容易使巴氏醋酸杆菌的生长受到抑制。
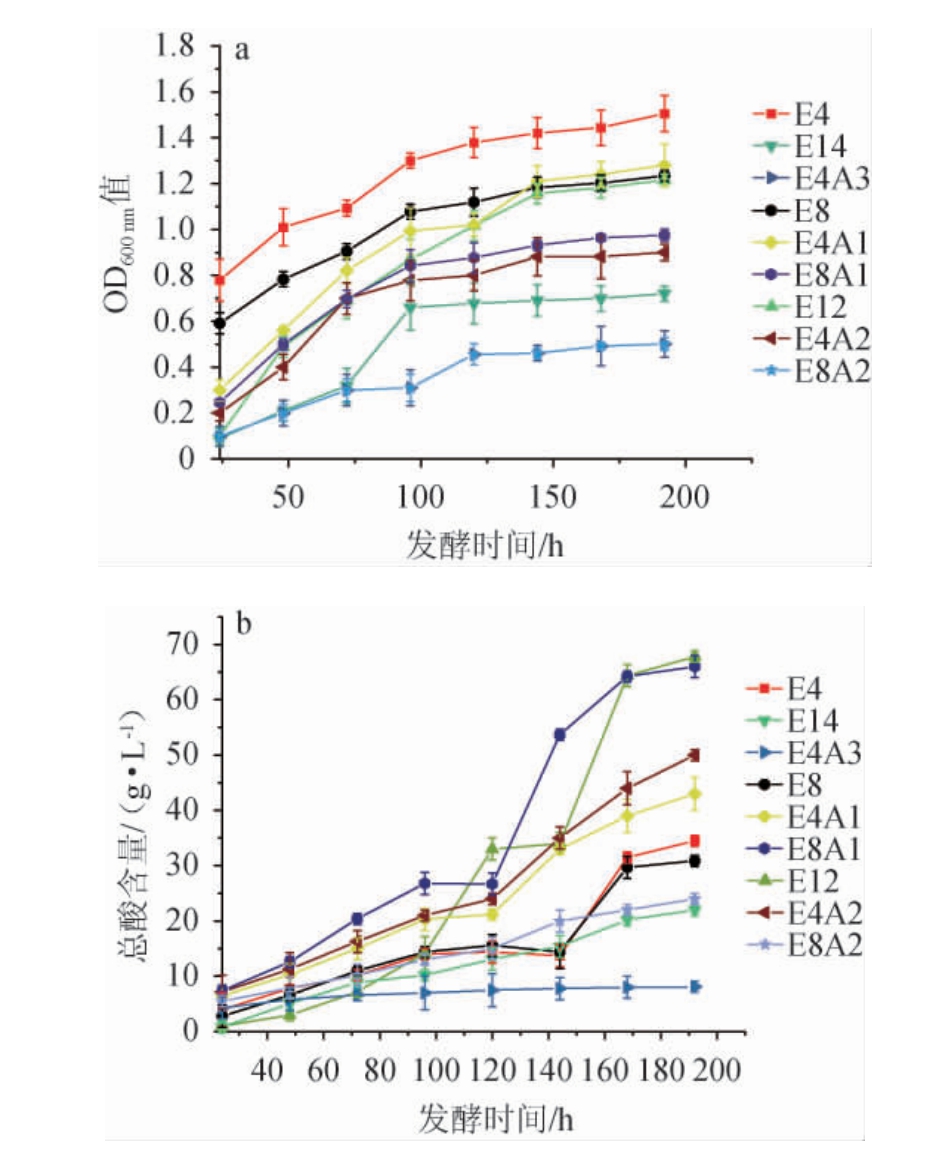
图2 不同酸醇因子对巴氏醋酸杆菌生物量(a)和总酸含量(b)的影响
Fig.2 Effect of different acid alcohol factors on biomass (a) and total acid content (b) of Acetobacter pasteurianus
适当的环境能促进醋酸菌的产酸代谢[10,24]。由图2b可知,当巴氏醋酸杆菌在乙醇体积分数0.12 mL/mL、乙醇体积分数0.08 mL及乙酸体积分数0.01 mL/mL条件下分别发酵192 h时,产酸量较高,分别为67.8 g/L、66.0 g/L。而当巴氏醋酸杆菌在乙醇体积分数0.04 mL/mL、0.08 mL/mL、0.14 mL/mL、乙醇体积分数0.04 mL/mL及乙酸体积分数0.01 mL/mL、乙醇体积分数0.04 mL/mL及乙酸体积分数0.02 mL/mL、乙醇体积分数0.04 mL/mL及乙酸体积分数0.03 mL/mL、乙醇体积分数0.08 mL/mL及乙酸体积分数0.02 mL/mL条件下分别发酵192 h时,产酸量分别为34.5 g/L、30.9 g/L、22.0 g/L、43.0 g/L、50.0 g/L、8.1 g/L、24.0 g/L,说明该巴氏醋酸杆菌能耐受体积分数为0.12 mL/mL的乙醇。此外,相比于乙醇体积分数0.08 mL,乙醇体积分数0.08 mL及乙酸体积分数0.01 mL/mL条件下,总酸含量提高79.6%(已扣除发酵起始加入的乙酸),说明体积分数0.08 mL/mL乙醇条件下添加体积分数0.01 mL/mL的乙酸能提高总酸产量。
2.3 巴氏醋酸杆菌生理响应分析
2.3.1 巴氏醋酸杆菌细胞膜结构分析
细胞膜作为一道屏障,可以维持细胞形态,参与物质交换和信息传递等功能。当微生物暴露在不同环境下时,细胞膜形态特性的变化是对环境最显著和最可视化的表型反应[25]。不同氮源及酸醇因子下巴氏醋酸杆菌细胞膜结构见图3。由图3可知,A组菌体表面呈紧实细密的皱缩状且菌体被拉伸,B组菌体呈破裂状且表面覆盖有一层物质,C组菌体断裂且呈较宽的沟壑状,D组菌体干瘪且呈细密的皱缩状,E组菌体表面出现多孔,F组菌体两端钝圆、表面略微粗糙,G组菌体表面粗糙且有内容物泄露,H组形态钝圆,表面粗糙。结果表明,各组菌体细胞膜均受到了破坏。A、B、C、D组菌体细胞膜受到的破坏较大,菌体表现为拉伸,说明菌体在有利于生长和产酸的氮源(酵母抽提物)环境中,菌体自身衰老的胁迫强度不小于酸醇因子带来的伤害。因此,为了促进巴氏醋酸杆菌的产酸代谢还应考虑通过减缓衰老而减小产酸抑制作用。E、F、G、H组菌体细胞膜受到的破坏较小,说明以动物蛋白胨为氮源时,菌体生长较为缓慢,菌体不被拉伸但表面粗糙多孔。此外,乙醇体积分数越高,越易使菌体细胞膜结构受到破坏。综上,酸醇因子体积分数低或以酵母抽提物为氮源时,菌体细胞结构易衰老变形;酸醇因子体积分数高或以动物蛋白胨为氮源时,菌体细胞结构易胁迫变形。因此,合理的氮源与适当体积分数的酸醇因子是保持巴氏醋酸杆菌细胞膜结构的基础。有研究报道,巴氏醋酸杆菌在发酵过程中,脱离其自然环境受到底物酸醇、产物酸的胁迫以及自身衰老的影响下,通过拉伸菌体长度,改变膜组成成分等从而增强对外界胁迫的抗性[26]。此外,形态性质的变化可能归因于表面组成的变化,巴氏醋酸杆菌菌体细胞在后期稳定阶段被非晶形物质聚集和覆盖,形成类似的生物膜,在一定程度上保护细胞免受乙酸的毒性作用,使其对更高浓度的乙醇和乙酸更有抵抗[25]。

图3 不同氮源及酸醇因子下巴氏醋酸杆菌细胞膜的扫描电镜结果
Fig.3 Scanning electron microscopy results of cell membrane of Acetobacter pasteurianus under different nitrogen sources and acid alcohol factors
2.3.2 巴氏醋酸杆菌细胞膜流动性差异
为研究不同氮源和酸醇因子对巴氏醋酸杆菌细胞膜流动性的影响,根据1.3.3中的底物条件采用1,6-二苯基-1,3,5-己三烯荧光探针考察不同条件下巴氏醋酸杆菌细胞膜流动性的变化[19],结果见图4。
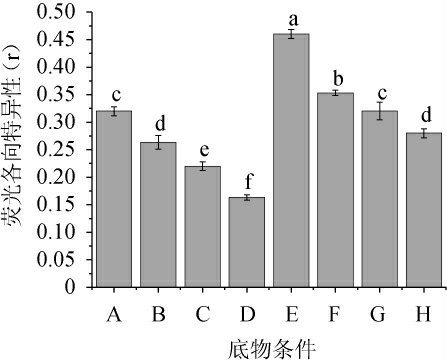
图4 不同氮源和酸醇因子对巴氏醋酸杆菌细胞膜流动性的影响
Fig.4 Effect of different nitrogen sources and acid alcohol factors on the membrane fluidity of Acetobacter pasteurianus
细胞膜流动性较低时,DPH分子和膜脂质之间的作用受到限制,导致DPH分子自由旋转受限制,从而引起荧光各向异性(r)变大;细胞膜流动性较大时,膜脂结构松散,DPH分子自由旋转度增加,引起荧光各向异性(r)降低[14]。由图4可知,相比于动物蛋白胨(E、F、G、H),巴氏醋酸杆菌以酵母抽提物为氮源时(A、B、C、D)具有更高的细胞膜流动性。推测可能是因为在酵母抽提物中,巴氏醋酸杆菌细胞生长快速,最终衰老胁迫导致细胞膜流动性增大。当乙醇体积分数不断增加时,细胞膜流动性也会增大。推测可能是因为暴露于乙醇环境下的巴氏醋酸杆菌细胞通过合成更高含量的不饱和脂肪酸,同时降低膜脂链中C—C的有序度和C—H侧向堆积程度,以此来增加细胞膜的流动性以应对乙醇的毒性应激。通过提高膜流动性亦可以促进微生物营养物质转运到细胞内,从而保证细胞在乙醇胁迫下生长的营养需求,提高抵御高浓度乙醇的抗性[27]。此外,相同乙醇体积分数下,添加0.01 mL/mL初始乙酸后,菌体细胞膜流动性亦增大。据报道,耐酸菌的细胞膜通常含有较高比例的长链脂肪酸,通过增大细胞膜流动性以适应酸胁迫环境[27]。
2.3.3 巴氏醋酸杆菌乙醇脱氢酶和乙醛脱氢酶酶活性差异有研究发现,当乙醇作为巴氏醋酸杆菌发酵底物,体积分数过高会使得菌体生长变缓,延滞期增长,抑制乙醇脱氢酶的活力;当乙醇体积分数过低,乙醇脱氢酶的亚基由于不正确的定位又会使得乙醇脱氢酶的酶活降低;在合理范围内,随着乙醇体积分数增加其乙醇脱氢酶酶活也会得到提高[28]。为了深入了解该巴氏醋酸杆菌在不同氮源及酸醇因子下的生理变化,检测不同氮源及酸醇因子下巴氏醋酸杆菌的乙醇脱氢酶和乙醛脱氢酶活性,结果见图5。由图5可知,乙醇脱氢酶和乙醛脱氢酶随时间都呈现出周期性先增大后减小。以酵母抽提物为氮源,乙醇体积分数0.08 mL/mL/乙酸体积分数0.01 mL/mL为酸醇因子,乙醇脱氢酶活性在发酵96 h达到最高,为0.88 U/mL;乙醛脱氢酶活性在发酵24 h达到最高,为0.68 U/mL。而以动物蛋白胨为氮源,乙醇体积分数0.08 mL/mL为酸醇因子,乙醇脱氢酶活性在发酵24 h达到最高,为0.21 U/mL;乙醇体积分数0.08 mL/mL/乙酸体积分数0.01 mL/mL为酸醇因子,乙醛脱氢酶活性在发酵24 h达到最高,为0.18 U/mL。相比于动物蛋白胨,两种酶在酵母抽提物中活性较高。此外,较高体积分数的乙醇虽然在发酵前期使菌株的酶活受到一定的抑制,但是在发酵后期却能提高酶活性。给予巴氏醋酸杆菌0.01 mL/mL初始乙酸刺激后,也能提高酶活性。研究发现,发酵初始时添加乙酸可上调菌株三羧酸循环和乙醇氧化相关酶的表达,改善能量代谢途径。乙醇脱氢酶表达的增强可以促进乙醇的氧化,提高乙酸生产率,从而产生强烈的质子动力,这是能量生产和细胞对乙酸耐受的必要条件[29]。
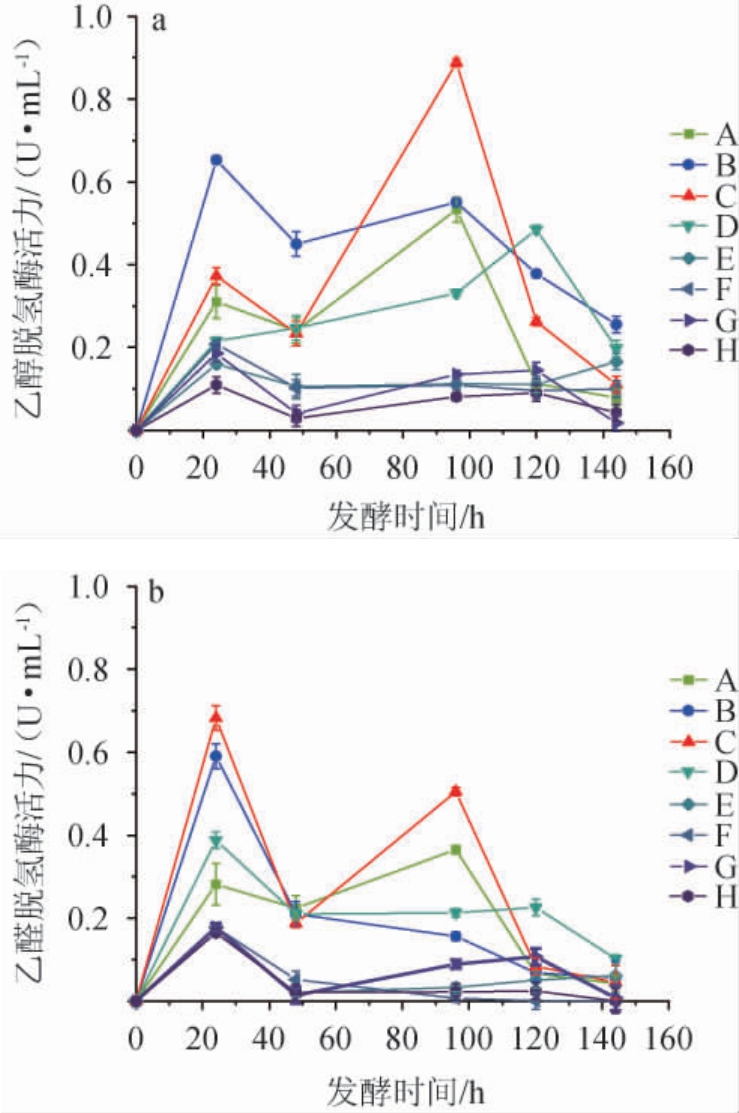
图5 不同氮源和酸醇因子对巴氏醋酸杆菌乙醇脱氢酶(a)和乙醛脱氢酶(b)酶活力的影响
Fig.5 Effect of different nitrogen sources and acid alcohol factors on the activities of ethanol dehydrogenase (a) and acetaldehyde dehydrogenase (b) of Acetobacter pasteurianus
3 结论
通过测定不同氮源和酸醇因子下巴氏醋酸杆菌的生长量和产酸量发现,相比于动物蛋白胨,酵母抽提物更易促进该菌的产酸代谢,当酵母抽提物为氮源时产酸量为34.5 g/L,当动物蛋白胨为氮源时产酸量仅为8.8 g/L。在耐受范围内,较高体积分数的乙醇易使该菌产酸,0.01 mL/mL初始乙酸也能提高总酸含量,相比于体积分数0.08 mL/mL乙醇条件,添加0.01 mL/mL初始乙酸,总酸产量提高79.6%。此外,合理的氮源与适宜体积分数的酸醇因子是保持该巴氏醋酸杆菌细胞膜结构的基础。而相比于动物蛋白胨,乙醇脱氢酶和乙醛脱氢酶在酵母抽提物中活性较高。同时,较高体积分数的乙醇虽然在发酵前期使菌株的酶活受到一定的抑制,但是在发酵后期却能提高酶活性。发酵前添加0.01 mL/mL初始乙酸后,将通过增大该巴氏醋酸杆菌的细胞膜流动性、乙醇脱氢酶及乙醛脱氢酶酶活性而产生更高含量的酸。
[1]ROMÁN-CAMACHO J,SANTOS-DUEÑAS I M,GARCÍA-GARCÍA I,et al.Metaproteomics of microbiota involved in submerged culture production of alcohol wine vinegar:A first approach[J].Int J Food Microbiol,2020,333:108797.
[2]潘红菊.果醋酿造用优良醋酸菌的选育及其特性研究[D].南昌:江西科技师范大学,2020.
[3]HAN C C,XIA K,YANG J Q,et al.Investigation of lipid profile in Acetobacter pasteurianus Ab3 against acetic acid stress during vinegar production[J].Extremophiles,2020,24(6):909-922.
[4]YANG H R,YU Y J,FU C X,et al.Bacterial acid resistance toward organic weak acid revealed by RNA-Seq transcriptomic analysis in Acetobacter pasteurianus[J].Front Microbiol,2019,10:1616.
[5]夏凯.巴氏醋杆菌耐酸性分子机制的研究[D].无锡:江南大学,2020.
[6]何宇宁.菠萝蜜果醋发酵醋酸菌选育与发酵工艺研究[D].湛江:广东海洋大学,2020.
[7] LYNCH K M, ZANNINI E, WILKINSON S, et al.Physiology of acetic acid bacteria and their role in vinegar and fermented beverages[J].Compr Rev Food Sci Food Saf,2019,18(3):587-625.
[8]周滟晴.高产酸醋酸菌的耐受性研究及其在李子醋的应用[D].上海:上海海洋大学,2021.
[9]李咪咪,龙虎,陈炼红.一株传统牦牛酸乳源醋酸杆菌鉴定及产酸条件优化[J].中国调味品,2022,47(6):50-54.
[10] SANKUAN X, CUIMEI Z, BINGQIAN F, et al.Metabolic network of ammonium in cereal vinegar solid-state fermentation and its response to acid stress[J].Food Microbiol,2021,95:103684.
[11]HUTCHINSON U F,NTWAMPE S K O,CHIDI B S,et al.Reusability of immobilized cells for subsequent balsamic-styled vinegar fermentations[J].Fermentation,2020,6(4):103.
[12]POTHIMON R,GULLO M,LA CHINA S,et al.Conducting high acetic acid and temperature acetification processes by Acetobacter pasteurianus UMCC 2951[J].Process Biochem,2020,98:41-50.
[13]SAINZ F,MAS A,TORIJA M J.Effect of ammonium and amino acids on the growth of selected strains of Gluconobacter and Acetobacter[J].Int J Food Microbiol,2017,242:45-52.
[14]牛德宝.脉冲电场杀灭醋酸菌及钝化其关键产酸酶机制研究[D].广州:华南理工大学,2020.
[15] PETERS B, MIENTUS M, KOSTNER D, et al.Expression of membrane-bound dehydrogenases from a mother of vinegar metagenome in Gluconobacter oxydans[J].Appl Microbiol Biotechnol,2017,101(21):7901-7912.
[16]闫玉婷.巴氏醋杆菌代谢酶基因的克隆与表达[D].西安:西北大学,2022.
[17]武晓丹.巴氏醋酸杆菌代谢调控提高乙酸生产效率研究[D].无锡:江南大学,2021.
[18]王超宇.山西老陈醋源优良醋酸菌的分离筛选及在山楂苦荞醋中的应用[D].晋中:山西农业大学,2019.
[19]周杰,吴政浩,李闯.黏质沙雷氏菌磷脂酶A1辅助蛋白PlaS对宿主菌细胞膜的影响及亚细胞定位[J].食品科学,2022,43(24):138-144.
[20]吴晓英.耐乙醇巴氏醋杆菌选育及其耐受机制研究[D].天津:天津科技大学,2015.
[21]徐静宜.一种高表达乙醛脱氢酶植物乳杆菌的筛选、驯化及初步应用[D].合肥:安徽农业大学,2021.
[22]谢锦明.苦荞醋醋酸发酵工艺及生物活性初探[D].武汉:湖北工业大学,2020.
[23]WANG D K,CHEN H,YANG H,et al.Incorporation of exogenous fatty acids enhances the salt tolerance of food yeast Zygosaccharomyces rouxii[J].J Agr Food Chem,2021,69(35):10301-10310.
[24]CHAI L J,QIU T,LU Z M,et al.Modulating microbiota metabolism via bioaugmentation with Lactobacillus casei and Acetobacter pasteurianus to enhance acetoin accumulation during cereal vinegar fermentation[J].Food Res Int,2020,138:109737.
[25]闫冠敏.低强交变磁场辅助生米酿造米醋液态发酵的研究[D].镇江:江苏大学,2021.
[26]HU Y H,ZHOU Y K,FU S M,et al.Coordination of characteristic cytomembrane and energy metabolism contributes to ethanol-tolerance of Acetobacter pasteurianus[J].LWT-Food Sci Technol, 2022, 169(1):113950.
[27]夏程程.耐乙醇乳酸菌耐受机制及其在食醋中的应用研究[D].武汉:湖北工业大学,2020.
[28] QI Z L, DONG D, YANG H L, et al.Improving fermented quality of cider vinegar via rational nutrient feeding strategy[J].Food Chem,2017,224:312-319.
[29] ZHENG Y, ZHANG R K, YIN H S, et al. Acetobacter pasteurianus metabolic change induced byinitial acetic acid to adapt to acetic acid fermentation conditions[J].Appl Microbiol Biotechnol,2017,101:7007-7016.