中国白酒历史悠久,其是以高粱等谷物为原料,以酒曲为糖化发酵剂,经蒸煮、发酵、蒸馏等工艺而制成的。“曲为酒之骨”,酒曲富含微生物菌系、酶系,用于白酒生产中的淀粉质原料糖化及物质转化,因此,酒曲在酿酒过程中扮演着重要的角色[1-2]。
目前,白酒生产用曲多为大曲、小曲、麸曲等,大曲是以小麦为主要原料,经传统固态发酵所制,用于白酒发酵,虽出酒率低,但品质最好[3];小曲以米粉或米糠为主要原料,由于其菌种特性而具有制曲周期短的特点[4];麸曲以麸皮为原料,具有发酵时间短、生产成本低等特点[5]。混合曲是陶融型白酒的代表用曲,其综合各种酒曲特点并配以优质酒糟,所酿之酒具有多香融合,风格独特的酒体[6]。实践表明,混合酒曲中丰富的菌系、酶系,对于底物的利用效率和呈香呈味物质转化效率均优于单一酒曲[7-8]。
近年来,业内学者针对白酒酒曲的研究有很多,多趋向于酒曲微生物群落、理化指标、风味物质等的研究,研究方法多为高通量测序技术、顶空固相微萃取-气相色谱-质谱(head space solid phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)等。WANG Z等[9]通过高通量测序技术和HS-SPME-GC-MS对三种不同产区的清香型小曲微生物群落结构及小曲生产的清香型白酒中的主要挥发性成分进行研究,研究表明,不同产区小曲微生物群落结构和组成具有差异且是导致白酒主要挥发性成分组成及含量差异的原因。向港兴等[10]通过高通量测序技术及理化指标测定,分析两种不同等级浓香型大曲微生物群落结构与理化特性之间的差异及相关性,研究表明,不同等级大曲微生物群落组成与理化指标存在差异且具有相关性。GOU M等[11]通过高通量测序技术对中国白酒生产所用三种酒曲大曲、小曲、麸曲的微生物群落特征进行研究,研究表明,三种酒曲的微生物多样性差异显著。目前,仅GOU M等[11]对大曲、小曲、麸曲三种酒曲微生物群落进行了比较研究。
本研究通过对大曲、小曲、陶融型混合曲的理化指标检测,应用高通量测序技术及HS-SPME-GC-MS分别对三种酒曲的微生物群落结构和挥发性风味物质进行分析,同时探究不同酒曲理化指标、微生物群落结构及挥发性风味物质之间的相关性,为白酒微生物信息数据库提供资源,为改善酒曲质量、提升白酒风味及质量提供理论支持。
1 材料与方法
1.1 材料与试剂
酒曲:河南仰韶酒业有限公司;Fast脱氧核糖核酸(deoxyribonucleic acid,DNA)SPINKitforSoil:美国MPBiomedicals公司;产物回收试剂盒:天根生化科技有限公司;Trans DNA 15Kmarker、DNA聚合酶:北京全式金生物技术公司;聚合酶链式反应(polymerase chain reaction,PCR)缓冲液、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)混合液;可溶性淀粉(分析纯):天津永城精细化工有限公司;氢氧化钠、无水葡萄糖、无水乙醇、碘、碘化钾(均为分析纯):天津市科密欧化学试剂有限公司;硫酸、盐酸(均为分析纯):天津市永大化学试剂有限公司;甲醛(分析纯):天津市盛奥化学试剂有限公司;酒石酸钾钠、五水硫酸铜(均为分析纯):成都金山化学试剂有限公司;邻苯二甲酸氢钾(分析纯):上海毕得医药科技股份有限公司。
1.2 仪器与设备
GeneAmp 9700型PCR仪:美国ABI公司;Quanti Fluor-ST DNA定量仪:美国Promega公司;Illumina Miseq高通量测序仪:美国Illumina公司;GCMS-QP2010Ultra气相色谱-质谱联用仪:日本岛津公司;HH-6数显恒温水浴锅:常州方科仪器有限公司;PHS-25精密pH计:上海雷磁仪器有限公司;A590紫外分光光度计:上海翱艺仪器有限公司;FA1104分析天平:上海舜宇恒平科学仪器有限公司;DNP-9272BS-Ⅲ电热恒温培养箱:上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 酒曲样品处理
大曲(DQ)(中温曲∶高温曲=25∶5)、小曲(XQ)、陶融型混合曲(MQ)(中温曲∶高温曲∶小曲∶麸曲=25∶5∶5∶1)样品各取三份,置于-20 ℃保存。一份用于测定微生物多样性,一份用于测定挥发性风味物质,一份用于测定理化性质。
1.3.2 酒曲样品总DNA提取及PCR扩增
样品DNA的提取:根据Fast DNA SPIN Kit for Soil说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA质量。
PCR扩增:细菌所用引物为338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3');真菌所用引物为SSU0817F(5'-TTAGCATGGAATAATRRAATAGGA-3')和1196R(5'-TCTGGACCTGGTGAGTTTCC-3')。PCR扩增体系:5×TransStart FastPfu缓冲液4 μL,引物338F(SSU0817F)(5 μmol/L)0.8 μL,806R(1196R)(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng/μL,补加双蒸水(ddH2O)至20 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共35个循环;最后72 ℃延伸10 min。PCR扩增结束后,采用1%琼脂糖凝胶电泳检测PCR扩增产物,检测合格后,使用2%琼脂糖凝胶回收PCR扩增产物,利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,Tris-HCl洗脱,再用2%琼脂糖凝胶电泳检测,并利用QuantiFluorTM-ST进行检测定量。
1.3.3 高通量测序
利用NovaSeq PE250平台对细菌和真菌菌群序列进行Illumina Miseq高通量测序分析,使用Uparse软件(v7.0.109 0)(http://drive5.com/uparse/)将相似性≥97%的序列归为1个操作分类单元(operational taxonomic unit,OTU)。采用核糖体数据库项目(ribosomal database project,RDP)classifier(v2.2)(http://rdp.cme.msu.edu/)对97%相似水平的OTU代表序列进行物种分类学分析,然后将来自每个聚类OTU的代表性序列与Silva数据库(Release138 http://www.arbsilva.de)进行比对,得到各样本的群落物种组成。通过mothur(v1.30.2)(https://mothur.org/wiki/calculators/)计算α多样性指数。原始数据上传至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的SRA数据库。
1.3.4 酒曲样品理化指标的测定
水分、酸度、还原糖、氨基酸态氮、淀粉含量、酯化力、糖化力、液化力和发酵力的测定:参照行业标准QB/T 4257—2011《酿酒大曲通用分析方法》[12]。
1.3.5 酒曲样品挥发性风味物质分析
取酒曲样品过40目筛,混匀,将2 g酒曲样品置于20mL顶空瓶中,加入30 μL 2-辛醇(质量浓度为12.60 mg/L)。然后加入5 mL纯净水和2 g氯化钠,60 ℃平衡20 min,顶空吸附30 min,最后在250 ℃条件下解吸5 min后进行GC-MS分析[13-14]。
1.3.6 数据处理
利用Microsoft Office Excel 2019、SPSS Statistics 22.0等统计软件对理化指标及风味物质数据进行处理及分析;基于美吉生物云平台绘制稀释曲线和相关性热图等。
2 结果与分析
2.1 不同酒曲微生物菌群多样性分析
2.1.1 不同酒曲微生物菌群高通量测序结果及Alpha多样性分析
不同酒曲样品微生物菌群高通量测序结果及Alpha多样性分析结果见表1。由表1可知,三种酒曲样品共获得细菌有效序列455 868条;共获得真菌有效序列354 366条。Coverage数值表示样本序列覆盖率,Coverage数值与样本中物种被测出的概率成正比[15]。三种酒曲样品的Coverage数值均>0.99,说明测序结果能够反映样本的真实情况。Alpha多样性分析是用来表征某个特殊区域或者生态环境中的物种多样性,常包括香农(Shannon)指数、辛普森(Simpson)指数、Ace指数和超1(Chao1)指数等[16-17],其中Shannon指数值越大,Simpson指数值越小,群落多样性越高;Chao 1和Ace指数值越大,物种丰富度越高[18]。细菌菌群高通量测序结果的Shannon指数值由大到小为XQ>MQ>DQ;Chao1指数值从大到小为XQ>DQ>MQ;Ace指数值从大到小为XQ>DQ>MQ。真菌菌群高通量测序结果的Shannon指数值由大到小为DQ>MQ>XQ;Chao1指数值从大到小为DQ>MQ>XQ;Ace指数值从大到小为DQ>MQ>XQ。由此说明XQ样品细菌群落多样性和物种丰富度最高,DQ样品真菌群落多样性和物种丰富度最高。
表1 不同酒曲样品微生物菌群高通量测序结果及Alpha多样性分析结果
Table 1 High-throughput sequencing results and Alpha diversity analysis results of different Jiuqu samples
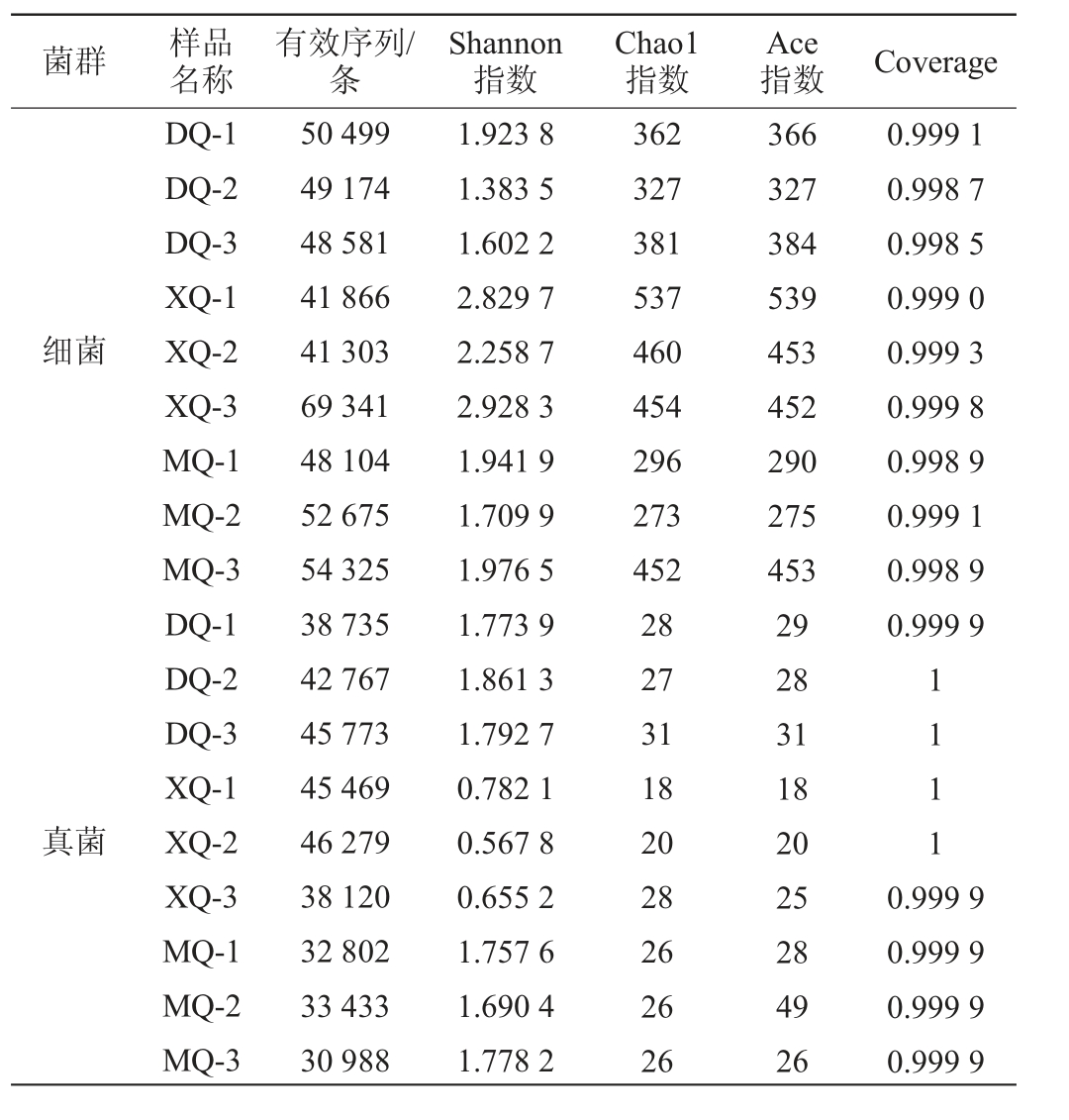
菌群 样品名称有效序列/条Shannon指数Chao1指数Ace指数 Coverage细菌0.999 1 0.998 7 0.998 5 0.999 0 0.999 3 0.999 8 0.998 9 0.999 1 0.998 9 0.999 9真菌DQ-1 DQ-2 DQ-3 XQ-1 XQ-2 XQ-3 MQ-1 MQ-2 MQ-3 DQ-1 DQ-2 DQ-3 XQ-1 XQ-2 XQ-3 MQ-1 MQ-2 MQ-3 50 499 49 174 48 581 41 866 41 303 69 341 48 104 52 675 54 325 38 735 42 767 45 773 45 469 46 279 38 120 32 802 33 433 30 988 1.923 8 1.383 5 1.602 2 2.829 7 2.258 7 2.928 3 1.941 9 1.709 9 1.976 5 1.773 9 1.861 3 1.792 7 0.782 1 0.567 8 0.655 2 1.757 6 1.690 4 1.778 2 362 327 381 537 460 454 296 273 452 28 27 31 18 20 28 26 26 26 366 327 384 539 453 452 290 275 453 29 28 31 18 20 25 28 49 26 1111 0.999 9 0.999 9 0.999 9 0.999 9
为考察本次试验取样及测序深度是否合理,绘制不同酒曲样品细菌和真菌菌群的Shannon指数曲线,结果见图1。
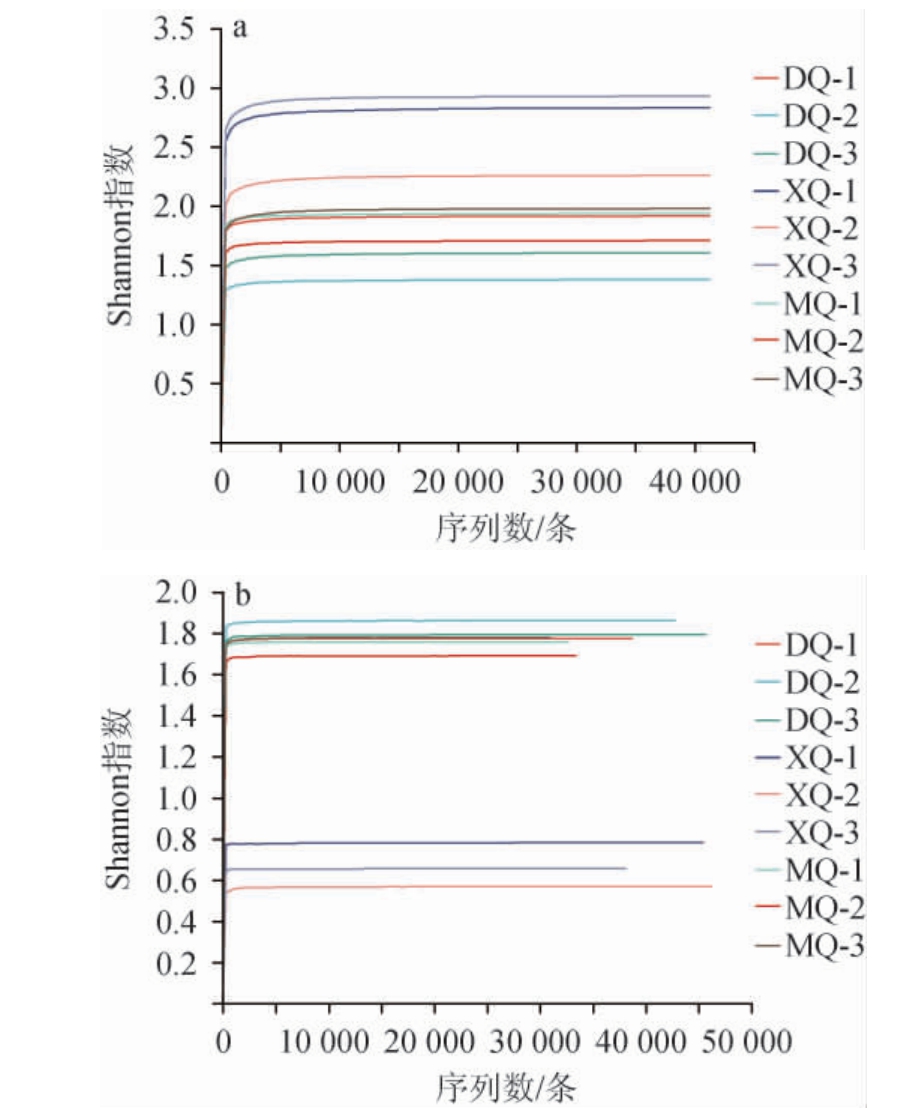
图1 不同酒曲样品细菌(a)和真菌(b)菌群的Shannon指数曲线
Fig.1 Shannon index curves of bacteria (a) and fungi (b) in different Jiuqu samples
由图1可知,随着样本序列数的增多,Shannon指数曲线逐渐趋于平坦,表明该试验的测序深度涵盖了大部分微生物,该测序结果可以准确地反映出三种酒曲微生物群落结构和多样性,说明测序数据量合理。
2.1.2 基于OTU的Venn图分析
Venn图可以用来统计多个样本中所共有和独有的物种数目,可以比较直观的表现不同酒曲样品中的共有OTU和特有OTU[19],不同酒曲样品细菌和真菌OTU的Venn图见图2。
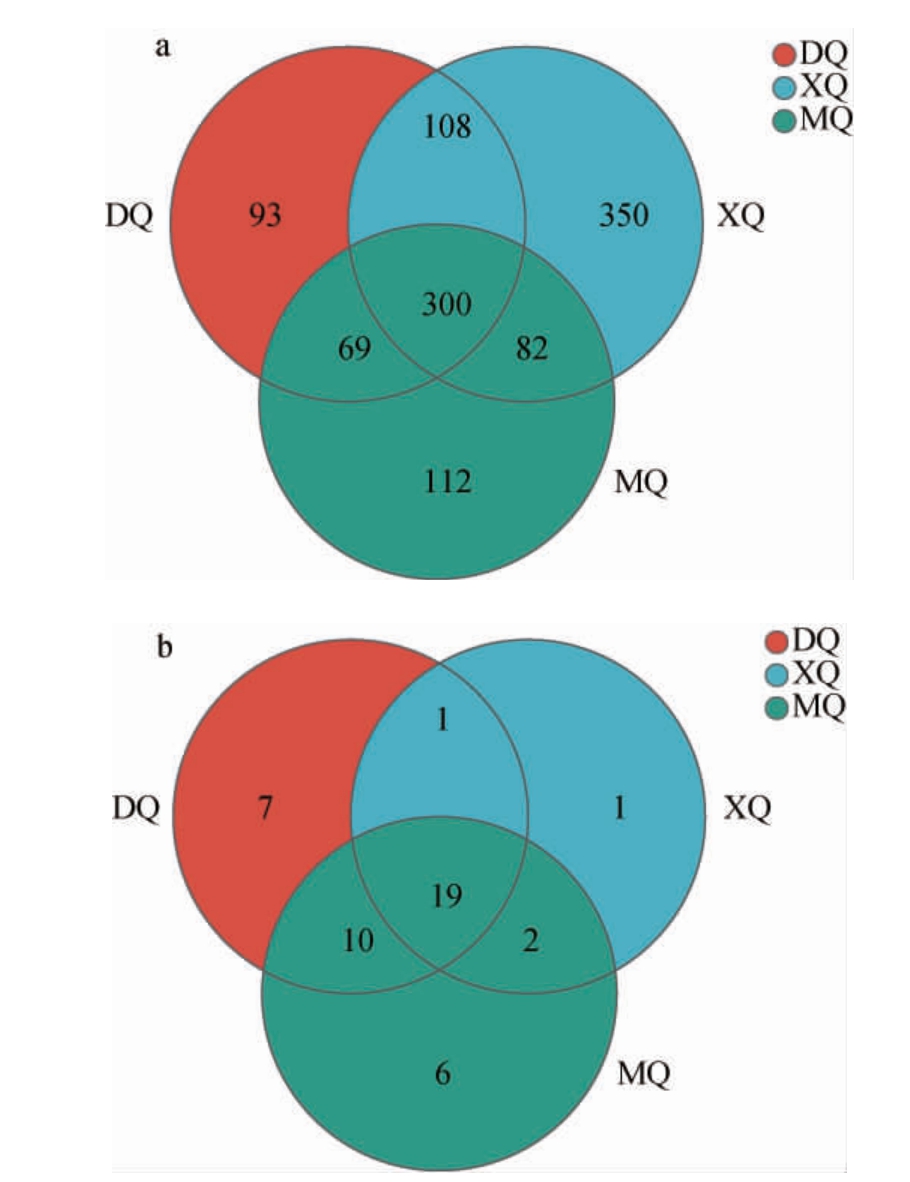
图2 不同酒曲样品细菌(a)和真菌(b)OTU的Venn图
Fig.2 Venn diagrams of bacterial (a) and fungal (b) OTUs of different Jiuqu samples
由图2a可知,DQ、XQ、MQ样品的细菌OTU数分别为570个、840个、563个,XQ样品中细菌OTU数最多,共有的OTU数为300个,DQ、XQ、MQ样品特有的OTU数分别为93个、350个、112个;由图2b可知,DQ、XQ、MQ样品的真菌OTU数分别为37个、23个、37个,DQ和MQ样品中真菌OTU数均较高,共有的OTU数目为19个,DQ、XQ、MQ样品特有的OTU数分别为7个、1个、6个。结果表明,三种酒曲样品中所含有的微生物种类既有相似性又有特异性。
2.2 不同酒曲样品微生物群落组成及差异分析
2.2.1 基于门水平微生物群落组成分析
在门水平上对三种酒曲的真菌和细菌菌群物种组成进行分析,结果见图3。将三种酒曲样品中平均相对丰度>1%的菌门定义为优势菌门。
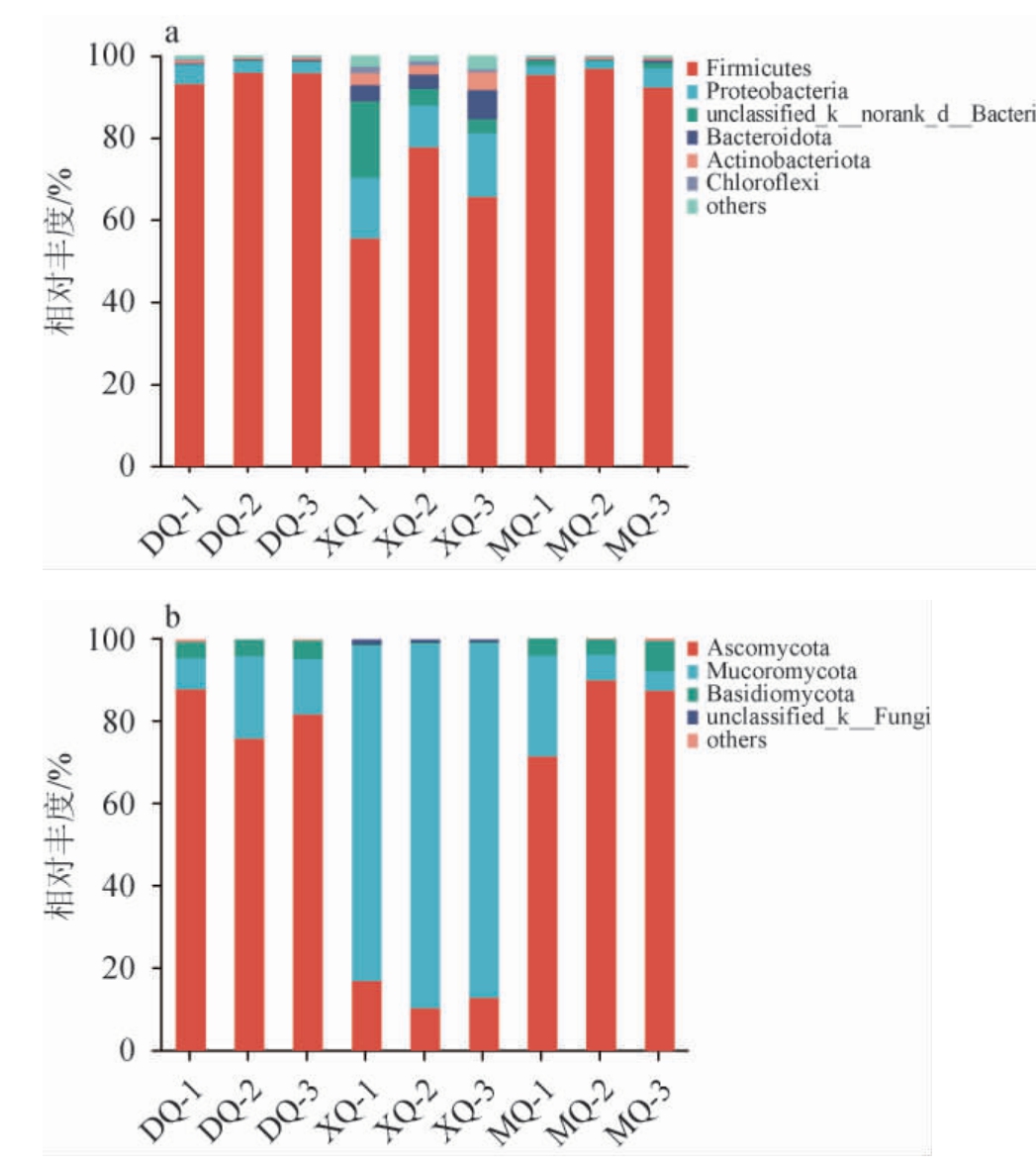
图3 基于门水平不同酒曲样品细菌(a)和真菌(b)菌群结构
Fig.3 Bacteria (a) and fungi (b) community structure in different Jiuqu samples based on phylum level
others表示相对丰度<1%的菌门,norank表示该分类水平上没有明确的
分类信息或分类名称,unclassified指在置信度70%下未与数据库比对。
由图3a可知,从样品中共检测到5个优势细菌门,DQ样品中优势细菌门有2个,分别为厚壁菌门(Firmicutes)(94.97%)、变形菌门(Proteobacteria)(3.36%);XQ样品中优势细菌门有5个,分别为厚壁菌门(Firmicutes)(66.18%)、变形菌门(Proteobacteria)(13.98%)、unclassified_k__norank_d__Bacteria(7.68%)、拟杆菌门(Bacteroidota)(5.25%)、放线菌门(Actinobacteriota)(3.41%);MQ样品中优势细菌门有2个,分别为厚壁菌门(Firmicutes)(94.85%)、变形菌门(Proteobacteria)(2.98%)。由图3b可知,从样品中共检测到3个优势真菌门,DQ样品中优势真菌门有3个,分别为子囊菌门(Ascomycota)(81.74%)、毛霉菌门(Mucoromycota)(13.86%)、担子菌门(Basidiomycota)(4.19%);XQ样品中优势真菌门有2个,分别为毛霉菌门(Mucoromycota)(85.26%)、子囊菌门(Ascomycota)(13.64%);MQ样品中优势真菌门有3个,分别为子囊菌门(Ascomycota)(82.89%)、毛霉菌门(Mucoromycota)(11.92%)、担子菌门(Basidiomycota)(5.02%)。
不同酒曲间优势细菌种类及相对丰度的不同,可能导致酒曲间的差异,进而导致不同酒曲酿造白酒风味、质量等的差异。三种酒曲样品中均检测到厚壁菌门。厚壁菌门菌群具有细胞壁结构,而且大多数能够产生内生孢子,可以抵抗极端的环境并且具备产己酸和降乳酸的功能[20]。XQ样品中厚壁菌门相对丰度为66.18%,均低于另外两种酒曲,这可能导致其酿造的白酒乳酸乙酯含量高,与小曲清香型白酒主体香为乳酸乙酯结果相对应[21]。DQ样品中的绝对优势细菌门为厚壁菌门(Firmicutes)(94.97%),这与张清玫等[22]研究的酱、浓、清三种香型大曲中的优势菌门结果一致。三种酒曲中均检测到子囊菌门,子囊菌门为DQ、MQ样品中的绝对优势真菌门,这说明其在白酒发酵过程中起到重要作用。同时MQ样品中绝对优势微生物为厚壁菌门和子囊菌门,陈蒙恩等[23]报道厚壁菌门和子囊菌门为陶融型大曲中绝对的优势微生物,与本研究结果相一致。DQ样品和MQ样品在门水平下优势真菌门结构相似,种类均高于XQ样品,但MQ样品绝对优势真菌子囊菌门相对丰度(82.89%)大于DQ样品子囊菌门的相对丰度(81.74%)。
2.2.2 基于属水平微生物群落组成分析
在属水平上对三种酒曲的真菌和细菌物种组成进行分析,并将平均相对丰度>1%的菌属定义为优势菌属,结果见图4。
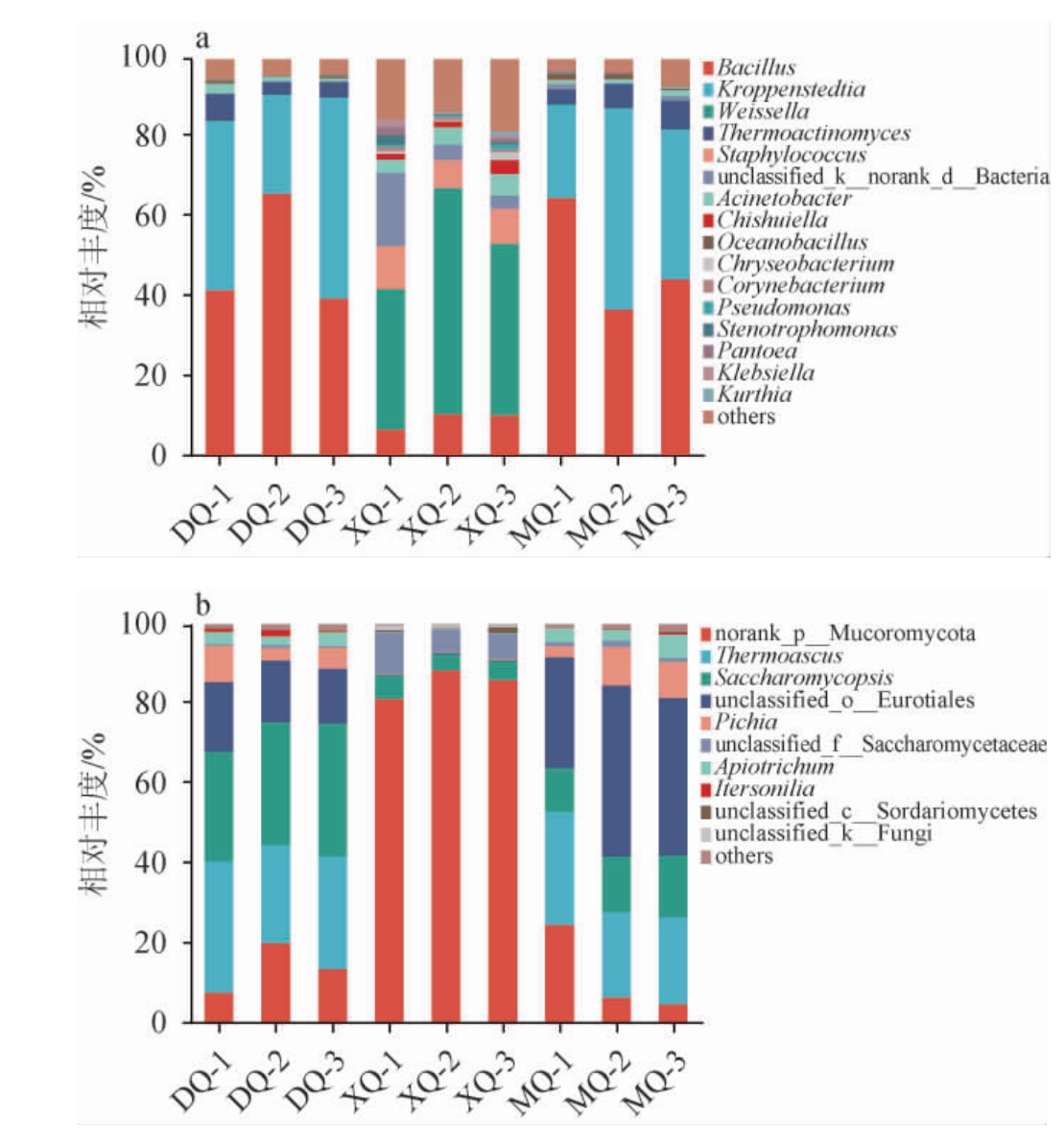
图4 基于属水平不同酒曲样品细菌(a)和真菌(b)菌群结构
Fig.4 Bacteria (a) and fungi (b) community structure in different Jiuqu samples based on genus level
others表示相对丰度<1%的菌属,norank表示该分类水平上没有明确的
分类信息或分类名称,unclassified指在置信度70%下未与数据库比对。
由图4a可知,从样品中共检测到10个优势细菌属,DQ样品中的优势细菌属有4个,分别为芽孢杆菌属(Bacillus)(49.08%)、克罗彭斯特菌属(Kroppenstedtia)(39.40%)、高温放线菌属(Thermoactinomyces)(4.58%)、不动杆菌属(Acinetobacter)(1.41%)。XQ样品中的优势细菌属有7个,分别有魏斯氏菌属(Weissella)(44.86%)、芽孢杆菌属(Bacillus)(9.22%)、葡萄球菌属(Staphylococcus)(8.86%)、unclassified k__norank d__Bacteria(7.68%)、不动杆菌属(Acinetobacter)(4.59%)、赤水菌属(Chishuiella)(2.34%)、金黄杆菌属(Chryseobacterium)(1.21%)。MQ样品中的优势细菌属有5个,分别为芽孢杆菌属(Bacillus)(48.21%)、克罗彭斯特菌属(Kroppenstedtia)(37.73%)、高温放线菌属(Thermoactinomyces)(5.71%)、不动杆菌属(Acinetobacter)(1.16%)、海洋芽孢杆菌属(Oceanobacillus)(1.07%)。
3种酒曲中均检测到芽孢杆菌属。芽孢杆菌属是各类白酒发酵中的常见菌和优势菌,此前研究中,芽孢杆菌属在浓香型和酱香型白酒中被认定为第一优势菌属[24],在中国传统白酒发酵领域,芽孢杆菌属是中国主流大曲白酒发酵中对风味起重要作用的细菌[25],芽孢杆菌属的种类和数量直接影响大曲和酒醅的质量,决定白酒质量和风格的差异[26]。克罗彭斯特菌属是样品DQ和MQ中的绝对优势细菌属,研究发现克罗彭斯特菌属经常在高温曲中被检测到[27],说明它能够适应高温环境且具有较强的耐热能力,姚粟等[28]研究发现,在芝麻香型白酒高温大曲中,克罗彭斯特菌属为优势细菌属。苏葛等[29]推测克罗彭斯特菌属发酵功能类似高温放线菌科多数菌属,可参与土壤中有机物的转化产生多种酶类物质的作用。目前,对克罗彭斯特菌属在酒曲中的发酵作用报道较少,有待进一步探索。魏斯氏菌属为XQ样品中的绝对优势细菌,属于乳酸菌,能够产乳酸、乙酸等有机酸类物质,有助于乳酸乙酯的生成和酒体风味的形成[30]。仅在MQ样品中发现海洋芽孢杆菌属,其是具有嗜盐性的细菌,是晒盐场、盐湖以及盐矿等富盐环境常见的微生物类群[31]。本研究中XQ样品中的优势细菌属种类大于MQ和DQ样品,微生物群落组成与此前文献报道的具有一定差异,可能与酒曲样本取样地区和方式、生产原料、贮存时间、制曲工艺不同有关[32-36],但总体分析XQ样品最主要优势菌属占比均较小。
由图4b可知,从样品中共检测到7个优势真菌属,DQ样品中优势真菌属有6个,分别为复膜孢酵母属(Saccharomycopsis)(30.72%)、嗜热子囊菌属(Thermoascus)(28.45%)、未归类散囊菌目(unclassified_o__Eurotiales)(15.54%)、未分类毛霉菌门(norank_p__Mucoromycota)(13.86%)、毕赤酵母菌属(Pichia)(5.73%)、Apiotrichum(2.90%);XQ样品中优势真菌属有3个,分别为未归类毛霉菌门(norank_p__Mucoromycota)(85.26%)、未归类酵母菌科(unclassified_f__Saccharomycetaceae)(7.80%)、复膜孢酵母属(Saccha romycopsis)(4.88%);MQ样品中优势真菌属有7个,分别为未归类散囊菌目(unclassified_o__Eurotiales)(36.80%)、嗜热子囊菌属(Thermoascus)(23.92%)、复膜孢酵母属(Saccharomycopsis)(13.46%)、未分类毛霉菌门(norank_p__Mucoromycota)(11.92%)、毕赤酵母菌属(Pichia)(7.16%)、Apiotrichum(4.08%)、未归类酵母菌科(unclassified_f__Saccharomycetaceae)(1.15%)。
三种酒曲中均检测到复膜孢酵母属,李斌等[37]研究表明,复膜孢酵母属能产生酶类和纤维素降解促进因子,是安全的生物资源菌。DQ样品和MQ样品中绝对优势真菌属均为嗜热子囊菌属,有研究表明,嗜热子囊菌属是浓香型中高温曲的优势真菌之一,可产生过氧化氢酶、内切葡聚糖酶、木聚糖酶、葡萄糖苷酶等,具有产纤维素酶、蛋白酶、淀粉酶、脂肪酶等酶类的能力,具有较强的热稳定性,能够在白酒发酵过程中温度较高的条件下保持稳定的催化效率,在后续的堆积糖化发酵以及对风味的形成起重要的作用[38-39],嗜热子囊菌属仅为DQ样品和MQ样品中优势真菌属,可能与其独特的制曲工艺有关。
2.2.3 不同酒曲微生物群落物种差异分析
为进一步分析不同酒曲中微生物的差异,利用线性判别分别效应大小(linear discriminant analysis effect size,LEfSe)分别解析三种酒曲中的差异微生物,三种酒曲中细菌和真菌差异微生物分别见图5和图6。

图5 不同酒曲样品细菌LEfSe多级物种层级树图(a)和LDA结果(b)
Fig.5 LEfSe multi-level species tree diagram (a) and LDA results (b)of bacteria in different Jiuqu samples
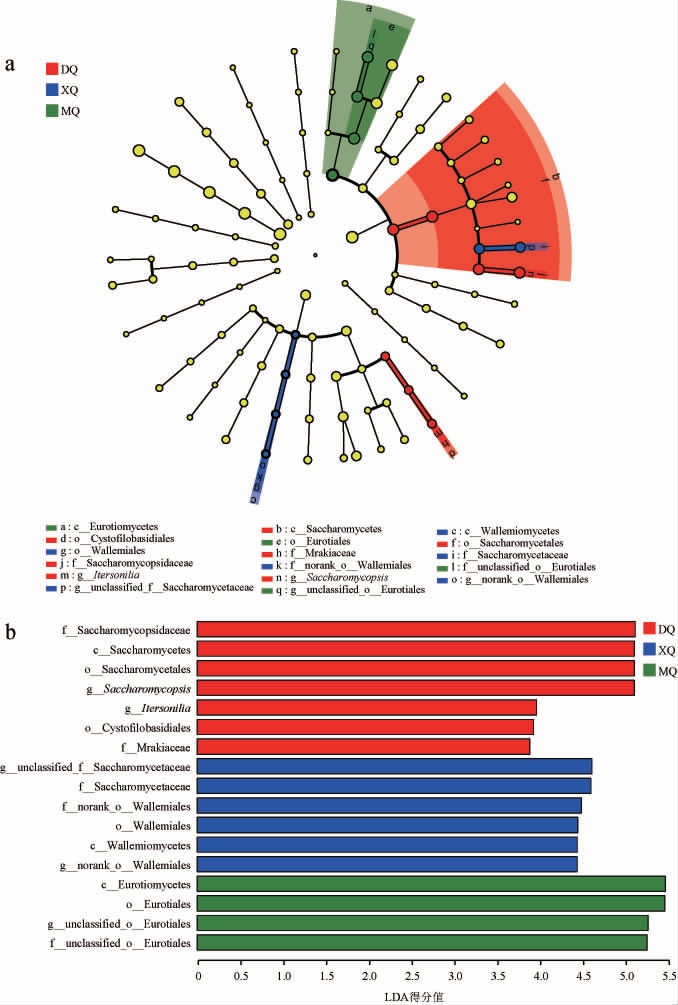
图6 不同酒曲样品真菌LEfSe多级物种层级树图(a)和LDA结果(b)
Fig.6 LEfSe multi-level species tree diagram (a) and LDA results (b)of fungi in different Jiuqu samples
由图5可知,在属水平上,三种酒曲样品中共检测出11种(LDA>3)差异微生物,DQ样品中差异微生物为norank_f__Mitochondria、白单胞菌属(Albimonas),XQ样品中的差异微生物为魏斯氏菌属(Weissella)、葡萄球菌属(Staphylococcus)、unclassified_k__norank_d__Bacteria、假单胞菌属(Pseudomonas)、微小杆菌属(Exiguobacterium)、norank_f__norank_o__PeM15、乳球菌属(Lactococcus)、未归类微球菌科(unclassified_f__Micrococcaceae),MQ样品中差异微生物为海洋芽孢杆菌属(Oceanobacillus)、尿素芽孢杆菌属(Ureibacillus)。
由图6可知,在属水平上,三种酒曲中共检测出5种(LDA>3)差异微生物,其中DQ样品中差异微生物为复膜孢酵母属(Saccharomycopsis)和锁霉属(Itersonilia);XQ样品中差异微生物为未归类酵母菌科(unclassified_f__Saccharomycetaceae)和未归类节担菌目(norank_o__Wallemiales);MQ样品中差异微生物为未归类散囊菌目(unclassified_o__Eurotiales)。
综上,三种酒曲中的微生物菌群存在差异。其中,大部分真菌差异微生物为样品中的优势真菌,且在白酒酿造过程中发挥着重要作用,如未归类散囊菌目(unclassified_o__Eurotiales)、复膜孢酵母属(Saccharomycopsis)、未归类酵母菌科(unclassified_f__Saccharomycetaceae)等,因此推测真菌微生物,特别是未归类散囊菌目(unclassified_o__Eurotiales)在制曲过程中大量繁殖,并产生各种代谢产物,最终导致了酒曲质量之间的差异。
2.3 不同酒曲样品理化指标差异分析
由表2可知,酒曲样品中水分含量由高到低依次为DQ、MQ、XQ,其中样品XQ的水分含量(7.4%)显著低于DQ(12.7%)和MQ(11.9%)(P<0.05)。一般白酒酿造成熟大曲水分含量<13%,说明3种酒曲均符合要求[40]。酒曲水分含量过高会导致酒曲再次生霉,不易贮存,而较低的水分含量不利于微生物的生长代谢活动[41]。样品MQ的液化力(4.71 U)高于样品DQ(4.48 U)和XQ(3.21 U),且与样品XQ差异显著(P<0.05)。样品MQ的糖化力(966 U)显著高于样品DQ(924 U)和XQ(544 U)(P<0.05)。酒曲的糖化力、液化力与白酒出酒率直接相关,糖化力高则出酒率高[42]。在发酵力上,样品XQ(1.75 U)和MQ(1.72 U)没有显著差异(P>0.05),但显著高于样品DQ(0.42 U)(P<0.05)。三种酒曲在淀粉含量上存在显著差异(P<0.05),其中样品DQ的淀粉含量最高达55.44 g/100 g,淀粉在白酒酿造中起着投粮作用,是作为微生物生长代谢的主要能量来源,其含量可以客观反映在制曲过程中大曲的发酵情况[2]。酸度指标在0.3~1.5 mmol/10 g范围内视为正常,三种酒曲的酸度在0.82~1.44 mmol/10 g之间,均属于正常,其中样品DQ和MQ之间差异不显著(P>0.05),样品XQ和DQ、MQ之间差异显著(P<0.05),且样品XQ的酸度最高达1.44 mmol/10 g。酒曲的酸度主要与产酸微生物的有机酸代谢及淀粉、蛋白质和脂肪等的降解有关,适当的酸度能在一定程度上抑制杂菌的生长,酸度过高或过低均不利于酿造微生物的生长[43]。三种酒曲在氨基酸态氮、酯化力上均差异显著(P<0.05)。这些理化指标的不同可能与三种酒曲中不同的微生物群落组成有着直接的关联性[44]。
表2 不同酒曲样品理化指标测定结果
Table 2 Determination results of physicochemical indexes of different Jiuqu samples
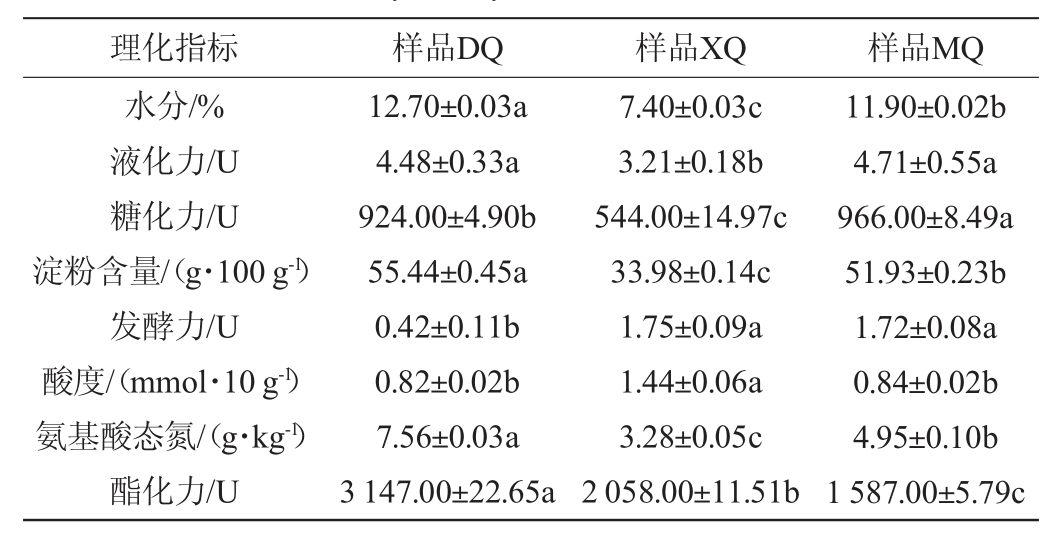
注:不同小写字母表示差异显著(P<0.05)。
理化指标 样品DQ 样品XQ 样品MQ水分/%液化力/U糖化力/U淀粉含量/(g·100 g-1)发酵力/U酸度/(mmol·10 g-1)氨基酸态氮/(g·kg-1)酯化力/U 12.70±0.03a 4.48±0.33a 924.00±4.90b 55.44±0.45a 0.42±0.11b 0.82±0.02b 7.56±0.03a 3 147.00±22.65a 7.40±0.03c 3.21±0.18b 544.00±14.97c 33.98±0.14c 1.75±0.09a 1.44±0.06a 3.28±0.05c 2 058.00±11.51b 11.90±0.02b 4.71±0.55a 966.00±8.49a 51.93±0.23b 1.72±0.08a 0.84±0.02b 4.95±0.10b 1 587.00±5.79c
2.4 不同酒曲理化指标与主要微生物属间相关性分析
为了解不同酒曲理化指标与其微生物之间的相关性,对不同酒曲理化指标与属水平上平均相对丰度前十的微生物菌属进行Spearman相关性分析,结果见图7。
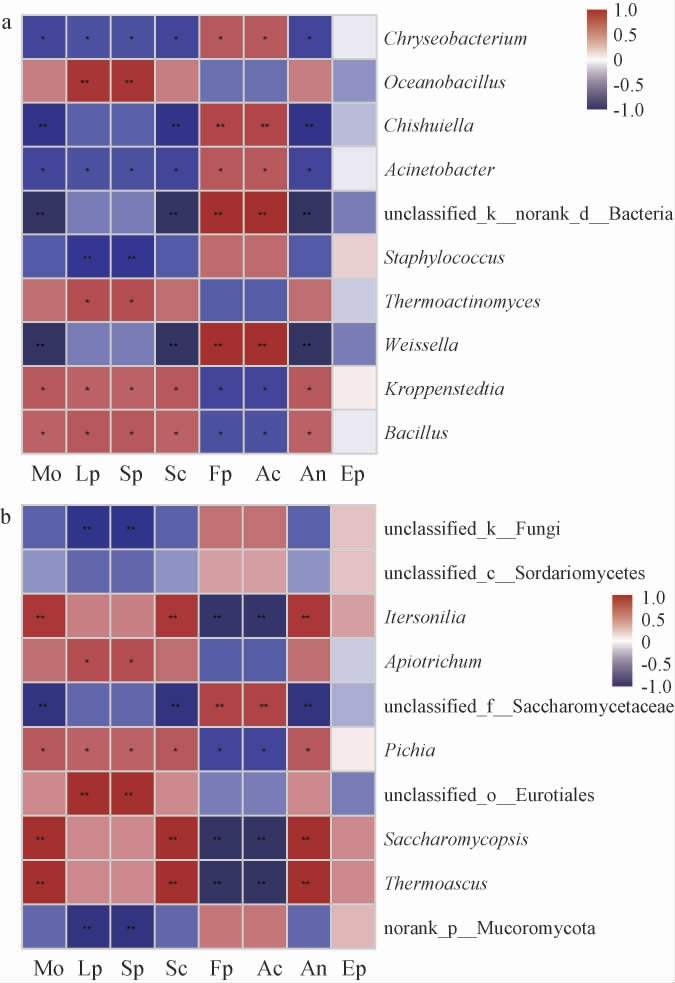
图7 酒曲中细菌属(a)和真菌属(b)与理化指标的Spearman相关性分析结果
Fig.7 Spearman correlation analysis results between bacterial genera(a)and fungal genera(b)in Jiuqu samples and physicochemical indexes
Mo:水分,Lp:液化力,Sp:糖化力,Sc:淀粉含量,Fp:发酵力,Ac:酸度,
An:氨基酸态氮,Ep:酯化力。红色表示正相关,蓝色表示负相关。“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)。下同。
由图7a可知,芽孢杆菌属与液化力、糖化力呈显著正相关(P<0.05),其在样品DQ和MQ中为主导细菌属,相对丰度均高于XQ,其分泌的淀粉酶和蛋白酶能将淀粉和蛋白质转化为葡萄糖和氨基酸[34]。液化力和糖化力是酒曲的两个重要指标,反映了酒曲中把淀粉转化为葡萄糖的能力[45],芽孢杆菌属的存在可能是导致DQ和MQ样品的液化力、糖化力高于XQ样品的主要原因。魏斯氏菌属与发酵力、酸度呈极显著正相关(P<0.01),与向港兴等[10]研究的浓香型大曲微生物群落与理化性质相关性结果一致。魏斯氏菌属属于乳酸细菌,能够将原料中的糖类转化为乳酸等有机酸[46],是样品XQ中的绝对优势细菌属,相对丰度均高于DQ和MQ样品,这可能是造成XQ样品酸度显著高于DQ和MQ的原因。高温放线菌属与液化力、糖化力呈显著正相关(P<0.05),其具有糖化力、液化力,可降解酿酒原料中的淀粉、蛋白质等生成风味物质[47]。海洋芽孢杆菌属与液化力、糖化力呈极显著正相关(P<0.01)。高温放线菌属、海洋芽孢杆菌属在样品MQ中相对丰度最高,这可能是造成MQ样品液化力、糖化力最高的重要原因。
由图7b可知,嗜热子囊菌属与水分呈极显著正相关(P<0.01),与程伟等[48]对浓香型大曲真菌群落与质量指标关联性研究结果一致。未归类散囊菌目与液化力、糖化力呈极显著正相关(P<0.01),其仅为样品MQ中的优势真菌属,因此推测样品MQ液化力、糖化力最高可能与之相关。毕赤酵母菌属与水分、液化力、糖化力、淀粉含量、氨基酸态氮含量呈显著正相关(P<0.05),其具有较强产酯功能,能够生成大量酯类风味物质,是白酒酿造中一类重要的功能微生物[49]。Apiotrichum与液化力、糖化力呈显著正相关(P<0.05),目前对于Apiotrichum的研究较少,其白酒酿造中的作用有待进一步研究。
2.5 不同酒曲挥发性风味物质差异分析
由表3可知,从三种酒曲样品中共检测出22种挥发性风味物质,包括醇类7种,酸类6种,烷类3种,吡嗪类2种,酯类1种,其他类3种。从化合物种类上来看,不同酒曲间挥发性风味物质种类不同,DQ样品中14种、XQ样品中12种、MQ样品中13种。从化合物含量来看,各种挥发性风味成分在三种酒曲中的相对含量不同,酸类化合物是酒曲中含量最高的化合物。酸类化合物中含量较高的物质有乙酸、3-甲基丁酸、十六烷酸、己酸,其中乙酸含量最高,在样品DQ、XQ、MQ中的相对含量分别为12.76%、9.09%、6.51%。虽然白酒中的典型风味化合物如乙酸乙酯、己酸乙酯未检出,但大量的前体物被检出,例如:乙酸、辛酸、己酸。醇类化合物是酒曲中检测到的种类最多的风味物质,其中样品MQ中醇类化合物含量明显高于样品DQ和XQ,且苯乙醇在样品MQ中含量最高。苯乙醇是具有玫瑰花香的高级醇,是酒精发酵代谢的副产物的主要成分,为白酒的酿造贡献香气成分[50]。其次,在样品DQ和MQ中检测出了四甲基吡嗪、三甲基吡嗪、石竹烯等风味物质。四甲基吡嗪、三甲基吡嗪属于吡嗪类化合物,是白酒香气成分的重要组成物质,同时也是促进白酒特定风味形成的决定性风味物质之一[50],它具有预防心血管疾病作用,对白酒的保健功能起着重要作用[51-52]。样品MQ中石竹烯含量最高为17.83%,其为萜烯类化合物,既是构成白酒香气特征的一类重要香气化合物,也是白酒中重要的生理活性物质,具有较强的抑菌活性和抗凝血活性[53]。
表3 不同酒曲挥发性风味物质GC-MS分析结果
Table 3 Results of volatile flavor substances in different Jiuqu analysis by GC-MS
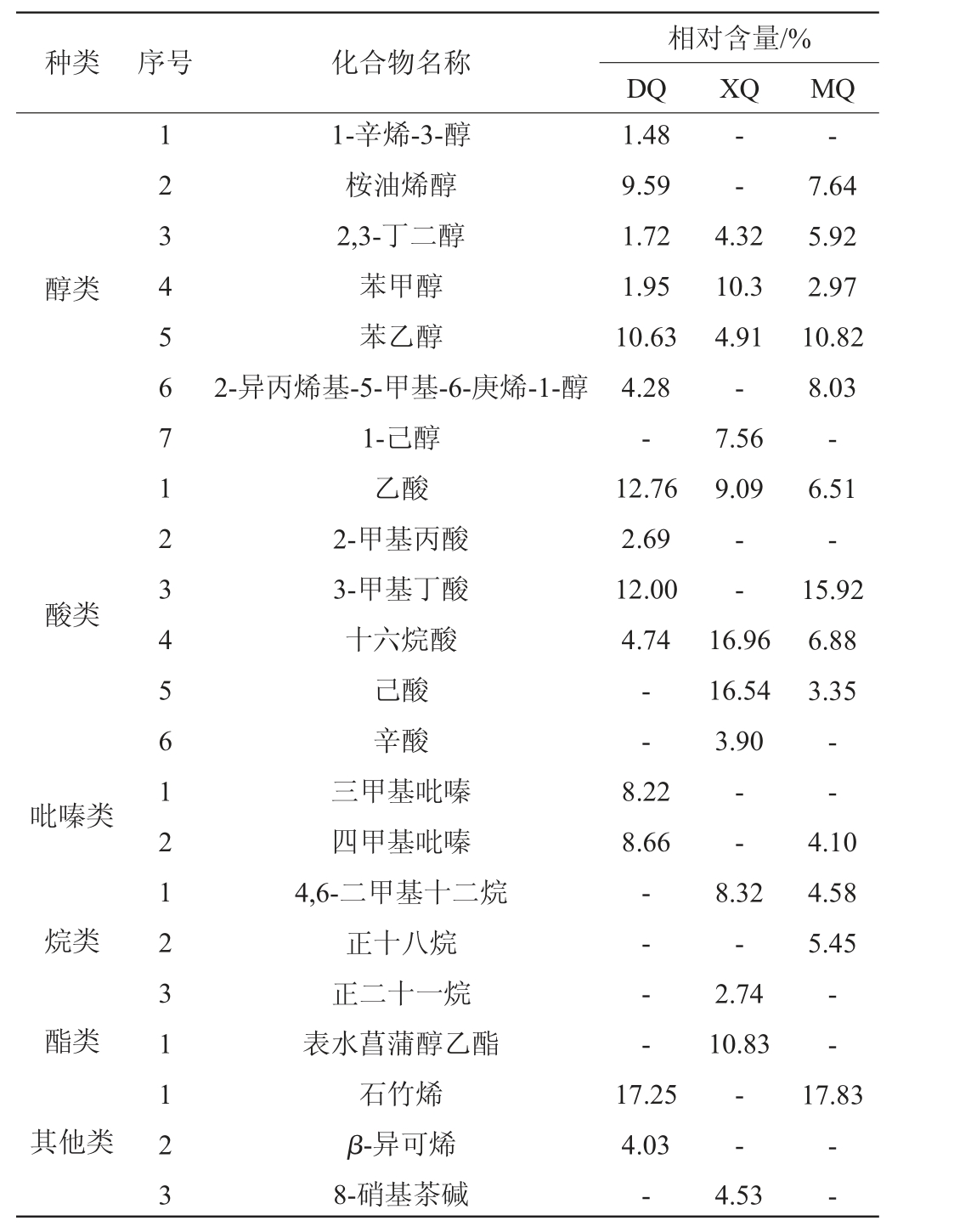
注:“-”表示未检测到。
种类 序号 化合物名称相对含量/%DQ XQ MQ---醇类4.32 10.3 4.91-7.56 9.09酸类1.48 9.59 1.72 1.95 10.63 4.28-12.76 2.69 12.00 4.74--1 2 3 4 5 6 7 1 2 3 4 5 6 1 2 1 2 3 1 1 2 3 1-辛烯-3-醇桉油烯醇2,3-丁二醇苯甲醇苯乙醇2-异丙烯基-5-甲基-6-庚烯-1-醇1-己醇乙酸2-甲基丙酸3-甲基丁酸十六烷酸己酸辛酸三甲基吡嗪四甲基吡嗪4,6-二甲基十二烷正十八烷正二十一烷表水菖蒲醇乙酯石竹烯β-异可烯8-硝基茶碱--16.96 16.54 3.90 7.64 5.92 2.97 10.82 8.03-6.51-15.92 6.88 3.35吡嗪类8.22 8.66——烷类4.10 4.58 5.45酯类-- - -8.32-2.74 10.83--17.83其他类17.25 4.03---4.53--
2.6 不同酒曲挥发性风味成分与主要微生物属间相关性分析
对三种酒曲中的挥发性风味物质与属水平上平均相对丰度前20的细菌、真菌分别进行相关性分析,结果见图8。
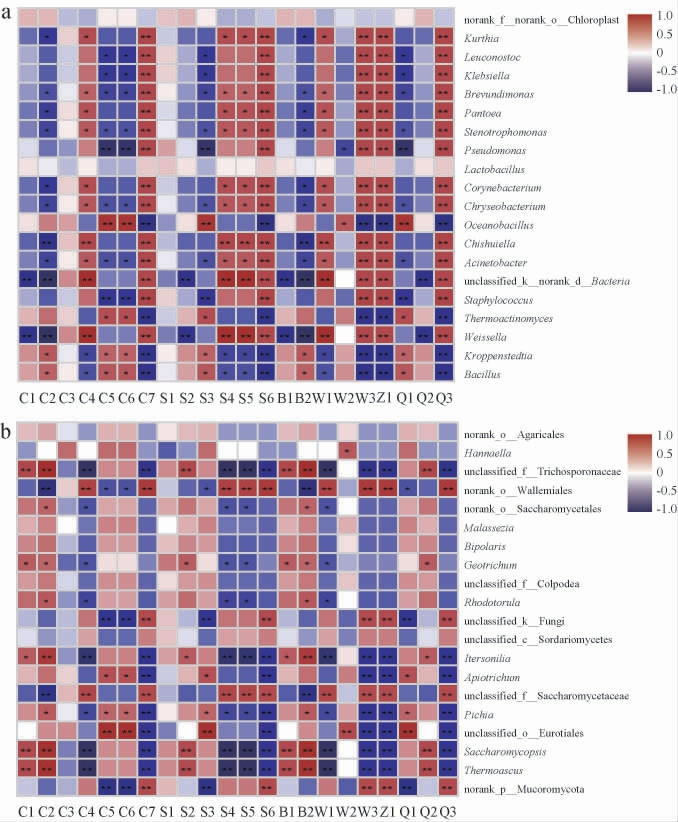
图8 不同酒曲样品主要细菌属(a)和真菌属(b)与挥发性风味物质的相关性分析热图
Fig.8 Heat maps of correlations between main bacterial genera (a)and fungal genera (b) and volatile flavor substances in different Jiuqu samples
C1:1-辛烯-3-醇;C2:桉油烯醇;C3:2,3丁二醇;C4:苯甲醇;C5:苯乙醇;C6:2-异丙烯基-5-甲基-6-庚烯-1-醇;C7:1-己醇;S1:乙酸;S2:2-甲基丙酸;S3:3-甲基丁酸;S4:十六烷酸;S5:己酸;S6:辛酸;B1:三甲基吡嗪;B2:四甲基吡嗪;W1:4,6-二甲基十二烷;W2:正十八烷;W3:正二十一烷;Z1:表水菖蒲醇乙酯;Q1:石竹烯;Q2:β-异可烯;Q3:8-硝基茶碱。
由图8可知,酒曲微生物群落结构与挥发性风味物质之间具有相关性,说明三种酒曲中的微生物群落多样性的差异是导致风味成分差异的重要原因之一。由图8a可知,与酒曲中挥发性风味物质相关性较大的细菌属有魏斯氏菌属、赤水菌属。己酸与魏斯氏菌属、赤水菌属呈极显著正相关(P<0.01),辛酸与酒曲中大多数细菌微生物呈极显著正相关(P<0.01)。四甲基吡嗪、三甲基吡嗪与魏斯氏菌属呈极显著负相关(P<0.01),这可能是XQ样品中未检测到吡嗪类物质的重要原因。由图8b可知,与酒曲中风味物质相关性较大的真菌属有嗜热子囊菌属、未归类酵母菌科、未归类散囊菌目、未归类节担菌目。四甲基吡嗪、三甲基吡嗪与嗜热子囊菌属、复膜孢酵母属呈极显著正相关(P<0.01)。1-辛烯-3醇、桉油烯醇与嗜热子囊菌属、复膜孢酵母属呈极显著正相关(P<0.01)。苯乙醇、石竹烯与海洋芽孢杆菌属呈极显著正相关(P<0.01),海洋芽孢杆菌属仅为MQ中的优势菌属,因此推断海洋芽孢杆菌属是造成MQ样品中苯乙醇、石竹烯含量最高的重要原因。
3 结论
本研究应用高通量测序技术,并结合顶空固相微萃取技术(HS-SPME)与气相色谱-质谱(GC-MS)联用的方法,对三种白酒生产酒曲的微生物群落、理化性质及挥发性风味物质进行解析,并分析其相关性。高通量测序结果表明,三种酒曲样品中共检测到10个优势细菌属和7个优势真菌属。共同优势细菌属为芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)。共同优势真菌属为复膜孢酵母属(Saccharomycopsis)、未归类毛霉菌门(norank_p__Mucoromycota)。三种酒曲中共发现11种差异细菌属和5种差异真菌属,且差异真菌属多为优势菌属。在理化性质上,三种酒曲存在差异,样品DQ在水分、淀粉含量、氨基酸态氮、酯化力上高于样品XQ和MQ,样品XQ发酵力、酸度高于样品DQ和样品MQ,样品MQ液化力、糖化力均高于DQ和XQ样品,有利于白酒出酒率。三种酒曲挥发性风味物质种类及各物质相对含量存在差异,从三种酒曲中共检测到22种挥发性风味物质,其中,DQ、XQ、MQ中分别检测出14种、12种、13种。相关性分析结果表明,部分微生物与理化指标、挥发性风味物质间存在一定的相关性。高温放线菌属与液化力、糖化力呈显著正相关(P<0.05)、海洋芽孢杆菌属与液化力、糖化力呈极显著正相关(P<0.01),苯乙醇、石竹烯与海洋芽孢杆菌属呈极显著正相关(P<0.01)。综上,不同酒曲微生物群落、理化性质、挥发性物质存在显著差异,MQ在优势真菌属、液化力、糖化力、某些挥发性风味物质等方面均优于DQ和XQ。本研究揭示混合酒曲微生物群落结构、理化指标与风味物质及之间的相关性,对后续混合酒曲在白酒酿造中的应用具有一定的指导意义。
[1]范光森,许岱,富志磊,等.古井贡酒曲中酵母的分离及其产香挥发性风味物质分析[J].中国食品学报,2018,18(7):220-229.
[2]吴树坤,谢军,程铁辕,等.不同地区浓香型大曲质量指标与细菌群落相关性研究[J].食品研究与开发,2019,40(4):158-164.
[3]XIAO C,YANG Y,LU Z M,et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiol,2021,98:103766.
[4]孙细珍,熊亚青,杜佳炜,等.不同品种高粱小曲白酒感官表征及重要风味物质对比分析[J].食品与发酵工业,2022,48(9):34-40.
[5]夏玙,谢军,黄丹,等.异常威克汉逊酵母的麸曲制作工艺优化[J].食品研究与开发,2018,39(22):118-123.
[6] LIU Y B, LI X, LI H D, et al.Taorong-type Baijiu starter: Analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].PloS One,2022,17(10):e0274881.
[7]ZHENG X W,YAN Z,NOUT M J R,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J].Int J Food Microbiol,2014,182:57-62.
[8]LIU P,ZHANG L,DU X,et al.Dynamic analysis of physicochemical and biochemical indices and microbial communities of light-flavor Daqu during storage[J].J Am Soc Brew Chem,2019,77(4):287-294.
[9]WANG Z,SU Z,YANG Q,et al.Characterizing relationship of microbial community in Xiaoqu and volatiles of light-aroma-type Xiaoqu Baijiu[J].Food Sci Technol Res,2020,26(6):749-758.
[10]向港兴,陈莹琪,沈毅,等.不同等级浓香型大曲微生物群落结构与理化性质的比较分析[J].食品科学,2022,43(18):184-191.
[11]GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[12]刘延波,刘润雨,赵志军,等.赊店老酒大曲质量差异研究[J].食品工业科技,2019,40(23):77-80,87.
[13] ZHANG C,AO Z,CHUI W Q,et al.Characterization of the aroma-active compounds in Daqu:a tradition Chinese liquor starter[J].Eur Food Res Technol,2012,234:69-76.
[14]张春林,敖宗华,炊伟强,等.顶空固相微萃取-气质联用快速测定大曲中的挥发性风味成分[J].食品科学,2011,32(10):137-140.
[15]WANG C,TANG J,QIU S.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Front Microbiol,2020,11:2103.
[16]SCHLOSS P D,GEVERS D,WESTCOTT S L.Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies[J].PloS One,2011,6(12):e27310.
[17]陈申习,宿智新,张磊,等.基于高通量测序的清香型和酱香型酒曲真菌群落特征研究[J].中国酿造,2021,40(7):49-53.
[18]ZOU Y,ZHAO P,AXMACHER J C.Estimating total species richness:Fitting rarefaction by asymptotic approximation[J].Ecosphere, 2023,14(1):e4363.
[19]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[20]SUN Z,CHEN C,HOU X,et al.Prokaryotic diversity and biochemical indexes in aging artificial pit mud used for the production of Chinese strong flavor liquor[J].3 Biotech,2017,7:1-9.
[21]王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J].食品科学,2022,43(14):264-271.
[22]张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
[23]陈蒙恩,赵聪,韩素娜.基于高通量测序的陶融型大曲微生物群落结构分析[J].食品科学,2021,42(8):106-113.
[24]SUN W,XIAO H,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Annal Microbiol,2016,66:1293-1301.
[25]冯佳婷,陆震鸣,时伟,等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报,2021,27(3):760-767.
[26]FAN G,SUN B,FU Z,et al.Analysis of physicochemical indices,volatile flavor components,and microbial community of a light-flavor Daqu[J].J Am Soc Brew Chem,2018,76(3):209-218.
[27]侯强川,王玉荣,王文平,等.茅台和尧治河高温大曲细菌群落结构差异及功能预测[J].食品与发酵工业,2022,48(1):36-44.
[28]姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业,2012,38(6):1-6.
[29]苏葛,王晓慧,董大伟,等.高通量测序技术在洋河大曲质量等级判定中的应用[J].酿酒科技,2019(1):86-90.
[30]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[31]张科,李臻,郑瑶,等.河南叶县岩盐可培养中度嗜盐菌的多样性[J].微生物学通报,2020,47(12):3987-3997.
[32]郑亚伦,赵婷,王家胜,等.数字化高温大曲发酵过程中微生物群落结构的变化[J].食品科学,2022,43(12):171-178.
[33]ZHENG X W,YAN Z,ROBERT NOUT M J,et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World J Microbiol Biotechn,2015,31:199-208.
[34]戴奕杰,李宗军,田志强.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学,2019,40(4):152-159.
[35]刘延波,王琳琳,金尚萍,等.不同储藏期浓香型白酒大曲的微生物多样性分析[J].中国酿造,2022,41(4):105-110.
[36]彭璐,明红梅,董异,等.不同曲层中高温大曲质量差异性研究[J].食品与发酵工业,2020,46(3):58-64.
[37]李斌,胡俊杰,张兰兰,等.基于高通量测序浓香型和芝麻香型白酒酒曲真菌群落结构的分析[J].中国酿造,2019,38(10):96-100.
[38]THAPA S,LI H,OHAIR J,et al.Biochemical characteristics of microbial enzymes and their significance from industrial perspectives[J].Mol Biotechnol,2019,61:579-601.
[39]YAN S B,CHEN X S,GUANG J Q.Bacterial and fungal diversity in the traditional Chinese strong flavour liquor Daqu[J].J I Brewing, 2019,125(4):443-452.
[40] YANG L, FAN W, XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical indexes to reveal the characteristics of different type daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol,2021,146:111416.
[41]丁芳,张原頔,蒋英丽,等.不同等级高温大曲微生物群落和代谢物的特征分析[J].中国酿造,2022,41(11):24-30.
[42]王晓丹,胡宝东,班世栋,等.酱香型大曲酶系与大曲中微生物产酶关系的研究[J].酿酒科技,2015(9):1-7.
[43]熊翔,余有贵,王文达,等.曲坯含水量对机压包包曲品质的动态影响[J].中国酿造,2010,29(6):141-143.
[44]王晓丹,班世栋,胥思霞,等.浓香型大曲中酶系与白酒品质的关系研究[J].中国酿造,2014,33(1):44-47.
[45]WANG Q,GUO D Y,WANG X L,et al.Comparative analysis of physiochemical indexes of Baijiu(Liquor)starter of different flavor types[J].Liquor-Making Sci Technol,2015,6:6-10.
[46] TAKEBE Y,TAKIZAKI M,TANAKA H,et al.Evaluation of the biogenic amine-production ability of lactic acid bacteria isolated from tofumisozuke[J].Food Sci Technol Res,2016,22(5):673-678.
[47]吴成,程平言,谢丹,等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学,2023,44(2):240-247.
[48]程伟,陈雪峰,陈兴杰,等.基于高通量测序解析浓香型大曲真菌群落结构及其与质量指标的关联性分析[J].食品与发酵工业,2022,48(22):194-200.
[49]施思,彭智辅,乔宗伟,等.浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析[J].食品与发酵工业,2017,43(5):76-79.
[50] SABIK H, FORTIN J, MARTIN N.Identification of pyrazine derivatives in a typical maple syrup using headspace solid-phase microextraction with gas chromatography-mass spectrometry[J].Food Chem,2012,133(3):1006-1010.
[51]吴继红,黄明泉,郑福平,等.健康白酒的研究进展[J].食品科学技术学报,2019,37(2):17-23.
[52]孙宝国,李贺贺,胡萧梅,等.健康白酒的发展趋势[J].中国食品学报,2016,16(8):1-6.
[53]DASTAN D,HAMAH-AMEEN B A,SALEHI P,et al.Chemical composition and bioactivities of essential oils from different plant parts of Ferula pseudalliacea Rech.f.as an endemic plant from Iran[J].Nat Prod Res,2022,36(5):1311-1316.