酱油生产以大豆和面粉或脱脂大豆和小麦为原料,在半开放环境下,由多种微生物共同参与发酵[1-2]。在高盐稀态发酵工艺中,一般通过使用高浓度盐水(18%~21%)来抑制杂菌污染和防止腐败发生[3-4]。虽然高盐分能够抑制腐败菌和致病菌的生长,但同时抑制了酱醪中有益微生物和酶的活性,导致发酵周期长、原料利用率低等问题发生[5-6]。另外高盐稀态发酵会直接导致最终产品盐含量过高,进而对人体健康产生负面影响。
钠摄入量过高容易导致高血压、增加心脏病和脑卒中的风险,随着消费水平的提高,减盐产品成为人们消费的新趋势。据报道,我国城乡居民平均每天食盐的摄入量高达12 g,是《中国居民膳食指南》建议值(每天摄入量≤6 g)的2倍[7]。因此,促进减盐平衡膳食行为形成,是高血压、心脏病等慢性病的有效防控措施之一。
目前,减盐酱油的生产方法有直接生产法和脱盐法[8],直接生产法成本低,但生产过程容易发生腐败,对酱油品质产生不良影响。对于减盐酱油发酵过程中腐败现象发生的机制尚未十分明晰,减盐酱油相比高盐酱油存在风味不足等问题[8]。脱盐法设备投资大、成本高,一般企业很难投资生产,且会造成酱油的营养物质和香气成分不同程度的损失[8]。张振斌[9]通过前高温、中降温、后升温的方式,在盐浓度8%、10%、12%条件下获得风味较好的减盐酱油。郭彩慧等[10]采用替代法,通过添加氯化钾和乙醇代替氯化钠,采用高盐稀态工艺,获得色、香、味整体品质高的低盐酱油。TIN H S等[11]基于Illumina HiSeq高通量测序分析及理化指标监测,研究不同盐分(12 g/100 mL、15 g/100 mL、18 g/100 mL)条件下不同发酵阶段微生物群落结构及理化指标变化规律,结果表明,盐分对微生物群落结构及理化指标有明显影响。杨希[12]采用高通量测序技术对不同发酵时间蚕豆酱的原核微生物多样性进行分析,结果表明,盐浓度不仅会影响pH、总酸、氨基酸态氮和还原糖含量,还会影响原核微生物的多样性和组成。解双瑜等[13]研究了盐分对东北农家酱品质的影响,结果表明,过高或过低的盐浓度都会降低东北农家酱的品质,结合感官评价与理化指标可知,盐浓度为10%比较适合东北农家酱的发酵。
本研究采用广式高盐稀态酱油发酵工艺,在酱醪发酵阶段,添加不同浓度的盐水,通过理化指标检测、挥发性风味成分测定、感官评价对发酵酱油的品质进行分析,同时采用高通量测序技术分析不同盐浓度条件下酱醪中的微生物菌群组成的变化,并探讨减盐条件下,酱醪中微生物的群落组成和酱醪发生腐败的关系,为在减盐条件下开发针对性的发酵调控技术提供理论支持。
1 材料与方法
1.1 材料与试剂
酱油成曲:李锦记(新会)食品有限公司;盐酸、葡萄糖、氧化钠、甲醛、重铬酸钾(均为分析纯):中国医药(集团)上海化学试剂公司;聚合酶链式反应(polymerase chain reaction,PCR)相关试剂:日本TOYOBO公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)凝胶提取试剂盒:美国Axygen公司;101定性滤纸:杭州双新滤纸有限公司。
1.2 仪器与设备
N4紫外可见光分光光度计:上海仪电分析仪器有限公司;MA35水分测定仪:德国赛多利斯公司;PAL-α Brix计:日本ATAGO公司;7820-5977B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪、VF-WAXms毛细管色谱柱(60 m×0.25 mm×0.50 μm)、50/30 μm DVB/CAR/PDMS固相微萃取纤维头:美国安捷伦公司;SKD-800自动凯氏定氮仪:上海沛欧仪器有限公司;FIVEEASY pH计:瑞士梅特勒-托利多集团;NanoDrop 2000微量分光光度计:赛默飞世尔科技公司;ETC811 PCR仪:苏州东胜兴业科学仪器有限公司;Tanon-2500凝胶成像系统:上海天能科技有限公司;DYY-6C琼脂糖凝胶电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 酱油酱醪的制备及取样
先配制不同盐浓度(9%、12%、15%、18%、21%)的盐水,再以酱油成曲:盐水按照1∶2.3(g∶mL)料水比配制发酵酱醪,编号分别为s9、s12、s15、s18、s21,在室温环境中进行发酵,每隔1 d搅拌1次,每个盐浓度做3个平行样。取样前将酱醪搅拌均匀,在发酵第90天时取样,-80 ℃保存,酱油成曲及酱醪样品委托广州基迪奥生物科技有限公司对微生物菌群的16S rRNA及ITS扩增子进行测序[14]。发酵90 d后,各酱醪样品用滤纸过滤后,取酱油样品用于常规理化指标测定、挥发性风味成分分析及感官评价。
1.3.2 酱油品质分析
(1)酱油理化指标的测定
氨基酸态氮(amino acid nitrogen,AAN)、无盐固形物、总酸、氯化钠含量:按照GB 18186—2000《酿造酱油》的方法测定;pH值:使用pH计直接测定;还原糖含量:按照GB 5009.7—2016《食品中还原糖的测定》的方法测定。
(2)酱油的感官评价
由5位酱油专业人员按GB 18186—2000《酿造酱油》的感官评价方法进行评定(满分10分,最低0分),去掉最高和最低分后,取平均值。
(3)酱油中挥发性风味成分的测定
固相微萃取:称取0.6 g氯化钠于5 mL顶空样品瓶中,萃取条件参考文献[14]。气相色谱-质谱条件:参考文献[14]。在美国国家标准与技术研究院(national institute of standards and technology,NIST)17谱库对未知化合物进行检索并计算匹配度,选取正反匹配度均>80(最大值为100)的物质进行定性。采用面积归一化法进行定量。
1.3.3 酱油成曲及酱醪中微生物菌群高通量测序分析
使用Axygen DNA提取试剂盒提取微生物基因组DNA,参考文献[14-15]对细菌菌群的16S rDNA基因序列及真菌菌群的ITS基因序列进行PCR扩增,并采用Illumina Novaseq 6000平台进行高通量测序。
1.3.4 数据处理
扩增子测序数据处理参考文献[14]。使用PAST 4.09软件绘图[16],使用SPSS 23进行显著性统计分析。
2 结果与分析
2.1 酱油品质分析
2.1.1 理化指标
由表1可知,不同盐浓度条件下发酵酱油样品的理化指标有差异。减盐酱油样品s9和s12的总酸含量(2.01g/100mL、1.59 g/100 mL)偏高,pH值(4.30、4.46)偏低。减盐酱油样品s12和s15的AAN(0.93 g/100 mL、0.92 g/100 mL)和无盐固形物(15.83%、15.90%)含量较高,无显著差异(P>0.05),说明在适当的减盐条件下,可以提高出品率和原料利用率,分析原因可能是盐分对曲料中的酶活力抑制力降低。酱油样品中的还原糖含量则随酱醪盐浓度的升高而升高,说明随着盐浓度的增加,抑制了微生物的繁殖,相应的底物消耗减少。
表1 不同盐浓度条件下发酵酱油样品的理化指标
Table 1 Physicochemical indexes of soy sauce samples fermented at different salt concentrations
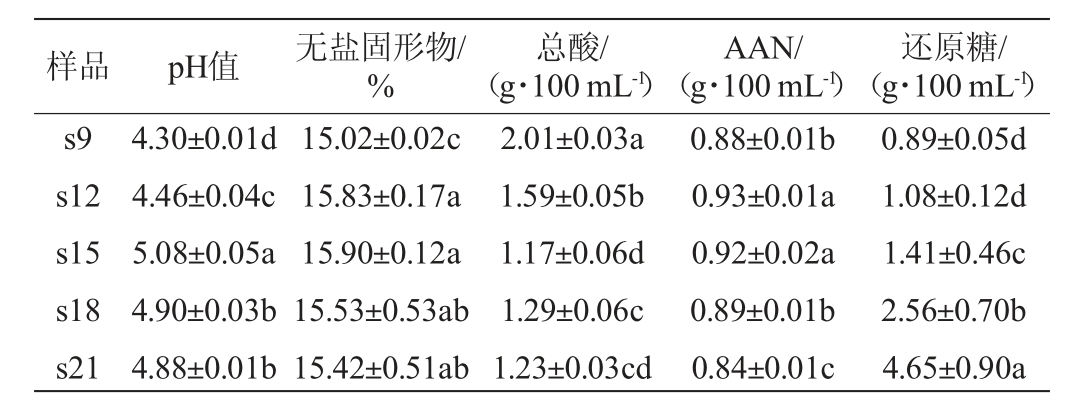
注:不同字母表示差异显著(P<0.05)。
样品 pH值 无盐固形物/%总酸/(g·100 mL-1)AAN/(g·100 mL-1)还原糖/(g·100 mL-1)s9 s12 s15 s18 s21 4.30±0.01d 4.46±0.04c 5.08±0.05a 4.90±0.03b 4.88±0.01b 15.02±0.02c 15.83±0.17a 15.90±0.12a 15.53±0.53ab 15.42±0.51ab 2.01±0.03a 1.59±0.05b 1.17±0.06d 1.29±0.06c 1.23±0.03cd 0.88±0.01b 0.93±0.01a 0.92±0.02a 0.89±0.01b 0.84±0.01c 0.89±0.05d 1.08±0.12d 1.41±0.46c 2.56±0.70b 4.65±0.90a
2.1.2 感官评价
由表2可知,减盐酱油样品s9和s12的感官评分较低,特别是样品s9,其呈酸臭味,香气和滋味得分均为0分。而减盐酱油样品s15的滋味(7.93分)及整体评价得分(8.03分)最高,其香气(8.07分)、色泽(7.50分)、体态方面得分(7.77分)也较高。香气方面,高盐酱油样品s18的得分最高(8.10分),而样品s21香气得分(7.20分)低于减盐酱油样品s15,这可能与其盐分过高抑制了产香微生物的生长有关,说明酱油发酵中并非盐分越高,酱油品质越好。另外,因盐浓度较高,样品s18和s21的滋味偏咸,滋味评分(7.00分、6.00分)相对样品s15较低。综上,减盐酱油样品s15的感官品质较好。
表2 不同盐浓度条件下发酵酱油样品的感官评分
Table 2 Sensory scores of soy sauce samples fermented at different salt concentrations

样品 色泽/分 香气/分 滋味/分 体态/分 整体评价/分s9 s12 s15 s18 s21 4.83±0.24 6.33±0.47 7.50±0 7.87±0.19 7.93±0.09 0±0 4.17±0.85 8.07±0.42 8.10±0.14 7.20±0.28 0±0 5.67±0.24 7.93±0.33 7.00±0 6.00±0 5.33±0.47 6.33±0.47 7.77±0.33 7.67±0.47 7.83±0.41 1.83±0.62 5.93±0.09 8.03±0.39 7.67±0.47 7.17±0.24
2.1.3 挥发性风味成分
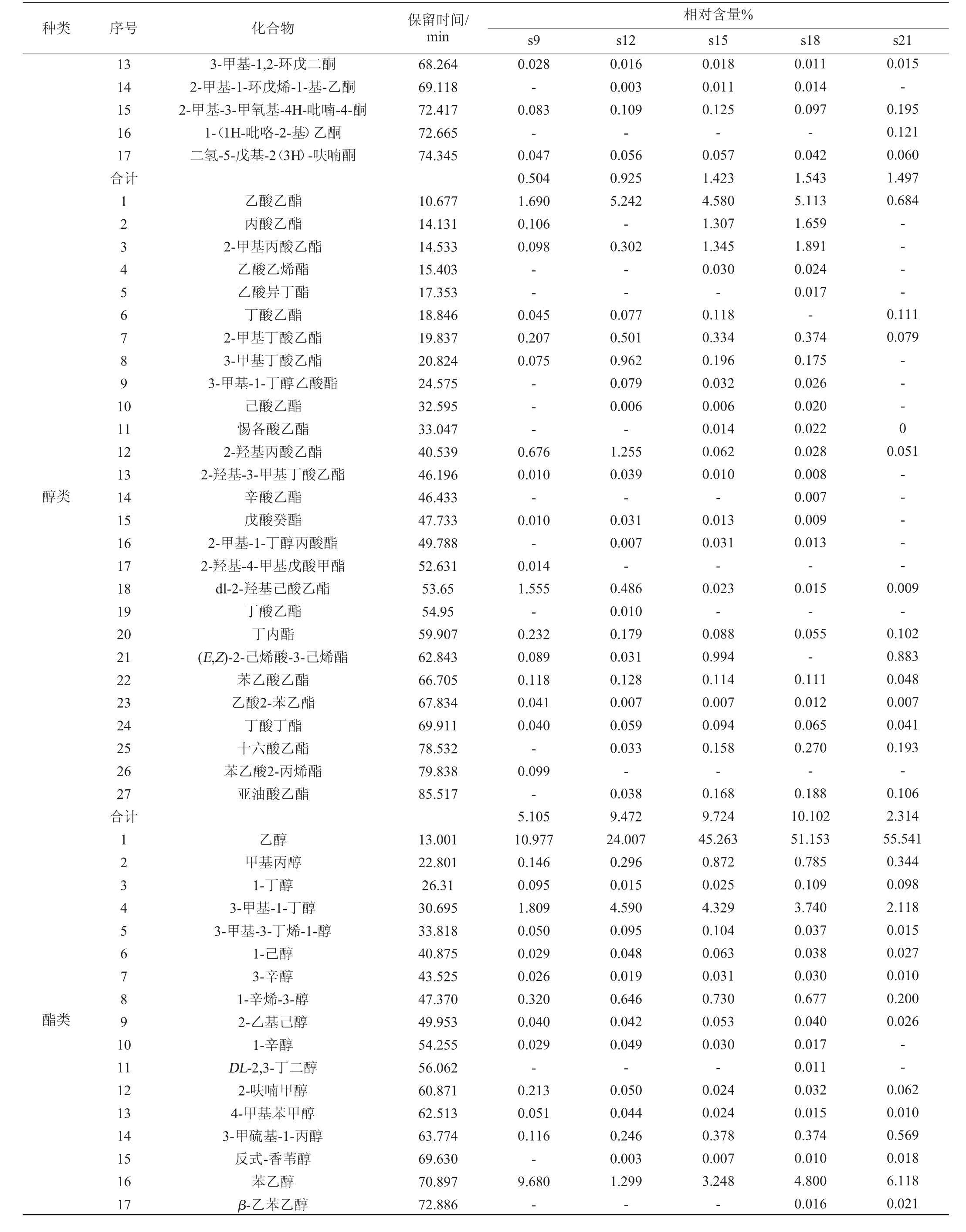
由表3可知,从酱油样品中共检出121种挥发性风味物质,包括醇类19种、酯类27种、醛类16种、酸类18种、酮类17种、酚类8种、吡嗪类5种、其他类11种。5种酱油样品中共有的挥发性风味物质为56种,样品s9~s21中这56种挥发性风味物质的相对含量分别为94.720%、96.761%、93.335%、94.175%、97.844%,说明这56种挥发性风味物质为酱油中的主体风味物质,但高盐酱油样品与减盐酱油样品中挥发性风味物质的组成有较大差异。在减盐酱油样品s9中,酸类物质的相对含量达46.565%,其中3-甲基丁酸相对含量高达35.028%,因其含量过高,导致酱油呈酸臭气味[17]。而在高盐酱油样品如s18中,酸类物质的相对含量只有2.728%。除此之外,减盐酱油样品s9中还检出噻唑,其是一种具有恶臭味的物质[18],但在其他样品中没有检出。在高盐酱油样品s18、s21中醇类物质的相对含量更高,样品s21中醇类物质的相对含量高达65.473%。其中酱油中的重要风味物质乙醇、苯乙醇、4-乙基-2-甲氧基-苯酚、4-乙基-苯酚的相对含量在高盐酱油样品中的相对含量明显更高,这些物质可能是高盐酱油样品香气得分高的重要原因。酯类物质也是酱油中重要的香气物质,其在减盐酱油样品s9中的相对含量较低,只有5.105%。但在高盐酱油样品s21中相对含量更低,只有2.313%,这可能与高盐导致酯类合成微生物(酵母类)生长受到抑制有关[19]。挥发性风味物质组成的不同很大程度上影响酱油品质的高低,甚至影响酱油风格的形成[20]。
表3 不同盐浓度条件下发酵酱油样品挥发性风味成分GC-MS分析结果
Table 3 Results of volatile flavor components in soy sauce samples fermented at different salt concentrations analyzed by GC-MS

种类 序号 化合物 保留时间/min相对含量%s9 s12 s15 s18 s21醛类酮类1234567891 0 11 12 13 14 15 16合计1234567891 0 11 12乙醛2-甲基丙醛2-甲基丁醛3-甲基丁醛2-丁烯醛2-甲基-2-己烯醛3-甲基己醛辛醛2-辛烯醛壬醛糠醛苯甲醛丁醛苯乙醛3,4-二甲基苯甲醛α-亚乙基-苯乙醛丙酮2-丁酮2-戊酮3-戊烯-2-酮1,2-环己二酮5-甲基-2(5H)-呋喃酮3-辛酮羟基丙酮2-呋喃基乙酮3-己酮二氢-5-甲基-2(3H)-呋喃酮5-乙基二氢-2(3H)-呋喃酮5.829 8.038 11.833 12.048 19.336 28.982 29.246 36.733 46.571 43.982 49.094 53.104 58.354 60.464 68.027 71.657 8.154 11.255 15.265 25.258 31.224 30.403 34.193 38.176 51.733 52.807 58.684 63.620 0.256 0.045 0.353 0.628-- - -0.009 0.038 6.755 13.926-0.385 0.087 0.121 22.603 0.174 0.138-- - - - - - -0.034-5.008 0.106 0.738 1.046-0.005 0.008 0.008 0.018 0.063 1.918 16.143-0.693 0.076 0.069 25.899 0.378 0.101-0.079-0.008 0.030-- -0.115 0.030 6.076 0.221 1.931 3.185 0.214 0.165--0.020 0.009 0.351 2.114 0.019 0.793 0.064 1.179 16.341 0.312 0.502 0.027 0.031 0.015 0.056 0.016-0.010 0.157 0.053 0.033 5.049 0.186 1.614 2.561 0.083 0.112--0.004 0.004 0.317 1.346 0.015 0.593 0.045 0.938 12.867 0.576 0.486 0.014 0.029 0.010 0.076 0.007 0.007-0.128 0.025 0.021 1.914-0.458 1.251-0.008-- - -0.524 0.771 0.012 1.098 0.025 0.807 6.868 0.635 0.053-0.037-0.015-0.027-0.266 0.035 0.038
续表
种类 序号 化合物 保留时间/min相对含量%s9 s12 s15 s18 s21醇类酯类13 14 15 16 17合计1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27合计1234567891 0 11 12 13 14 15 16 17 3-甲基-1,2-环戊二酮2-甲基-1-环戊烯-1-基-乙酮2-甲基-3-甲氧基-4H-吡喃-4-酮1-(1H-吡咯-2-基)乙酮二氢-5-戊基-2(3H)-呋喃酮乙酸乙酯丙酸乙酯2-甲基丙酸乙酯乙酸乙烯酯乙酸异丁酯丁酸乙酯2-甲基丁酸乙酯3-甲基丁酸乙酯3-甲基-1-丁醇乙酸酯己酸乙酯惕各酸乙酯2-羟基丙酸乙酯2-羟基-3-甲基丁酸乙酯辛酸乙酯戊酸癸酯2-甲基-1-丁醇丙酸酯2-羟基-4-甲基戊酸甲酯dl-2-羟基己酸乙酯丁酸乙酯丁内酯(E,Z)-2-己烯酸-3-己烯酯苯乙酸乙酯乙酸2-苯乙酯丁酸丁酯十六酸乙酯苯乙酸2-丙烯酯亚油酸乙酯乙醇甲基丙醇1-丁醇3-甲基-1-丁醇3-甲基-3-丁烯-1-醇1-己醇3-辛醇1-辛烯-3-醇2-乙基己醇1-辛醇DL-2,3-丁二醇2-呋喃甲醇4-甲基苯甲醇3-甲硫基-1-丙醇反式-香苇醇苯乙醇β-乙苯乙醇68.264 69.118 72.417 72.665 74.345 10.677 14.131 14.533 15.403 17.353 18.846 19.837 20.824 24.575 32.595 33.047 40.539 46.196 46.433 47.733 49.788 52.631 53.65 54.95 59.907 62.843 66.705 67.834 69.911 78.532 79.838 85.517 13.001 22.801 26.31 30.695 33.818 40.875 43.525 47.370 49.953 54.255 56.062 60.871 62.513 63.774 69.630 70.897 72.886 0.028-0.083-0.047 0.504 1.690 0.106 0.098--0.045 0.207 0.075-- -0.676 0.010-0.010-0.014 1.555-0.232 0.089 0.118 0.041 0.040-0.099-5.105 10.977 0.146 0.095 1.809 0.050 0.029 0.026 0.320 0.040 0.029-0.213 0.051 0.116-9.680-0.016 0.003 0.109-0.056 0.925 5.242-0.302--0.077 0.501 0.962 0.079 0.006-1.255 0.039-0.031 0.007-0.486 0.010 0.179 0.031 0.128 0.007 0.059 0.033-0.038 9.472 24.007 0.296 0.015 4.590 0.095 0.048 0.019 0.646 0.042 0.049-0.050 0.044 0.246 0.003 1.299-0.018 0.011 0.125-0.057 1.423 4.580 1.307 1.345 0.030-0.118 0.334 0.196 0.032 0.006 0.014 0.062 0.010-0.013 0.031-0.023-0.088 0.994 0.114 0.007 0.094 0.158-0.168 9.724 45.263 0.872 0.025 4.329 0.104 0.063 0.031 0.730 0.053 0.030-0.024 0.024 0.378 0.007 3.248-0.011 0.014 0.097-0.042 1.543 5.113 1.659 1.891 0.024 0.017-0.374 0.175 0.026 0.020 0.022 0.028 0.008 0.007 0.009 0.013-0.015-0.055-0.111 0.012 0.065 0.270-0.188 10.102 51.153 0.785 0.109 3.740 0.037 0.038 0.030 0.677 0.040 0.017 0.011 0.032 0.015 0.374 0.010 4.800 0.016 0.015-0.195 0.121 0.060 1.497 0.684-- - -0.111 0.079-- - 0 0.051-- - - -0.009-0.102 0.883 0.048 0.007 0.041 0.193-0.106 2.314 55.541 0.344 0.098 2.118 0.015 0.027 0.010 0.200 0.026--0.062 0.010 0.569 0.018 6.118 0.021
续表
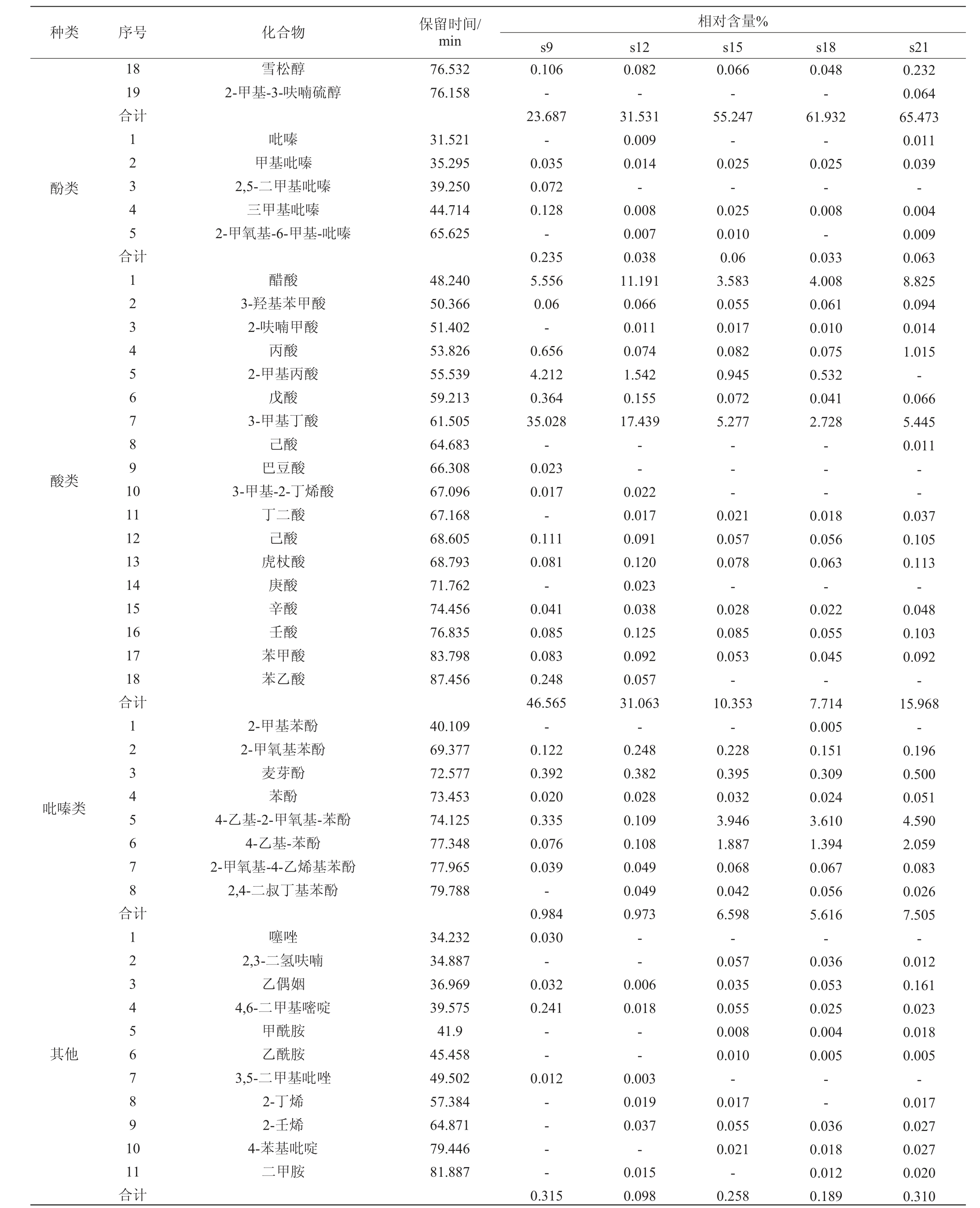
注:“-”表示未检出。
种类 序号 化合物 保留时间/min 18 19合计雪松醇2-甲基-3-呋喃硫醇76.532 76.158酚类12345合吡嗪甲基吡嗪2,5-二甲基吡嗪三甲基吡嗪2-甲氧基-6-甲基-吡嗪31.521 35.295 39.250 44.714 65.625酸类计1234567891 0 11 12 13 14 15 16 17 18合计醋酸3-羟基苯甲酸2-呋喃甲酸丙酸2-甲基丙酸戊酸3-甲基丁酸己酸巴豆酸3-甲基-2-丁烯酸丁二酸己酸虎杖酸庚酸辛酸壬酸苯甲酸苯乙酸48.240 50.366 51.402 53.826 55.539 59.213 61.505 64.683 66.308 67.096 67.168 68.605 68.793 71.762 74.456 76.835 83.798 87.456吡嗪类12345678合2-甲基苯酚2-甲氧基苯酚麦芽酚苯酚4-乙基-2-甲氧基-苯酚4-乙基-苯酚2-甲氧基-4-乙烯基苯酚2,4-二叔丁基苯酚40.109 69.377 72.577 73.453 74.125 77.348 77.965 79.788其他计1234567891 0 11合计噻唑2,3-二氢呋喃乙偶姻4,6-二甲基嘧啶甲酰胺乙酰胺3,5-二甲基吡唑2-丁烯2-壬烯4-苯基吡啶二甲胺34.232 34.887 36.969 39.575 41.9 45.458 49.502 57.384 64.871 79.446 81.887相对含量%s9 s12 s15 s18 s21 0.106-23.687-0.035 0.072 0.128-0.235 5.556 0.06-0.656 4.212 0.364 35.028-0.023 0.017-0.111 0.081-0.041 0.085 0.083 0.248 46.565-0.122 0.392 0.020 0.335 0.076 0.039-0.984 0.030-0.032 0.241 0.082-31.531 0.009 0.014-0.008 0.007 0.038 11.191 0.066 0.011 0.074 1.542 0.155 17.439 0.066-55.247-0.025-0.025 0.010 0.06 3.583 0.055 0.017 0.082 0.945 0.072 5.277 0.048-61.932-0.025-0.008-0.033 4.008 0.061 0.010 0.075 0.532 0.041 2.728--0.232 0.064 65.473 0.011 0.039-0.004 0.009 0.063 8.825 0.094 0.014 1.015-0.066 5.445 0.011 0.022 0.017 0.091 0.120 0.023 0.038 0.125 0.092 0.057 31.063-0.248 0.382 0.028 0.109 0.108 0.049 0.049 0.973-- --- ——-0.006 0.018——0.018 0.056 0.063-0.022 0.055 0.045-7.714 0.005 0.151 0.309 0.024 3.610 1.394 0.067 0.056 5.616-0.036 0.053 0.025 0.004 0.005 0.012-- - ---0.315 0.003 0.019 0.037-0.015 0.098 0.021 0.057 0.078-0.028 0.085 0.053-10.353-0.228 0.395 0.032 3.946 1.887 0.068 0.042 6.598-0.057 0.035 0.055 0.008 0.010-0.017 0.055 0.021-0.258 0.036 0.018 0.012 0.189 0.037 0.105 0.113-0.048 0.103 0.092-15.968-0.196 0.500 0.051 4.590 2.059 0.083 0.026 7.505-0.012 0.161 0.023 0.018 0.005-0.017 0.027 0.027 0.020 0.310
2.2 不同盐浓度条件下发酵酱醪样品中微生物群落分析
2.2.1 不同盐浓度酱醪中真菌群落组成分析
通过对酱油成曲及酱醪样品中真菌菌群的ITS基因序列进行高通量测序,18个样品共获得1 162 425条Reads,每个样品至少产生60 640条Clean Reads,平均产生64 579条Clean Reads。各样品平均获得63 615条有效Tags,Tags的总碱基长度平均值为21 371 144 bp,最长Tag的碱基长度为440 bp,最短Tag的碱基长度为222 bp,各样品Goods Coverage均在0.999以上,说明数据采集具有足够的完整性及代表性。经分类学注释,共注释到3个真菌门和13个真菌属(至少在1个样本中相对丰度>0.01%的真菌门和真菌属)。基于门水平和属水平,不同盐浓度酱醪样品中微生物真菌菌群的相对丰度见图1。
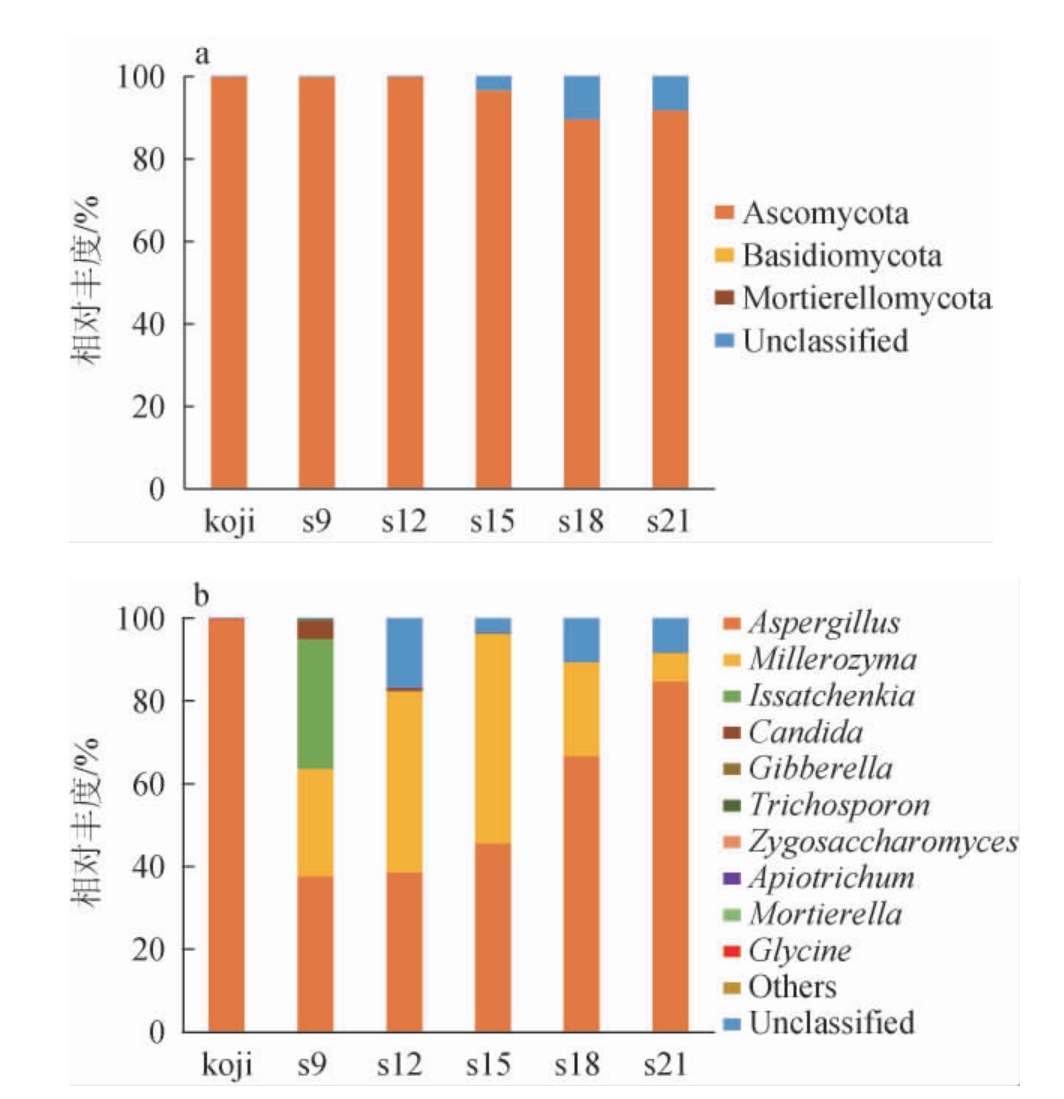
图1 基于门(a)和属(b)水平酱油成曲及不同盐浓度酱醪样品中真菌菌群结构
Fig.1 Fungal flora structure in sauce finished koji and sauce mash samples with different salt concentrations at phylum (a) and genus (b) level
Others:相对丰度排名10之后已归类的真菌属。
由图1a可知,各样品中的真菌门主要为子囊菌门(Ascomycota)(89.52%~99.89%),其次是担子菌门(Basidiomycota)(0.01%~0.17%)和被孢霉门(Mortierellomycota)(0.01%~0.08%)。由图1b可知,酱油成曲中,曲霉属(Aspergillus)的相对丰度达到99.8%,其次为米勒酵母属(Millerozyma)(0.02%)。发酵酱醪样品中相对丰度较高的真菌属为曲霉属(Aspergillus)(37.69%~84.70%)、米勒氏酵母属(Millerozyma)(6.96%~50.58%)、伊萨酵母属(Issatchenkia)(0~31.37%)、假丝酵母菌属(Candida)(0~4.21%)、赤霉属(Gibberella)(0.02%~0.37%)、毛孢子菌属(Trichosporon)(0~0.16%)、接合酵母属(Zygosaccharomyces)(0~0.11%)和被孢霉属(Mortierella)(0~0.02%)。
曲霉属(Aspergillus)是所有样品中的优势真菌,来源于人工接种,是重要的蛋白质和淀粉的分解菌,也是整个发酵过程的优势菌种,与文献[21]报道相符。其次,酵母是主要真菌微生物,包括米勒氏酵母属(Millerozyma)、伊萨酵母属(Issatchenkia)、假丝酵母菌属(Candida)、接合酵母属(Zygosaccharomyces)。这些酵母菌在不同盐浓度酱醪中的相对丰度有明显差异,其中低盐酱醪样品s9中伊萨酵母属(Issatchenkia)的相对丰度达到31.37%,远高于其他样品。有研究表明,伊萨酵母是白酒发酵过程中的风味酵母[22],但其代谢产物及作用在酱油研究中未见相关报道。米勒氏酵母属(Millerozyma)、假丝酵母菌属(Candida)和接合酵母属(Zygosaccharomyces)是酱油发酵过程中的重要风味产生菌[23-25],这些菌属的相对丰度在高盐酱醪样品s21中的相对丰度(6.96%、0.01%、0)明显低于其他样品中的相对丰度(26.0%~50.58%、0.02%~4.21%、0.01%~0.12%),说明过高的盐浓度会明显抑制酱油风味酵母的繁殖。
2.2.2 不同盐浓度酱醪中细菌群落组成分析
通过对酱油成曲及酱醪样品中细菌菌群的16S rDNA基因序列进行高通量测序,18个样品共获得1 161 235条Reads,每个样品至少产生60 054条Clean Reads,平均产生64 481条Clean Reads。各样品平均获得62 104条有效Tags,有效Tags的总碱基长度平均值为28 280 255 bp,最长Tag的碱基长度为460 bp,最短Tag的碱基长度为235 bp,各样品的Goods Coverage均在0.999以上,说明数据采集具有足够的完整性及代表性。经分类学注释,共注释到5个细菌门和23个细菌属(至少在1个样本中相对丰度>0.01%的细菌门和细菌属)。基于门水平和属水平,不同盐浓度酱醪中微生物细菌菌群的相对丰度见图2。
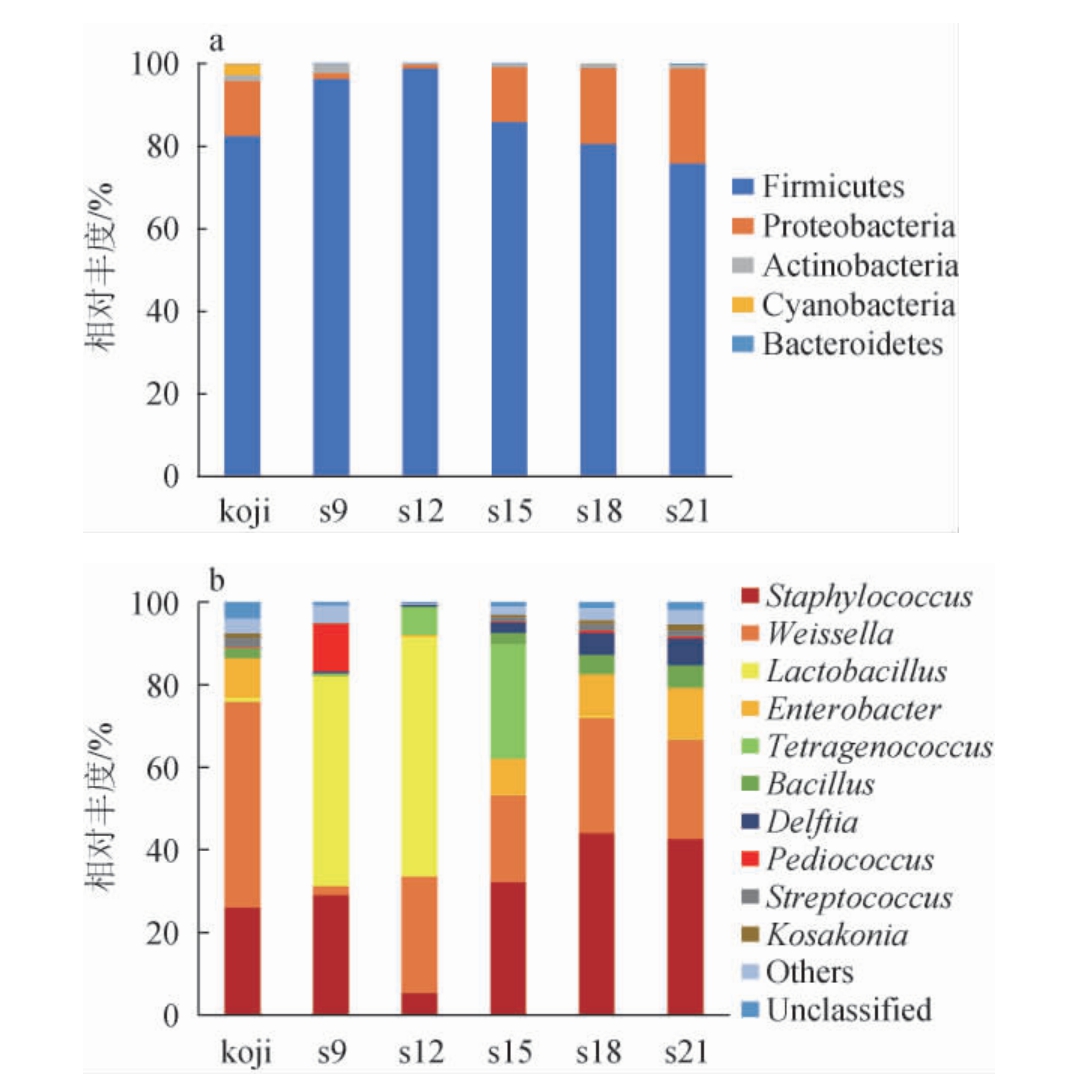
图2 基于门(a)和属(b)水平酱油成曲及不同盐浓度酱醪样品中细菌菌群结构
Fig.2 Bacterial flora structure in soy sauce finished koji and sauce mash samples with different salt concentrations at phylum (a)and genus (b) level
Others:相对丰度排名10之后已归类的细菌属。
由图2a可知,各样品中的细菌门有厚壁菌门(Firmicutes)(75.94%~98.87%)、变形菌门(Proteobacteria)(0.99%~22.99%)、放线菌门(Actinobacteria)(0.12%~2.17%)、蓝细菌(Cyanobacteria)(0~2.72%)、拟杆菌门(Bacteroidetes)(0.01%~0.24%)。由图2b可知,酱油成曲中,相对丰度最高的细菌属为魏斯氏菌属(Weissella)(49.78%),其次为葡萄球菌属(Staphylococcus)(26.14%)、肠杆菌属(Enterobacter)(9.55%)、芽胞杆菌属(Bacillus)(2.50%)、链球菌属(Streptococcus)(2.30%)、考氏科萨克氏菌属(Kosakonia)(1.07%)、乳杆菌属(Lactobacillus)(0.90%)和片球菌属(Pediococcus)(0.21%)。不同盐浓度发酵酱醪样品中相对丰度较高的细菌属为葡萄球菌属(Staphylococcus)(5.48%~44.12%)、魏斯氏菌属(Weissella)(2.14%~28.14%)、乳杆菌属(Lactobacillus)(0.12%~58.01%)、肠杆菌属(Enterobacter)(0.09%~12.18%)、四联菌属(Tetragenococcus)(0.02%~27.81%)、片球菌属(Pediococcus)(0.02%~11.63%)、芽胞杆菌属(Bacillus)(0.14%~5.46%)、代尔夫特菌属(Delftia)(0.48%~6.52%)、链球菌属(Streptococcus)(0.04%~1.49%)和考氏科萨克氏菌属(Kosakonia)(0.01%~1.39%)。
不同盐浓度酱醪样品中,各细菌属的相对丰度有明显差异。其中在低盐酱醪样品s9(50.68%)和s12(58.01%)中乳杆菌属(Lactobacillus)的相对丰度明显高于其他样品。结合酱油样品s9和s12的理化指标总酸显著高于其他样品,说明乳杆菌属可能是造成酱醪在减盐条件下酸败的重要原因。低盐酱醪样品s9中片球菌属(Pediococcus)的相对丰度(11.63%)显著高于其他样品,其是酱油中的一类重要的乳酸菌,除了产酸外,还可提高食品中有机酸、醛类和酯类等风味物质含量[26]。结合酱油理化指标发现,低盐酱油样品s9的总酸含量(2.01 g/100 mL)比样品S12的总酸含量(1.59 g/100 mL)更高,感官评分更低,说明该菌的过度繁殖亦可能是造成酱醪酸败的重要原因。
葡萄球菌属(Staphylococcus)在酱醪样品s9(29.14%)、s15(32.30%)、s18(44.12%)、s21(42.64%)中都具有较高的相对丰度,但酱醪样品s15、s18、s21没有发生腐败,因此推测其不是酱醪的腐败菌。有研究表明,葡萄球菌属(Staphylococcus)如肉葡萄球菌(Staphylococcus carnosus),是豆类发酵食品风味的主要贡献者之一,其主要参与酸性化合物和氨基酸的生成[27]。魏斯氏菌属(Weissella)在酱醪样品s12(28.14%)、s15(21.0%)、s18(27.97%)、s21(24.23%)中都具有较高相对丰度,但酱醪样品s15、s18、s21没有发生腐败,因此说明其亦不是酱醪的腐败菌。研究表明,魏斯氏菌属(Weissella)是多种风味物的重要产生菌,对食品有机酸、酯类和短链脂肪酸等风味物质的生成有着重要的意义[28]。四联球菌属(Tetragenococcus)在酱醪样品s15中的相对丰度达到27.81%,显著高于其他样品。杨希飞[29]采用添加嗜盐四联球菌(Tetragenococcus halophilus)改善酱油风味及降低了酱油中氨基甲酸乙酯(ethyl carbamate,EC)的含量。肠杆菌属(Enterobacter)在酱醪样品s15(8.73%)、s18(10.14%)、s21(12.18%)和酱油成曲(9.55%)中有较高相对丰度,在酱醪样品s9(0.09%)、s12(0.44%)中相对丰度较低,说明该菌是酱醪中的风味产生菌,非腐败菌。这类菌发酵葡萄糖产酸或产气,可将硝酸盐还原成亚硝酸盐[24]。芽孢杆菌属(Bacillus)在酱醪样品s15(2.60%)、s18(4.72%)、s21(5.46%)和酱油成曲(2.5%)中有较高相对丰度,在酱醪样品s9(0.14%)、s12(0.27%)中相对丰度较低,说明该菌亦非腐败菌。有研究表明,在酱油发酵过程中该菌可以协助真菌分解原料中蛋白质和淀粉,是酱油中酱香风味成分形成的基础和关键[30]。代尔夫特菌属(Delftia)、链球菌属(Streptococcus)和考氏科萨克氏菌属(Kosakonia)在酱醪样品s9中的相对丰度分别为0.48%、0.04%、0.01%;其相对丰度随酱醪盐度升高而上升,在酱醪样品s21中分别达到6.52%、1.44%、1.39%,说明这3种菌均为非腐败菌。
3 结论
在减盐条件下,如盐浓度9%、12%条件下,酱醪会发生酸败现象,表现为总酸含量过高,风味较差,感官评分低。呈酸臭气味的物质主要是酸类物质,主要有3-甲基丁酸、2-甲基丙酸、醋酸等。在盐浓度为9%条件下,酱醪中还检出恶臭物质噻唑。当盐浓度≥15%时,可以抑制腐败菌的过度繁殖,从而避免酱醪发生酸败。当酱醪中盐浓度过高(如21%),会抑制有益微生物的生长及降低原料利用率,表现为酯类物质相对含量的的减少和酱油氨基酸态含量的降低,从而影响酱油品质。综合理化指标、挥发性风味成分、感官评价分析,酱醪盐浓度为15%最好。通过高通量测序分析,发现乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)两种细菌的过度繁殖是减盐条件下导致酱醪酸败的重要原因。
[1]胡传旺.酱油发酵过程微生物群落解析及功能研究[D].无锡:江南大学,2017.
[2]谢小保,欧阳友生,曾海燕,等.高盐稀醪酱油发酵原油中微生物区系研究[J].微生物学通报,2007,34(3):204-507.
[3]鲁肇元,唐娟娟.传统工艺与酱油行业的发展[J].中国酿造,2009,28(11):5-10.
[4]包启安.酱油科学与酿造技术[M].北京:中国轻工业出版社,2011:345-448.
[5]朱莉,许长华.酱油关键风味物质及其功能与发酵工艺研究进展[J].食品与发酵工业,2018,44(6):287-292.
[6]庄海宁,许滢,李明明,等.高盐稀态酱油酱渣的挥发性风味成分分析[J].中国食品添加剂,2022,33(12):225-232.
[7]中国营养学会.中国居民膳食指南2016[M].北京:人民卫生出版社,2016:166-254.
[8]蒋木培.减盐酱油生产研究进展[J].农产品加工,2022,557(8):92-97.
[9]张振斌.新型减盐酱油及固态发酵工艺的开发与研究[D].天津:天津科技大学,2021.
[10]郭彩慧,马卫玲,宋明翰,等.替代法低盐酿造酱油品质研究[J].食品安全质量检测学报,2021,14(12):5553-5560.
[11]TIN H S,周斌,侯莎,等.盐分对广式高盐稀态酱油发酵微生物菌群结构的影响[J].食品与发酵工业,2022,48(1):45-54.
[12]杨希.盐浓度对蚕豆酱发酵过程中原核微生物多样性及理化因子的影响[J].食品与发酵工业,2022,48(4):200-206.
[13]解双瑜,毛文颖,李智,等.盐浓度对东北农家酱品质变化的影响[J].中国调味品,2022,47(7):14-19.
[14]曾小波,王婷婷,李学伟,等.添加大曲发酵对广式酱油品质影响的研究[J].中国酿造,2022,41(6):99-105.
[15]GUO M J,WU F H,HAO G E,et al.Bacillus subtilis improves immunity and disease resistance in rabbits[J].Front Immunol,2017,8:354.
[16]HAMMER O,HARPER D A T,RYAN P D.Past:Paleontological statistics software package for education and data analysis[J].Palaeontol Electron,2001,4(1):4-9.
[17]范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,7(4):80-84.
[18]申泮文,王积涛.化合物词典[M].上海:上海辞书出版社,2002:583.
[19] XU D D,WANG P,ZHANG X, et al.High-throughput sequencing approach to characterize dynamic changes of the fungal and bacterial communities during the production of sufu,a traditional Chinese fermented soybean food[J].Food Microbiol,2020,86:103340.
[20]朱新贵,李学伟,曾小波,等.典型广式酱油与日式酱油的风味物质差异研究[J].中国酿造,2016,35(7):30-35.
[21]刘婷婷,蒋雪薇,周尚庭,等.高盐稀态发酵与低盐固态发酵酱油中次生菌群分析[J].食品与机械,2010,26(6):13-17.
[22]杨婧,李娜娜,刘子恒,等.高粱单宁对清香型大曲白酒发酵过程中真菌群落结构的影响[J].食品科技,2022,47(7):1-9.
[23]WEI Q Z,WANG H B,CHEN Z X,et al.Profiling of dynamic changes in the microbial community during the soy sauce fermentation process[J].Appl Microbiol Biotechnol,2013,97:9111-9119.
[24]SULAIMAN J,GAN H M,YIN W F,et al.Microbial succession and the functional potential during the fermentation of Chinese soy sauce brine[J].Front Microbiol,2014,5:556.
[25]HAN D M,CHUN B H,FENG T Y,et al.Dynamics of microbial communities and metabolites in ganjang,a traditional Korean fermented soy sauce,during fermentation[J].Food Microbiol,2020,92:103591.
[26]ZHANG J R,FANG F,CHEN J,et al.The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce[J].FEMS Microbiol Lett,2014,358(1):91-97.
[27]续丹丹,王文平,张欣,等.一株耐盐产香鲁氏接合酵母FA-1的鉴定及其在酱油酿造中的应用[J].中国酿造,2022,41(12):31-39.
[28]徐园园,李静,王敏,等.自然发酵三樱椒中乳酸菌的分离及鉴定[J].中国酿造,2022,41(4):147-151.
[29]杨希飞.嗜盐四联球菌用于改善酱油风味和安全性的研究[D].无锡:江南大学,2016.
[30]安飞宇.豆酱自然发酵过程中菌群结构及其代谢功能的宏转录组学分析[D].沈阳:沈阳农业大学,2020.