酵母菌是葡萄酒发酵过程中主要的微生物,对葡萄酒的色泽、风味和口感有重要影响[1]。然而在葡萄酒酿造过程中,低pH、高乙醇、高浓度SO2和高糖等因素会影响酵母菌株的生长能力和发酵速率,甚至会导致发酵过程无法正常进行。因此,优良的酵母菌株不仅可以保证葡萄酒正常发酵,而且还能够改善葡萄酒的品质。
目前,葡萄酒生产中大多采用进口商业酵母,存在成本高、风味特征不突出的问题[2-3]。我国幅员辽阔,生物多样性丰富,其中不乏优良的酿酒酵母(Saccharomyces cerevisiae)资源[4]。李金鹏[5]对宁夏贺兰山东麓的酿酒酵母进行分离鉴定和发酵性能研究,结果显示,与商业酿酒酵母发酵酒样相比,筛选的酿酒酵母发酵酒样中香气成分种类更多。PARAPOULI M等[6]使用从当地葡萄自然发酵过程中筛选得到的野生酿酒酵母进行葡萄酒发酵,结果表明,野生酿酒酵母所发酵的酒样中风味物质更加丰富。虽然已有学者筛选出部分优良酵母,但仍有许多未发现的酵母菌株及其在葡萄酒中的酿造应用值得探索。
前期研究筛选出一株较好的商业酿酒酵母F15,本研究以其为对照菌株,从宁夏葡萄酒产区的葡萄生长环境(土壤、葡萄叶、葡萄表皮)中分离并筛选优良酵母菌株,研究菌株生长性能、耐受性及在赤霞珠葡萄酿造中的发酵特性,以期为葡萄酒品质的提升提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌种
商业酿酒酵母(Saccharomyces cerevisiae)F15:法国Laffort公司;赤霞珠葡萄(可溶性固形物含量为18°Brix,可滴定酸(以酒石酸计)为8.19 g/L):河北秦皇岛昌黎产区;葡萄、土壤:宁夏志辉源石葡萄酒庄有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[7]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸出粉10 g/L,121 ℃高压蒸汽灭菌20 min。固体YPD培养基中添加琼脂粉20 g/L。
氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)上层培养基[7]:TTC 0.5 g/L,葡萄糖5 g/L,琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
TTC下层培养基[7]:葡萄糖10 g/L,蛋白胨20 g/L,酵母浸出粉1.5 g/L,MgSO4 0.4 g/L,KH2PO4 1.0 g/L,琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
产酯固体培养基[8]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸出粉10 g/L,三丁酸甘油酯15 mL/L,溴甲酚紫0.04 g/L,琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
酵母浸粉(生化试剂):北京奥博星生物技术有限公司;蛋白胨(生化试剂):天津市英博生化试剂有限公司;葡萄糖(分析纯):天津市永大化学试剂开发中心;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、琼脂粉(生化试剂):北京索莱宝科技有限公司;4-甲基-2-戊醇(纯度≥98.0%):上海安谱试验科技股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
L-550台式离心机:湖南湘仪仪器开发有限公司;S20 pH计:梅特勒-托利多仪器有限公司;UV-5200紫外可见分光光度计:上海元析仪器有限公司;Eppendorf Mastercycler系列聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;Bio-RadPowerPac电泳仪:美国Bio-Rad公司;GenoSens 2100凝胶成像系统:上海琴翔科学仪器有限公司;Infinite200PRO多功能酶标仪:奥地利TECAN公司;1260示差高效液相色谱(high performance liquid chromatography,HPLC)仪、5975C-7890A气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪、CP-WAX 57 CB(60 m×0.25 mm×0.4 μm)色谱柱:美国Agilent公司;50/30 μm DVB/CAR/PDMS萃取头:美国Supelco公司。
1.3 试验方法
1.3.1 酵母菌株的分离纯化
称取1 g葡萄或土壤样品到9 mL无菌生理盐水中,30 ℃、200 r/min条件下富集培养20 min;吸取100 μL上清液至900 μL无菌生理盐水中,按10倍梯度稀释至10-3,然后分别吸取稀释度为10-2、10-3的菌液100 μL涂布于YPD固体培养基(含100 mg/L氯霉素),于30 ℃条件下培养24 h。挑取具有典型酵母菌菌落特征(如表面光滑、湿润、粘稠等)且形态差异较为明显的单个菌落,以平板划线法反复分离纯化,直至得到纯菌落,菌株保藏于-80 ℃,备用。
1.3.2 优良酵母菌株的筛选
产乙醇酵母菌株的筛选:将活化好的酵母菌株划线接种于TTC下层培养基上,以商业酿酒酵母F15作为对照,30 ℃培养3 d后,避光条件下在菌落上覆盖一层TTC上层培养基,30 ℃避光培养3~4 h,由菌落的颜色来判断酵母产乙醇的能力[9]。
产酯酵母菌株的筛选:将产乙醇能力较强的酵母菌株划线接种于产酯固体培养基上,以商业酿酒酵母F15作为对照,30 ℃培养3 d后,观察其菌落颜色[8]。
酵母菌株絮凝特性的测定:参照张博润等[10]的方法稍作修改。将筛选得到的产酯酵母菌和商业酿酒酵母F15按5%(V/V)的接种量接种于YPD液体培养基中,30 ℃培养24 h,7 500 r/min离心5 min,收集菌体,采用250 mmol/L EDTA和无菌水分别洗涤两次,并将菌体悬于0.1 mol/L柠檬酸钠缓冲溶液中,立即在波长600 nm处测定吸光度值(A)。将细胞悬液于30 ℃、120 r/min条件下振荡培养2 h,取出后室温静置培养30 min,在波长600 nm处测定吸光度值(B),试验平行三次,计算絮凝值(flocculation value,Flo),其计算公式如下:
当Flo为70%~100%时,属于低絮凝性;当Flo为30%~70%时,属于中絮凝性;当Flo为0~30%时,属于高絮凝性。
1.3.3 生长曲线的绘制
将-80 ℃保存的菌株接种于YPD液体培养基,30 ℃、200 r/min条件下活化24 h。将活化好的菌液以5%(V/V)的接种量接种于100 mL YPD液体培养基中,30 ℃、200 r/min条件下振荡培养,每隔2 h取样,使用紫外可见分光光度计在波长600 nm处测定菌悬液的吸光度值,以培养时间为横坐标,OD600nm值为纵坐标,绘制生长曲线[11]。
1.3.4 酵母菌株的鉴定
参考文献[12],采用26S rDNA D1/D2区序列分析对筛选得到的酵母菌株进行分子生物学鉴定。
1.3.5 酵母菌株耐受性的测定
酸耐受性[13]:将活化后的酵母菌株按5%(V/V)的接种量接种于不同pH(2.5、3.0、3.5、4.0和4.5)的YPD液体培养基中,30 ℃条件下培养24 h后,测定OD600nm值。
乙醇、SO2、糖耐受性[14]:将活化后的酵母菌株按5%(V/V)的接种量接种于YPD液体培养基中,30 ℃条件下培养24 h,取样,采用生理盐水梯度稀释至10-5,取稀释度为10-2、10-3、10-4、10-5的菌悬液涂布于含不同体积分数乙醇(8%、10%、12%、14%和16%)、不同质量浓度SO2(100 mg/L、150mg/L、200 mg/L、250 mg/L和300 mg/L)、葡萄糖(100 g/L、150 g/L、200 g/L、250 g/L和300 g/L)的YPD固体培养基中,30 ℃条件下培养2 d后,观察菌落生长情况。
1.3.6 酵母菌株发酵葡萄汁试验
赤霞珠葡萄除梗破碎后分装于三角瓶中,每个三角瓶中装有150 mL葡萄汁,巴氏灭菌(70 ℃、15 min)。以商业酿酒酵母F15为对照,将活化好的酵母菌株离心(7 500 r/min,5 min)后收集菌体,经0.9%的生理盐水洗涤两次后,按照2×106 CFU/mL的接种量接入三角瓶中,25 ℃下静置发酵,每隔12 h测定CO2质量损失,绘制发酵曲线,监测发酵进程,若连续两次的质量变化<0.2 g,则认为发酵结束。发酵结束后经12 000 r/min离心10 min,取上清液作为葡萄酒样用于后续分析。
1.3.7 测定方法
(1)理化指标的测定
残糖、酒度、总酸含量的测定:依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》;pH值的测定:采用pH计法。
(2)甘油含量的测定
参考张博钦等[15]的HPLC法检测甘油含量并稍作修改。HPLC条件为HPX-87H色谱柱(300 mm×7.8 mm),示差折光检测器,流动相为5 mmol/L的H2SO4-水溶液,流速0.6 mL/min,进样量20 μL,柱温65 ℃,检测器温度45 ℃,分析时间25 min。
(3)香气物质测定
参考文献[16]并稍作修改,采用顶空固相微萃取-气相色谱-质谱(headspace-solid phase microextraction-gas chromatography-mass spectrometer,HS-SPME-GC-MS)技术对葡萄酒样中的香气成分进行检测。
HS-SPME条件:取葡萄酒样品5 mL置于20 mL的顶空瓶中,加入1.5 g NaCl和5 μL 2.55 g/L的4-甲基-2-戊醇(内标),40 ℃平衡30 min,萃取30 min。
GC条件:色谱柱CP-WAX 57 CB(60 m×0.25 mm×0.4 μm),萃取头在进样口200 ℃解吸8 min,采用不分流模式进样,载气为高纯氦气(He)(>99.99%),流速为1.0mL/min,程序升温为初始温度50 ℃,保持1 min,以3 ℃/min升到200 ℃,保持5 min,总运行时间56 min。
MS条件:质量选择检测器(massselective detector,MSD)传输线250 ℃,离子源温度230 ℃,连接杆温度150 ℃,质谱选择SCAN模式进行扫描。
定性、定量分析:质谱结果利用美国国家标准与技术研究院(national institute of standards and technology,NIST)14谱库进行各挥发性物质的定性,采用内标法进行定量。
(4)感官评价
邀请经过专业训练的10人(5名男性,5名女性)组成品评小组,从色泽、口感、果香、花香、酸味和溶剂味6个方面对葡萄酒样品进行感官评价[17-18],以10分结构数值量化为标准,0~10分表示强度逐渐增强。每一样品重复分析3次,所有结果取平均值。
1.3.8 数据处理及分析
每个试验重复3次,结果用“平均值±标准差”表示,采用SPSS 26.0软件进行数据处理,采用Duncan检验法进行方差分析。采用Origin 2019软件绘图。
2 结果与分析
2.1 酵母菌的分离纯化
采用平板分离法及形态观察从宁夏葡萄酒产区葡萄或土壤样品中共分离纯化出13株酵母菌株,编号为J-1~J-13。
2.2 优良酵母菌株的筛选
2.2.1 产乙醇性能的测定
酒精发酵的主要途径包括葡萄糖酵解和丙酮酸的无氧降解,而TTC能对酵母的代谢产物产生显色反应,通过其颜色的深浅可以判断呼吸酶活力的大小,颜色越深其呼吸酶活力越强,产乙醇能力也越强[19]。商业酿酒酵母F15与13株酵母菌株在TTC培养基上的显色结果见表1。
表1 筛选酵母菌菌株在TTC培养基上的显色结果
Table 1 Chromogenic results of screened yeast strains on TTC medium
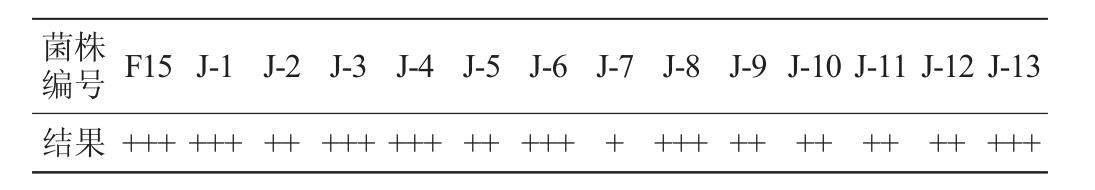
注:“+++”表示深红;“++”表示红色;“+”表示浅红。
?菌株编号F15 J-1 J-2 J-3 J-4 J-5 J-6 J-7 J-8 J-9 J-10 J-11 J-12 J-13结果+++ +++ ++ +++ +++ ++ +++ + +++ ++ ++ ++ ++ +++
由表1可知,6株酵母菌(J-1、J-3、J-4、J-6、J-8和J-13)与商业酿酒酵母F15在TTC培养基上呈现深红色,说明产乙醇能力与F15相当,因此,选取酵母菌株J-1、J-3、J-4、J-6、J-8和J-13用于后续研究。
2.2.2 产酯性能的测定
菌株产酯能力不同在产酯培养基上所呈现的菌落颜色不同,其黄色越深,表明菌株产酯能力越强[8]。商业酿酒酵母F15及6株酵母菌株产酯性能测定结果见表2。由表2可知,不同酵母菌产酯能力具有较大的差异,其中2株酵母菌(J-1、J-3)产酯能力与对照菌株F15相当,在产酯培养基上呈现黄色,所以选取酵母菌株J-1和J-3进行进一步研究。
表2 筛选酵母菌菌株在产酯培养基上的颜色
Table 2 Color of screened yeast strains on ester producing medium
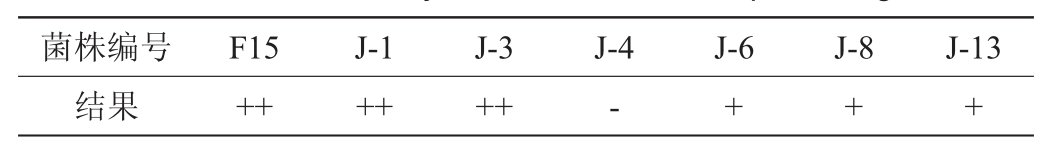
注:“++”表示黄色;“+”表示浅黄;“-”表示白色。
菌株编号 F15 J-1 J-3 J-4 J-6 J-8 J-13结果 ++ ++ ++ - + + +
2.2.3 絮凝特性的测定
絮凝性是酵母黏附成团最终沉降的特性,良好的絮凝性有利于葡萄酒的澄清及后期管理,因此,酵母絮凝性是葡萄酒酿造特性的重要指标[20]。通过测定酵母菌株F15、J-1和J-3的絮凝性发现,各菌株的絮凝性差异显著(P<0.05),商业酿酒酵母F15的絮凝值为(57.9±1.8)%,属于中絮凝性菌株,酵母菌株J-1、J-3的絮凝值分别为(29.7±1.6)%、(24.9±2.0)%,都属于高絮凝性菌株,因此,选择酵母菌株J-1和J-3用于后续研究。
2.3 酵母菌株的生长曲线
酵母菌株F15、J-1和J-3的生长曲线见图1。由图1可知,酵母菌株F15、J-1和J-3与商业酿酒酵母F15的生长情况相似,均在4 h进入对数生长期,18 h进入生长稳定期。
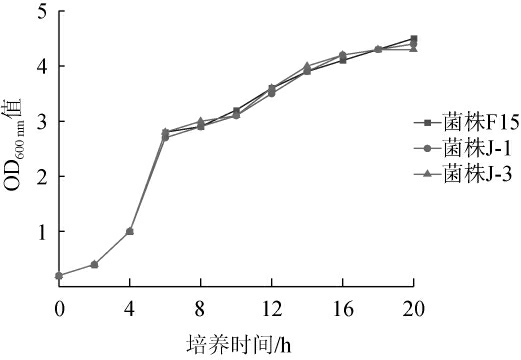
图1 筛选酵母菌菌株的生长曲线
Fig.1 Growth curve of screened yeast strains
2.4 酵母菌株的鉴定
基于26S rDNA基因序列构建酵母菌株的系统发育树,结果见图2。由图2可知,菌株J-1和J-3均与酿酒酵母(Saccharomyces cerevisiae)OP644188.1聚于一支,亲缘关系最近,最终鉴定酵母菌株J-1和J-3为酿酒酵母(Saccharomyces cerevisiae)。

图2 基于26S rDNA基因序列酵母菌株J-1和J-3的系统发育树
Fig.2 Phylogenetic tree of yeast strains J-1 and J-3 based on 26S rDNA gene sequences
2.5 酵母菌株耐受能力的测定
商业酿酒酵母F15及酿酒酵母菌株J-1和J-3对酸的耐受性见图3。由图3可知,除pH 3.5时,菌株J-1的OD600nm值略微高于商业酿酒酵母F15,其他pH条件下,菌株J-1对酸的耐受性相比于对照菌株F15略差。然而在不同pH条件下,对照菌株F15及菌株J-1的OD600 nm值均高于酵母菌株J-3,说明菌株J-1对酸的耐受性比菌株J-3好。当pH降至2.5时,对照菌株F15及酵母菌株J-1和J-3的OD600nm值均<0.5,生长明显受到抑制。与张翠英[21]报道的酿酒酵母最低生长pH 2.5相比,菌株耐受性略低。葡萄汁的pH值通常在3.0~4.0[21],说明酵母菌株J-1和J-3能满足葡萄酒酿造的pH环境。
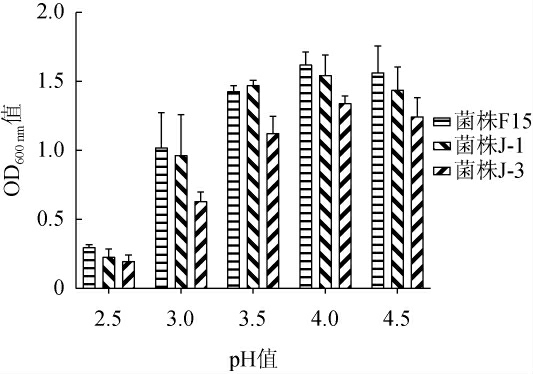
图3 不同酵母菌株的酸耐受性
Fig.3 Tolerance of different yeast strains to acid
较高含量的葡萄糖、SO2和乙醇等会影响酵母菌株的生长,从而延长发酵时间,而且高渗透压也会影响酵母酒精发酵过程中的代谢产物[22]。随着葡萄糖和SO2质量浓度的升高,对照菌株F15、菌株J-1和J-3的生长未受到明显抑制,均可耐受400 g/L的葡萄糖、300 mg/L的SO2。另外,在培养基中添加不同体积分数的乙醇后,随着乙醇含量的增加,对照菌株F15、菌株J-1和J-3的生长均逐渐受到抑制,但它们均可耐受体积分数为14%的乙醇,且菌株J-1对乙醇的耐受性较菌株J-3更强,但两株酵母菌基本满足葡萄酒酿造的条件。综上,酵母菌株J-1对酸、葡萄糖、SO2和乙醇的耐受性优于菌株J-3。
2.6 酵母菌株在葡萄汁中的发酵性能
2.6.1 不同酿酒酵母菌株的发酵曲线
商业酿酒酵母F15及酿酒酵母菌株J-1和J-3在葡萄汁中的发酵曲线见图4。由图4可知,菌株F15、J-1和J-3均在96 h内完成发酵,且CO2质量损失分别为10.9 g、10.8 g和11.0 g。在24~60 h发酵期间,菌株J-1与F15的CO2质量损失速度基本一致,而菌株J-3的CO2质量损失速度较慢,说明相较于菌株J-3,菌株J-1起酵速度快,能快速适应葡萄汁条件,缩短酒精发酵周期。
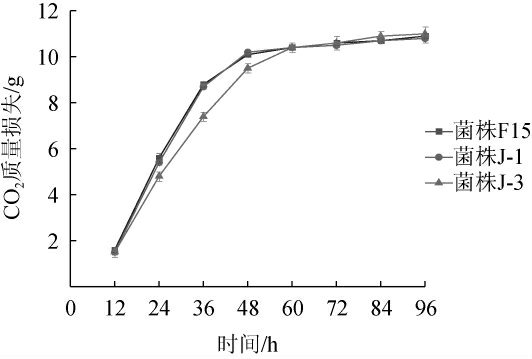
图4 不同酵母菌株发酵葡萄汁的CO2质量损失曲线
Fig.4 CO2 mass loss curve of grape juice fermented with different yeast strains
2.6.2 葡萄酒理化指标及甘油含量的分析
不同酿酒酵母菌株发酵葡萄酒样的理化指标及甘油含量见表3。由表3可知,酒精发酵结束后,商业酿酒酵母F15和菌株J-1、J-3发酵葡萄酒中残糖含量为4.48~4.90 g/L,均大于4 g/L,满足GB/T 15037—2006《葡萄酒》中半干型葡萄酒要求(4.1~12.0 g/L)。菌株J-1和J-3发酵葡萄酒样酒精度分别为9.43%vol、9.42%vol,与商业酿酒酵母F15发酵葡萄酒样的酒精度(9.54%vol)差异不显著(P>0.05),符合GB/T 15037—2006《葡萄酒》中酒精度≥7%vol的要求。总酸含量可以判定酵母的产酸能力,其含量对酒的色泽和风味具有一定的影响[23],3个葡萄酒样的总酸含量无显著差异(P>0.05),为6.00~6.30 g/L。pH值对葡萄酒的稳定性和感官质量都具有非常重要的作用,一般在2.8~3.8之间[24],3个葡萄酒样的pH值无显著差异(P>0.05),为3.62~3.63。甘油是酒精发酵的主要副产物之一,具有一定的甜味,能使葡萄酒口感圆润,在葡萄酒中,甘油含量一般为6~10 g/L[25]。菌株F15、J-1、J-3发酵葡萄酒样中的甘油含量差异显著(P<0.05),分别为9.32 g/L、9.20 g/L、8.24 g/L。相比于对照菌株F15,酵母菌株J-1和J-3产甘油能力略差。
表3 不同酵母菌株发酵葡萄酒样的理化指标及甘油含量测定结果
Table 3 Determination results of physicochemical indexes and glycerol content of wine samples fermented with different yeast strains
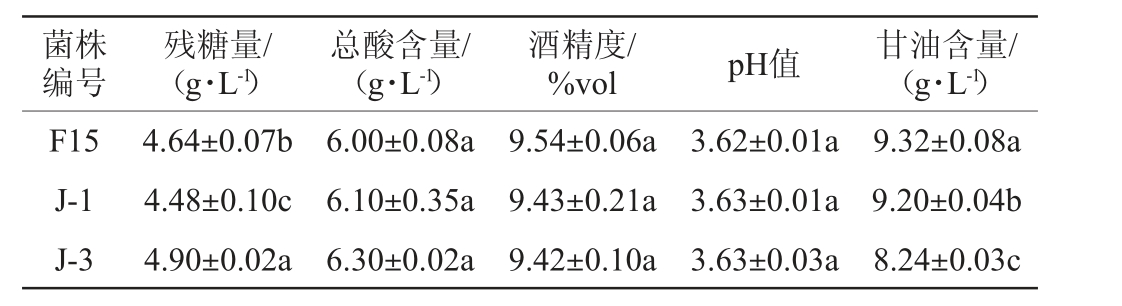
注:同列不同小写字母表示差异显著(P<0.05)。
菌株编号残糖量/(g·L-1)总酸含量/(g·L-1)酒精度/%vol pH值 甘油含量/(g·L-1)F15 J-1 J-3 4.64±0.07b 4.48±0.10c 4.90±0.02a 6.00±0.08a 6.10±0.35a 6.30±0.02a 9.54±0.06a 9.43±0.21a 9.42±0.10a 3.62±0.01a 3.63±0.01a 3.63±0.03a 9.32±0.08a 9.20±0.04b 8.24±0.03c
2.6.3 葡萄酒香气成分分析
香气是葡萄酒最重要的感官品质之一,采用GC-MS对酿酒酵母J-1、J-3及商业酿酒酵母F15发酵酒样中的挥发性风味成分进行测定,结果见表4。由表4可知,共检测到67种香气物质,包括26种酯类、22种醇类、10种醛酮类、6种萜烯类、2种酸类和1种酚类。其中菌株J-1发酵酒样中共检测出53种香气物质,而菌株J-3和F15发酵酒样都检测到51种香气物质。
表4 不同酵母菌株发酵葡萄酒样挥发性风味成分含量GC-MS分析结果
Table 4 Determination results of volatile flavor compounds contents in wine samples fermented with different yeast strains analysis by GC-MS μg/L
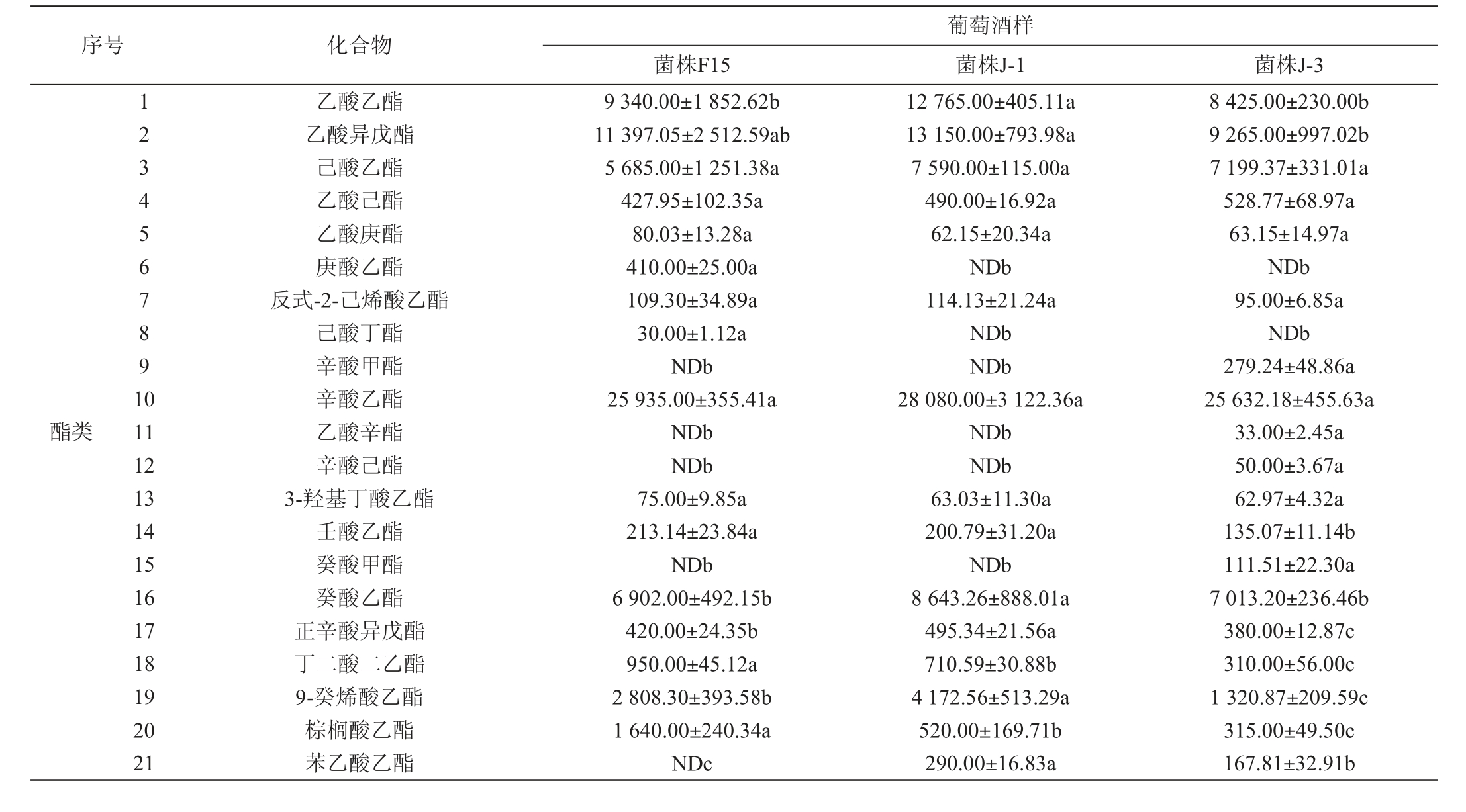
序号 化合物菌株F15葡萄酒样菌株J-1 菌株J-3酯类1234567891 0 11 12 13 14 15 16 17 18 19 20 21乙酸乙酯乙酸异戊酯己酸乙酯乙酸己酯乙酸庚酯庚酸乙酯反式-2-己烯酸乙酯己酸丁酯辛酸甲酯辛酸乙酯乙酸辛酯辛酸己酯3-羟基丁酸乙酯壬酸乙酯癸酸甲酯癸酸乙酯正辛酸异戊酯丁二酸二乙酯9-癸烯酸乙酯棕榈酸乙酯苯乙酸乙酯9 340.00±1 852.62b 11 397.05±2 512.59ab 5 685.00±1 251.38a 427.95±102.35a 80.03±13.28a 410.00±25.00a 109.30±34.89a 30.00±1.12a NDb 25 935.00±355.41a NDb NDb 75.00±9.85a 213.14±23.84a NDb 6 902.00±492.15b 420.00±24.35b 950.00±45.12a 2 808.30±393.58b 1 640.00±240.34a NDc 12 765.00±405.11a 13 150.00±793.98a 7 590.00±115.00a 490.00±16.92a 62.15±20.34a NDb 114.13±21.24a NDb NDb 28 080.00±3 122.36a NDb NDb 63.03±11.30a 200.79±31.20a NDb 8 643.26±888.01a 495.34±21.56a 710.59±30.88b 4 172.56±513.29a 520.00±169.71b 290.00±16.83a 8 425.00±230.00b 9 265.00±997.02b 7 199.37±331.01a 528.77±68.97a 63.15±14.97a NDb 95.00±6.85a NDb 279.24±48.86a 25 632.18±455.63a 33.00±2.45a 50.00±3.67a 62.97±4.32a 135.07±11.14b 111.51±22.30a 7 013.20±236.46b 380.00±12.87c 310.00±56.00c 1 320.87±209.59c 315.00±49.50c 167.81±32.91b
续表

注:同行不同小写字母表示差异显著(P<0.05);“ND”表示未检出。
22 23 24 25 26醇类27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48醛酮类49 50 51 52 53 54 55 56 57 58萜烯类59 60 61 62 63 64酸类序号 化合物乙酸苯乙酯月桂酸乙酯癸酸异戊酯肉豆蔻酸乙酯亚油酸乙酯小计1,2,4-丁三醇异丁醇异戊醇正戊醇4-甲基-1-戊醇顺-2-戊烯醇3-甲基-1-戊醇(S)-(+)-3-甲基-1-戊醇正己醇顺-3-己烯-1-醇正庚醇正辛醇2,3-丁二醇(R)-(-)-3-甲基-2-丁醇3-甲基-2-丁醇反式-2-癸烯醇1-壬醇(E)-6-壬烯-1-醇(Z)-6-壬烯-1-醇3-甲硫基丙醇苯甲醇苯乙醇小计乙醛正庚醛壬醛癸醛苯甲醛β-环柠檬醛反-2-辛烯醛4-羟基-2-丁酮2-壬酮香叶基丙酮小计芳樟醇4-萜烯醇香茅醇金合欢醇橙花醇香叶醇小计正己酸辛酸小计2,4-二叔丁基苯酚65 66酚类67菌株F15 2 502.27±703.89a 1 094.59±204.47a NDc 1 400.00±103.00a 5 630.00±249.00a 77 049.13 65.00±7.07b 11 067.83±1 397.01a 134 309.53±2513.67a 116.80±20.57a 115.75±19.52a 66.22±12.00a 245.00±45.00b NDb 7 277.49±500.39a 510.00±56.80a 1 015.00±122.82a 825.00±19.86a 1 000.00±26.91a 210.00±3.70a NDb NDb 730.00±26.74ab 260.00±16.59a NDb 460.00±14.03a NDb 65 210.79±1 582.79a 223 483.96 24.01±5.99a NDb 133.22±6.78a 148.52±8.52ab 103.08±3.03a NDc NDb 360.00±32.15a NDb NDb 768.83 360.00±24.60a 450.00±4.50a 680.00±131.11a 180.00±16.75a 330.00±70.06a 1 070.00±8.96a 3 070.00 5 385.42±812.58a 8 820.04±777.84a 14 205.46 1 260.54±116.12a葡萄酒样菌株J-1 菌株J-3 2 405.00±93.91a 1 195.84±150.43a 240.00±12.14a 1 030.00±223.38b NDb 82 217.69 NDc 10 230.00±436.80a 125 550.00±3 410.69a 103.69±14.89a 118.29±16.05a 76.34±11.84a NDc 310.00±52.92a 5 101.40±491.68b 325.18±39.19b 1 082.23±167.48a 696.67±141.54a 1 035.00±178.51a NDb 215.00±21.25a 112.00±6.00a 852.09±155.08a NDc 187.45±6.56a 403.23±28.78b 1 030.00±97.80a 66 040.00±215.26a 213 468.57 14.64±5.04ab 60.00±120.00a 138.29±24.62a 181.94±22.39a 110.00±9.69a 135.00±4.76a NDb NDb 40.72±5.40a 360.00±40.86a 1 040.59 375.00±34.41a 275.26±56.14b 682.88±73.19a NDb 271.64±46.45ab 1 026.19±226.24a 2 630.97 5 328.41±181.60a 10 550.00±456.15a 15 878.41 1 195.00±154.84ab 2 097.00±449.92a 948.77±141.68a 190.00±3.56b 660.00±153.32c NDb 65 283.23 180.00±5.67a 4 479.00±120.00b 74 555.00±2 120.00 b 95.00±7.90a 112.54±10.00a 60.00±4.30a 455.00±20.00a NDb 3 670.00±30.00b NDc 650.00±40.00b 340.00±23.89b 220.00±10.00b NDb NDb NDb 550.00±60.00a 160.00±12.00b NDb 350.00±20.00c NDb 45 450.00±1 250.00b 131 326.65 10.00±0.20b NDb 85.00±10.97b 88.75±19.76b 55.00±6.79b 80.00±10.00b 100.00±9.98a NDb NDb 295.00±49.55a 713.68 NDb 200.00±7.80c 590.00±50.00a NDb 205.00±10.00b NDb 995.00 5 192.58±691.62a 8 670.00±1 493.03a 13 862.58 970.00±87.50b
酯类物质主要来源于酵母在生物合成或陈酿过程中的酯化反应[26],能为葡萄酒提供令人愉悦的花香和果香,是葡萄酒香气的重要组成部分[15]。由表4可知,酒精发酵结束后,酵母菌株F15、J-3及J-1发酵酒样中酯类物质总量分别为77.05 mg/L、65.28 mg/L和82.22 mg/L。与菌株F15发酵葡萄酒样相比,菌株J-1发酵酒样中乙酸乙酯、己酸乙酯、癸酸乙酯和乙酸异戊酯含量较高,分别为12.75mg/L、7.59 mg/L、8.64 mg/L和13.15 mg/L,这些物质可为葡萄酒带来青苹果和香蕉等水果香气[27-28]。乙酸苯乙酯是一种特殊的芳香化合物,当其质量浓度>0.25 mg/L时,能够给葡萄酒增添玫瑰和花的芳香[29],其在商业酿酒酵母F15发酵的酒样中含量最高(2.50 mg/L),其次为酵母菌株J-1(2.41 mg/L)、J-3(2.10 mg/L),但各组差异不显著(P>0.05);丁二酸二乙酯具有花香、果香和薰衣草香气[30],其在商业酿酒酵母F15发酵的酒样中含量最高(950 μg/L),分别为酵母菌株J-1和J-3发酵酒样的1.33倍和3.06倍。
醇类物质是酵母代谢产生的次级产物,当高级醇含量<300 mg/L,会提高葡萄酒的复杂感,但当其含量>400 mg/L,则会给葡萄酒带来不良风味,进而导致葡萄酒感官品质下降[24,31]。由表4可知,各酒样中醇类物质的含量由低到高分别为131.33 mg/L(菌株J-3)、213.47 mg/L(菌株J-1)和223.48 mg/L(菌株F15),均低于300 mg/L,能给酒样的香气带来正面影响。正己醇会给葡萄酒带来生青味和植物味[15],酿酒酵母J-1和J-3发酵酒样中正己醇含量(5.10 mg/L、3.67 mg/L)均低于商业酿酒酵母菌株F15发酵酒样(7.28 mg/L)。苯乙醇是由苯丙氨酸代谢产生,能够给酒样带来独特的紫罗兰香、丁香、茴香和玫瑰香味[32],酵母菌株J-1发酵酒样(66.04 mg/L)中苯乙醇含量略微高于商业酿酒酵母菌株F15发酵酒样(65.21 mg/L),然而菌株J-3发酵酒样中苯乙醇含量较低,为45.45 mg/L。
酸类物质能够提高葡萄酒香气的复杂性,在接近其阈值时对葡萄酒起到积极作用,而浓度过高(>20 mg/L)时会给葡萄酒带来不愉快的脂肪、奶酪香气等[33]。商业酿酒酵母F15、酵母菌株J-1和J-3发酵酒样中酸类物质含量均<20 mg/L,其中菌株J-1发酵酒样中酸类物质含量最高(15.88 mg/L),其次为菌株F15发酵酒样(14.21 mg/L),菌株J-3发酵酒样中含量最低,为13.86 mg/L。
醛酮类物质也是葡萄酒香气的重要组成部分[33]。由表4可知,各菌株发酵酒样中醛酮类物质的含量由低到高分别为713.68 μg/L(菌株J-3)、768.83 μg/L(菌株F15)、1 040.59 μg/L(菌株J-1)。与商业酿酒酵母菌株F15发酵的酒样相比,菌株J-1和J-3发酵酒样中均检测到了香叶基丙酮,含量分别为360 μg/L、295 μg/L,其可赋予葡萄酒浓郁的奶香味和水果味[23]。此外,醛类物质在低质量浓度水平时贡献出令人愉悦的水果香气,但是在高质量浓度水平(>125 mg/L)时会影响葡萄酒的感官特性,产生辛辣刺激性气味[34],菌株J-1和J-3发酵酒样中醛类物质含量均远低于125 mg/L,不会对葡萄酒带来负面影响。仅有菌株J-1发酵的酒样中检测到微量的正庚醛(60 μg/L)和2-壬酮(40.72 μg/L)。
由于萜烯类化合物的香气阈值低,所以少量的萜烯对增加葡萄酒风味的丰富性起重要作用[35]。由表4可知,菌株J-3和J-1发酵酒样中的萜烯类物质含量(995.00 μg/L、2 630.97 μg/L)低于商业酿酒酵母菌株F15(3 070.00 μg/L)。除此之外,菌株F15与J-1、J-3发酵酒样中均检测到了一种酚类物质,即2,4-二叔丁基苯酚(辛辣、烟熏香气[34]),然而菌株J-1和J-3发酵酒样中2,4-二叔丁基苯酚含量(1 195.00 μg/L、970.00 μg/L)均低于菌株F15发酵酒样(1 260.54 μg/L)。
2.6.4 葡萄酒感官分析
各组酒样的感官分析雷达图见图5。由图5可知,酿酒酵母J-1发酵酒样的花香、果香和酸味得分均高于商业酿酒酵母F15发酵酒样,分析原因可能是酿酒酵母J-1发酵结束后显著增加了葡萄酒中酯类物质的含量,赋予了葡萄酒浓郁的花香和果香,而其酸味高的原因可能与其辛酸含量高有关。酿酒酵母J-1发酵酒样的口感得分与商业酿酒酵母F15发酵酒样相当,但色泽上得分略微低于商业酿酒酵母F15发酵酒样。然而,酿酒酵母J-3发酵酒样由于其花香和果香味不足,感官评分较低。综上,酿酒酵母J-1适合作为葡萄酒酿造的优良菌株。
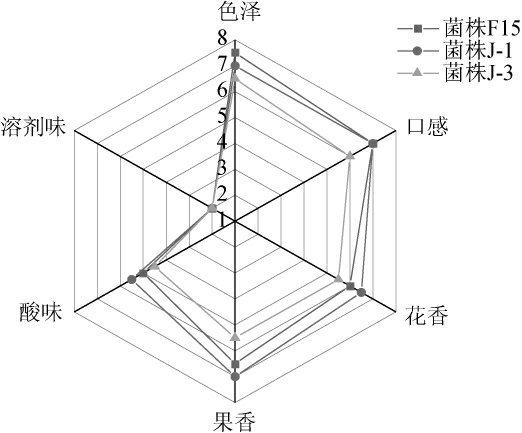
图5 不同酵母菌株发酵葡萄酒样感官分析雷达图
Fig.5 Sensory analysis radar map of wine samples fermented with different yeast strains
3 结论
本研究以宁夏葡萄酒产区的土壤、葡萄为分离源,并以商业酿酒酵母F15为对照,通过产乙醇性能、产酯性能及絮凝特性测定筛选得到2株性能较好的菌株,编号为J-1、J-3,经26S rDNA D1/D2区基因序列分析鉴定这2株菌均为酿酒酵母菌(Saccharomyces cerevisiae)。这2株菌株生长特性良好,均具有较好的耐受性,均可耐受pH值3.0、体积分数14%乙醇,300 mg/L SO2,400 g/L葡萄糖,且菌株J-1的耐受性能优于J-3。采用2株菌株发酵葡萄汁,结果表明,菌株J-1的发酵速度与商业酿酒酵母F15相当。与商业酿酒酵母F15发酵酒样相比,酿酒酵母J-1发酵酒样中残糖含量较低(4.48 g/L)。挥发性风味分析结果表明,菌株J-1发酵酒样中共检测出53种香气物质,比商业酿酒酵母F15发酵酒样中多2种香气物质,其中菌株J-1发酵酒样中酯类物质含量较高,如乙酸乙酯、乙酸异戊酯和辛酸乙酯等,能够给葡萄酒带来更多的果香和花香;感官评价结果也显示,酿酒酵母J-1发酵酒样的花香和果香比较浓郁,口感较好。综上,酿酒酵母J-1具有较好的酿造特性,在葡萄酒工业上具有一定的应用潜力。
[1] SUAREZ-LEPE J A, MORATA A.New trends in yeast selection for winemaking[J].Trends Food Sci Tech,2012,23(1):39-50.
[2]程仕伟,屈慧鸽,栾丽英,等.新疆霞多丽自然发酵醪中本土酿酒酵母的选育与发酵特性[J].中国食品学报,2017,17(8):119-125.
[3]朱娟娟,马海军,李敏,等.不同酿酒酵母共发酵对干红葡萄酒理化特性和香气成分的影响[J].食品与发酵工业,2020,46(2):194-202.
[4]姜东琪,张云舒,武晓玮,等.酿酒酵母对樱桃酒挥发性组分及感官品质的影响[J].中国酿造,2019,38(8):94-99.
[5]李金鹏.宁夏贺兰山东麓酿酒酵母的分离鉴定与发酵特性研究[D].银川:宁夏大学,2017.
[6] PARAPOULI M, HATZILOUKAS E, DRAINAS C, et al.The effect of Debina grapevine indigenous yeast strains of Metschnikowia and Saccharomyces on wine flavor[J].J Ind Microbiol Biot,2010,37(1):85-93.
[7]岑涛,岳田利,袁亚宏,等.云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用[J].食品科学,2015,36(11):119-124.
[8]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[9]王梅,张彭湃,帅桂兰,等.TTC在黄酒酵母选育中的应用[J].酿酒,2001,28(5):62-64.
[10]张博润,陈蔚,铁翠娟,等.酵母菌絮凝的分型及其生理生化特性的研究[J].微生物学报,1999(6):527-532.
[11]丛文蓉,陈晶瑜,韩北忠,等.不同酿酒酵母发酵特性及抗氧化特性的比较[J].中国酿造,2012,31(5):21-24.
[12] SUN Y, QIN Y, PEI Y F, et al.Evaluation of Chinese Saccharomyces cerevisiae wine strains from different geographical origins[J].Am J Enol Viticult,2017,68(1):73-80.
[13]高娉娉,朱亚同,刘宇,等.高产酸性β-葡萄糖苷酶的优良本土酵母菌株筛选、鉴定及酶学性质分析[J].食品与发酵工业,2022,48(12):30-36.
[14]张晓晓,任剑星,刘凯毅,等.TOR1基因缺失对酿酒酵母耐受性的影响[J].食品与发酵工业,2021,47(2):1-7.
[15]张博钦,方梓庄,成池芳,等.5株低产乙醇的非酿酒酵母筛选及其酿造特性[J].食品科学,2021,42(8):114-121.
[16] ZHANG B, LUAN Y, DUAN C, et al.Use of Torulaspora delbrueckii co-fermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J].Front Microbiol,2018,9:606.
[17]周继亘,杨学山,祝霞,等.不同浸渍工艺对赤霞珠干红葡萄酒香气的影响[J].食品与生物技术学报,2019,38(9):50-59.
[18]LOIRA I,VEJARANO R,MORATA A,et al.Effect of Saccharomyces strains on the quality of red wines aged on lees[J].Food Chem,2013,139(1-4):1044-1051.
[19]徐俊,雍晓雨,费文斌,等.基于TTC染色法的高活力酵母细胞定量筛选[J].食品与发酵工业,2014,40(7):1-5.
[20]郑海武,雷蕾,李正英,等.本土优良酿酒酵母的酿造学特性[J].食品与发酵工业,2020,46(8):118-122,130.
[21]张翠英.优良果酒酵母的分离选育及发酵性能研究[D].扬州:扬州大学,2006.
[22]闫兴敏,姜娇,高辉,等.优良本土酿酒酵母的酿酒特性及产香能力初析[J].食品与发酵工业,2022,48(4):62-68.
[23]冯涛,王旭增,王一非,等.葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J].食品科学,2018,39(14):213-220.
[24]余欢,管敬喜,杨莹,等.7株野生葡萄酒酵母对‘桂葡3号’干白葡萄酒香气成分的影响[J].食品科学,2019,40(4):251-258.
[25]李华.葡萄酒工艺学[M].北京:科学出版社,2006:78.
[26]PERESTRELO R,FERNANDES A,et al.Analytical characterization of the aroma of Tinta Negra Mole red wine:Identification of the main odorant compounds[J].Anal Chim Acta,2006,563(1):154-164.
[27]SWIEGERS J H,PRETORIUS I S.Yeast modulation of wine flavor[J].Adv Appl Microbiol,2005,57:131-175.
[28]SAFC.Flavors&fragrances[M].Madrid,Spain:European ed catalogue SAFC Specialties,2012.
[29] MEDINA K,BOIDO E,FARINÑA L,et al.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chem,2013,141(3):2513-2521.
[30]张文静,杨诗妮,杜爽,等.本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力分析[J].食品科学,2020,41(12):84-90.
[31]RAPP A,VERSINI G,et al.Influence of nitrogen compounds in grapes on aroma compounds of wine[J].Dev Food Sci,1997,37(6):71-82.
[32] ÁLVAREZ M G, GONZÁLEZ-BARREIRO C, CANCHOGRANDE B,et al.Relationships between Godello white wine sensory properties and its aromatic fingerprinting obtained by GC-MS[J].Food Chem, 2011,129(3):890-898.
[33]管敬喜,黄羽,韦荣福,等.三种酿造工艺对野酿2号毛葡萄酒香气成分的影响[J].食品工业科技,2020,41(2):220-226.
[34]冯涛,桑敏,庄海宁,等.银杏葡萄酒香气成分的萃取条件优化及其香气物质的测定[J].食品与生物技术学报,2019,38(5):124-131.
[35]宋茹茹,段卫朋,祝霞,等.戴尔有孢圆酵母与酿酒酵母顺序接种发酵对干红葡萄酒香气的影响[J].食品与发酵工业,2019,45(24):1-9.