青稞是一种特殊类型的杂粮大麦,是西藏最优势的特色作物,西藏青稞酒历史悠久,文化深厚,为西藏地区特色民族食品之瑰宝[1]。青稞不同于高粱,质地较硬,蛋白质含量高,在发酵之后分解成氨基酸和多元醇,加上西藏独特的高海拔、低气压条件,使青稞白酒的酒体滋味不仅丰富,而且细腻[2-5]。
酒曲质量是影响白酒品质与风味的重要因素,其质量的优劣很大程度上取决于酒曲中微生物组成[6-7]。酒曲中含有种类繁多的微生物,既有细菌,又有酵母、霉菌等真菌[8-10]。酒曲微生物能产生大量的酶,分解蛋白质、淀粉等物质,进而产生氨基酸、葡萄糖等营养物质并进行生物代谢,产生一系列的代谢产物,对酒的风味、口感、质量、功能都有着非常重要的作用。王晓燕等[11]在青稞酒曲中经筛选与分子生物学鉴定,筛选出糖化能力强的优势菌株为霉菌。张晓蒙等[12-15]利用高通量测序技术分析酒曲的微生物多样性,西藏自治区青稞酒酒曲中共检测到69个真菌属和309个细菌属,同时发现酒曲中的真菌优势菌群和细菌优势菌群,分别为覆膜孢酵母属(Saccharomycopsis)、根霉属(Rhizopus)、毛霉属(Mucor),以及乳酸杆菌属(Lactobacillus)和明串珠菌属(Leuconostoc)。
酒曲的微生物组成影响西藏青稞白酒的风味品质,黄昊等[16]对藏曲中的菌株进行分离筛选及酿造能力测试,发现酿酒酵母为主要产酒酵母。细菌在酒曲中多为球菌或杆菌,具有产酸,产香的能力,决定着酒曲的风味与质量。刘小改等[17]在清香型大曲中采用涂布法及感官嗅闻法分离筛选出具有产香功能的细菌,可增加酒香,提升白酒品质。WANG X D等[18]利用高通量测序的方法从茅台风味大曲样品中检测出芽孢乳杆菌科、假单胞菌科等细菌科,并同时发现嗜热放线菌科与芽孢杆菌科两个优势细菌科,有助于制造其他酱味酒与提升酒的质量。张双燕等[19]利用高通量测序从清香型大曲中测序分析出大曲优势微生物乳酸菌与假丝酵母属。
为了提升西藏青稞白酒产品品质,本研究以不同工艺所制作的青稞曲为研究对象,采用高通量测序技术分析青稞曲中微生物多样性的群落结构,分析其微生物群落组成的差异性,明确优势菌群,并分析西藏青稞白酒挥发性风味成分与微生物间的关系,为后期对青稞曲中功能菌种的筛选和改良提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
青稞藏青2000、糌粑粉、小曲粉、稻壳:均由西藏自治区农牧科学院提供。
E.Z.N.A.R Soil DNA Kit 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;AxyPrep DNA Gel Extraction Kit:美国Axygen公司;琼脂糖:西班牙Biowest公司。
1.2 仪器与设备
5702R高速台式冷冻离心机:德国Eppendorf公司;7500型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;NEXTFLEXRapid DNA-Seq Kit:美国Bioo Scientific公司;Miseq高通量测序仪:美国Illumina公司;DYCP-31DN电泳仪:北京市六一仪器厂;固相微萃取头(DVB/CAR/PDMS):美国Supelco公司;DB-FFAP色谱柱(60 m×0.25 mm×0.25 μm):美国Agilent公司;Clarus680-Clarus 600T型气相色谱-质谱联用仪(gaschromatography-massspectrometer,GC-MS):美国Perkin Elmer公司;RS-FS1406粉碎机:荣事达有限公司;SPX-250B-Z型生化培养箱:上海博讯实业有限公司;JX-A20002电子天平:武义今选贸易有限公司经销;SUS304-20L不锈钢发酵桶及配套蒸馏器:上海科兴仪器有限公司;CJM-105-C酒精计:四川东华计量检测技术有限公司。
1.3 实验方法
1.3.1 5种青稞曲的制作工艺
以青稞为原料,利用粉碎机将青稞粉碎为粗粉和细粉(以通过20目标准筛孔筛的青稞粉为细粉,未通过为粗粉),进行混合拌匀。1号曲:粗粉∶细粉=3∶2,水分含量29.5%;4号曲:粗粉∶细粉=3∶2,水分含量43.8%;6号曲:粗粉∶细粉=3∶2,10%糌粑粉(单独添加),水分含量43.8%;7号曲:粗粉100%,水分含量43.8%;8号曲:粗粉+10%小曲粉(单独添加),水分含量43.8%。1号、4号、6号和7号样品于制曲模具(27 cm×17 cm×6.5 cm)中踩曲,形成曲坯,曲坯表面晾干后在生化培养箱中按照表1进行参数控制,根据制曲周期720 h(30 d),得到成品青稞大曲。8号样品按照西藏传统小曲工艺进行制曲[20],得到成品青稞小曲(球曲)。
表1 制曲过程中时间、温度、湿度参数
Table 1 Time, temperature and humidity parameters during koji-making process
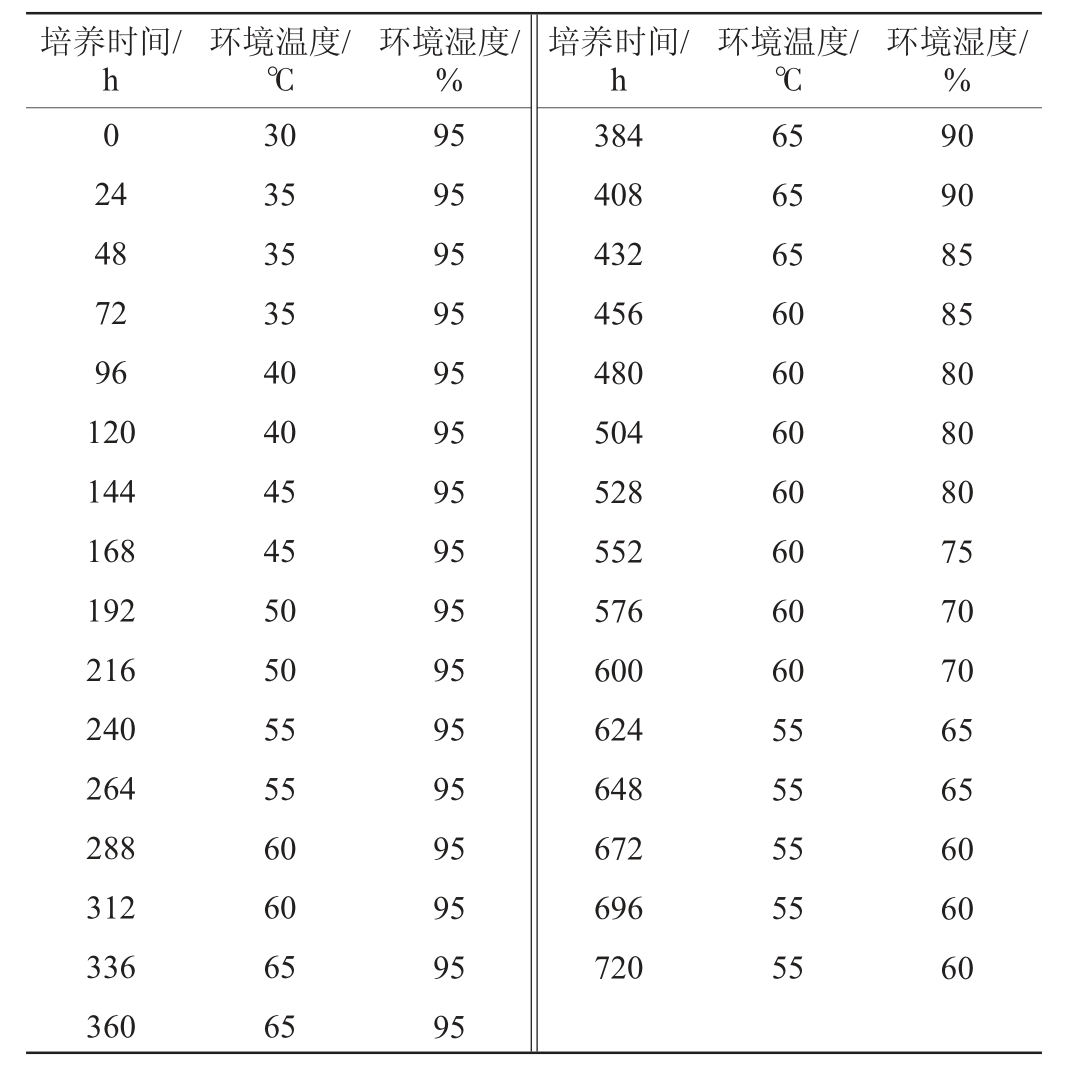
培养时间/h环境温度/℃环境湿度/%培养时间/h环境温度/℃环境湿度/%0 24 48 72 96 120 144 168 192 216 240 264 288 312 336 360 30 35 35 35 40 40 45 45 50 50 55 55 60 60 65 65 95 95 95 95 95 95 95 95 95 95 95 95 95 95 95 95 384 408 432 456 480 504 528 552 576 600 624 648 672 696 720 65 65 65 60 60 60 60 60 60 60 55 55 55 55 55 90 90 85 85 80 80 80 75 70 70 65 65 60 60 60
1.3.2 高通量测序
将不同工艺制作的青稞曲样品粉碎好,按照DNA提取试剂盒的说明进行微生物总DNA提取,后用1%琼脂糖凝胶电泳检测DNA提取的纯度和完整性,电压5 V/cm,时间为20 min。
PCR扩增体系为:10×PCR buffer(Mg2+plus)2.5 μL,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTP)Mixture 2.0 μL,上游引物1.0 μL,下游引物1.0 μL,DNA模板1.0 μL,rTaq DNA聚合酶(5 U/μL)0.3 μL,ddH2O 17.2 μL。
细 菌V3-V4 区 域 的 通 用 引 物 为:338F(5'-ACTCC TACGGGAGGCAGCAG-3')、806R(5'-GGACTACHVGGGTWTCTAAT-3'),PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增30个循环;72 ℃再延伸10 min,4 ℃保存。
真菌内转录间隔区域(internal transcribed spacer,ITS)的通用引物为ITS1F(5'-CTTGGTCATTAGAGGAAGTAA-3'),ITS2R(5'-GCTGCGTTCTTCATCGATGC-3'),PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增35个循环;72 ℃再延伸10 min,4 ℃保存。
PCR产物用1%琼脂糖凝胶电泳检测,使用Axy Prep DNA Gel Extraction Kit对PCR产物进行纯化。利用NEXTFLEXRapid DNA-Seq Kit进行建行文库构建,建库后利用Illumina公司的MiseqRPE300平台进行上机测序。
1.3.3 青稞白酒的制作工艺
除杂、泡粮:青稞经除尘、除杂后,进行泡粮,向清洗好的青稞中加入3倍质量的80 ℃水,浸泡12 h,以确保初始状态下青稞及泡涨之后的青稞均能浸泡在水中,使整粒青稞均匀吸水、膨化,利于蒸粮。
蒸粮:将泡好的青稞进行蒸煮,蒸煮时间3 h,打量水按照投粮量的10%分两次进行。
摊凉拌曲:将蒸好的青稞粮醅均匀铺撒进行摊晾(投料期间,铺撒前可洒入适量量水,并翻拌均匀),将青稞粮醅温度降至25 ℃左右,等量分成数份,分别撒入10%上述不同青稞曲粉,并翻拌均匀。
入桶发酵:将上述拌曲后粮醅分别放入20 L不锈钢发酵桶内进行发酵,28 ℃发酵30 d,定期查看不锈钢发酵桶,预防漏气、染菌。
取醅蒸馏:发酵完毕,取酒醅并添加10%稻壳,混拌均匀,然后进行上甑蒸馏,即得青稞白酒原酒。上甑要求“轻、松、薄、均、缓”,保证酒醅在甑内疏松均匀,不压气,不跑气。
1.3.4 青稞曲常规理化指标分析
酒曲理化指标等相关参数的检测参考QB/T 4257—2011《酿酒大曲通用分析方法》进行。
1.3.5 青稞白酒挥发性风味物质分析
将不同的酒样稀释至酒精度10%vol,量取稀释酒样8 mL,加入10 μL内标物质仲辛醇(500 mg/L),再加入3 g氯化钠振荡使其充分溶解。在50 ℃恒温水浴平衡5 min,萃取头(50/30 μm DVB/CAR/PDMS)顶空吸附45 min,进样时在进样口解吸5 min。
气相色谱条件:进样口温度250 ℃;载气高纯氦气(He,99.999%):恒流,柱流速1 mL/min;色谱柱出口压力0;进样体积1.0 μL;分流比10∶1;DB-FFAP色谱柱(60 m×0.25 mm×0.25 μm);升温程序:初始50 ℃,保持2 min;以6 ℃/min升至230 ℃,保持45 min,共78 min。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV;离子源230 ℃;四级杆温度150 ℃;传输线温度245℃;采用FullScan扫描模式;扫描质量范围:29~300 amu;溶剂延迟:5 min。
定性、定量方法:采用全扫描方式分析出峰的离子碎片信息,结合美国国家标准技术研究所(national institute of standards and technology,NIST)谱库进行分析;采用内标法对酒样中各化合物的含量进行计算,各化合物与内标色谱图峰面积比值和内标化合物浓度的乘积作为该化合物在酒样中的含量。
1.3.6 数据处理
利用SPSS26、Origin 2018对实验数据进行整理和作图分析,Cytoscape 3.8.0对微生物与挥发性风味物质数据的相关性进行可视化分析。
2 结果与分析
2.1 5种青稞曲样品常规理化指标分析
采用常规方法对5种青稞曲进行理化指标分析,结果见表3。
表3 5种青稞曲常规理化指标分析
Table 3 Analysis of conventional physicochemical indexes of 5 kinds of highland barley koji
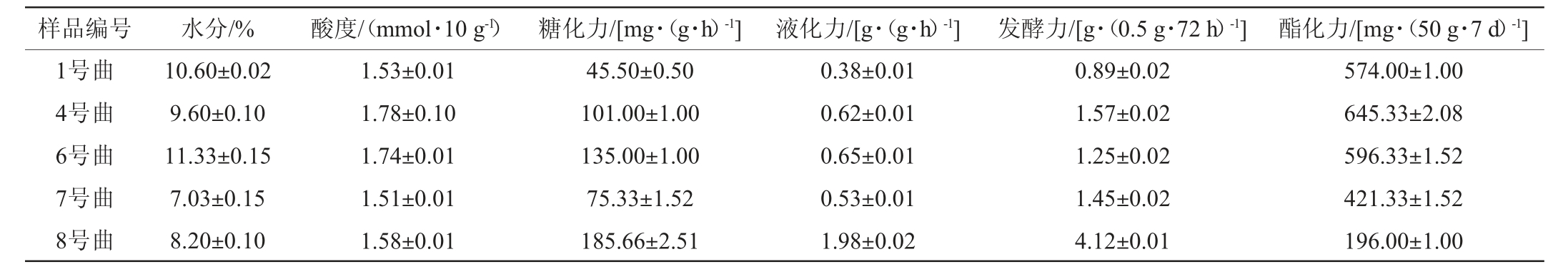
样品编号 水分/% 酸度/(mmol·10 g-1)糖化力/[mg·(g·h)-1] 液化力/[g·(g·h)-1] 发酵力/[g·(0.5 g·72 h)-1] 酯化力/[mg·(50 g·7 d)-1]1号曲4号曲6号曲7号曲8号曲10.60±0.02 9.60±0.10 11.33±0.15 7.03±0.15 8.20±0.10 1.53±0.01 1.78±0.10 1.74±0.01 1.51±0.01 1.58±0.01 45.50±0.50 101.00±1.00 135.00±1.00 75.33±1.52 185.66±2.51 0.38±0.01 0.62±0.01 0.65±0.01 0.53±0.01 1.98±0.02 0.89±0.02 1.57±0.02 1.25±0.02 1.45±0.02 4.12±0.01 574.00±1.00 645.33±2.08 596.33±1.52 421.33±1.52 196.00±1.00
5种工艺制作得到水分含量不同的青稞曲,理化指标间存在差异。6号曲水分含量最高,7号曲含量最低;4号曲酸度最高,7号曲最低;8号曲糖化力、液化力、发酵力最高,1号曲最低;4号曲酯化力最高,8号曲最低。通过以上理化指标间的差异,发现8号曲的酸度、糖化力、液化力、发酵力是5种曲中较好的,更适合青稞酒的酿造。另外,5种不同工艺青稞曲在酿造性能参数上均存在着不同程度的差异,说明制曲的水分含量、青稞粉粗细比例以及制曲工艺均能够直接影响青稞曲的酿造理化指标,这些差异将直接影响青稞酒醅发酵过程中微生物的代谢,进而影响西藏青稞白酒中的挥发性风味物质成分。
2.2 5种青稞曲细菌Alpha多样性分析
Alpha多样性分析可反映所测样本中微生物群落物种的丰富度与多样性,其中菌群的丰富度是衡量一个生态系统中含有多少不同的物种,主要是以Chao1指数与ACE指数来表现,一般值越高,表明丰富度越高。菌群的多样性指数主要是包括Shannon指数与Simpson指数,一般值越大,表明多样性越高[21]。对5种青稞曲中细菌多样性进行评价,结果见表4。
表4 5种青稞曲细菌Alpha多样性
Table 4 Alpha diversity of bacteria in 5 kinds of highland barley koji
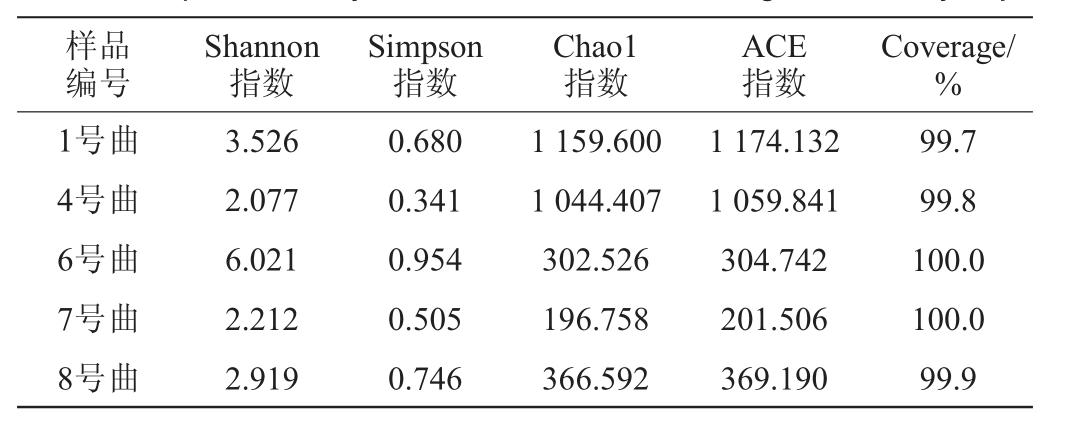
样品编号Shannon指数Simpson指数Chao1指数ACE指数Coverage/%1号曲4号曲6号曲7号曲8号曲3.526 2.077 6.021 2.212 2.919 0.680 0.341 0.954 0.505 0.746 1 159.600 1 044.407 302.526 196.758 366.592 1 174.132 1 059.841 304.742 201.506 369.190 99.7 99.8 100.0 100.0 99.9
由表4可知,5种青稞曲的覆盖率(Coverage)均在99%以上,说明文库的覆盖率基本涵盖样本中的所有序列,表明此次测序结果较为可靠,大部分微生物都已被检出。5种青稞曲所检测出的细菌Alpha多样性指数存在较大差异,其中6号曲Shannon指数最高,具有最高的细菌多样性,所含细菌的种类多于其他样品。1号曲、4号曲的ACE指数、Chao 1指数远高于其他青稞曲,表示这两个样品的细菌丰富度较其他青稞曲高。7号曲的多样性指数及丰富度指数均较低,表示该样品的细菌多样性及丰富度低于其他样品,说明仅用青稞粗粉工艺制作的青稞曲中细菌种类较其他曲低,可能是因为青稞粉碎过粗,制成的区块过于疏松,制曲过程中水分容易蒸发,热量也不容易保持,不利于细菌的生长与富集。
2.3 5种青稞曲细菌OTU数目分析
5种青稞曲细菌OTU数目Venn图见图1。
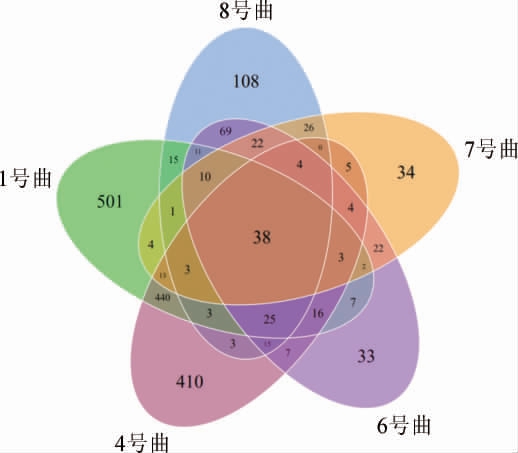
图1 5种青稞曲细菌OTU数目Venn图
Fig.1 Venn diagram of OTU number of bacteria in 5 kinds of highland barley koji
由图1可知,青稞曲中共同含有的细菌OTU数目为38个;1号曲特有OTU501个、4号曲特有OTU410个、6号曲特有OTU33个、7号曲特有OTU34个、8号曲特有OTU108个。
2.4 5种青稞曲细菌群落结构分析
在所检出的众多微生物中,有些微生物含量过少,不具有代表意义。所以,将相对丰度<1%的微生物归为其他类(others),相对丰度>1%的按丰度大小进行绘图。5种青稞曲细菌在属水平的群落结构见图2。
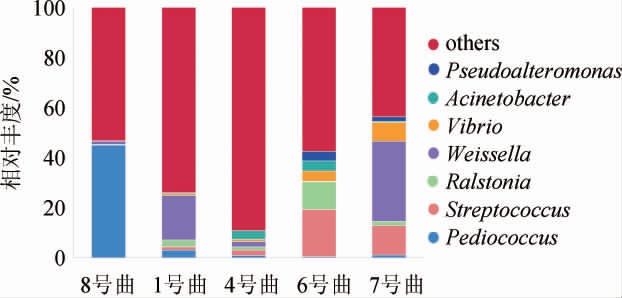
图2 5种青稞曲细菌在属水平的群落结构
Fig.2 Community structure of bacteria in 5 kinds of highland barley koji at genus level
由图2可知,5种青稞曲中细菌群落结构差异较大,其他类相对丰度最高,表示青稞曲中细菌组成较为复杂。在1号曲和7号曲中魏斯氏菌属(Weissella)相对丰度较高,为优势菌属,且7号曲的相对丰度高,7号曲只用了粗粉且比1号曲的水分含量高,说明粗细粉的比例、含水量的差异均对酒曲微生物组成产生一定影响,魏斯氏菌属代谢产生乳酸、乙酸等物质,可提升后期白酒柔和醇厚的口感。6号曲、7号曲中链球菌属(Streptococcus)相对丰度较高,6号曲中的优势菌属罗尔斯通氏菌属(Ralstonia)相对丰度较高。4号曲中,除其他菌属(others)外,各菌属相对丰度较低。1号曲、4号曲、6号曲与7号曲细菌群落结构相似,而8号曲中的片球菌属相对丰度较高,这可能与添加的小曲粉原料有关。
2.5 5种青稞曲细菌Beta多样性分析
5种青稞曲中细菌在基于Unweighted Unifrac距离的非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析图见图3。
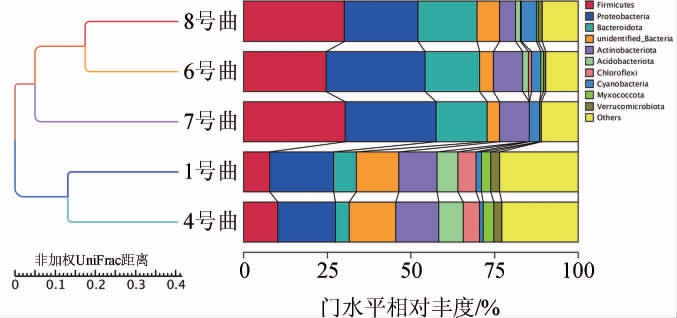
图3 5种青稞曲细菌UPGMA聚类结果
Fig.3 UPGMA clustering results of bacteria in 5 kinds of highland barley koji
由图3可知,5种青稞曲可分为2类:6号曲、8号曲先聚为一类、再与7号曲共同聚为一类,1号曲与4号曲聚为一类。说明1号曲与4号曲细菌菌落结构较为相似,7号曲与6号曲、8号曲细菌菌落结构相似度较高,1号曲、4号曲菌落结构相似度低。
2.6 5种青稞曲真菌Alpha多样性分析
5种青稞曲真菌Alpha多样性分析见表5。
表5 5种青稞曲真菌Alpha多样性
Table 5 Alpha diversity of fungi in 5 kinds of highland barley koji
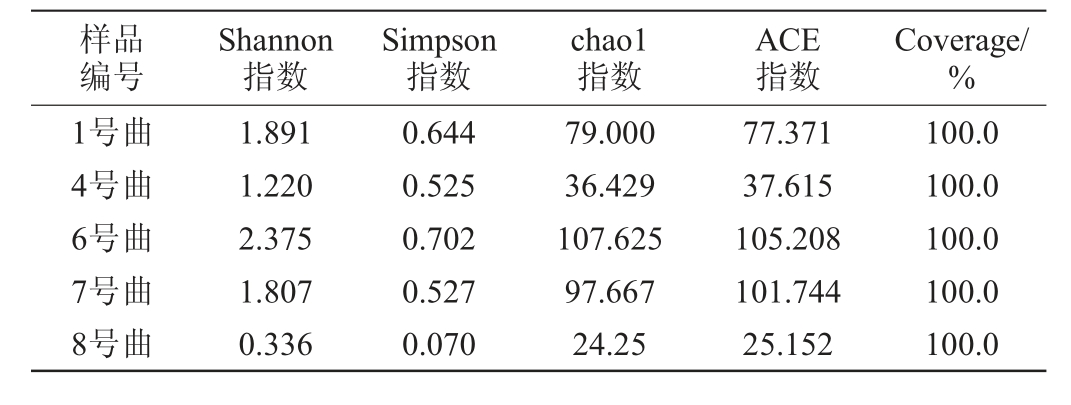
样品编号Shannon指数Simpson指数chao1指数ACE指数Coverage/%1号曲4号曲6号曲7号曲8号曲1.891 1.220 2.375 1.807 0.336 0.644 0.525 0.702 0.527 0.070 79.000 36.429 107.625 97.667 24.25 77.371 37.615 105.208 101.744 25.152 100.0 100.0 100.0 100.0 100.0
由表5可知,5种青稞曲的覆盖率均为100%,表明此次测序结果较为可靠,足以反映其物种的多样性。在5种青稞曲中,6号曲中的Shannon、Simpson、Chao1、ACE指数最高,8号曲中各项指数最低,表示6号曲的真菌多样性最高,8号曲的真菌多样性最低。6号曲中真菌多样性高,这可能是与曲中添加了一定量的糌粑粉有关,糌粑粉是青稞膨化后磨成的粉,营养成分易于被微生物分解代谢,因此,在制曲过程中,一定程度上可能促进了真菌微生物的生长与富集。
2.7 5种青稞曲真菌OTU数目分析
5种青稞曲真菌OTU数目Venn图见图4。
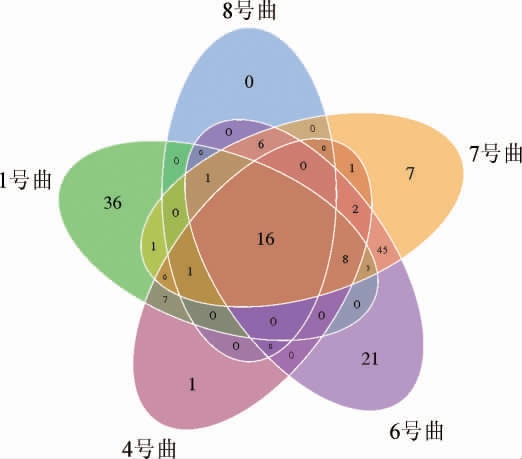
图4 5种青稞曲真菌OTU数目Venn图
Fig.4 Venn diagram of OTU number of fungi in 5 kinds of highland barley koji
由图4可知,青稞曲中共同含有真菌OTU16个,1号曲特有OTU36个、4号曲特有OTU1个、6号曲特有OTU21个、7号曲特有OTU7个、8号曲无特有OTU。
2.8 5种青稞曲真菌群落结构分析
5种青稞曲真菌在属水平的群落结构分析见图5。
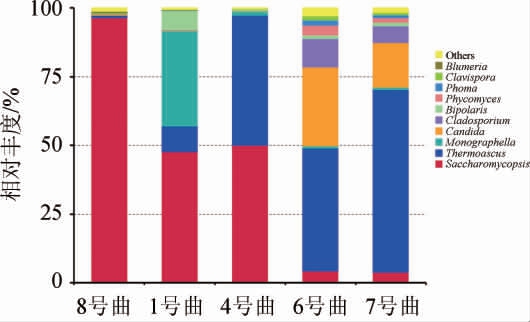
图5 5种青稞曲真菌在属水平的群落结构
Fig.5 Community structure of fungi in 5 kinds of highland barley koji at genus level
由图5可知,5种青稞曲中共有的优势菌属为覆膜孢酵母属(Saccharomycopsis),在8号曲中占有绝对优势,其相对丰度在95%以上,说明真菌较单一,但是数量大。在1号曲和4号曲中,覆膜孢酵母属(Saccharomycopsis)所占相对丰度也在50%左右,主要差异体现在Monographella和热子囊菌属(Thermoascus),其中前者是1号曲中的特有优势菌属,且相对丰度较高,可能来源于青稞原料,而后者在4号曲中相对丰度处于较高的水平,具有产淀粉酶的功能,用于白酒酿造。1号曲和4号曲的粗粉细粉比例相同,但是水分含量有所差异,说明水分含量对酒曲微生物的组成也产生了显著的影响。覆膜孢酵母属(Saccharomycopsis)在6号曲、7号曲中相对丰度较低,不足10%,与1号曲、4号曲和8号曲差异显著。热子囊菌属(Thermoascus)也是样品中优势菌属,除8号曲外,在其余4个样品中所占相对丰度均较高。6、7号曲真菌群落结构相似,其第一优势菌属为热子囊菌属(Thermoascus)、第二优势菌属为假丝酵母属(Candida)、第三优势菌属为枝孢属(Cladosporium),第四优势菌属为覆膜孢酵母属(Saccharomycopsis)。
2.9 5种青稞曲真菌Beta多样性分析
5种青稞曲中真菌在基于Unweighted Unifrac距离的UPGMA聚类分析结果见图6。
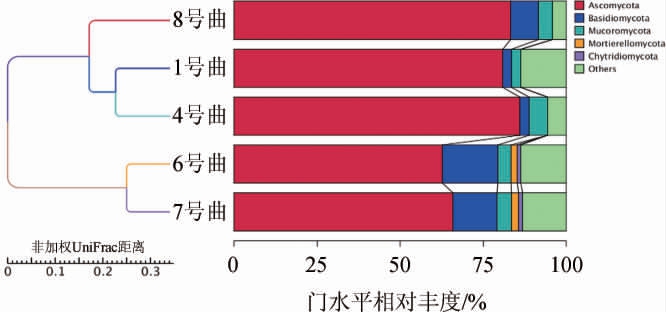
图6 5种青稞曲真菌UPGMA聚类结果
Fig.6 UPGMA clustering results of fungi in 5 kinds of highland barley koji
由图6可知,5种青稞曲可分为2类:1号曲、4号曲先聚为一类,再与8号曲共同聚为一类,6号曲、7号曲聚为一类。结合青稞曲的属水平真菌相对丰度柱形图分析,6号曲与7号曲真菌菌落结构较为相似,1号曲和4号曲菌落结构相似度较高,8号曲与1号曲、4号曲菌落结构相似度高,与6号曲、7号曲相似度低。
2.10 5种青稞曲酿造西藏青稞白酒挥发性风味物质分析
对5种青稞曲所酿造蒸馏的西藏青稞白酒的挥发性风味物质做聚类热图分析,结果见图7。
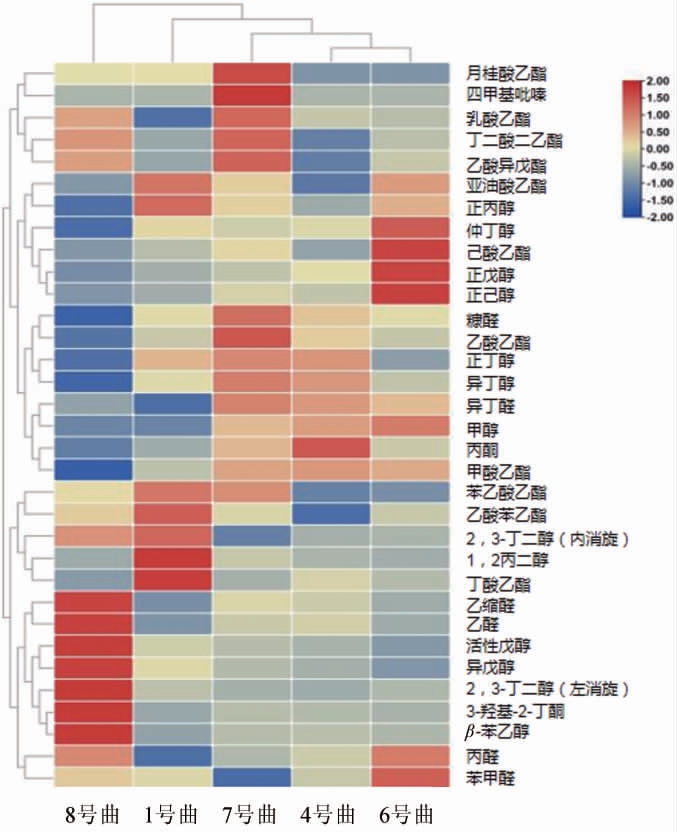
图7 5种青稞曲酿造青稞白酒挥发性风味物质热图
Fig.7 Heat map of volatile flavor substances in highland barley Baijiu brewed by 5 kinds of highland barley koji
颜色的深浅程度代表物质含量的高低,颜色越红表示相对含量越高,
颜色越蓝表示相对含量越低。
由图7可知,相对其他酒曲所酿造的西藏青稞白酒,8号曲酿造的西藏青稞白酒含量高的物质主要有乙醛、乙缩醛、活性戊醇、异戊醇、3-羟基-2-丁酮、β-苯乙醇等。其中含量最高的是乙醛和乙缩醛,乙醛具有亲和性,能够和乙醇缩合成乙缩醛;乙醛具有青苹果的香味,其能够对酒体提供较好的风味。但是,乙醛含量过高将会引起人体头痛,并且由于其可以促进毛细血管扩张,是喝酒脸红的主要成因。乙缩醛的气味芬芳、绵柔爽净,是调节酒体风味和绵软爽冽的重要物质,是白酒老熟和质量的重要指标[22]。此外,β-苯乙醇含量也高于其他酒曲所酿造的青稞白酒,β-苯乙醇具有淡雅蜜甜的玫瑰花香气,是米香型白酒的典型性挥发性风味物质。6号曲酿造的西藏青稞白酒含量高的物质主要有仲丁醇、己酸乙酯、正戊醇和正己醇。其中正己醇、己酸乙酯是浓香型白酒中的典型性挥发性风味物质[23-24]。7号曲酿造的西藏青稞白酒含量高的物质主要有月桂酸乙酯、4-甲基吡嗪、糠醛、乙酸乙酯和乳酸乙酯等。其中4-甲基吡嗪属于含氮香味成分,此类香味成分的产生突进除了美拉德反应途径外,还有蛋白质的热分解、氨基酸的加热分解反应和微生物的代谢等途径,其感官特征一般具有坚果、烘烤、水果和蔬菜等气味,其的嗅觉阈值极低,香气持久难消,对酒体空杯留香、形成酒体幽雅陈香和自然发酵香气、协调酒体香气等有很好的效果,对白酒风味有着重要的贡献作用,这类风味成分在白酒中含量甚微。在酱香型白酒的高温制曲、高温堆积、高温发酵等工艺环节中产生的吡嗪类化合物,除了酶或非酶参与的褐变反应生成的产物外,其他大部分是微生物的代谢产物,因为这三个阶段中都存在大量的可产生吡嗪类香味成分的枯草芽孢杆菌。1号曲酿造的青稞白酒含量高的物质主要是亚油酸乙酯、正丙醇、苯乙酸乙酯、乙酸苯乙酯、丁酸乙酯、1,2-丙二醇等挥发性风味物质。其中正丙醇,在不同香型白酒中,含量有着较明显的差异,酱香型白酒中正丙醇含量最高,含量变化幅度已比较大,浓香型和清香型白酒中正丙醇含量相对普遍较低。
对5种青稞曲所酿造的西藏青稞白酒的挥发性风味物质进行主成分分析,结果见图8。
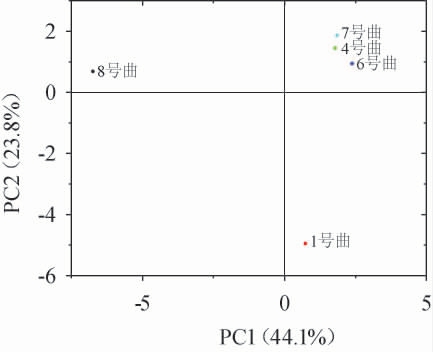
图8 5种青稞曲酿造西藏青稞白酒挥发性风味物质主成分分析结果
Fig.8 Principal component analysis results of volatile flavor substances in Tibetan highland barley Baijiu brewed by 5 kinds of highland barley koji
由图8可知,第一主成分和第二主成分的方差贡献率分别为44.1%和23.8%。此时,4号曲、6号曲和7号曲样品位置集中,距离较近,说明这三种青稞曲所酿造白酒样品挥发性风味物质相似度较高,与其他样品在PCA图中的距离较远,说明与其他两种曲(1号曲和8号曲)挥发性风味物质相似度较低。8号曲属于小曲工艺,与1号曲、4号曲、6号曲和7号曲具有显著性差异,说明了青稞曲类型对西藏青稞白酒风味成分的重要影响。
2.11 青稞曲中微生物与西藏青稞白酒挥发性风味物质的相关性分析
为探究青稞曲中微生物与所酿造西藏青稞白酒挥发性风味物质的关系,找出对挥发性风味物质有所影响的关键微生物,计算样品中相对丰度前10的细菌菌属、前10的真菌菌属与20种挥发性风味物质间的Sperman相关性系数ρ,选取|ρ|≥0.8且P<0.05、具有显著性关联的微生物与挥发性风味物质,使用Cytoscape 3.8.0对微生物与挥发性风味物质相关性进行可视化。青稞曲微生物与西藏青稞白酒挥发性挥发性风味物质间的相关性网络图见图9。
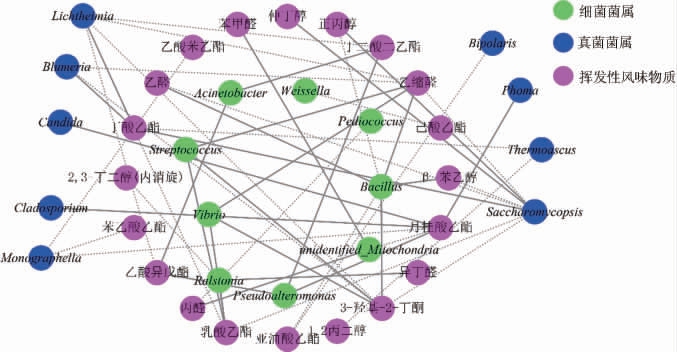
图9 5种青稞曲微生物与西藏青稞白酒挥发性风味物质的相关性网络图
Fig.9 Correlation network diagram of microorganisms in 5 kinds of highland barley koji and volatile flavor substances in Tibetan highland barley Baijiu
由图9可知,青稞曲中微生物与挥发性风味物质共有51种相关性,有9种细菌菌属、9种真菌菌属与9种酯类、5种醇类、5种醛类、1种酮类,共计20种挥发性风味物质存在较强相关性。
芽孢杆菌属(Bacillus)、链球菌属(Streptococcus)、假单胞菌属(Pseudoalteromonas)、弧菌属(Vibrio)是连接数较多的细菌菌属,与乙醛、乙缩醛、乳酸乙酯、3-羟基-2-丁酮、乳酸乙酯等挥发性风味物质存在显著的正相关性,覆膜孢酵母属(Saccharomycopsis)是连接数较多的真菌菌属,与正丙醇、仲丁醇、丁酸乙酯等挥发性风味物质存在显著的正相关性。
青稞曲中微生物与酿造西藏青稞白酒挥发性风味物质的相关性分析结果表明,这些连接数较多的微生物可能对西藏青稞白酒的挥发性风味物质产生重要影响,最终影响产品的品质[7,25]。
3 结论
以5种青稞曲为研究对象,通过微生物多样性、菌群结构和所酿造西藏青稞白酒挥发性风味的检测分析,揭示了青稞曲中微生物菌群与挥发性风味的相关性。根据高通量分析结果可知,对于5种不同工艺青稞曲,在细菌属水平上,片球菌属(Pediococcus)、魏斯氏菌属(Weissella)、链球菌属(Streptococcus)、罗尔斯通氏菌属(Ralstonia)为样品的优势菌属。在真菌属水平上,覆膜孢酵母属(Saccharomycopsis)、热子囊菌属(Thermoascus)、假丝酵母属(Candida)为样品中的优势菌属。其中酒曲类型(青稞小曲和青稞大曲)差异,含水量(高和低)差异,粗细粉比例(高和低)差异,糌粑粉(加与不加)差异均能够影响酒曲理化指标和微生物组成,表明了制曲工艺的差异对青稞曲理化指标、微生物多样性、菌群结构以及西藏青稞白酒挥发性风味物质具有显著性影响。
本研究对西藏青稞曲的微生物多样性以及对酒体风味影响进行了分析,以期为西藏自治区传统特色发酵食品的微生物资源库的构建、功能菌种的筛选与评价、西藏青稞白酒风格剖析与调控,以及提高西藏青稞白酒的质量提供一定的理论基础。
[1]张志薇,靳玉龙,刘小娇,等.传统青稞酒现状探究[J].西藏农业科技,2020,42(1):91-93.
[2]高文俊.青稞酒重要风味成分及其酒醅中香气物质研究[D].无锡:江南大学,2014.
[3]焦兴弘.舟曲青稞酒的营养价值及保健功能[J].食品安全导刊,2020(12):95.
[4]冯声宝,喇录忠,李寻,等.青稞酒风味的独特性[J].休闲读品,2021(2):82-85.
[5]GUO L X,LUO Y M,ZHOU Y,et al.Exploring microbial dynamics associated with flavours production during highland barley wine fermentation[J].Food Res Int,2020,130:108971.
[6] YANG Q L, YAO H L, LIU S P, et al.Interaction and application of molds and yeasts in Chinese fermented foods[J].Front Microbiol,2022,12:664850.
[7]QIAN Y L,AN Y,CHEN S,et al.Characterization of Qingke liquor aroma from Tibet[J].J Agr Food Chem,2019,67(50):13870-13881.
[8]王柏文,吴群,徐岩,等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报,2021,48(5):1737-1746.
[9]黄和强,张芬军,李善文,等.夏冬两季青稞酒发酵过程中酒醅微生物菌群多样性分析[J].酿酒,2021,48(2):71-76.
[10]陈孝,温承坤,巩园园,等.酒曲的研究进展[J].中国酿造,2019,38(10):7-11.
[11]王晓燕,王蓉福,张昊宇,等.青稞酒曲中糖化菌的筛选鉴定及降低青稞淀粉工艺优化[J].食品与发酵工业,2020,46(5):160-165.
[12]张晓蒙,李德美,金玮鋆,等.西藏青稞酒酿造小曲微生物多样性分析[J].中国酿造,2018,37(9):28-33.
[13]MA W R,GENG X J,JIA F C,et al.Investigation of microbial composition and functional characterization of Zangqu using high throughput sequencing[J].LWT-Food Sci Technol,2021,136:110342.
[14]郭小芳,王燕鸽,刘帅,等.西藏青稞酒曲中真菌的分离与鉴定[J].西藏大学学报(自然科学版),2014,29(6):37-43.
[15]赵东.西藏青稞酒酒曲微生物多样性的研究[D].泰安:山东农业大学,2011.
[16]黄昊,哈祖德,顾京赛,等.西藏传统青稞酒酿造用藏曲中主要酵母菌的分离及酿造特性研究[J].食品与发酵工业,2021,47:8-14.
[17]刘小改,李洪媛,周林艳,等.清香型大曲中产香细菌的分离筛选及鉴定[J].中国酿造,2022,41(5):96-100.
[18] WANG X D, BAN S D, HU B D, et al.Bacterial diversity of Moutaiflavour Daqu based on high-throughput sequencing method[J].J I Brewing,2017,123(1):138-143.
[19]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[20]刘义刚,李兰.青稞小曲白酒生产方法初论[J].酿酒科技,2002(4):57-59.
[21]JU F,ZHANG T.16S rRNA gene high-throughput sequencing data mining of microbial diversity and interactions[J].Appl Microbiol Biotechnol,2015,99(10):4119-4129.
[22]朱梦旭,范文来,徐岩.我国白酒蒸馏过程及原酒、成品酒中乙醛的研究[J].食品与发酵工业,2016,42(4):6-11.
[23] ZHENG J, HE Z L, YANG K Z, et al.Volatile analysis of Wuliangye Baijiu by LiChrolut EN SPE fractionation coupled with comprehensive GC×GC-TOFMS[J].Molecules,2022,27(4):1318.
[24]胡景辉,陈禹锜,薛新新,等.浓香型白酒发展概述[J].中国酿造,2022,41(6):24-30.
[25] ZHA M S, SUN B G, WU Y P, et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Wickerhamomyces anomalus for Chinese Baijiu making[J].J Biosci Bioeng,2018,126(2):189-195.