“曲为酒之骨”,酒曲是中国白酒生产重要的糖化剂、发酵剂和生香剂,对白酒品质的形成至关重要。根据制作工艺的不同,酒曲可分为大曲、小曲、麸曲等,并应用于不同香型白酒的生产[1]。
芝麻香型白酒作为建国后发展起来的一种创新香型白酒,近年来因其独特、淡雅的芝麻香风味受到消费者的喜爱[2]。与其他香型的白酒相比,用于制作芝麻香型白酒的酒曲更为复杂,包括高温大曲和细菌曲、酵母曲、霉菌曲,即“大麸结合,多微共酵”[3]。大曲是以大麦(或小麦、豌豆、高粱等)为主要原料,经自然培菌、发酵、储存而成的酒曲[4]。根据制备过程中可达到的最高品温,大曲可分为高温(60~70 ℃)、中温(50~60 ℃)和低温(40~50 ℃)大曲三种类型[1]。芝麻香型白酒的制作一般选用中温大曲和高温大曲[5]。麸曲是以麸皮为原料,通过接种纯种菌株制作而成的酒曲[6]。根据接种菌株的不同,麸曲可分为细菌曲、霉菌曲和酵母曲[5]。大曲制作采用自然接种,形成了复杂而独特的微生物群落结构和众多的香气物质,能增加酒体的饱满度和优雅度[7],但相对于麸曲,其耐酸性、耐热性及糖化力较弱;而麸曲通过添加人为筛选的纯种微生物,可以通过提高蛋白酶、淀粉酶和葡萄糖淀粉酶等酶的含量增加其糖化力和液化力,并在高温高湿的环境下仍能保持。但是麸曲中菌种单一,香味前体物质有限,对酒体的醇厚度、细腻度贡献较低[7]。同时使用大曲和麸曲作为发酵剂能融合各自的优点,对芝麻香型白酒的独特风味的形成至关重要。因此,了解麸曲和大曲的微生物群落结构和功能的差异,对芝麻香型白酒的研究具有重要意义。
近年来,随着现代分子生物学技术的发展,基于免培养的高通量测序技术被广泛应用于解析不同酒曲微生物群落组成[8-11]。以高通量测序为主的分子生物技术相比于传统培养法,具有高灵敏度、快速、高通量等优点,还可以避免在培养中微生物种群结构发生变化、微生物多样性丢失等局限,能够更直接和全面地反映样品微生物的原始组成[12-13]。GOU M等[14]比较了大曲、小曲和麸曲中的微生物群落,发现三种酒曲中的优势细菌和真菌存在显著差异。虽然高通量测序技术已被广泛应用于分析各类酒曲的微生物群落,但尚未阐明应用于制作芝麻香型白酒用曲的微生物群落差异,并且关于麸曲的理化性质差异的报道有限。因此,本研究对4种芝麻香型酒曲(高温大曲、细菌曲、酵母曲、霉菌曲)的理化指标进行检测,并基于高通量测序技术对其微生物群落组成进行比较分析。在此基础上,利用PICRUSt2基于京都基因与基因组百科全书(Kyoto encyclo pedia of genes and genomes,KEGG)通路对微生物的潜在功能进行预测,为芝麻香型白酒的生产提供理论基础。
1 材料与方法
1.1 材料与试剂
高温大曲(DQ)和麸曲(细菌曲(FQB)、酵母曲(FQY)、霉菌曲(FQM)):某芝麻香型酒厂。
TIANGEN Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit试剂盒:北京天根生化科技有限公司;饱和盐酸溶液、氯化钠、无水乙醇(均为分析纯):中国医药集团有限公司;氢氧化钠(分析纯):上海麦克林生化试剂公司。
1.2 仪器与设备
DPH-9052微生物培养箱:上海一恒科学仪器有限公司;RS489恒温摇床:北京东联哈尔仪器有限公司;BSA2202S电子天平:北京赛多利斯科学仪器有限公司;GeneAmp 9700聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;PowerPace Basic琼脂糖凝胶电泳仪:美国Bio-Rad公司;TGL-20M台式高速冷冻离心机:长沙平凡仪器仪表有限公司;Multiskan FC酶标仪:美国赛默飞世尔仪器有限公司。
1.3 方法
1.3.1 芝麻香型酒曲理化指标的分析
参照QB/T 4257—2011《酿酒大曲通用分析方法》对酒曲样本的水分、酸度、液化力和糖化力进行检测。液化力定义为:在35 ℃、pH 4.6条件下,1.0 g绝干酒曲1 h能液化淀粉的克数为一个单位(U),以g/(g·h)表示;糖化力定义为:在35 ℃、pH 4.6条件下,1.0 g酒曲转化可溶性淀粉生成葡萄糖的毫克数为一个单位(U),以mg/(g·h)表示。
1.3.2 DNA提取、PCR扩增及Illumina Miseq高通量测序
使用TIANGEN Soil DNA Kit对酒曲样本的DNA进行提取。并使用1%琼脂糖凝胶电泳对提取的DNA的完整性和纯度进行检测。使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GTGGACTACHVGGGTWTCTAAT-3')对细菌16S rRNA基因的V3-V4区基因序列进行PCR扩增。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,40 ℃复性30 s,72 ℃延伸1 min,循环30次;72 ℃再延伸5 min。使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-TGCGTTCTTCATCGATGC-3')对真菌的ITS区基因序列进行PCR扩增。PCR扩增程序:94℃预变性5min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,循环34次;72 ℃再延伸7 min。PCR扩增体系(25 μL):DNA模板2 μL,正向引物(5 μmol/L)1 μL,反向引物(5 μmol/L)1 μL,牛血清白蛋白(2 ng/μL)3 μL,2×Taq Plus Master Mix 12.5 μL,双蒸水(ddH2O)5.5 μL。纯化后的扩增子根据标准操作在Illumina MiSeq PE300系统上进行双端测序。
1.3.3 测序数据处理与生物信息学
在QIIME2平台上,对测序数据进行处理和生物信息学分析[15]。使用DADA2插件[16]对原始序列进行质量过滤、去噪、合并和去除嵌合体,生成扩增子序列变异体(amplicon sequence variants,ASV)。以Silva数据库(细菌)和Unite数据库(真菌)为参考,使用朴素贝叶斯分类器对所有的ASVs进行分类学注释。根据ASVs丰度信息,进行Alpha多样性分析,计算Shannon和Chao1指数,反映微生物的多样性和丰富度。使用PICRUSt2[17]预测酒曲中细菌和真菌的潜在功能。
1.3.4 统计分析
使用IBM-SPSS 25进行统计分析。采用单因素方差分析(analysis of variance,ANOVA)和Duncan's对理化性质的差异显著性进行分析。使用Origin Lab 9.0绘图。
2 结果与分析
2.1 芝麻香型酒曲的理化指标分析
理化指标是反映酒曲质量的重要参数。高温大曲、细菌曲、霉菌曲和酵母曲的理化指标见图1。
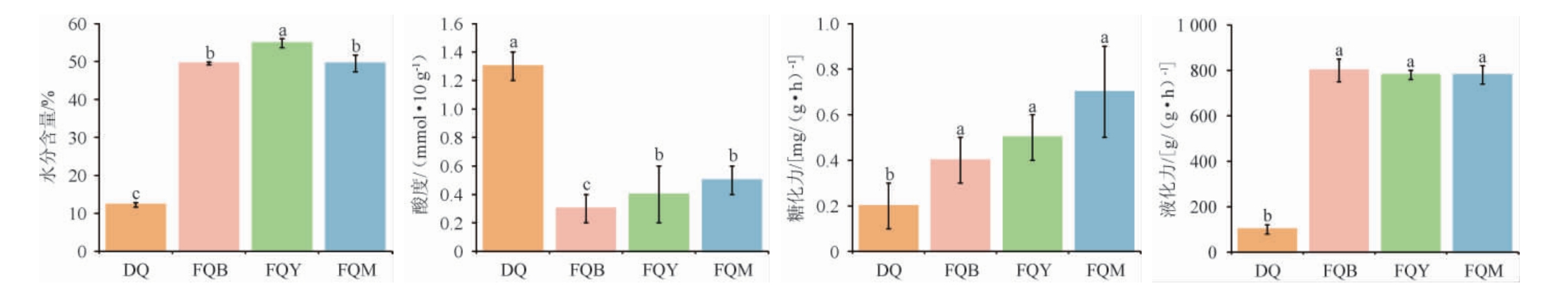
图1 4种芝麻香型酒曲的理化指标
Fig.1 Physicochemical indexes of four kinds of sesame-flavor Jiuqu
不同小写字母表示差异显著(P<0.05)。
由图1可知,3种麸曲的平均含水量为51.3%,大曲的含水量为12.3%,这可能是由于麸曲和大曲的生产工艺不同所致。适宜的水分含量对酒曲的质量有重要影响,水分含量过低,酒曲过于干燥,达不到酒曲中微生物生长繁殖所需要的水分含量;水分含量过高,酒曲容易二次生霉,从而降低酒曲的品质[18]。含水量的高低还会对麸曲的糖化力和液化力有影响。颜兵[19]研究发现,麸曲的液化酶活性受含水量的影响较小,而糖化酶活性受含水量的影响较大,随着含水量的增加,麸曲的糖化酶活力先升高后降低,当含水量为50%时,麸曲的糖化酶活性最高。
酸度是酒曲的关键性指标之一,是微生物综合作用的结果。适宜的酸度有利于酒曲中有益微生物的生长繁殖。4种芝麻香型酒曲的酸度由高到低分别为:大曲(1.3 mmol/10g)>霉菌曲(0.5 mmol/10 g)>酵母曲(0.4 mmol/10 g)>细菌曲(0.3 mmol/10 g)。大曲的酸度显著高于麸曲(P<0.05),可能是由于大曲中微生物较为复杂,有一定数量的产酸菌,而麸曲中的产酸菌,如乳酸菌含量较低[14]。
糖化力和液化力是衡量酒曲发酵性能的重要指标[20]。大曲的糖化力和液化力显著低于麸曲(P<0.05),这主要与大曲和麸曲中的微生物组成有关,麸曲制作过程中通过人为添加纯化菌株增强了其糖化力和液化力[7]。
综上,结果表明,麸曲的水分含量、液化力和糖化力均显著高于大曲(P<0.05),而大曲的酸度显著高于麸曲(P<0.05)。
2.2 芝麻香型酒曲的微生物菌群多样性分析
4种芝麻香型酒曲的微生物Alpha多样性分析结果见表1。由表1可知,大曲和细菌曲的真菌群落多样性(Shannon指数)和丰富度(Chao1指数)高于细菌群落,霉菌曲和酵母曲则相反。其中,大曲的细菌群落多样性和丰富度与真菌群落多样性最高,其细菌Shannon指数、Chao1指数及真菌Shannon指数分别为3.07、47.50、3.42;酵母曲的细菌和真菌群落多样性最低,其细菌和真菌的Shannon指数分别为2.45和0.26;霉菌曲的真菌群落丰富度最低,其真菌Chao1指数为10.00;细菌曲的真菌群落丰富度最高,而细菌群落丰富度最低,其真菌和细菌的Chao1指数分别为11.50和50.50。结果表明,大曲中含有较多种类和较为丰富的微生物群落,而细菌曲中细菌群落较为单一,酵母曲和霉菌曲中真菌群落较为单一。
表1 4种芝麻香型酒曲微生物菌群的Alpha多样性分析结果
Table 1 Alpha diversity analysis results of microbial community in four kinds of sesame-flavor Jiuqu
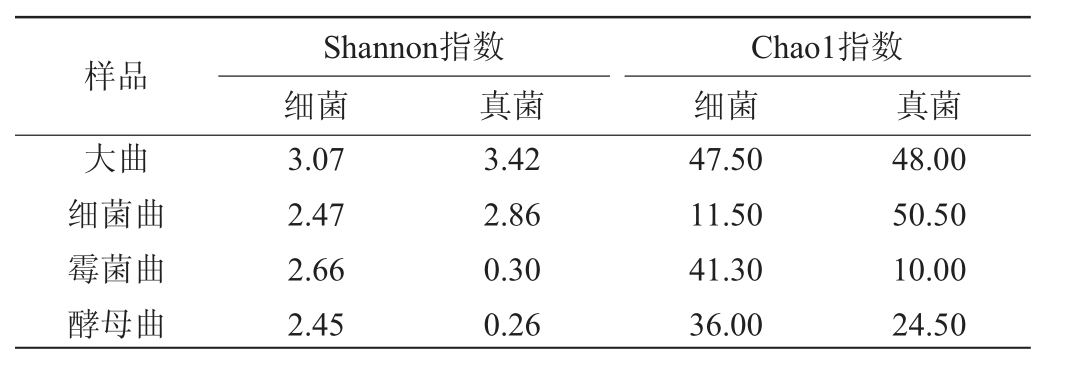
样品大曲细菌曲霉菌曲酵母曲Shannon指数细菌真菌Chao1指数细菌 真菌3.07 2.47 2.66 2.45 3.42 2.86 0.30 0.26 47.50 11.50 41.30 36.00 48.00 50.50 10.00 24.50
为了比较麸曲样本和大曲样本之间的微生物群落组成差异,基于ASVs绘制4种芝麻香型酒曲的Venn图和Upset图,结果见图2。由图2可知,4个样品共检出133个细菌ASVs和214个真菌ASVs,共有的真菌ASVs有4个,没有共有的细菌ASVs。其中,大曲中的细菌ASVs数量最多(76个);细菌曲中的真菌ASVs数量最多(92个),细菌曲中ASVs数量最少(13个);霉菌曲中的真菌ASVs数量最少(18个)。综上,4种芝麻香型酒曲的微生物群落组成存在一定差异。
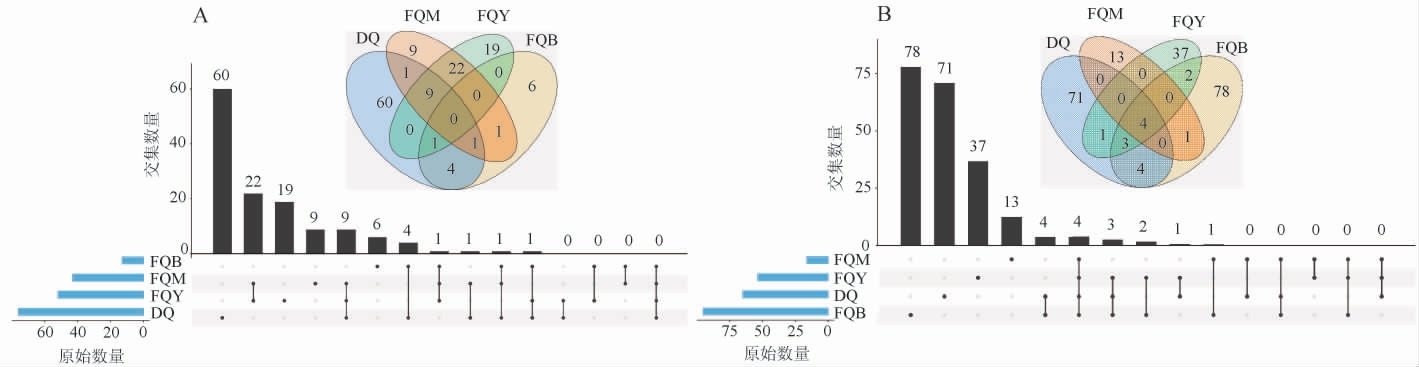
图2 4种芝麻香型酒曲细菌(A)和真菌(B)扩增子序列变异体的Venn图和Upset图
Fig.2 Venn and Upset diagrams of bacterial (A) and fungal (B) amplicon sequence variants of four kinds of sesame-flavor Jiuqu
2.3 芝麻香型酒曲的微生物群落组成
为了阐明不同酒曲菌群的组成,将高通量测序得到的所有具有代表性的ASVs在Silva和Unite数据库中进行比对和注释,4种酒曲样品在门和属水平上的微生物菌群组成见图3。
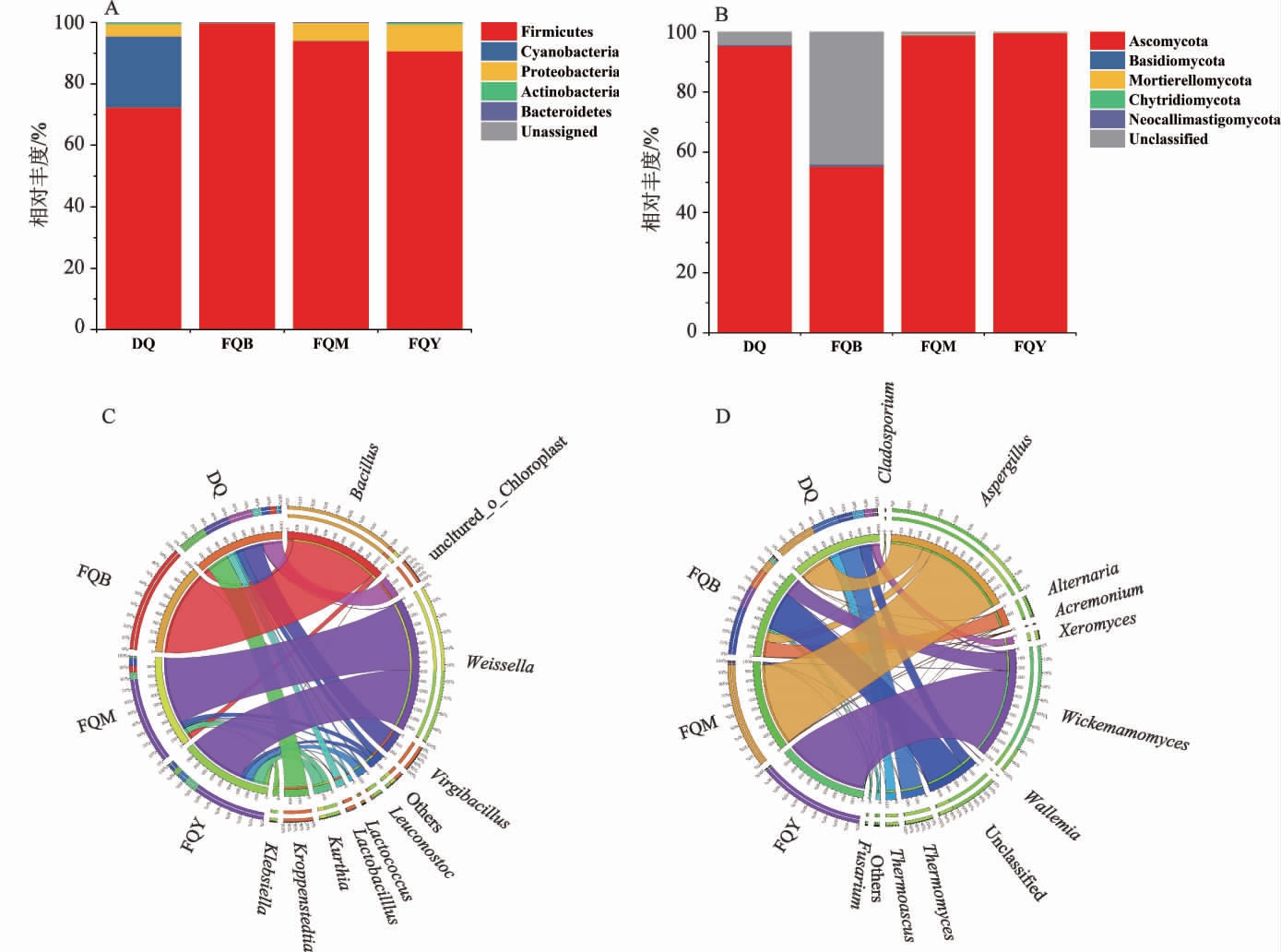
图3 基于门和属水平4种芝麻香型酒曲细菌(A和C)和真菌(B和D)群落组成
Fig.3 Composition of bacterial (A and C) and fungal (B and D) community at the phylum and genus level in four kinds of sesame-flavor Jiuqu
由图3A可知,在细菌门水平上,所有酒曲中均以厚壁菌门(Firmicutes)为主,且麸曲中厚壁菌门的相对丰度(细菌曲99.8%,霉菌曲94.0%,酵母曲90.7%)高于大曲(72.4%)。由图3C可知,在细菌属水平上,酵母曲中细菌属以魏斯氏菌属(Weissella)(66.5%)为主,其次为库特氏菌属(Kurthia)(12.6%)、明串珠菌属(Leuconostoc)(8.20%)和克雷伯氏菌属(Klebsiella)(5.63%)。霉菌曲中细菌属以魏斯氏菌属(78.3%)为主,其次为库特氏菌属(6.69%)和芽孢杆菌属(Bacillus)(6.04%)。而细菌曲的细菌组成相对简单,以芽孢杆菌属(99%)为主。大曲中的细菌群落较为丰富,相对丰度较高的细菌属为克罗彭斯特菌属(Kroppenstedtia)(26.5%)、枝芽孢杆菌属(Virgibacillus)(23.7%),其次为乳酸杆菌属(Lactobacillus)(8.7%),这与以往的研究一致[21-22]。乳酸杆菌属能将葡萄糖或淀粉转化为乳酸,使酒曲的酸度升高,促进酒精发酵顺利进行,同时乳酸与酯类结合可以生成白酒中重要的风味物质乳酸乙酯[23]。大曲中存在一定数量的乳酸杆菌属,而在麸曲中未检出,这也与大曲较高的酸度相一致。芽孢杆菌属是酒曲中常见的耐热微生物,具有分泌淀粉酶、蛋白酶和产吡嗪类风味物质的能力[24-25],是酒曲中重要的功能微生物。细菌曲中芽孢杆菌属的相对丰度较高,与其较高的糖化力和液化力相一致。
由图3B可知,在真菌门水平上,所有酒曲中主要的真菌门均为子囊菌门(Ascomycota)。由图3D可知,在真菌属水平上,霉菌曲和酵母曲的真菌群落组成相对简单,分别以曲霉属(Aspergillus)(96.2%)和异常威克汉姆酵母属(Wickerhamomyces)(97.7%)为主。大曲中相对丰度较高的真菌属为曲霉属(37.2%)和嗜热真菌属(Thermomyces)(25.5%)。细菌曲中异常威克汉姆酵母属的相对丰度较高(20.6%)。曲霉属是酒曲中常见的优势霉菌,能够分泌淀粉酶、蛋白酶等多种水解酶,对白酒的出酒率和质量有重要影响[26]。霉菌曲中曲霉属的相对丰度较高,与其较高的糖化力和液化力相一致。异常威克汉姆酵母属能分泌多种糖苷酶、酯化酶,具有一定的产香和产酒精能力[27]。酵母曲中异常威克汉姆酵母属相对丰度较高,与其功能相一致[7]。
总体而言,大曲的微生物群落组成比麸曲更丰富,这与大曲和麸曲的制作工艺有关。在制作麸曲时,人为添加了纯化菌种,最终形成了较为单一的菌落结构。而大曲通常在露天环境下自然发酵,其微生物群落受到原料[28]和环境[29](空气、车间、地面、工具等)的影响,最终形成了复杂的微生物群落结构。
2.4 芝麻香型酒曲的细菌和真菌菌群基因功能预测
为了更好地了解芝麻香型酒曲中微生物群落的作用,利用PICRUSt2预测酒曲中与淀粉和蔗糖代谢、丙酮酸代谢和三羧酸(tricarboxylic acid,TCA)循环相关酶的编码基因丰度,结果见图4。
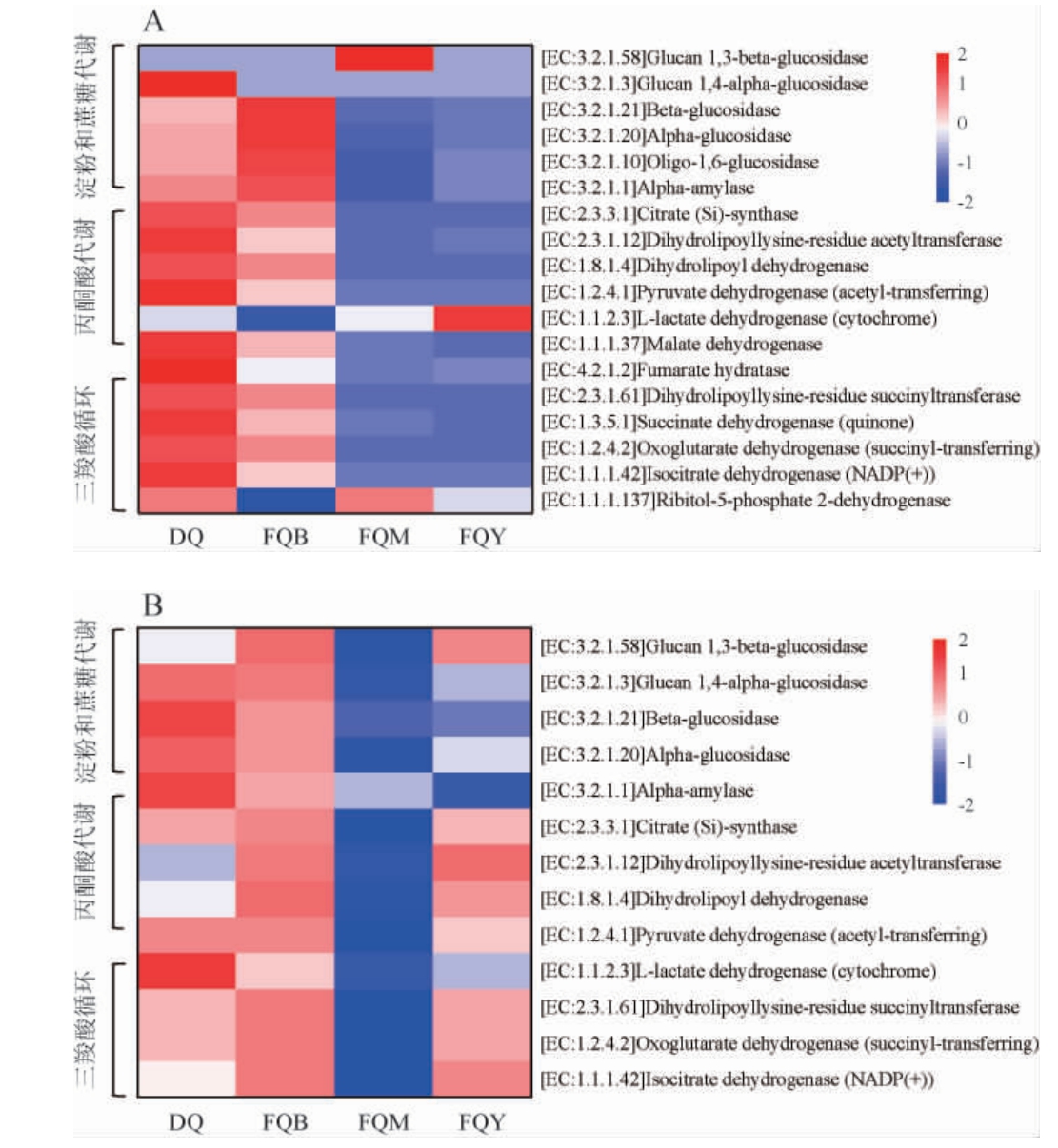
图4 4种芝麻香型酒曲细菌(A)及真菌(B)菌群基因的功能预测结果
Fig.4 Functional prediction results of bacterial (A) and fungal (B)community genes of four kinds of sesame-flavor Jiuqu
淀粉水解和葡萄糖形成是白酒发酵的基本过程[5],丙酮酸代谢和TCA循环与白酒香型的形成密切相关[11]。由图4可知,4种芝麻香型酒曲中微生物的潜在功能不同。大曲和细菌曲中与这3种途径相关的酶的编码基因丰度高于霉菌曲和酵母曲。
对于细菌,细菌曲中细菌菌群与淀粉和蔗糖代谢相关酶的编码基因丰度较高,这可能与细菌曲中高丰度的芽孢杆菌属(99.7%)有关,这也与细菌曲较高的液化力相一致。LI R Y等[30]研究发现,芽孢杆菌属分泌的淀粉酶可以将淀粉转化为葡萄糖,促进白酒发酵过程。因此,细菌曲丰度较高的芽孢杆菌属可以增加与淀粉代谢相关酶的编码基因丰度较高的机会。大曲中细菌菌群与丙酮酸代谢和TCA循环相关酶的编码基因丰度最高,这可能与大曲中高丰度的克罗彭斯特菌属和枝芽孢杆菌属有关。克罗彭斯特菌属和枝芽孢杆菌属与白酒风味的形成密切相关[31-32]。
对于真菌,大曲和细菌曲中真菌菌群与淀粉和蔗糖代谢相关酶的编码基因丰度较高,细菌曲和酵母曲中真菌菌群与丙酮酸代谢和TCA循环相关酶的编码基因丰度较高。酵母曲中真菌菌群与丙酮酸代谢和三羧酸循环相关酶的编码基因丰度较高,这可能与其高丰度的异常威克汉姆酵母属(97.7%)有关。异常威克汉姆酵母属能代谢产生多种酯类和芳香化合物,对白酒风味具有重要影响[33]。
综上,结果表明,用于酿造芝麻香型白酒的大曲和麸曲,其真菌和细菌的基因功能表达存在差异。相较于麸曲,大曲中的细菌和真菌在淀粉和蔗糖代谢、丙酮酸代谢和三羧酸循环基因功能丰度较高。
3 结论
高温大曲和细菌曲、酵母曲、霉菌曲是芝麻香型白酒重要的发酵剂,对芝麻香型白酒的品质和风味起到重要作用。本研究比较了4种芝麻香型酒曲的理化性质、微生物群落组成及潜在功能。结果表明,麸曲(细菌曲、酵母曲、霉菌曲)的水分、液化力和糖化力均高于高温大曲,而高温大曲的酸度更高。麸曲和高温大曲的微生物群落组成也存在差异。高温大曲中微生物菌群比较丰富,相对丰度较高的菌属为克罗彭斯特菌属(Kroppenstedtia)(26.5%)、枝芽孢杆菌属(Virgibacillus)(23.7%)、曲霉属(Aspergillus)(37.2%)、嗜热真菌属(Thermomyces)(25.5%),细菌曲中细菌属以芽孢杆菌属(Bacillus)(99%)为主;霉菌曲和酵母曲中真菌属分别以曲霉菌属(96.2%)和异常维克汉姆酵母属(Wickerhamomyces)(97.7%)为主。功能预测结果表明,高温大曲和麸曲中细菌和真菌群落的淀粉和蔗糖代谢、丙酮酸代谢和三羧酸循环基因功能丰度存在差异,高温大曲细菌和真菌群落的这三种代谢的基因功能丰度较高。综上所述,高温大曲和麸曲在芝麻香型白酒品质形成过程中发挥着不同的作用,共同形成了芝麻香型白酒特殊的风味,这为进一步控制芝麻香型白酒的生产提供了理论依据。
[1]ZHENG X W,TABRIZI M R,NOUT M J,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[2]徐岩.科学传承、集成创新走中国白酒技术持续发展的道路——对芝麻香酒的看法和认识[J].酿酒科技,2013(4):17-20.
[3]陈孝,温承坤,巩园园,等.酒曲的研究进展[J].中国酿造,2019,38(10):7-11.
[4]中华人民共和国工业和信息化部.QB/T 4258—2011酿酒大曲术语[S].北京:轻工业出版社,2012.
[5]ZHANG W Q,LI J L,RAO Z M,et al.Sesame flavour Baijiu:a review[J].J I Brewing,2020,126(3):224-232.
[6]XIA Y,LUO H,WU Z,et al.Microbial diversity in Jiuqu and its fermentation features:saccharification,alcohol fermentation and flavors generation[J].Appl Microbiol Biotechnol,2023,107(1):25-41.
[7]来安贵,赵德义,曹建全.芝麻香型白酒的发展历史、现状及发展趋势[J].酿酒,2009,36(1):91-93.
[8]KANG J M,CHEN X X,HAN B Z,et al.Insights into the bacterial,fungal,and phage communities and volatile profiles in different types of Daqu[J].Food Res Int,2022,158:111488.
[9] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150:110734.
[10]CAI W C, XUE Y A, WANG Y R, et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by high-throughput sequencing and electronic senses[J].Front Microbiol,2021,12:784651.
[11]DENG L,MAO X,LIU D,et al.comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11:588117.
[12]BRUNO A,SANDIONIGI A,GALIMBERTI A,et al.One step forwards for the routine use of high-throughput DNA sequencing in environmental monitoring.An efficient and standardizable method to maximize the detection of environmental bacteria[J].Microbiologyopen,2017,6(1):e00421.
[13]QUAIL M A,SMITH M,COUPLAND P,et al.A tale of three next generation sequencing platforms:comparison of ion torrent,pacific biosciences and Illumina MiSeq sequencers[J].BMC Genom,2012,13:341.
[14]GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[15]BOLYEN E,RIDEOUT J R,DILLON M R,et al.Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J].Nat Biotechnol,2019,37:852-857.
[16]CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al.DADA2:Highresolution sample inference from Illumina amplicon data[J].Nat Methods,2016,13(7):581-583.
[17] DOUGLAS G M, MAFFEI V J, ZANEVELD J R, et al.PICRUSt2 for prediction of metagenome functions[J].Nat Biotechnol,2020,38:685-688.
[18]王贤,丁琳.中高温大曲制曲过程关键控制点探析[J].酿酒,2015,42(1):115-118.
[19]颜兵.米酒酿造过程酿酒酵母与异常汉逊酵母的相互作用及工艺优化研究[D].广州:华南理工大学,2016.
[20]施思,彭智辅,乔宗伟,等.浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析[J].食品与发酵工业,2017,43(5):76-79.
[21]XIE M W,LV F X,MA G X,et al.High throughput sequencing of the bacterial composition and dynamic succession in Daqu[J].J I Brewing,2020,126(1):98-104.
[22]姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业,2012,38(6):1-6.
[23]来欢欢,张凯悦,田青,等.清香酒醅来源Lactobacillusplantarum SL32-2自溶酶的酶学性质及其底物特异性初探[J].食品与发酵工业,2022,48(7):64-69.
[24]KANG J M,HU Y N,DING Z Y,et al.Deciphering the shifts in microbial community diversity from material pretreatment to saccharification process of Fuyu-flavor Baijiu[J].Front Microbiol,2021,12:705967.
[25]梁慧珍,卢延想,刘正,等.高温大曲中高产吡嗪类物质芽孢杆菌的筛选与应用[J].中国酿造,2022,41(1):116-122.
[26] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[27]谢再斌,王太玉,王茜,等.异常威克汉姆酵母在白酒酿造中的应用研究[J].中国酿造,2022,41(5):18-22.
[28]ZHANG Y D,XU J G,DING F,et al.Multidimensional profiling indicates the shifts and functionality of wheat-origin microbiota during hightemperature Daqu incubation[J].Food Res Int,2022,156:111191.
[29]WANG X S,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2018,84(4):e02369-17.
[30] LI R Y, ZHENG X W, ZHANG X, et al.Characterization of bacteria and yeasts isolated from traditional fermentation starter (Fen-Daqu)through a 1H NMR-based metabolomics approach[J].Food Microbiol,2018,76:11-20.
[31]马琳娜.基于Meta分析酿酒微生物与风味物质的关系[D].贵阳:贵州大学,2021.
[32]马冰涛,范恩帝,李泽霞,等.老白干香型白酒制曲过程中微生物多样性及其与风味成分的关系[J].食品与发酵工业,2020,46(16):7-16.
[33] CHEN L H, LI D N, REN L X, et al.Effects of simultaneous and sequential cofermentation of Wickerhamomyces anomalus and Saccharomyces cerevisiae on physicochemical and flavor properties of rice wine[J].Food Sci Nutr,2020,9(1):71-86.