氨基甲酸乙酯(ethyl carbamate,EC)是一种具有遗传毒性的2A类致癌物[1-3]。白酒、食醋和黄酒等传统发酵食品的生产过程中,由于原料带入、微生物作用以及化学反应等因素,不可避免地导致产品中含有EC,严重影响传统发酵食品的食品安全性。在白酒中,浓香型白酒、酱香型白酒和芝麻香型白酒的EC含量相对较高,许多白酒的EC含量已超出国际常用蒸馏酒限量标准(150 μg/L)[4-7]。调查显示,若饮用EC含量超过30 μg/L的酒,人饮用后患癌的机率大大增加[8]。白酒深受我国消费者喜爱,但其存在EC,具有致癌风险,因此,如何有效消减白酒中的EC亟需探索。
目前,国内外研究报道关于消减酒精饮料中的EC策略主要包括优化生产工艺、控制微生物代谢和酶法降解等[9]。优化生产工艺及控制微生物代谢可一定程度地控制EC含量,但易造成原料营养物质流失、酒体风味改变[2,9],且利用这两种策略不能直接消除已经形成的EC,也无法有效控制发酵过程中EC及其前体物积累,不适用于发酵体系复杂的白酒生产过程。相比其他方法,酶法降解消减EC含量更具有优势,其可直接降解尿素和EC,具有高效性。研究者已利用酸性脲酶及EC水解酶有效降低了日本清酒、黄酒、米酒及浓香型白酒等的EC含量[10-13],但关于酶法消减其他香型白酒中尿素及EC的研究报道仍匮乏。研究证实,白酒存在EC为普遍现象,一方面影响白酒的安全性,另一方面,该问题一直存在将严重影响白酒产业的发展。因此,本研究拟从酸性脲酶和EC水解酶研究现状、白酒中EC的现状分析、EC的形成机制和酶法降解在消减白酒中EC的应用等多方面进行综合分析,提出未来的研究方向和思路,希望为有效消减白酒中的EC及提高其食品安全性的研究提供参考。
1 酶法降解EC的研究现状
目前,用于消减酒精饮料中EC的酶类主要为酸性脲酶和EC水解酶,酸性脲酶主要通过消除EC的前体物尿素来减少EC生成,EC水解酶则直接将EC降解[1,14-15]。
1.1 酸性脲酶
1.1.1 酸性脲酶的来源及性质
脲酶(EC 3.5.1.5)是第一个获得晶体结构的酶,它可将尿素分解为氨和CO2[16-17]。1979年,酸性脲酶在发酵乳杆菌(Lactobacillus fermentum)中首次被发现,此后研究者们发掘了更多的酸性脲酶[18]。研究者发掘的天然酸性脲酶性质见表1。许多天然酸性脲酶为双功能酸性脲酶,具有尿素和EC降解活性,但降解EC的效率较低。天然酸性脲酶最适温度为35~65 ℃,具有一定程度的乙醇耐受性。此外,大多数酸性脲酶具有镍离子(Ni2+)依赖性,这导致其无法应用于食品的生产,且酶的表达量较低,不利于工业化应用。
表1 不同来源的天然酸性脲酶性质比较
Table 1 Comparison of the properties of natural acidic urease from different sources
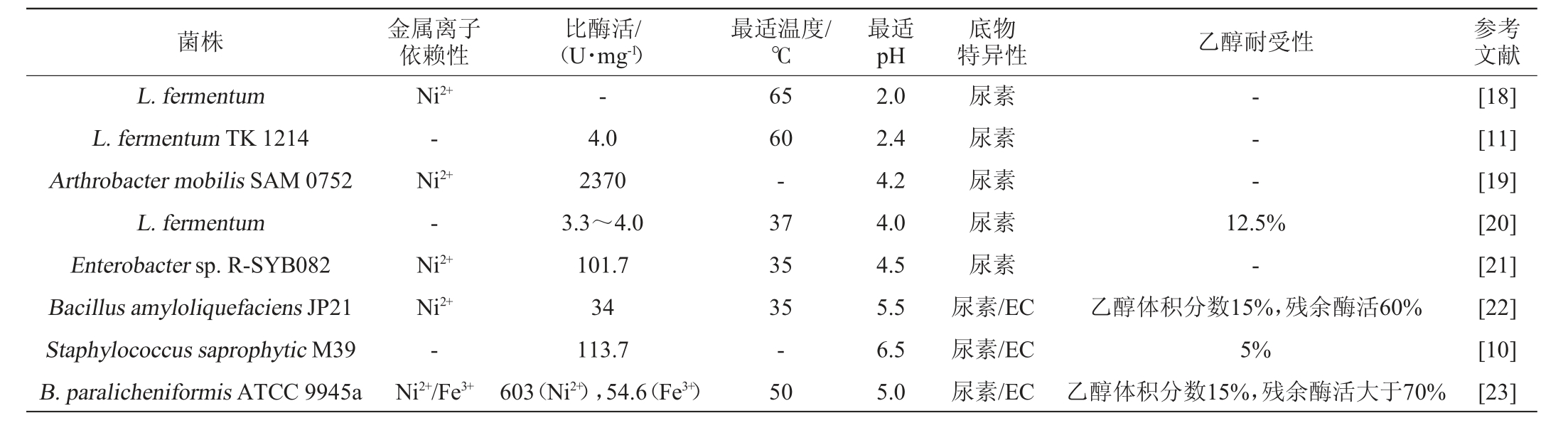
注:“-”表示未报道。
菌株 金属离子依赖性比酶活/(U·mg-1)最适温度/℃最适pH 特异性 乙醇耐受性 参考文献底物L.fermentum L.fermentum TK 1214 Arthrobacter mobilis SAM 0752 L.fermentum Enterobacter sp.R-SYB082 Bacillus amyloliquefaciens JP21 Staphylococcus saprophytic M39 B.paralicheniformis ATCC 9945a Ni2+-Ni2+-Ni2+Ni2+-Ni2+/Fe3+-4.0 2370 3.3~4.0 101.7 34 113.7 603(Ni2+),54.6(Fe3+)65 60-37 35 35-50 2.0 2.4 4.2 4.0 4.5 5.5 6.5 5.0尿素尿素尿素尿素尿素尿素/EC尿素/EC尿素/EC-- -12.5%-乙醇体积分数15%,残余酶活60%5%乙醇体积分数15%,残余酶活大于70%[18][11][19][20][21][22][10][23]
1.1.2 酸性脲酶的结构及作用位点
已发掘的脲酶存在于植物、真菌和细菌中,植物和真菌脲酶由相同的亚基组成,而细菌脲酶则由3个不同的亚基组成,最常见的组装为三聚体和六聚体[16,23]。虽然不同来源脲酶由不同类型的亚基组成,但其氨基酸序列具有高度的同源性[16]。目前,已有许多研究者对微生物来源酸性脲酶的结构进行了研究,大多数酸性脲酶的结构基因为ureA、ureB、和ureC,而幽门螺旋菌的酸性脲酶结构基因为ureA和ureA2的融合体[16,24]。酸性脲酶单体三维结构如下[25-26]:
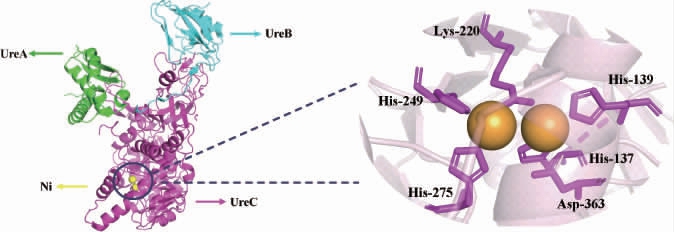
酸性脲酶的单体包含一个双核Ni中心,位于UreC。脲酶中与Ni2+结合的氨基酸分别为4个组氨酸(His)、1个赖氨酸(Lys)和1个天冬氨酸(Asp)。脲酶活性中心平面示意图如下[27]:
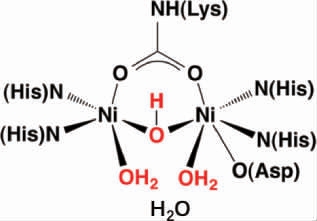
在脲酶活化过程中,氨基酰化Lys是必不可少的,其羧酸基团的O原子与Ni连接,4个His通过N原子与Ni配位,Asp通过O原子与Ni配位,Ni与末端3个H2O形成一个H键水四面体簇填满活性位点空腔[16,27-28]。在UreC中存在一个Flap区域,此区域覆盖在活性中心上,其可控制底物和产物的进出[29]。不同微生物来源的酸性脲酶基因簇如下:
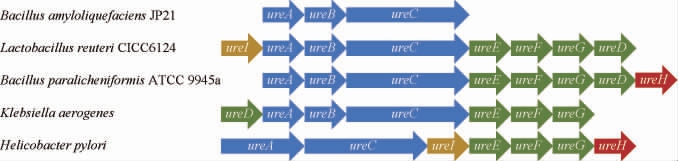
除脲酶结构基因ureA、ureB、ureC编码的结构亚基外,大多数微生物脲酶还需基因ureE、ureF、ureG、ureD/H编码的辅助亚基共同组成,这些辅助亚基是活性位点金属化和脲酶成熟所必需的,且不同微生物来源脲酶的辅助亚基不同[24,30]。经研究发现,UreE为金属伴侣蛋白,可通过伴侣复合物将Ni2+转运到脲酶载脂蛋白,UreD为其他附属亚基聚集的支架,UreF的存在保证金属活性中心的保真度,UreG是一种鸟苷三磷酸酶,用于促进Ni2+的进入[31-32]。部分微生物中脲酶的UreH与UreD功能一致,而在某些微生物脲酶中ureH和ureD基因都是保守的,地衣芽孢杆菌(Bacillus paralicheniformis)ATCC 9945a中酸性脲酶的UreH是一种跨膜蛋白,用于运输Ni2+和Fe3+[21,32-33]。此外,一些微生物脲酶中还存在UreI,幽门螺杆菌(Helicobacter pylori)UreI蛋白不参与脲酶活性,但对体内细菌存活至关重要,其可能有助于胃黏膜对严酷酸性环境的特异性适应,也有研究者预测UreI可能是一个跨膜结构域的尿素或氨转运体[34]。
1.1.3 酸性脲酶分子改造及异源表达研究
已发掘的天然脲酶普遍具有较低的EC亲和力及催化效率,因此,需通过蛋白质工程手段对脲酶进行定向进化以提高脲酶对EC的底物亲和力及催化效率。据文献报道,对酶底物结合口袋和活性中心附近的氨基酸改造可以实现酶底物特异性和催化效率等性质的改变[35]。目前,关于改变脲酶的底物特异性和催化效率的研究相对较少。刘庆涛[36]选取酸性脲酶底物进出通道旁存在的α-螺旋及环区、Flap区域上的氨基酸和位于酶活性中心附近底物结合口袋内的氨基酸作为突变对象进行单点饱和突变和复合突变,提高了酶对EC的底物亲和力和催化效率。贾云耀等[37]选择两个最靠近脲酶活性中心的甲硫氨酸作为改造位点,通过定点突变使酶对EC的亲和力显著提高。
天然脲酶的表达效率较低,无法满足工业化应用,因此,研究者们采用异源表达策略以提高脲酶的表达效率。YANG Y Q等[38]扩增了罗伊氏乳杆菌(Lactobacillus reuteri)CICC6124的脲酶基因簇ureABCEFGD,实现了重组酸性脲酶在乳酸乳球菌中的高效表达。LIU Q T等[39]通过食品级表达系统实现了地衣芽孢杆菌源含铁脲酶的高效生产,其在3 L发酵罐中产量达到了21 964 U/L。
1.2 EC水解酶
1.2.1 EC水解酶的来源与应用
氨基甲酸乙酯水解酶(EC 3.5.1.75)是一种可以直接降解EC生成乙醇、CO2和氨的酶类。1990年,日本学者从小鼠粪便中分离出柠檬酸杆菌(Citrobacter sp.),发现其具有EC水解酶活性[40]。此后,国内外研究者发现了大量EC水解酶,如从地衣芽孢杆菌(Bacillus licheniformis)[41]、变幻青霉(Penicillium variabile)[42]、马红球菌(Rhodococcus equi)[43]、微球菌属(Micrococcus sp.)[44]、梭形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)SCO2[45]和近平滑假丝酵母(Candida parapsilosis)[46]等微生物中挖掘的EC水解酶。大多数EC水解酶在偏中性的环境下稳定,且具有一定的乙醇耐受性。EC水解酶已被用于米酒、黄酒中EC的去除,ZHOU N D等[13]添加0.9 U/mL来源于变幻青霉EC水解酶至米酒中,EC的去除率可达到35%,研究初步认为,其对米酒风味未产生显著影响。WU Q等[47]从胶红酵母(Rhodotorula mucilaginosa)CGMCC 5081中分离得到一种EC水解酶,其可使米酒中EC去除率达到51.6%。杨广明等[48]将EC水解酶粗酶液用于黄酒中EC的去除,发现粗酶液加酶量为0.3 U/mL时黄酒中EC的去除率可达到25.5%。
1.2.2 EC水解酶的结构、异源表达及分子改造研究
已发掘的天然EC水解酶在活性较低、适应酸性环境、乙醇耐受性、工业化应用等方面具有缺陷,因此,需通过异源表达及分子改造提高EC水解的表达效率和改善其特性,但关于EC水解酶的异源表达及分子改造的研究较少。张献等[49]通过基因克隆实现了假丝酵母(Candida parapsilosis)CCTCC AY 2017001源EC水解酶基因在大肠杆菌中的高效表达,该重组酶具有一定的乙醇耐受性,但其热稳定性及对酸性环境的适应性较差。李京京[50]对来源于梭形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)SCO2的EC水解酶进行N端测序得到了基因序列,并实现其在大肠杆菌中的可溶性表达,该EC水解酶的表达效率较低、热稳定性、酸和乙醇耐受性较差。吕思熠等[51]将该酶基因在枯草芽抱杆菌(Bacillus subtilis)WB600中进行克隆,实现该酶的异源表达,通过发酵条件优化使EC水解酶的酶产量达到18.03 U/mL。刘晓慧等[52]采用融合双亲短肽的改造策略提高了该EC水解酶的热稳定性;采用计算机辅助设计突变位点,对其进行饱和突变,通过改造发现,酶的热稳定性及对酸和乙醇的耐受性均得到了提升。研究者们虽对EC水解酶实现了异源表达,但酶表达效率仍无法达到工业应用的需求,且目前关于EC水解酶食品级异源表达的研究鲜有报道,因此,未来需加强食品级表达系统的构建,实现EC水解酶的高效表达。
明确EC水解酶结构,对其催化行为进行深入研究,可为高效改善EC水解酶的特性提供指导。但目前未见有关EC水解酶蛋白结构的报道,已发掘的天然EC水解酶中具有已知氨基酸序列的EC水解酶仅2个,其他来源的EC水解酶尚未得到有效解析[13,45]。张献等[53]对已知氨基酸序列的EC水解酶进行生物信息学分析,得知EC水解酶属于亲水性蛋白,且这些EC水解酶都不含跨膜区和信号肽,二级结构氨基酸都以α螺旋以及无规则卷曲为主。此结果仅为计算机软件分析与预测结果,还需通过实验对其进行验证,以得到有效结论。由于参与分析的EC水解酶样本较少,其生物信息学分析结果可能无法涵盖EC水解酶家族的结构信息。随着生物信息学的技术发展,对EC水解酶的分子结构进行有效解析,并深入探索其催化行为,可为实现EC水解酶高效降解EC提供理论参考。
2 白酒的EC现状分析
在白酒的生产过程中,经发酵和蒸馏会产生许多风味物质,同时也不可避免地会产生EC等有害物质[54]。研究报道不同香型白酒的EC含量范围见表2。由表2可知,EC含量在不同香型白酒中有显著差异。熊晓通等[55]对5个不同品牌酱香型白酒的EC含量进行分析,发现不同品牌酱香型白酒的EC含量存在差异,其原因可能在于使用高粱原料的品种不同或生产工艺不同等。不同等级的白酒EC含量也不同,卓俊纳等[3]检测不同等级浓香型、酱香型和清香型白酒成品酒的EC含量,发现EC含量随白酒等级提升而逐渐升高。研究表明,随着白酒储存时间的延长EC含量也会逐渐增加[56]。综上所述,不同香型白酒的EC含量存在差异且不稳定,因此需对其进行控制以提高白酒的品质。
表2 部分文献报道不同香型白酒的氨基甲酸乙酯含量
Table 2 Ethyl carbamate contents of Baijiu with different flavor type reported by some literature
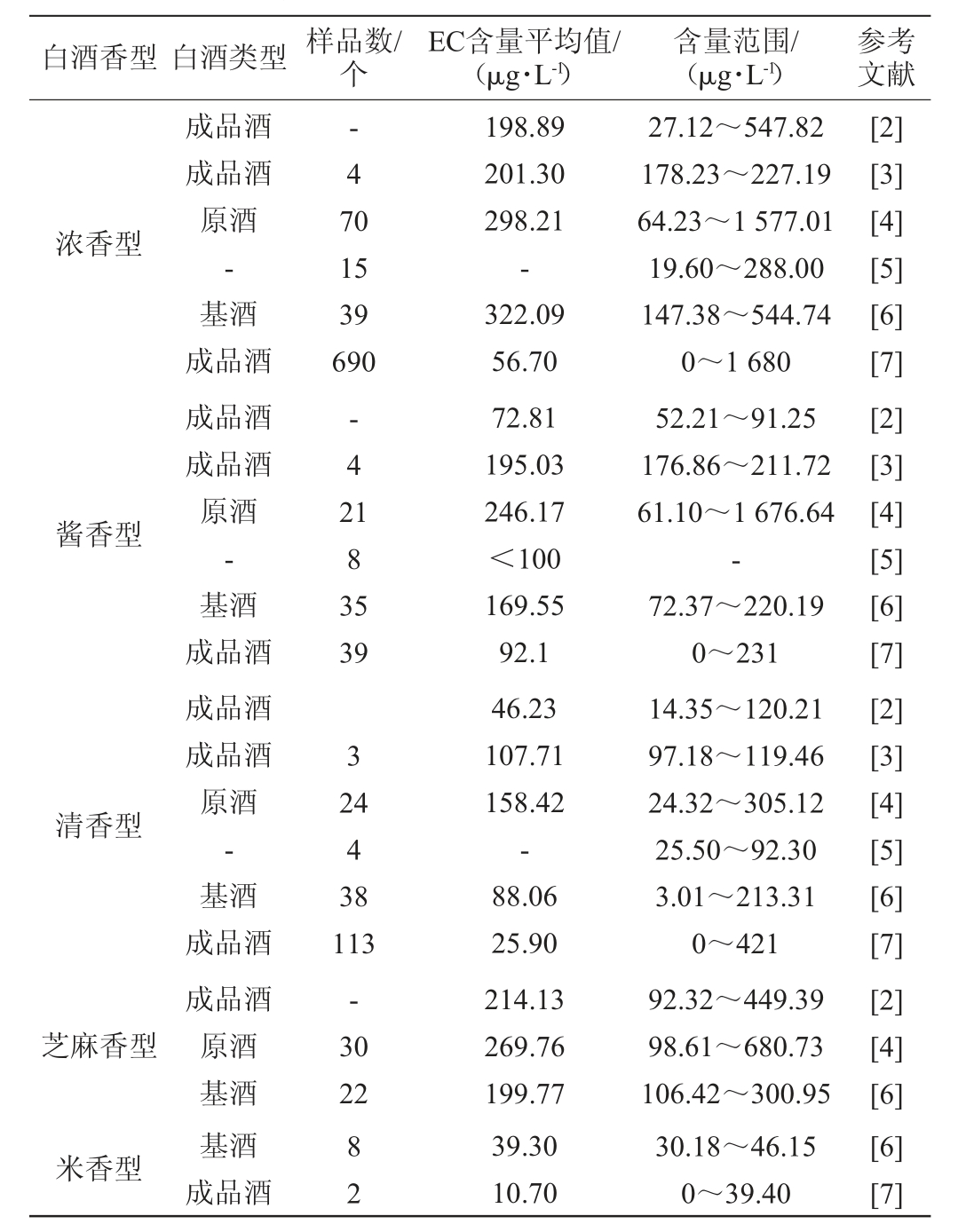
注:“-”表示未报道。
白酒香型 白酒类型 样品数/个EC含量平均值/(μg·L-1)含量范围/(μg·L-1)参考文献浓香型-47 0 15 39 690酱香型-42 183 5 39 3清香型芝麻香型24 4 38 113-30 22米香型[2][3][4][5][6][7][2][3][4][5][6][7][2][3][4][5][6][7][2][4][6][6][7]成品酒成品酒原酒-基酒成品酒成品酒成品酒原酒-基酒成品酒成品酒成品酒原酒-基酒成品酒成品酒原酒基酒基酒成品酒82 198.89 201.30 298.21-322.09 56.70 72.81 195.03 246.17<100 169.55 92.1 46.23 107.71 158.42-88.06 25.90 214.13 269.76 199.77 39.30 10.70 27.12~547.82 178.23~227.19 64.23~1 577.01 19.60~288.00 147.38~544.74 0~1 680 52.21~91.25 176.86~211.72 61.10~1 676.64-72.37~220.19 0~231 14.35~120.21 97.18~119.46 24.32~305.12 25.50~92.30 3.01~213.31 0~421 92.32~449.39 98.61~680.73 106.42~300.95 30.18~46.15 0~39.40
3 白酒中EC的形成机制
许多研究证实,白酒酿造过程中形成EC的主要前体物有两个来源,其一由原料带入经酶促反应生成,其二主要由发酵过程微生物作用而积累[1-2,57],形成途径见图1。由图1可知,无论是生产原料带入还是发酵过程中微生物代谢产生的主要前体物—尿素、瓜氨酸、氰化物最终均能与乙醇反应生成EC。此外,氨甲酰磷酸和焦碳酸二乙酯也是导致EC形成的前体物,但经许多研究证实,这两种前体物对EC形成的影响可被忽略[1,2,14]。

图1 白酒中氨基甲酸乙酯形成机制
Fig.1 Mechanism of ethyl carbamate formation in Baijiu
相较于其他酒精饮料,白酒的生产过程存在复杂的发酵体系,EC的形成与发酵中存在的微生物具有极强的相关性[58]。DU H等[59]报道了酱香型白酒固态发酵过程中EC的变化规律,该研究表明,堆积发酵阶段是酵母菌和乳酸菌的主要增殖阶段,而入窖发酵阶段是EC产生的主要阶段。在发酵过程中,尿素在氰化物、瓜氨酸和尿素这三种前体物中占绝对优势,EC主要由尿素和乙醇产生,但原料中存在的尿素较少,因此,酱香型白酒中的大部分尿素为酵母菌等微生物的精氨酸分解代谢产生,产生的尿素大部分被消耗利用生成EC。
白酒中的EC不仅在谷物发酵阶段产生,也在蒸馏与贮存阶段产生,且白酒中的EC主要产生于蒸馏阶段[1]。在白酒蒸馏早期,EC的产生主要由发酵过程生成的EC带入,但发酵过程产生的EC只有少部分进入白酒蒸馏阶段[1]。而在白酒蒸馏的后期,EC主要由蒸馏前体物和乙醇产生。张庄英[60]报道了白酒蒸馏前体物主要为氰化物,高粱等原料中富含氰,在高温下可转变为氰化物,氰化物的沸点非常低,因而极易形成蒸汽与乙醇反应。此外,在蒸馏阶段高粱中的尿素也可被高温降解为氢氰酸,与乙醇反应生成EC。目前,已有研究报道了浓香型白酒、清香型白酒、米香型白酒、芝麻香型白酒等蒸馏过程中EC的变化规律[1,61-63],但酱香型白酒蒸馏阶段的EC及前体物变化规律未见报道。白酒酿造体系复杂,微生物种类丰富,多种香型白酒生产过程中EC及其前体物质的变化规律仍不明晰,因此需进一步对其进行研究积累,明确白酒中EC的形成机制,为有效控制白酒的EC含量提供理论基础。
4 酶法降解EC在白酒中的应用
白酒中的EC主要产生于蒸馏阶段,一旦生成其化学性质十分稳定,一般方法很难消除,因此需在蒸馏前有效降低EC前体物的含量。酶法消减EC及其前体物可有效减少EC及其前体物进入蒸馏阶段,从而减少EC的产生。尿素与乙醇反应生成EC,酸性脲酶可将尿素分解,因此可通过降低尿素的含量有效降低EC的产生。近年来,许多学者将酸性脲酶用于白酒发酵生产中尿素的去除。CUI K X等[64]将具有脲酶和EC水解酶活性的球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)MT33应用于芝麻香型白酒的发酵过程,发酵后白酒的EC含量降低了63.32%。孟庆达[10]将罗伊氏乳杆菌及其脲酶应用于浓香型白酒出窖酒醅中尿素的去除,对不同尿素含量的酒醅模拟蒸馏,发现尿素含量的减少有效降低了白酒中的EC含量,最高可降低65.3%。EC水解酶已被用于米酒、黄酒中EC的去除,尚未报道将EC水解酶用于白酒中EC的去除。目前,酶法降解消减白酒中EC的研究主要集中在消减EC前体物尿素上,相关研究仍处于初始阶段。
5 结论与展望
白酒是深受我国居民喜爱的传统发酵食品之一,含有丰富的决定风格和品质的风味物质,同时也存在EC等有害物质。白酒因其生产工艺复杂使EC含量无法得到有效控制,需采用有效方法消减白酒中的EC。酶法消减由于其高效安全的特点备受研究者关注,根据国内外研究,酸性脲酶和EC水解酶成为两类消减尿素(EC前体物)和EC的重要酶类。目前,酶法消减白酒中的EC相关研究仍处于初级阶段。对于酸性脲酶,研究者们已发掘出了大量的天然酸性脲酶,部分酸性脲酶具有双功能活性,对酸性脲酶的结构及催化行为进行了深入的探究,并对其进行了应用探索,但将其应用于白酒的发酵生产过程中存在以下两方面问题:①目前已发掘出的酸性脲酶大部分需要Ni2+作为辅助因子,若应用于白酒的EC消减,会对白酒的安全性构成威胁。②目前主要关注于酸性脲酶的热稳定性及酸性耐受性,而白酒发酵过程中存在的其它生物活性物质是否会对酸性脲酶行使催化功能造成影响尚不清楚。因此,未来需继续发掘双功能酸性脲酶及非Ni2+依赖性酸性脲酶,通过分子改造提高酶对尿素和EC的亲和力,实现尿素和EC的高效去除;根据酸性脲酶结构构建高效的食品级表达系统,实现酸性脲酶的高效表达,利于其在白酒等发酵食品中的应用;关注白酒中其它生物活性成分对酸性脲酶行使催化功能的影响,促进其实现高效催化。对于EC水解酶,研究者已发掘出天然EC水解酶,对EC水解酶的结构及催化行为进行更深入的研究,可为将其应用于白酒等发酵食品的EC消减提供有效理论指导。酶法降解消减白酒中的EC对于提升白酒的品质,提高竞争性,推动白酒的现代化生产及国际化具有重要意义。因此,未来需对酸性脲酶及EC水解酶开展更加系统的研究,为其应用于白酒的生产提供科学参考。
[1] WANG C,WANG M,ZHANG M P.Ethyl carbamate in Chinese liquor(Baijiu): presence, analysis, formation, and control[J].Appl Biochem Biotech,2021 105:4383-4395.
[2]林宜锦,欧梦莹,关统伟,等.酿造酒中氨基甲酸乙酯的研究进展[J].食品工业科技,2019,40(11):358-364.
[3]卓俊纳,吴卫宇,陈静,等.三种香型白酒中氨基甲酸乙酯的研究及聚类分析[J].酿酒科技,2021(8):22-27.
[4]张顺荣,范文来,徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业,2016,42(5):198-202.
[5]苏占元,郑若欣,杨晓军,等.白酒中氨基甲酸乙酯含量检测与分析[J].酿酒,2019,46(1):55-57.
[6]黄松,黄小清,张辉,等.多种香型白酒中氨基甲酸乙酯残留含量的研究[J].酿酒科技,2021(10):76-80.
[7]姚晓洁,谷瑞丽,姬建生,等.白酒中氨基甲酸乙酯含量检测及在不同香型白酒中的含量分析[J].食品安全导刊,2019(18):136-138.
[8]高年发,宝菊花.氨基甲酸乙酯的研究进展[J].中国酿造,2006,25(9):1-4.
[9]杨红,刘晓艳.氨基甲酸乙酯的研究进展[J].食品安全导刊,2020(20):80-81.
[10]孟庆达.微生物法减少白酒生产中氨基甲酸乙酯前体物质的研究[D].无锡:江南大学,2017.
[11] KOBASHI K, TAKEBE S, SAKAI T.Removal of urea from alcoholic beverages with an acid urease[J].J Appl Toxico,1988,8(1):73-74.
[12] LIU J, XU Y, NIE Y, et al.Optimization production of acid urease by Enterobacter sp.in an approach to reduce urea in Chinese rice wine[J].Bioproc Biosyst Eng,2012,35:651-657.
[13] ZHOU N D,GU X L,TIAN Y P.Isolation and characterization of urethanase from Penicillium variabile and its application to reduce ethyl carbamate contamination in Chinese rice wine[J].Appl Biochem Biotech,2013,170:718-728.
[14]刘庆涛,康振,堵国成.微生物酶法消除黄酒中氨基甲酸乙酯研究进展[J].生物工程学报,2019,35(4):567-576.
[15]辛茜,贾少杰,郑欣欣,等.白酒中氨基甲酸乙酯的研究进展[J].酿酒科技,2022(1):42-46.
[16]KRAJEWSKA B.Ureases I.functional,catalytic and kinetic properties:A review[J].J Mol Catal B-Enzym,2009,59(1-3):9-21.
[17]BALASUBRAMANIAN A,PONNURAJ K.Crystal structure of the first plant urease from jack bean:83 Years of journey from its first crystal to molecular structure[J].J Mol Biol,2010,400(3):274-283.
[18]SUZUKI K,BENNO Y,MITSUOKA T,et al.Urease-producing species of intestinal anaerobes and their activities[J].Appl Environ Microbiol,1979,37(3):379-382.
[19] MIYAGAWA K, SUMIDA M, NAKAO M, et al.Purification, characterization, and application of an acid urease from Arthrobacter mobilis[J].J Biotechnol,1999,68:227-236.
[20]ESTI M,FIDALEO M,MORESI M,et al.Modeling of urea degradation in white and rose'wines by acid urease[J].J Agr Food Chem,2007,55(7):2590-2596.
[21]YANG L Q,WANG S H,TIAN Y P.Purification,properties,and application of a novel acid urease from Enterobacter sp.[J].Appl Biochem Biotech,2010,160:303-313.
[22]丁霞,李巧玉,刘凡,等.降解浓香型白酒中氨基甲酸乙酯菌株的筛选及产酶特性研究[J].食品与发酵工业,2018,44(7):29-36.
[23] LIU Q T,CHEN Y Q, YUAN M L, et al.A Bacillus paralicheniformis iron-containing urease reduces urea concentrations in rice wine[J].Appl Environ Microb,2017,83(17):e01258-17.
[24]KAPPAUN K,PIOVESAN A R,CARLINI C R,et al.Ureases:Historical aspects,catalytic,and non-catalytic properties-A review[J].J Adv Res,2018,13:3-17.
[25] MAZZEI L, MUSIANI F, CIURLI S.The structure-based reaction mechanism of urease,a nickel dependent enzyme: tale of a long debate[J].J Biol Inorg Chem,2021,26(1):171-173.
[26]VOLKMER D,HOMMERICH B,GRIESAR K,et al.Dinuclear Nickel(II)Complexes as models for the active site of urease[J].Inorg Chem,1996,35(13):3792-3803.
[27]FARRUGIA M A,MACOMBER L,HAUSINGER R P.Biosynthesis of the urease metallocenter[J].J Biol Chem,2013,288(19):13178-13185.
[28]BENINI S,CIANCI M,MAZZEI L,et al.Fluoride inhibition of Sporosarcina pasteurii urease:structure and thermodynamics[J].J Biol Inorg Chem,2014,19(8):1243-1261.
[29]贺越,赵圣国,张晓音,等.细菌脲酶蛋白结构与催化机制[J].生物技术通报,2020,36(12):208-215.
[30]HABEL J E,BURSEY E H,RHO B S,et al.Structure of Rv1848(UreA),the Mycobacterium tuberculosis urease γ subunit[J].Acta Crystallogr F,2010,66:781-786.
[31] FARRUGIA M A,HAN L J,ZHONG Y Y,et al.Analysis of a soluble(UreD:UreF:UreG)2 accessory protein complex and its interactions with Klebsiella aerogenes urease by mass spectrometry[J].J Am Soc Mass Spectr,2013,24(9):1328-1337.
[32]FARRUGIA M A,WANG B B,FEIG M,et al.Mutational and computational evidence that a nickel-transfer tunnel in UreD is used for activation of Klebsiella aerogenes urease[J].Biochemistry, 2015, 54(41):6392-6401.
[33]FONG Y H,WONG H C,CHUCK C P,et al.Assembly of preactivation complex for urease maturation in Helicobacter pylori crystal structure of UreF-UreH protein complex[J].J Biol Chem, 2011, 286(50): 43241-43249.
[34]SCOTT D,WEEKS D,MELCHERS K,et al.UreI-mediated urea transport in Helicobacter pylori:an open and shut case?[J].Trends Microbiol,2000,8(8):348-349.
[35] REETZ M T,BOCOLA M,CARBALLEIRA J D, et al.Expanding the range of substrate acceptance of enzymes:combinatorial active-site saturation test[J].Angew Chem Int Edit,2005,44(27):4192-4196.
[36]刘庆涛.Bacillus paralicheniformis酸性脲酶表达、分子改造及用于黄酒中氨基甲酸乙酯消减[D].无锡:江南大学,2019.
[37]贾云耀,方芳.定点突变提高解淀粉芽孢杆菌JP-21脲酶应用特性[J].生物工程学报,2020,36(8):1640-1649.
[38] YANG Y Q, KANG Z, ZHOU J L, et al.High-level expression and characterization of recombinant acid urease for enzymatic degradation of urea in rice wine[J].Appl Microbiol Biot,2015,99:301-308.
[39] LIU Q T, JIN X R, FANG F, et al.Food-grade expression of an ironcontaining acid urease in Bacillus subtilis[J].J Biotechnol,2019,293:66-71.
[40] KOBASHI K, TAKEBE S, SAKAI T.Urethane-hydrolyzing enzyme from Citrobacter sp.[J].Chem Pharm Bull,1990,38(5):1326-1328.
[41] ZHAO C J,KOBASHI K.Purification and characterization of iron-containing urethanase from Bacillus licheniformis[J].J Biosci Bioeng,1994,17:773-778.
[42]ZHOU N D,GU X L,ZHA X H.Purification and Characterization of a urethanase from Penicillium variabile[J].Appl Biochem Biotech,2014,172:351-360.
[43]AKUTSU-SHIGENO Y,ADACHI Y,YAMADA C,et al.Isolation of a bacterium that degrades urethane compounds and characterization of its urethane hydrolase[J].Appl Biochem Biotech,2006,70(4):422-429.
[44] MOHAPATRA B R, BAPUJI M.Characterization of urethanase from Micrococcus species associated with the marine sponge (Spirastrella species)[J].Lett Appl Microbiol,1997,25:393-396.
[45] JIA Y Y, ZHOU J W, DU G C, et al.Identification of an urethanase from Lysinibacillus fusiformis for degrading ethyl carbamate in fermented foods[J].Food Biosci,2020,36:100666.
[46] MASAKI K, MIZUKURE T, KAKIZONO D, et al.New urethanase from the yeast Candida parapsilosis[J].J Biosci Bioeng,2020,130(2):115-120.
[47] WU Q, ZHAO Y M, WANG D, et al.Immobilized Rhodotorula mucilaginosa:a novel urethanase-producing strain for degrading ethyl carbamate[J].Appl Biochem Biotech,2013,171(8):2220-2232.
[48]杨广明,查小红,田亚平.一种氨基甲酸乙酯与尿素降解酶产生菌的鉴定及酶学特性[J].食品与生物技术学报,2015,34(1):7-14.
[49]张献,冯治平,张耀,等.假丝酵母氨基甲酸乙酯水解酶的分子克隆及酶学性质[J].食品与发酵工业,2022,48(3):56-62.
[50]李京京.赖氨酸芽孢杆菌氨基甲酸乙酯水解酶的性质研究及异源表达[D].无锡:江南大学,2014.
[51]吕思熠,方芳,堵国成,等.氨基甲酸乙酯水解酶在枯草芽孢杆菌中的表达及发酵优化[J].过程工程学报,2014,14(5):846-852.
[52]刘晓慧,方芳,夏小乐,等.定点突变改造提高纺锤形赖氨酸芽孢杆菌氨基甲酸乙酯水解酶稳定性[J].生物工程学报,2016,32(9):1233-1242.
[53]张献,彭涛,张耀,等.氨基甲酸乙酯水解酶的家族生物信息学分析[J].生物信息学,2022,20(1):64-74.
[54] DUAN J W,YANG S Q,LI H H,et al.Why the key aroma compound of soy sauce aroma type Baijiu has not been revealed yet?[J].LWT-Food Sci Technol,2022,154:112735.
[55]熊晓通,胡峰,尤小龙,等.超高效液相色谱-高分辨质谱测定白酒中氨基甲酸乙酯含量[J].食品科学,2021,42(8):283-287.
[56]LI G H,ZHONG Q D,WANG D B,et al.Determination and formation of ethyl carbamate in Chinese spirits[J].Food Control,2015,56:169-176.
[57] ZHAO X R,DU G C,ZOU H J,et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends Food Sci Tech,2013,32:97-107.
[58]董蔚,施珂,孙啸涛,等.白酒中潜在化学污染物的研究进展[J].中国食品学报,2018,18(5):185-194.
[59]DU H,SONG Z W,XU Y,et al.Ethyl carbamate formation regulated by lactic acid bacteria and nonconventional yeasts in solid-state fermentation of Chinese moutai-flavor liquor[J].J Agr Food Chem, 2018, 68:387-392.
[60]张庄英.白酒蒸馏和贮存过程中氨基甲酸乙酯的研究[D].无锡:江南大学,2014.
[61]高晓娟,王凤仙,石潇璇,等.清香型白酒蒸馏过程中氨基甲酸乙酯变化研究[J].酿酒,2021,48(1):92-95.
[62]张温清,司冠儒,刘凤茹,等.小窖芝麻香型白酒蒸馏过程中氨基甲酸乙酯的研究[J].酿酒科技,2016(1):53-55,59.
[63]吴晨岑,范文来,徐岩.不同二次蒸馏方式对浓香型白酒中氨基甲酸乙酯去除率的影响[J].食品与发酵工业,2015,41(6):1-7.
[64] CUI K X, WU Q, XU Y.Biodegradation of ethyl carbamate and urea with Lysinibacillus sphaericus MT33 in Chinese liquor fermentation[J].J Agr Food Chem,2018,66:1583-1590.