γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种天然存在的非蛋白质功能性氨基酸,参与人体中多种代谢活动,具有很多重要的生理活性功能[1-3]。GABA能抑制交感神经系统的兴奋,有助于改善睡眠、镇静和防焦虑[4]。GABA在胰岛β细胞内可增加胰岛素分泌,作用于胰岛α细胞可抑制胰高血糖素分泌,在预防和治疗糖尿病上有潜在应用[5]。GABA可以促进脑细胞的新陈代谢,帮助脑细胞恢复功能,增强长期记忆[6]。此外,GABA还具有抗高血压[7]、抗氧化[8]、缓解压力、抗肿瘤[9]等健康益处。
食品中GABA可能的生成途径有两条[4,10]:第一条是谷氨酸脱羧酶及其辅助因子磷酸吡哆醛催化谷氨酸或其盐脱羧合成,称为GABA支路;第二条途径是由二胺氧化酶和多胺氧化酶降解多胺(腐胺、精胺、亚精胺)形成多胺中间产物,多胺中间产物在脱氢酶的催化下形成GABA。GABA是酒的功能性成分之一,可来源于酿酒原料和发酵过程微生物代谢。从现有文献数据看,白酒[11]、啤酒[12]、红酒[13-14]以及黄酒[15]都含有一定量的GABA。
由于其健康属性,GABA的检测受到学术界的广泛关注。现有文献报道GABA的检测方法主要有液相色谱法[16]、Berthelot比色法[17]、气相色谱-质谱法[18]等。液相色谱法一般使用紫外-可见光或荧光检测器,氨基酸需要在柱前或柱后进行衍生反应生成有色物质,是目前氨基酸分析中应用最多的方法[19-20],但是对于基质复杂的发酵酒,存在目标物GABA与其他氨基酸或杂质干扰物不能有效分离、色谱图基线不平、定量不准、灵敏度低等缺点[14]。Berthelot比色法利用苯酚和次氯酸钠与GABA中游离氨发生显色反应来检测GABA的含量[21],该方法方便快捷且成本低廉,可快速检测大批量GABA样品,但易受样品中其他成分干扰,不适用成分复杂样品。气相色谱-质谱法虽然准确度和精密度较高,但是实验过程繁琐,涉及液液萃取、离心、浓缩、冷冻干燥、衍生化等多个步骤,单次实验操作时间超过24 h[18]。近年来,越来越多研究人员采用液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)测定食品中GABA[22-24]。LC-MS/MS具有操作简单快捷、定性定量准确、灵敏度高等优点,适用于基质复杂酒类中GABA测定。
本研究使用LC-MS/MS法,以氘代同位素GABA-d6为内标,建立酒类食品中GABA的检测方法,并将此方法应用于不同类型酒中GABA的检测,以期为评价酒类食品保健功能、提高产品健康属性提供技术支撑。
1 材料与方法
1.1 材料与试剂
白酒、啤酒、红酒、黄酒样品:市售;乙腈(色谱纯):德国Merck公司;GABA标准品(纯度99.7%):上海安谱实验科技股份有限公司;GABA-d6标准品(纯度99.0%):北京振翔科技有限公司;实验用水(超纯水):由Milli-Q纯水系统制备;乙酸铵(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
LCMS-8050液相色谱-三重四级杆质谱联用仪:日本岛津公司;Mili-Q Reference型超纯水机:美国Millipore公司;XS205高精密分析天平(精密度0.01 mg):Mettler-Toledo公司;KH-1000DE型数控超声波清洗器:昆山禾创超声仪器有限公司;Thermo Acclaim Trinity P1色谱柱(2.1 mm×100 mm,3 μm):赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 样品处理
白酒的处理:取1 mL酒样,加入150 μL质量浓度为6.65 mg/L的GABA-d6内标溶液,用10 mmol/L乙酸铵溶液稀释定容至5 mL,混匀后过0.22 μm水系滤膜,滤液供LC-MS/MS测定。
啤酒、黄酒、红酒的处理:取1 mL酒样(啤酒需预先超声脱气5 min,超声功率1 000 W),用10 mmol/L乙酸铵溶液稀释定容至5 mL,再取100 μL酒样稀释液,加入150 μL质量浓度为6.65 mg/L的GABA-d6内标溶液,用10 mmol/L乙酸铵溶液稀释定容至5 mL,混匀后过0.22 μm水系滤膜,滤液供LC-MS/MS测定。
1.3.2 液相色谱-串联质谱条件
(1)液相色谱条件
色谱柱:Thermo Acclaim Trinity P1(2.1 mm×100 mm,3 μm);流动相:乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(1∶1,V/V);流速:0.3 mL/min;进样体积:2 μL;柱温:35 ℃。
(2)质谱条件
雾化气和干燥气均为高纯氮气,流速分别为3 L/min、10 L/min;加热气:3 L/min;接口温度:300 ℃;脱溶剂温度:526 ℃;加热块温度:400 ℃;离子源:电喷雾离子(electrospray ionization,ESI)源,正离子模式;扫描方式:多反应监测(multi-reaction monitoring,MRM)模式。
(3)定性定量方法
按1.3.2中(1)、(2)设定仪器条件,待仪器稳定后,将标准工作液和样品制备液等体积进样测定。根据样品的保留时间、离子质量数及相对丰度进行定性,以内标法定量。
1.3.3 色谱条件优化
分别考察不同色谱柱(C18反相色谱柱、Acclaim Trinity P1色谱柱)、流动相(乙腈+10 mmol/L乙酸铵(1∶1,V/V)、乙腈(含0.1%甲酸)+10mmol/L乙酸铵(1∶1,V/V))、乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(7∶3,V/V))、流速(0.15 mL/min、0.3 mL/min、0.4 mL/min)对分离效果的影响。
1.3.4 基质效应分析方法
由于酒样中含有GABA,较难获得基质空白样品,GABA-d6与GABA有着相同的离子化效应,本研究采用GABA-d6代替性考察酒类基质中GABA的线性关系。
基质标准曲线的绘制:将白酒、啤酒、黄酒、红酒按照1.3.2中稀释倍数稀释,以稀释后酒样为溶剂将GABA-d6标准储备溶液稀释配制成质量浓度为10 μg/L、20 μg/L、50 μg/L、100 μg/L、200 μg/L、500 μg/L的标准工作溶液。采用LC-MS/MS测定,以峰面积(y)为纵坐标,以质量浓度(x)为横坐标绘制基质标准曲线。
溶剂标准曲线的绘制:以10 mmol/L乙酸铵溶液将GABA-d6标准储备溶液稀释配制成质量浓度为10 μg/L、20 μg/L、50 μg/L、100 μg/L、200 μg/L、500 μg/L的标准工作溶液。采用LC-MS/MS测定,以峰面积(y)为纵坐标,以质量浓度(x)为横坐标绘制基质标准曲线。
根据两种标准曲线,计算基质效应(matrix effect,ME)[25],其计算公式如下:
1.3.5 GABA含量的计算
样品中GABA含量计算公式如下:
式中:X为试样中GABA含量,mg/L;C为由标准曲线得出的试样液中GABA的质量浓度,μg/L;F为试样稀释倍数。
1.3.6 数据处理
利用仪器自带的LabSolutions软件绘制质谱图及标准曲线,利用Origin 9.0软件绘制色谱图,利用WPS Office软件处理数据。
2 结果与分析
2.1 质谱条件优化
根据GABA与GABA-d6的结构特征,参考文献数据采用ESI正离子扫描模式分析[26]。使用标准溶液不接色谱柱直接进样,确定定性、定量离子对,同时对Q1预杆偏差、碰撞能量以及Q3预杆偏差等参数进行优化,提高定量、定性子离子信号,优化后的MRM参数见表1。由表1可知,GABA与GABA-d6加氢的母离子[M+H]+的m/z分别为104.1、110.1。选择响应值最高的m/z为87.1、93.2的子离子作为定量离子,综合考虑信号强度与稳定性选择m/z为69.1、73.2的子离子作为定性离子。
表1 γ-氨基丁酸与γ-氨基丁酸-d6的MRM参数
Table 1 MRM parameters of γ-aminobutyric acid and γ-aminobutyric acid-d6
2.2 色谱条件优化
2.2.1 色谱柱的选择
GABA极性较大,从文献结果来看,GABA在普通C18反相色谱柱上几乎无保留,出峰时间在1 min以前,易受杂质干扰[22,24]。Acclaim Trinity P1是一种混合模式色谱柱,其硅胶球孔内具有反相和阴离子交换特性,硅胶球外孔区具有阳离子交换性质。当目标物形式上为中性时,可以以盐形式保留离子;目标物带电荷时,可以通过离子交换相互作用。GABA中同时含有酸性基团和碱性基团,可以通过调节流动相pH,来改变其电离方式和离子存在形式,调整其在色谱柱上的保留强度。因此,选择Acclaim Trinity P1色谱柱分析GABA。
2.2.2 流动相的选择
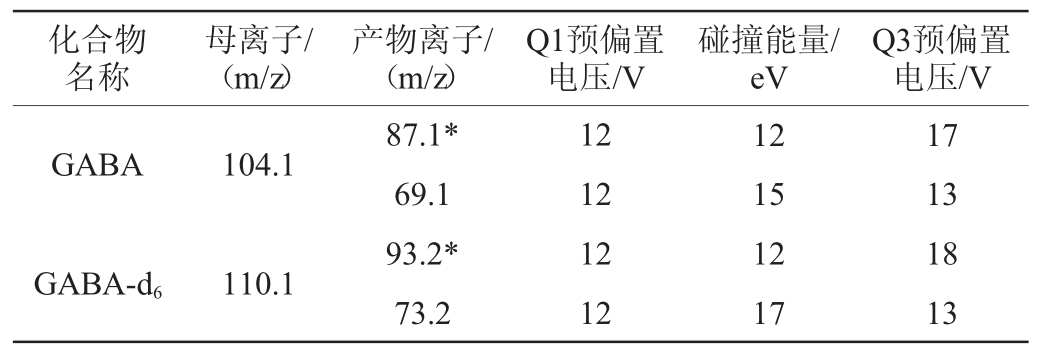
不同流动相对GABA检测的影响见图1。由图1可知,采用乙腈+10 mmol/L乙酸铵(1∶1,V/V)为流动相时,GABA的保留时间为1.65 min,在此条件下GABA主要以中性形式存在,Acclaim Trinity P1柱发挥反相模式作用,对目标物的保留较弱。采用乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(1∶1,V/V)、乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(3∶7,V/V)为流动相时,GABA的保留时间分别为3.85 min、5.54 min,可能原因是这两种流动相中GABA主要为酸式构型,Acclaim Trinity P1柱对目标物的保留增强。死时间是指目标物在整个色谱过程中完全不被保留、通过整个色谱系统所需要的时间,根据Acclaim Trinity P1柱的容积与流动相流速可大致计算出死时间约为1.15 min。保留时间接近死时间时,说明色谱柱与目标物相互作用弱,分离效果差,此时目标物更易受基质干扰。考虑到采用乙腈+10 mmol/L乙酸铵(1∶1,V/V)为流动相时保留时间较为接近死时间,影响目标物与干扰物的分离,乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(3∶7,V/V)为流动相时GABA峰形略宽,选择以乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(1∶1,V/V)为流动相。
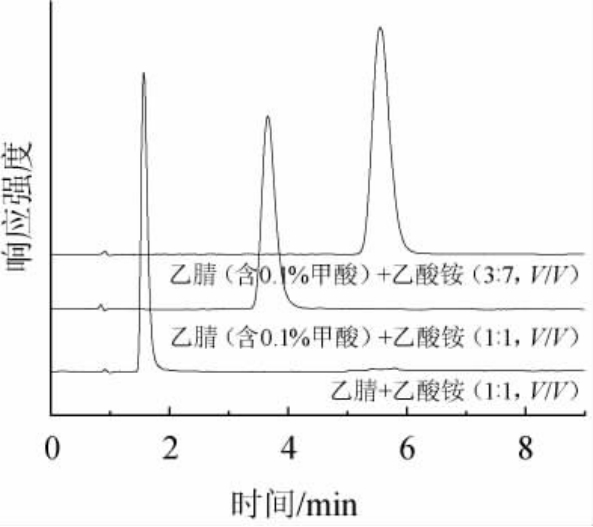
图1 不同流动相对γ-氨基丁酸检测的影响
Fig.1 Effect of different mobile phases on the detection of γ-aminobutyric acid
2.2.3 流速的选择
考察了流动相流速对GABA分离效果的影响,结果见图2。由图2可知,流速为0.15 mL/min时,峰形变宽;流速为0.4 mL/min时,保留时间前移,不利于目标物与杂质之间分离;流速为0.3 mL/min时,峰形好,保留时间适中。因此选择流动相最优流速为0.3 mL/min。
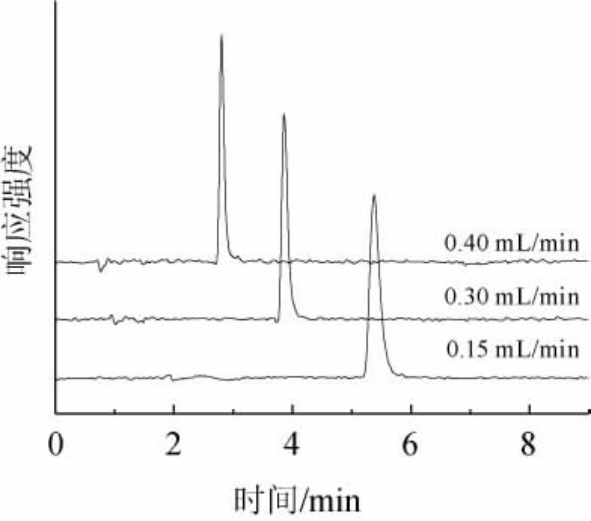
图2 不同流速对γ-氨基丁酸检测的影响
Fig.2 Effect of different flow rates on the detection of γ-aminobutyric acid
2.2.4 优化色谱条件后样品的MRM色谱图
采用优化后的色谱条件对样品进行分析,待测目标物GABA的MRM色谱图见图3。由图3可知,各样品中目标物峰形良好,保留时间适中,目标物出峰时间附近无干扰物,因此可用Acclaim Trinity P1色谱柱、0.3 mL/min流速乙腈(含0.1%甲酸)+10 mmol/L乙酸铵(1∶1,V/V)流动相体系分析样品。
图3 白酒、啤酒、葡萄酒以及黄酒样品中γ-氨基丁酸的MRM色谱图
Fig.3 MRM chromatogram of γ-aminobutyric acid in Baijiu,beer,wine and Huangjiu samples
2.3 基质效应
质谱与液相色谱技术相结合时,基质中非挥发组分会与目标物在液滴表面离子化过程中产生竞争,影响离子化效率[27],表现为基质抑制或增强效应。按1.3.4方法分析白酒、啤酒、红酒以及黄酒的ME分别为152%、176%、212%、181%,表现为基质增强效应。以外标法定量,GABA回收率将偏高。使用与目标物具有相似理化性质与离子化效应的稳定同位素内标进行校正是消除基质效应的最便捷有效的方法[28]。本研究以GABA-d6为内标,补偿了GABA由于基质效应引起的响应信号增强,消除了进样过程中目标物损失所带来的误差,校正回收率,可获得更准确的实验结果。
2.4 方法的线性关系、检出限及定量限
将标准系列溶液按照1.3.2中仪器条件进行测定,以GABA与GABA-d6的质量浓度比(X)为横坐标,峰面积比(Y)为纵坐标,绘制标准曲线。GABA在10~500 μg/L质量浓度范围内呈现良好的线性关系,线性回归方程Y=1.918 46X-0.012 401 4,R2为0.999 9。
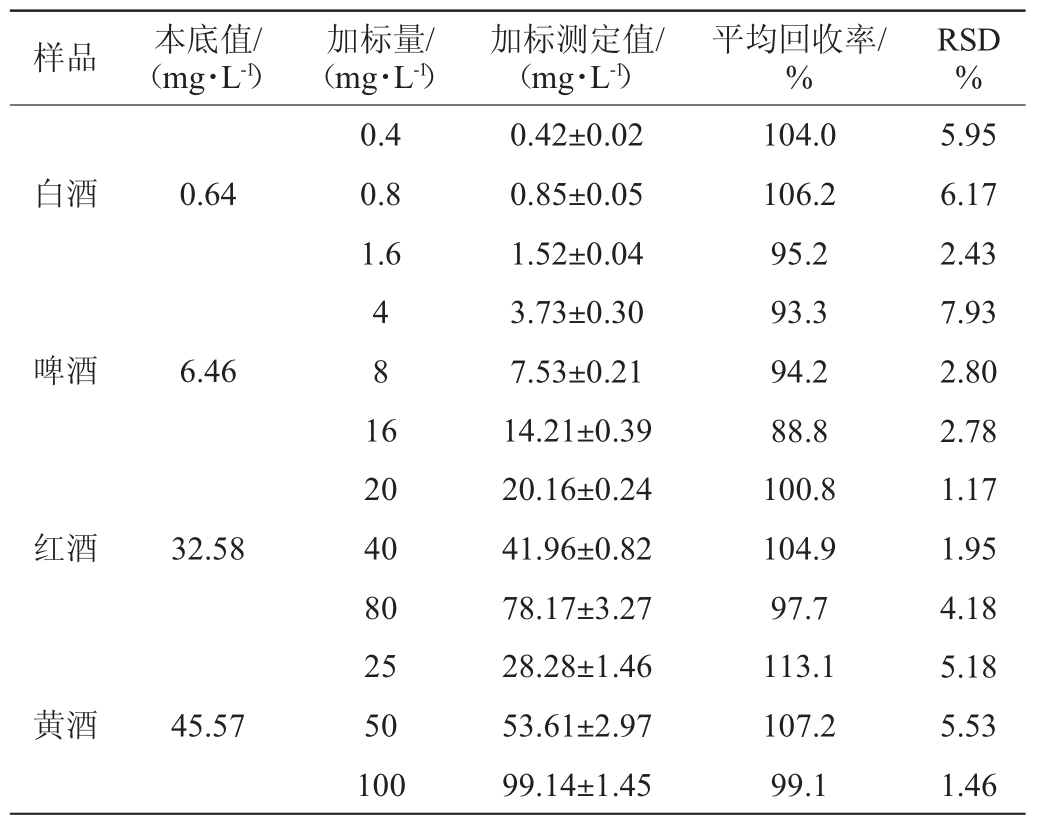
取四种酒样逐级稀释,经0.22 μm滤膜过滤后按照1.3.2中仪器条件进行测定,以S/N=3计算GABA的检出限(limit of detection,LOD),S/N=10计算其定量限(limit of quantitation,LOQ)。结合不同类型酒样的稀释倍数,经计算可得四种酒样中GABA的LOD与LOQ,结果见表2。由表2可知,白酒的LOD与LOQ分别为0.02 mg/L、0.05 mg/L,啤酒、红酒、黄酒的LOD均小于1.7 mg/L,LOQ均小于5.5 mg/L。
表2 不同类型酒样的检出限与定量限
Table 2 LOD and LOQ of different types of alcoholic beverage
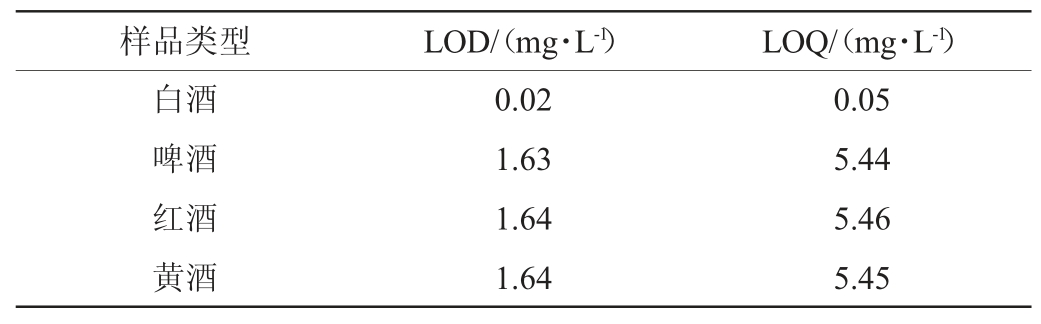
2.5 精密度试验
分别取同一白酒、啤酒、红酒、黄酒样品各6份,按照1.3.1方法处理样品,测定酒中的GABA含量,计算精密度试验结果相对标准偏差(relative standard deviation,RSD)见表3。由表3可知,该方法精密度试验结果RSD为0.86%~2.04%,均小于5%,说明该方法精密度良好,可以用于酒中GABA含量的测定。
表3 精密度试验结果
Table 3 Results of precision tests
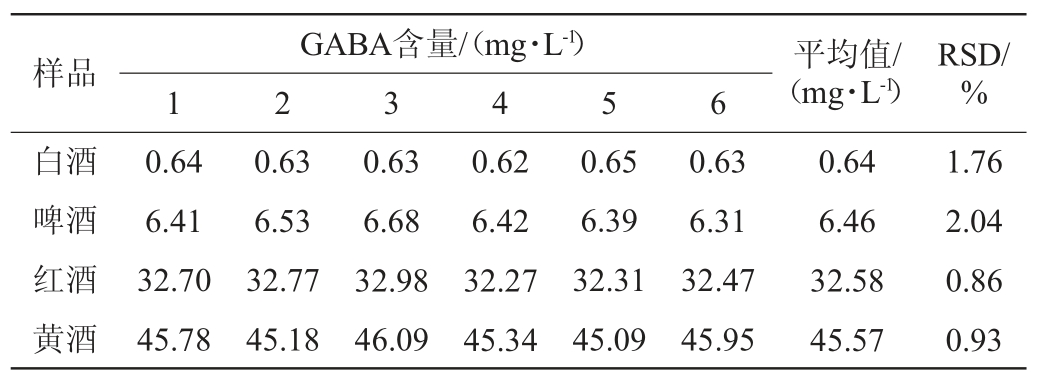
2.6 加标回收率试验
向已知GABA含量的白酒、啤酒、红酒、黄酒样品中分别加入相当于约0.5倍、1倍、2倍本底值的目标物,进行加标回收率试验。按照1.3.1方法处理加标样品,平行测定6次,计算GABA加标回收率,结果见表4。由表4可知,四种酒中GABA的平均加标回收率为88.8%~113.1%,回收率试验结果的RSD为1.17%~7.93%,说明该方法的准确度良好。
表4 加标回收率试验结果
Table 4 Results of adding standard recovery tests
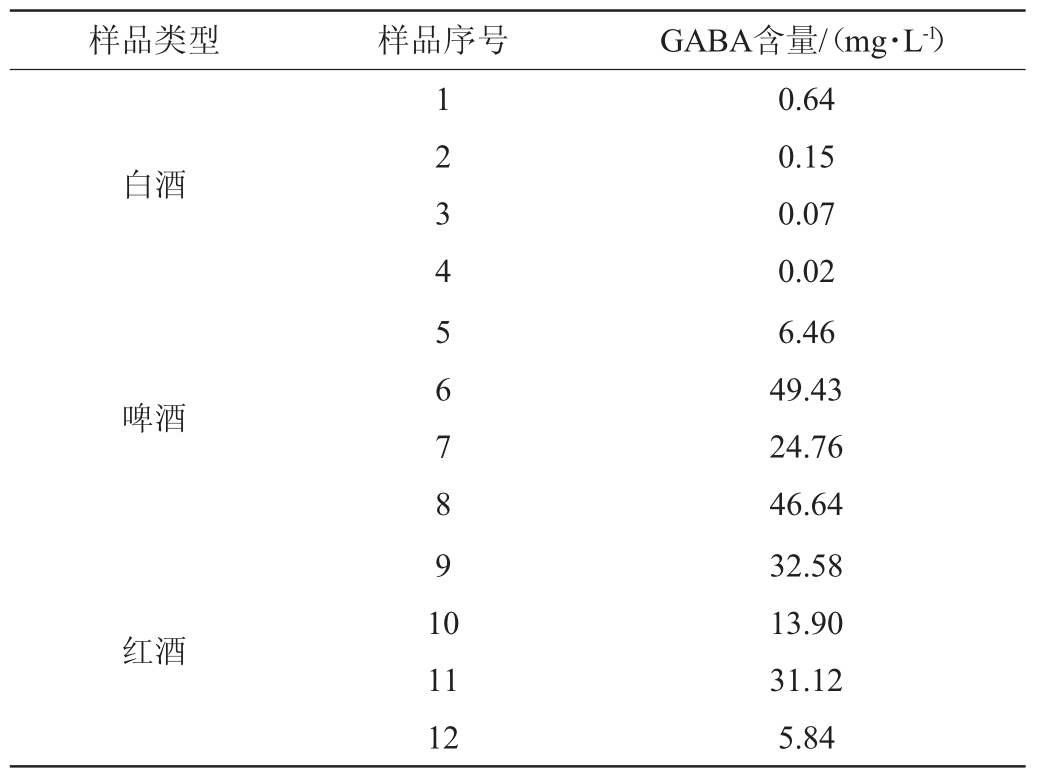
2.7 实际样品的检测
采用建立好的方法对4类酒样中GABA含量进行检测,每类酒样检测4种不同产品,结果见表5。由表5可知,白酒中GABA普遍低于其他三类酒,可能原因是大部分GABA在白酒蒸馏工序流失。相同大类的不同酒样中GABA含量差别较大,这与酿酒原料品种、生产条件控制有关。
表5 不同类型酒样中γ-氨基丁酸含量测定结果
Table 5 Determination results of γ-aminobutyric acid contents in different types of alcoholic beverage
续表

3 结论
本研究建立了同位素内标液相色谱-串联质谱法检测酒中γ-氨基丁酸含量的分析方法。采用Acclaim Trinity P1(2.1 mm×100 mm,3 μm)色谱柱,选择ESI正离子MRM模式进行检测,同位素内标法定量。经方法验证,综合白酒、啤酒、红酒以及黄酒样品的检测结果,该方法精密度实验结果的相对标准偏差为0.86%~2.04%,样品加标回收率为88.8%~113.1%,表明该方法准确度和精密度良好,可以满足不同类型酒中GABA的检测要求。该方法较液相色谱法操作步骤更简单快捷,无需衍生化,定性更准确可靠。该方法采用稳定同位素为内标,能有效消除基质干扰与进样误差。该方法为检测酒中γ-氨基丁酸的含量提供可靠实验方法,为更好研究酒中功能性成分提供技术支持。
[1]龚金炎,单之初,潘兴祥,等.传统手工黄酒发酵过程中常见游离氨基酸和γ-氨基丁酸的变化研究[J].中国食品学报,2017,17(5):232-238.
[2]李玲,杨玲,路江浩,等.产γ-氨基丁酸的复合益生菌制品对睡眠的改善作用[J].中国微生态学杂志,2022,34(9):1006-1012.
[3]OH S J,KIM H S,LIM S T.Enhanced accumulation of gamma-aminobutyric acid in rice bran using anaerobic incubation with various additives[J].Food Chem,2019,271(15):187-192.
[4]俞德慧,杨杨,陈凤莲,等.γ-氨基丁酸及其在谷物发酵食品中的研究进展[J].食品与发酵工业,2022,48(11):290-296.
[5]杨曦,刘玉洁,马慧娟.γ-氨基丁酸与糖尿病[J].国际内分泌代谢杂志,2017,37(1):45-47.
[6]刘晓娟,刘海洋,李明,等.γ-氨基丁酸的生理作用及应用分析[J].中国食品工业,2021(8):20-21.
[7]CHEN G Y,WANG Y S,ZHANG M Y,et al.Cold atmospheric plasma treatment improves the γ-aminobutyric acid content of buckwheat seeds providing a new anti-hypertensive functional ingredient[J].Food Chem,2022,388(15):133064.
[8]LIU T T,TSENG Y W,YANG T S.Functionalities of conjugated compounds of γ-aminobutyric acid with salicylaldehye or cinnamaldehyde[J].Food Chem,2016,190(1):1102-1108.
[9]SUN Y,METHMOOD A,BATTINO M,et al.Enrichment of gammaaminobutyric acid in foods: From conventional methods to innovative technologies[J].Food Res Int,2022,162:111801.
[10]宁亚维,马梦戈,杨正,等.γ-氨基丁酸的制备方法及其功能食品研究进展[J].食品与发酵工业,2020,46(3):238-247.
[11]郭莹,李景辉,李霄霄,等.HPLC法测定中国白酒中的γ-氨基丁酸和核苷类物质[J].食品研究与开发,2021,42(1):153-158.
[12]陈祖乙,安明哲,李丽,等.青稞精酿啤酒酿造工艺优化[J].中国酿造,2022,41(4):174-179.
[13]李波,李磊,邓旭衡,等.葡萄酒发酵过程中γ-氨基丁酸含量变化的研究[J].中国酿造,2011,30(7):171-173.
[14]张璐,张昱,蒲云峰,等.慕萨莱思葡萄酒酿造过程中的氨基酸组成及含量分析[J].食品工业,2018,39(4):260-263.
[15]周建弟,赖敏辉,应维茂,等.黄酒功能性成分与保健功能研究进展[J].酿酒,2021,48(5):24-28.
[16]谌珍,刘青茹,张晓伟,等.高效液相色谱法测定桑叶γ-氨基丁酸和谷氨酸[J].食品研究与开发,2019,40(3):162-166.
[17]汤彩云,王涛,屠洁,等.比色法与HPLC法对比测定桑叶茶中γ-氨基丁酸的含量[J].食品科学,2018,39(24):256-260.
[18]PARK Y J,PARK S U,HA S H,et al.Improved quantification of γ-aminobutyric acid in rice using stable isotope dilution gas chromatography-mass spectrometry[J].Food Chem,2018,266(15):375-380.
[19]顾小焱,郑琦,陈浩云,等.国内外氨基酸技术指标对比及分析方法研究进展[J].化学试剂,2019,41(1):39-46.
[20]AYAG N,DAGDERMIR E,HAYALOGLU A A.Comparison of γ-aminobutyric acid and free amino acid contents of some common va-rieties of Turkish cheeses[J].Int Dairy J,2022,128:105285.
[21]闫朝阳,李旭,马钰柯,等.Berthelot比色法测定γ-氨基丁酸含量的实验条件优化[J].济南大学学报(自然科学版),2020,34(3):306-312.
[22]刘晓茂,杨志伟,崔宗岩,等.超高效液相色谱-串联质谱法同时测定芦笋保健食品中L-茶氨酸和γ-氨基丁酸[J].食品科技,2018,43(3):277-281.
[23]LI W L,WU X Y,ZHOU W H,et al.Rapid evaluation of γ-aminobutyric acid in foodstuffs by direct real-time mass spectrometry[J].Food Chem,2019,277(30):617-623.
[24]秦宇,侯蓓蓓,张斌骏,等.超高效液相色谱-串联质谱法测定南瓜中γ-氨基丁酸的含量[J].食品安全质量检测学报,2020,11(2):528-532.
[25]高玉杰,张立佳,刘丽君,等.UPLC-MS/MS测定生乳与豆制饮品中咪喹烟酸残留[J].中国酿造,2023,42(2):235-239.
[26]屠钰,李无双,朗文成,等.串联质谱法实时直接测定茶叶中γ-氨基丁酸含量[J].分析化学,2020,48(9):1252-1259.
[27]苏萌,艾连峰.液相色谱-串联质谱基质效应及其消除方法[J].食品安全质量检测学报,2014,5(2):511-515.
[28]刘晓云,陈笑艳,钟大放.液相色谱-串联质谱生物分析方法的基质效应和对策[J].质谱学报,2017,38(4):388-399.