生物表面活性剂是由微生物在特定条件下代谢产生的一类具有双亲性的活性表面分子,能够降低表/界面张力[1]。可由细菌、酵母和丝状真菌产生,分为糖脂、磷脂、脂肽和脂蛋白及大分子乳化剂,其中糖脂类以鼠李糖脂、槐糖脂和海藻糖脂的研究比较深入[2]。生物表面活性剂具有低毒性、环境相容性好、高选择性、极端条件下活性稳定、较低的临界胶束浓度(critical micelle concentration,CMC)等优势[3],同时具有抗病毒、抗菌、抗肿瘤、无毒等性能[4]。因此,在石油工业、农业、生物修复、洗涤剂、食品工业、医药工程、化妆品等领域具有潜在的应用前景[5]。
海藻糖脂因较高的发酵成本限制了其大规模工业化生产,主要原因有原料成本过高、糖脂浓度偏低及副产物的形成等[6],因此需要寻找降低生产成本和提高产量的关键措施。研究表明,可以采用工农业加工过程的各种废弃物和副产品(如石油加工废物、淀粉生产废物、糖蜜、水果和蔬菜废物、豆饼粉以及动物脂肪等)作为生产原料[7]。培养基组成和培养条件均会影响微生物的生长、代谢和产物累积。碳氮源是决定生物表面活性剂产量、种类和结构的重要因素,通过控制合适的碳氮比可提高生物表面活性剂的产率[8];培养温度、初始pH值、接种量等发酵条件也是影响生物表面活性剂产率的关键因素[9]。因此,优化微生物培养基组成和发酵条件是提高生物表面活性剂产率和降低规模化生产成本的重要途径。
本研究以单因素试验结合Plackett-Burman、最陡爬坡和Box-Behnken等试验对红平红球菌XH-1合成海藻糖脂的培养基组成及发酵条件进行优化,初步探究了海藻糖脂粗品的CMC及温度、pH和盐度对其表面活性的影响,以期为海藻糖脂的低成本工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
红平红球菌(Rhodococcus erythropolis)XH-1:由本实验室保存。
发酵培养基[10]:甘油15 g/L、硝酸钾1 g/L、硫酸铵2 g/L、酵母浸粉0.1 g/L、磷酸氢二钾2 g/L、磷酸二氢钾2 g/L、硫酸镁0.2 g/L、无水氯化钙0.02 g/L、氯化钠1 g/L、氯化铁0.01 g/L。
LB培养基:青岛海博生物技术有限公司;三氯甲烷、甲醇(均为分析纯):烟台三和化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
JK99C全自动表界面张力测量仪:上海中晨数字技术设备有限公司;DNP-9162型电热恒温培养箱:宁波江南仪器厂;N-1100旋转蒸发仪:EYELA东京理化器械株式会社;VS-1300L-U洁净工作台:苏州安泰空气技术有限公司;GZX-9240MBE数显鼓风干燥箱:上海博迅实业有限公司医疗设备厂;HNYC-200B智能恒温振荡器:天津欧诺仪器股份有限公司。
1.3 方法
1.3.1 菌株活化与种子液培养
采用LB平板划线法活化-80 ℃保存的红平红球菌XH-1,30 ℃培养72 h后转接至LB斜面,4 ℃冰箱保存,为保持活性每月转接一次。取一环菌接种到发酵培养基中,30 ℃、150 r/min振荡培养72 h,获得种子培养液。
1.3.2 海藻糖脂的提取
将种子液按5%(V/V)的接种量接入装液量为50 mL/250 mL发酵培养基中,30 ℃、150 r/min振荡培养144 h,每12 h取样一次。所取样品6 000 r/min离心15 min,用等体积的氯仿/甲醇=2∶1(V/V)萃取上清液3次,合并萃取液,减压蒸馏后60 ℃烘至质量恒定,得到海藻糖脂粗产品;菌体沉淀用去离子水洗涤两次,6 000 r/min离心15 min,沉淀置于60 ℃烘至质量恒定,得生物量[11]。
1.3.3 单因素试验
固定其他条件不变,采用单因素试验优化发酵培养基组成,分别考察碳源种类(15 g/L的乳糖、乙酸钠、甘油、蔗糖、甘蔗糖蜜、淀粉、大豆糖蜜、葡萄糖)及最佳碳源添加量(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L),氮源种类(2 g/L的硝酸铵、硫酸铵、牛肉膏、蛋白胨、尿素、玉米浆、豆饼粉)及最佳氮源添加量(1 g/L、2 g/L、5 g/L、8 g/L、11 g/L、14 g/L、17 g/L)及酵母浸粉添加量(0、0.05 g/L、0.1 g/L、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L)对菌株XH-1产海藻糖脂的影响。
以优化后的发酵培养基为基础,保持其他培养条件不变,分别考察摇床转速(90 r/min、120 r/min、150 r/min、180 r/min、210 r/min),装液量(15 mL/250 mL、30 mL/250 mL、50 mL/250 mL、70 mL/250 mL、90 mL/250 mL),初始pH值(5、6、7、8、9),接种量(1%、3%、5%、7%、9%),培养温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)及种龄(24 h、36 h、48 h、60 h、72 h、84 h、96 h)等条件对海藻糖脂产量的影响。
1.3.4 Plackett-Burman试验
为考察影响海藻糖脂产量的因素,根据单因素试验结果,产脂量为响应值,设计8因素2水平的Plackett-Burman试验,试验中的高水平(1)是低水平(-1)的1.25倍。
1.3.5 最陡爬坡试验
根据1.3.4得出显著因素设计最陡爬坡试验,变化步长和方向根据因素的正负效应设计,确定响应面分析的试验中心点。
1.3.6 Box-Behnken试验设计
以1.3.4确定的显著因素为设计因素,1.3.5所得结果为中心点,根据Box-Behnken试验设计原理,通过3因素3水平的响应面试验,获得显著影响因素的最终优化值,确定海藻糖脂最佳的培养条件。
1.3.7 海藻糖脂的理化性质
参考文献[12]采用吊环法在常温条件下测定糖脂的表面张力(γ):将所得海藻糖脂粗品配制成含量1 g/L的溶液,测定不同稀释倍数糖脂溶液的表面张力;依据表面张力的变化(表面活性剂到达一定浓度后则变化缓慢或不再变化此时)确定临界胶束浓度(CMC)。
将5 mL无菌海藻糖脂粗品溶液(5 g/L),分别加入含有5 mL底物(环己烷、正己烷、正十六烷、柴油、液体石蜡、玉米油、棉籽油、橄榄油)的带刻度比色管中,每组3支,充分振荡3 min,静置24 h。参考文献[12]测定海藻糖脂的乳化活性,乳化指数(emulsion index,EI)计算公式如下:
为了考察海藻糖脂的稳定性,配制含量为100 mg/L的海藻糖脂粗品溶液,测定不同沸水浴时间(20 min、40 min、60 min、80 min、100 min、120 min),盐度(2%、5%、8%、12%、15%、18%、20%NaCl)及pH(2.0、4.0、6.0、7.0、8.0、10.0、12.0)条件下的表面张力变化。
1.3.8 数据处理
每组试验重复3次,取平均值。运用Origin 9.0软件作图,采用SPSS 16.0软件进行单因素方差与显著性差异分析,Design-Expert 10.0进行Plackett-Burman和Box-Behnken试验设计。
2 结果与分析
2.1 发酵时间对海藻糖脂产量的影响
按照1.3.2方法进行海藻糖脂发酵试验,以发酵时间为横坐标,生物量和海藻糖脂产量为纵坐标,绘制菌株XH-1的生长及产脂动力学变化曲线,结果见图1。由图1可知,菌体生物量与糖脂分泌呈正相关,发酵60 h后糖脂的分泌进入稳定期,84 h的海藻糖脂产量达到最高。因此,选择最佳发酵时间为84 h。
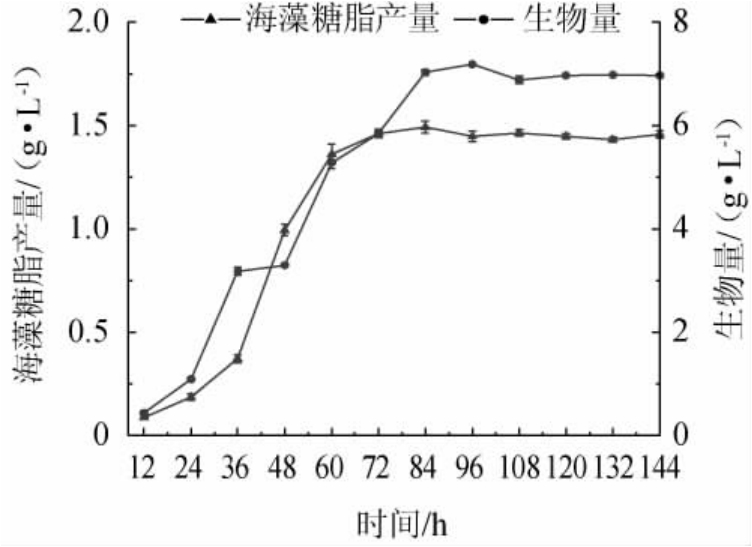
图1 菌株XH-1的生物量及海藻糖脂产量曲线
Fig.1 Biomass and trehalolipids yield curve of strain XH-1
2.2 发酵培养基组成及发酵条件优化单因素试验
2.2.1 碳源种类及碳源含量对菌株XH-1产海藻糖脂的影响
微生物生长代谢需要碳源提供能量,生成菌体细胞、积累代谢产物,影响生物表面活性剂产量和结构的重要因素。由图2A可知,菌株XH-1利用甘油作碳源时,海藻糖脂产量明显优于其他碳源。由图2B可知,海藻糖脂产量随甘油含量的增加呈先升高后降低的趋势,甘油含量为30 g/L时海藻糖脂产量最高,为3.126 g/L。研究表明,红平红球菌(R.erythropolis)可利用烷烃、甘油、乙醇、动物油脂、煤油等多种碳源生长并产生海藻糖脂[13]。解脂亚罗酵母(Yarrowia lipolytica)以3%粗甘油为唯一碳源,发酵生产可获得7.9 g/L生物表面活性剂[14]。甘油较烷烃分布广泛,是制备生物柴油的主要副产物,易获取且价格低廉,可以极低的成本用于海藻糖脂的生产。因此采用30 g/L甘油作为发酵培养基最佳碳源。
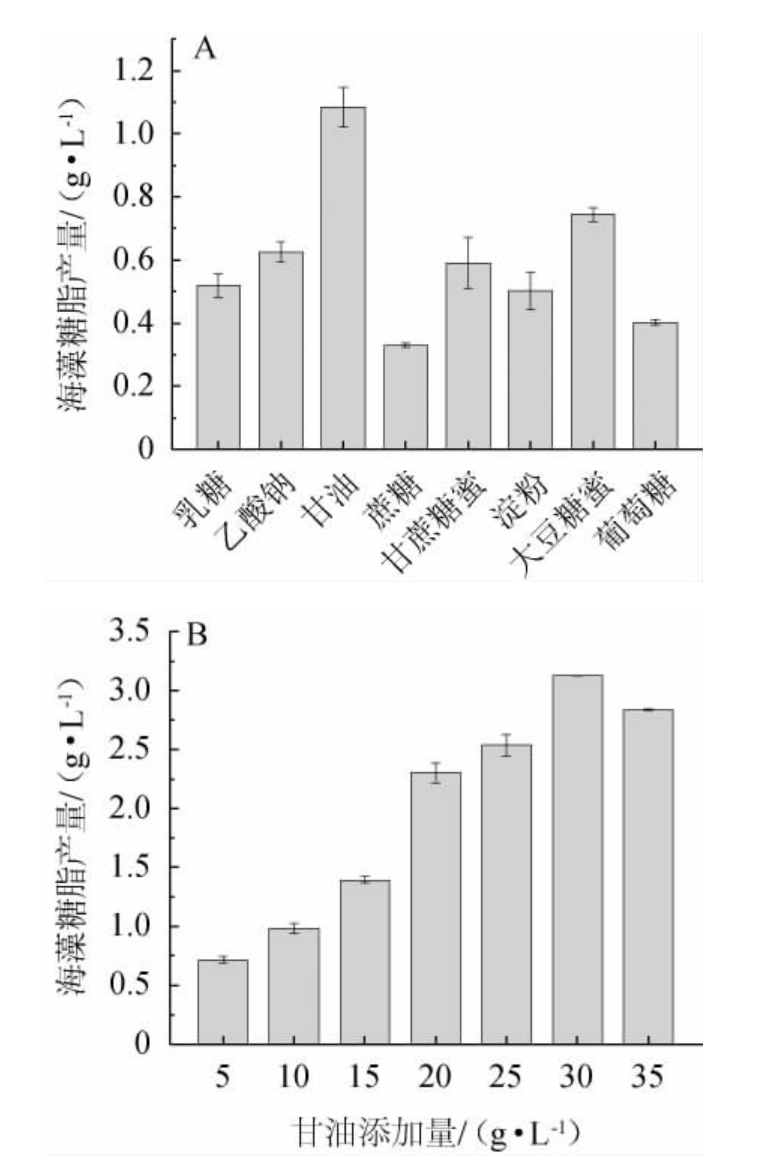
图2 不同碳源种类(A)及甘油添加量(B)对菌株XH-1产海藻糖脂的影响
Fig.2 Effect of different carbon sources (A) and glycerol addition (B)on trehalolipids produced by strain XH-1
2.2.2 氮源种类及氮源含量对菌株XH-1产海藻糖脂的影响
氮源是影响合成生物表面活性剂的另一关键因素,常用的有机氮源为牛肉膏、豆饼粉、玉米浆、蛋白胨、尿素等,无机氮源为硝酸盐、铵盐等。由图3A可知,菌株XH-1利用豆饼粉作氮源时,海藻糖脂产量明显优于其他氮源。由图3B可知,海藻糖脂产量随豆饼粉量的增加呈先升高后降低的趋势,豆饼粉含量达到14 g/L时海藻糖脂产量最高,为3.413 g/L。豆饼粉的成分较复杂,营养丰富,蛋白质含量较高,氨基酸种类十分丰富[15],有利于海藻糖脂的生物合成。GOVARTHANANM等[15]研究表明,豆饼粉可作为合成培养基的替代品,利用其营养特性成为生物表面活性剂生产菌株Rahnella sp.RM的培养基组分。作为农业副产品的豆饼粉是可再生资源,来源广泛,价格低廉,可作为优质氮源。因此采用14 g/L豆饼粉作为发酵培养基最佳氮源。
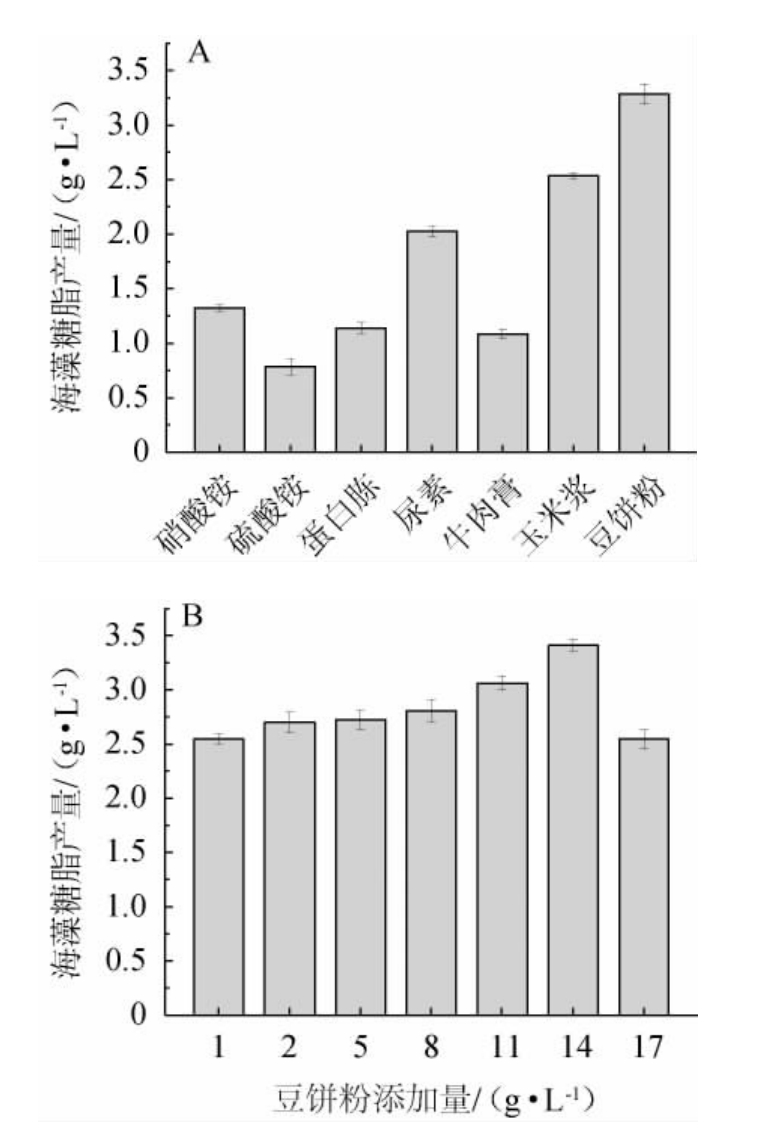
图3 不同氮源种类(A)及豆饼粉添加量(B)对菌株XH-1产海藻糖脂的影响
Fig.3 Effect of different nitrogen sources(A)and soybean cake powder addition (B) on trehalolipids produced by strain XH-1
2.2.3 酵母浸粉对菌株XH-1产海藻糖脂的影响
酵母浸粉含有丰富的蛋白质、氨基酸、维生素、微量元素等营养成分,既为微生物生长提供氮素,更为其发酵提供必需的生长因子。由图4可知,海藻糖脂产量随酵母浸粉含量的增加呈先升高后降低的趋势,酵母浸粉含量达到0.2 g/L时海藻糖脂产量最高,为4.458 g/L。因此,发酵培养基最佳酵母浸粉添加量为0.2 g/L。
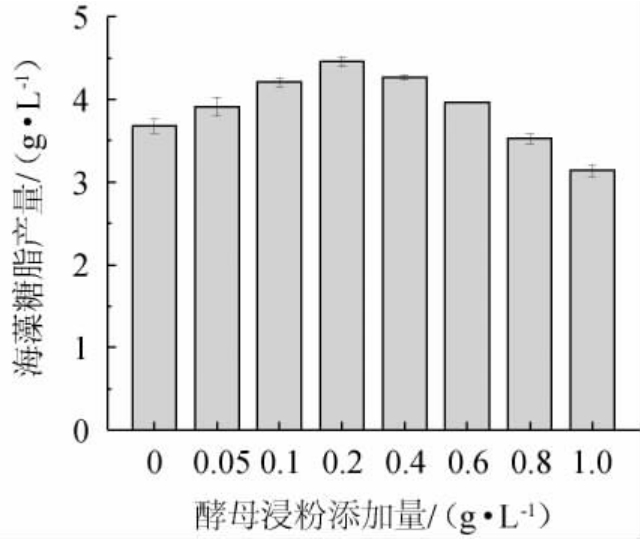
图4 酵母浸粉添加量对菌株XH-1产海藻糖脂的影响
Fig.4 Effect of yeast extract addition on trehalolipids produced by strain XH-1
2.2.4 摇床转速及装液量对菌株XH-1产海藻糖脂的影响
菌体细胞生长和表面活性剂合成受发酵液中溶解氧的直接影响,多数情况产物随溶氧的增加而增多[16]。由图5可知,海藻糖脂产量随溶解氧的增加呈先升高后降低的趋势,转速180 r/min,装液量50 mL/250 mL时,海藻糖脂产量最高,分别为4.442 g/L、4.714 g/L;当转速>180 r/min,装液量>50 mL/250 mL时,海藻糖脂产量反而呈下降趋势,可能因转速增加引起发酵液中的泡沫增多,反而会降低氧气在培养液中的传递,从而降低海藻糖脂的产率。KRETSCHMER A等[17]研究表明,溶解氧是通过增加红球菌的生物量来提高海藻糖脂的产量,说明海藻糖脂的分泌与生物量增长密切相关。摇床转速为180 r/min与150 r/min(4.246 g/L)时海藻糖脂产量差别不显著(P>0.05),考虑到节能降耗、降低成本。因此,最佳摇床转速和装液量分别确定为150 r/min和50 mL/250 mL。
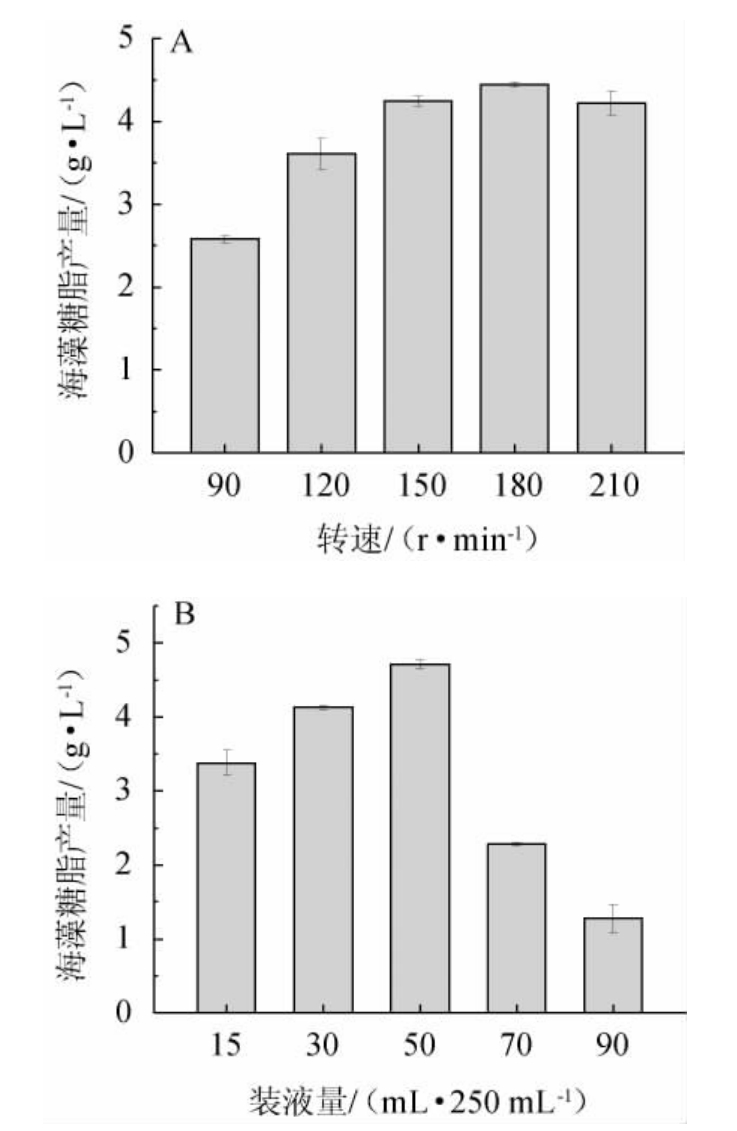
图5 摇床转速(A)及装液量(B)对菌株XH-1产海藻糖脂的影响
Fig.5 Effect of shaking speed (A) and liquid volume (B) on trehalolipids produced by strain XH-1
2.2.5 初始pH对菌株XH-1产海藻糖脂的影响
由图6可知,低pH条件不利于合成海藻糖脂,海藻糖脂产量随初始pH的增加呈先升高后降低的趋势,初始pH值为8时的海藻糖脂产量达到最大,为5.806 g/L。UCHIDA Y等[18]研究发现,菌株SD-74细胞生长和海藻糖脂合成的最适pH值也在偏碱条件下,为7.0~7.5。因此,发酵培养的最佳初始pH为8。
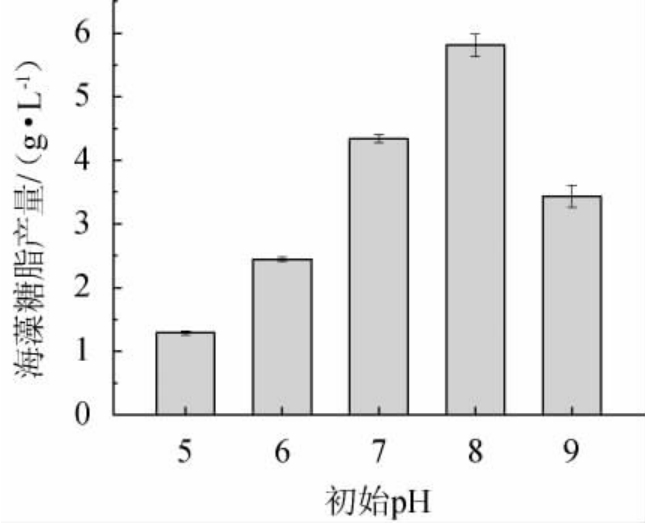
图6 初始pH对菌株XH-1产海藻糖脂的影响
Fig.6 Effect of initial pH on trehalolipids produced by strain XH-1
2.2.6 接种量对菌株XH-1产海藻糖脂的影响
适宜的接种量可增加生物表面活性剂的产量,接种量过低,延滞期延长,降低生产效率;接种量过大,菌体生长迅速,营养物质消耗过快,菌体过早衰老死亡,原料转化率降低。由图7可知,海藻糖脂产量随接种量的增加呈先增高后降低的趋势,接种量为3%(V/V)时的海藻糖脂产量最高,为6.318 g/L,随接种量的不断增加,造成营养供应不足,海藻糖脂产量下降[19]。因此发酵培养的最佳接种量为3%。
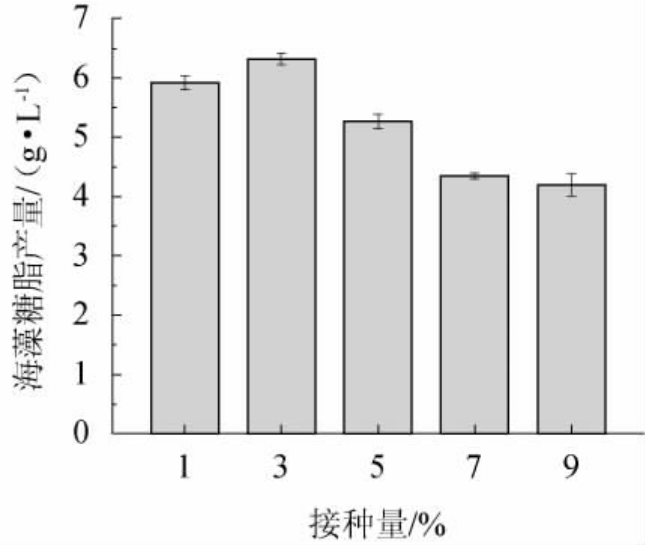
图7 接种量对菌株XH-1产海藻糖脂的影响
Fig.7 Effect of inoculum on trehalolipids produced by strain XH-1
2.2.7 培养温度对菌株XH-1产海藻糖脂的影响
温度通过改变酶促反应速率来影响生物表面活性剂的合成,是重要的环境影响因素。据报道,30~40 ℃的培养温度可促进微生物生产生物表面活性剂,且产量最高,可能由于30 ℃是多数菌株生长代谢的最佳温度[20]。由图8可知,海藻糖脂产量随温度的升高逐渐增加,随后逐渐降低,培养温度为30 ℃时最高,为7.099 8 g/L,结果与文献[18]报道一致,红平红球菌在培养温度和氮源受限的条件下具有较高的海藻糖脂产量。因此最佳发酵培养温度选择为30 ℃。
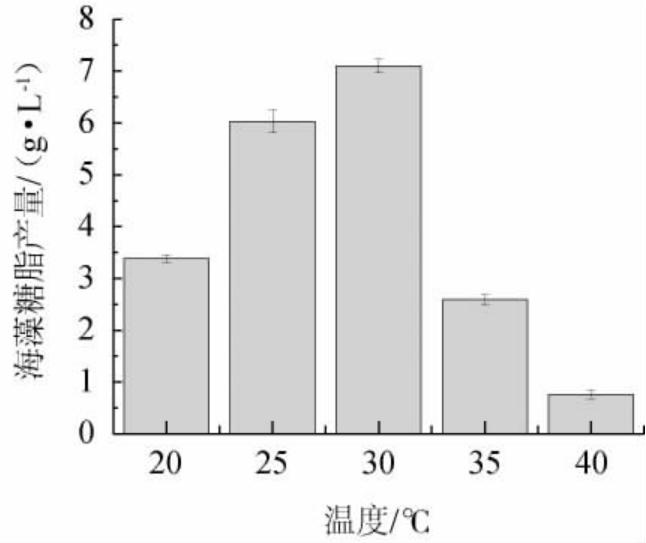
图8 培养温度对菌株XH-1产海藻糖脂的影响
Fig.8 Effect of culture temperature on trehalolipids produced by strain XH-1
2.2.8 种龄对菌株XH-1产海藻糖脂的影响
处于对数中后期的种子液,细胞代谢旺盛,适应新环境的能力较强,利于缩短发酵周期,更有利于海藻糖脂的合成。由图9可知,海藻糖脂产量随种龄的增加呈先升高后降低的趋势,当种龄为60 h时海藻糖脂产量最高,为7.746 g/L。菌株XH-1培养60 h的菌体细胞正处于对数生长中后期(图1),因此发酵培养的最佳种龄选择为60 h。
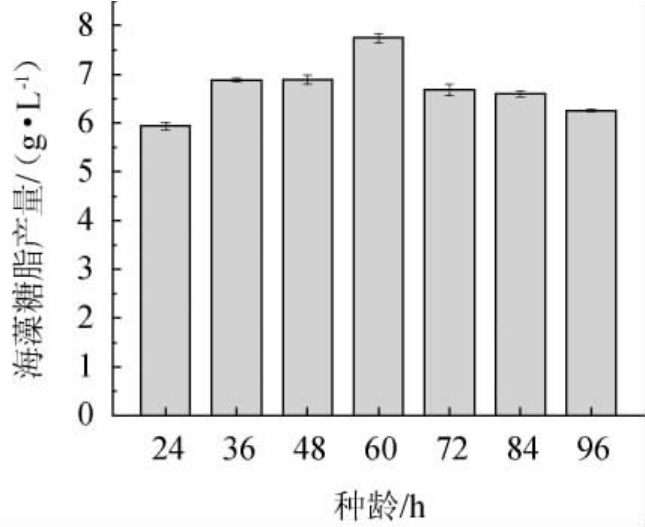
图9 种龄对菌株XH-1产海藻糖脂的影响
Fig.9 Effect of seed age on trehalolipids produced by strain XH-1
2.3 Plackett-Burman试验
基于单因素试验结果,采用N=12的Plackett-Burman试验设计,研究影响海藻糖脂产量的8个因素(甘油、豆饼粉、酵母浸粉、摇床转速、种龄、初始pH值、装液量和接种量),以海藻糖脂产量为响应值,试验设计和结果见表1,利用Design-Expert 10.0对Plackett-Burman设计的各因素水平及效应评价见表2。
表1 Plackett-Burman试验设计及结果
Table 1 Design and results of Plackett-Burman tests
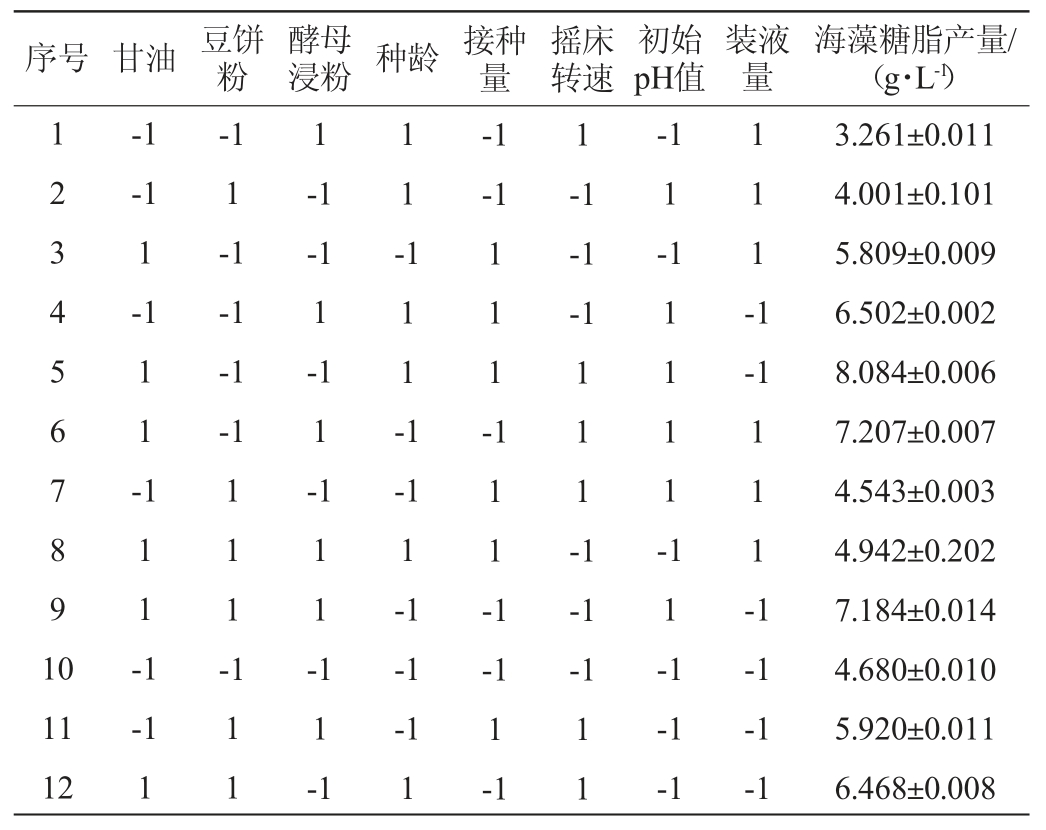
表2 Plackett-Burman试验的各因素水平及效应评价
Table 2 Factors and levels of Plackett-Burman tests and effect evaluation
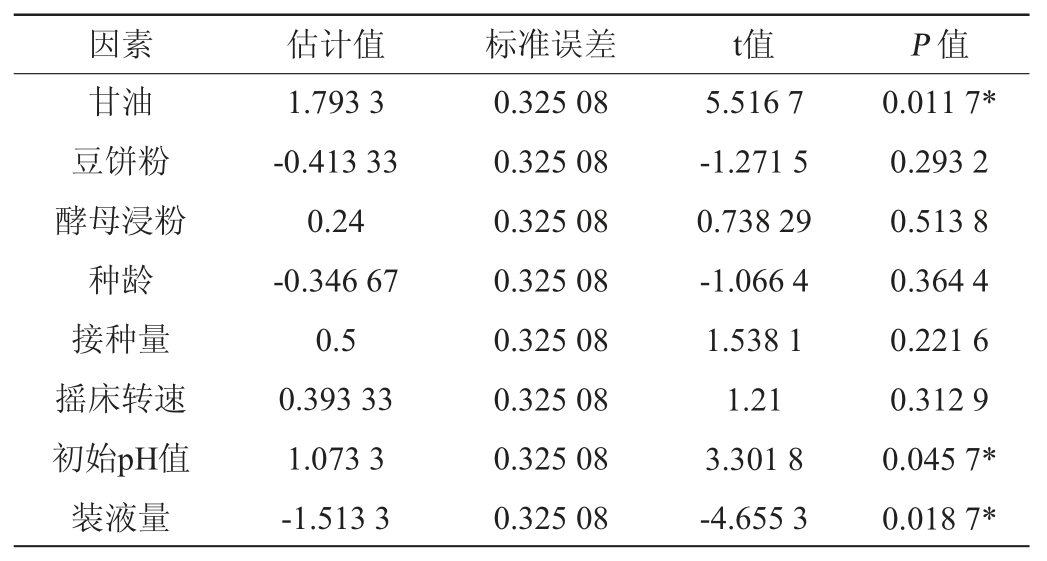
注:“*”表示对结果影响显著(P<0.05)。
通过比较各因素对响应值影响程度的显著性(P值),获得对海藻糖脂产量影响显著的3个因素为甘油添加量、装液量、初始pH值(表2),确定最陡爬坡试验显著因素取值。
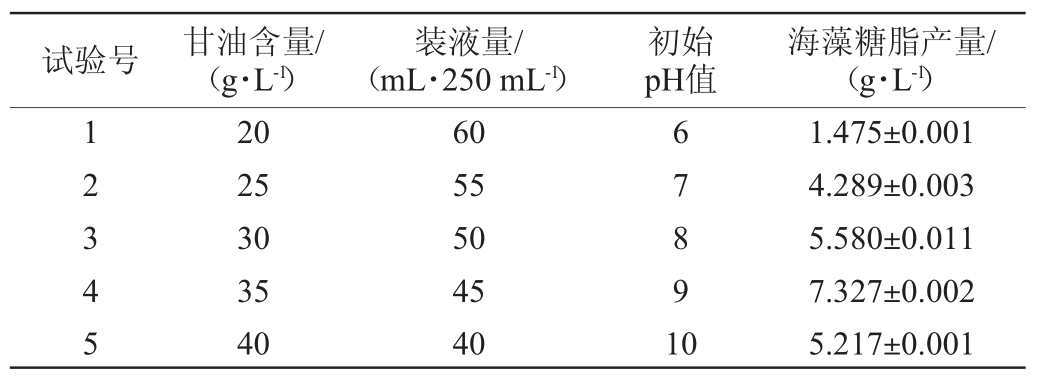
2.4 最陡爬坡试验结果
根据2.3中3个因素的效应大小,设计变化方向和步长,最陡爬坡试验设计与结果见表3。由表3可知,海藻糖脂产量先增高后降低,在4号试验组出现最高值,此时菌株XH-1的海藻糖脂产量最大,为7.327 g/L;该点处甘油添加量为35 g/L,初始pH值为9,装液量为45 mL/250 mL。因此,选择海藻糖脂产量最大的各因素值作为Box-Behnken试验设计中心点。
表3 最陡爬坡试验设计及结果
Table 3 Design and results of steepest ascent tests
2.5 Box-Behnken响应面试验结果
根据中心组合试验设计原理,以最陡爬坡试验确定的最优条件为中心,利用Design-Expert 10.0软件对装液量、初始pH、甘油含量设计3因素3水平Box-Behnken试验,结果见表4,方差分析结果见表5。
表4 Box-Behnken试验设计及结果
Table 4 Design and results of Box-Behnken tests
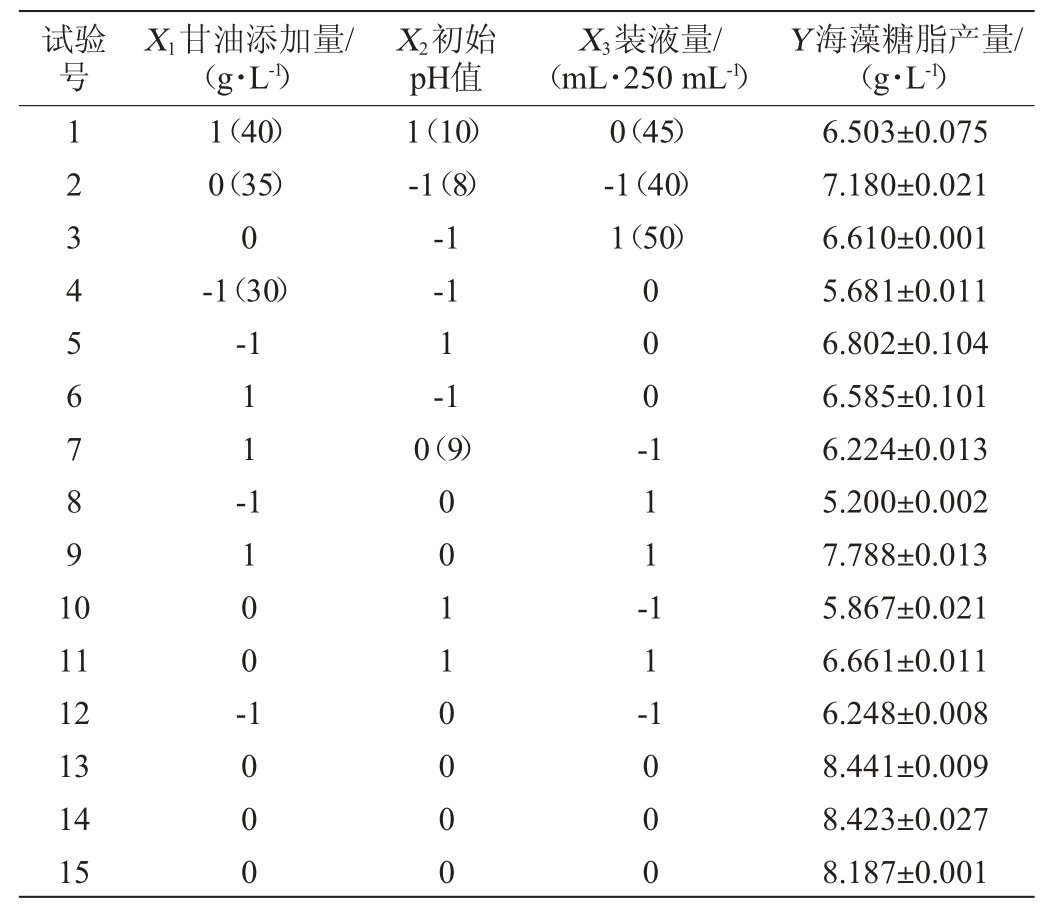
表5 回归模型的方差分析
Table 5 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表4可知,回归模型对试验结果有显著影响(P=0.032 4<0.05),方程具有可信度;失拟项检验不显著(P=0.370 7>0.05),模型适合。海藻糖脂产量(Y)对甘油含量(X1)、初始pH(X2)、装液量(X3)的多元二次回归方程为:
该方程的决定系数R2=0.956 1,校正决定系数为R2adj=0.914 0,表明模型可信度很高,说明该方程能够比较准确反映甘油添加量、初始pH值、装液量对菌株XH-1产海藻糖脂产量的影响。由回归方程显著性检验可知,模型一次项X1、X2、X3不显著(P>0.05);二次项X12、X22、X32均处于显著水平(P<0.05或P<0.01),交互项X1X2、X2X3不显著(P>0.05),X1X3显著(P<0.05)。回归方程一次项的回归系数X1>X3>X2,因此,3个因素对菌株XH-1产海藻糖脂影响顺序从大到小依次为甘油添加量、装液量、初始pH值。
根据响应面回归方程,利用Design-Expert 10.0软件绘制出甘油添加量(X1)、初始pH值(X2)、装液量(X3)相互作用对海藻糖脂产量影响的响应曲面及等高线见图10。

图10 各因素间交互作用对海藻糖脂产量影响的响应曲面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between various factors on trehalolipids yield
由图10可知,等高线均为椭圆形曲线,说明各因素对糖脂产量有影响,其中甘油含量与装液量的交互作用显著,而初始pH与二者的交互作用均不显著。拟合方程的二次项系数为负,抛物线开口向下,因而有极大值点。经过计算,海藻糖脂的最优发酵条件为:甘油添加量36.1572 g/L、初始pH值8.9693、装液量44.335 1 mL/250 mL,此时模型对菌株XH-1海藻糖脂产量的预测值为8.350 3 g/L。为方便实际操作,修正试验条件为甘油添加量36.2 g/L、初始pH值9.0、装液量45 mL/250 mL,在此条件下进行3组平行试验,海藻糖脂平均产量为8.339 g/L,与预测值(8.350 3 g/L)接近,表明所选优化模型可靠。
2.6 海藻糖脂的理化性质
2.6.1 表面张力和临界胶束浓度
由图11可知,表面张力随海藻糖脂含量的增大迅速减小,在表面张力低于40 mN/m后维持稳定,求算出海藻糖脂粗品溶液的CMC为100 mg/L,高于以正十四烷为碳源时菌株51T7所产海藻糖脂的CMC值(37 mg/L)[23],明显低于菌株PML026以葵花籽油为碳源所产海藻糖脂的CMC值(250 mg/L)[24],可能红球菌所产海藻糖脂的结构和组成随底物不同而有所差异,糖脂纯度也会影响CMC值。有研究报道海藻糖脂的CMC值为20~170 mg/L[13],具有较大的应用潜能。
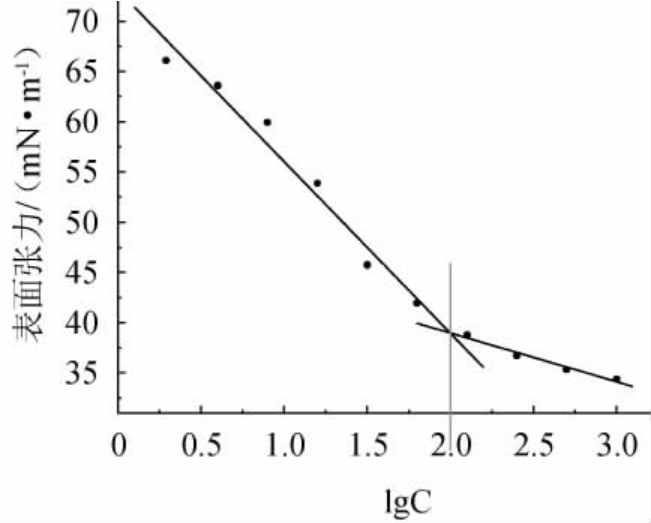
图11 海藻糖脂溶液的表面张力
Fig.11 Surface tension of trehalolipids solution
2.6.2 乳化活性
由图12可知,海藻糖脂对棉籽油、玉米油、橄榄油观察不到乳化层,对液体石蜡、柴油、环己烷的效果较差,而对正十六烷和正己烷的乳化指数分别达到40%和37.5%。红球菌PML026所产海藻糖脂对葵花籽油的乳化指数为34%~44%,乳化性能具有酸碱、温度和盐度稳定性[23]。结果表明,菌株XH-1所产海藻糖脂具有较好乳化活性,对不同类型底物的乳化作用不同[24]。
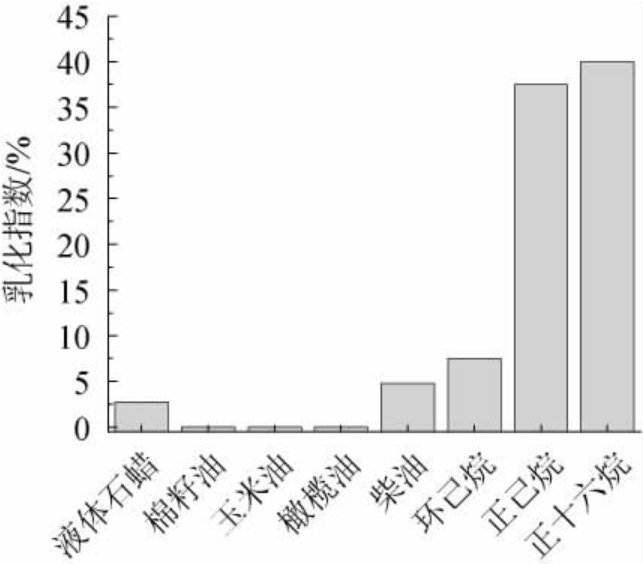
图12 海藻糖脂对不同底物的乳化作用
Fig.12 Emulsification of trehalolipids on different substrates
2.6.3 热稳定性及耐受性
由图13可知,沸水浴2 h及0~20%NaCl范围表面张力稳定,pH 2~12仍有较好的表面活性,说明菌株XH-1所产海藻糖脂具有很强的热稳定性、酸碱及耐盐性,与其他研究者的结果一致[5,24]。宋丹丹[25]研究了假丝酵母菌(S.bombicola)O-13-1所产的槐糖脂,在宽的盐度和pH范围及沸水浴2 h仍保持较高表面活性,为糖脂类表面活性剂应用于强酸、强碱、高温、高盐等极端环境提供理论依据。
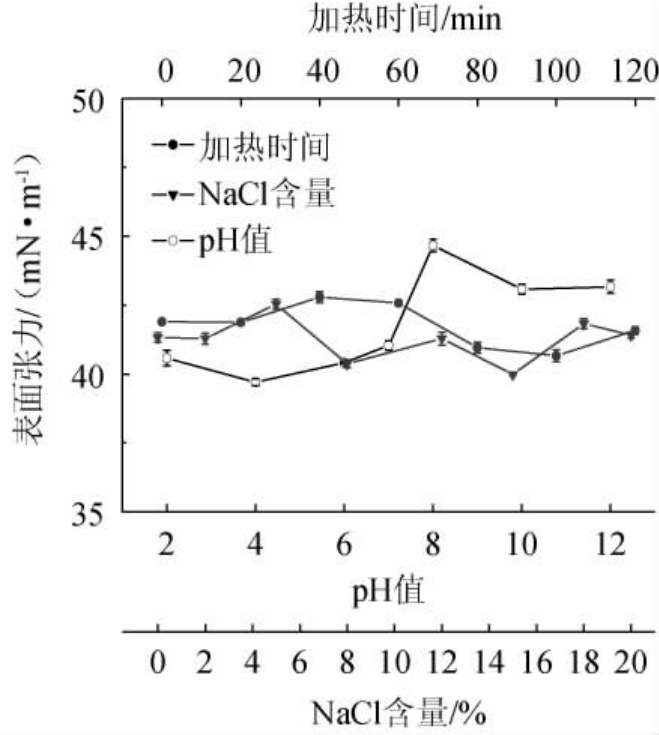
图13 不同盐度、pH和加热时间对海藻糖脂溶液表面张力的影响
Fig.13 Effect of different salinity,pH and heating time on surface tension of trehalolipids solution
3 结论
通过单因素试验和Plackett-Burman试验设计,确定了最佳碳源为甘油,最佳氮源为豆饼粉,筛选出对海藻糖脂产量具有主要影响的3个因素:甘油添加量、初始pH值和装液量。通过最陡爬坡试验与Box-Behnken响应面试验,建立了海藻糖脂产量与甘油添加量、初始pH值及装液量的回归方程,确定最佳培养基配方为豆饼粉14.0 g/L,甘油36.2 g/L,酵母浸粉0.2 g/L,KH2PO42.0 g/L,K2HPO4 2.0 g/L,NaCl 1.0 g/L,KNO3 1.0 g/L;最优发酵条件为发酵温度30 ℃、初始pH值9.0、摇床转速150 r/min、装液量45 mL/250 mL、种龄60 h、接种量3%。在此条件下菌株XH-1的海藻糖脂产量(8.339 g/L)是优化前(1.492 g/L)的5.59倍,试验证明所选模型合理可靠。通过理化性质分析,证明海藻糖脂具有较低的CMC(100 mg/L),较强的耐热(100 ℃2 h)、耐酸碱(pH 2~12)及盐度(0~20%NaCl)稳定性,因此,在清洁日化、石油工业、制药工业、食品工业等加工领域具有应用的潜力。
[1]ROELANTS S,SOLAIMAN D K Y,ASHBY R D,et al.Biobased surfactants:synthesis,properties and applications[M].UK:Academic Press,2019:65-119.
[2]CHEN W C,JUANG R S,WEI Y H.Applications of a lipopeptide biosurfactant,surfactin,produced by microorganisms[J].Biochem Eng J,2015,103:158-169.
[3]RIVERA Á D,URBINA M Á M,LÓPEZ Y LÓPEZ V E.Advances on research in the use of agro-industrial waste in biosurfactant production[J].World J Microb Biot,2019,35:155.
[4]KÜGLER J H,MUHLE-GOLL C,KÜHL B,et al.Trehalose lipid biosurfactants produced by the actinomycetes Tsukamurella spumae and T.pseudospumae[J].Appl Microb Biotechnol,2014,98:8905-8915.
[5]WANG Y,NIE M Q,DIWU Z J,et al.Characterization of trehalose lipids produced by a unique environmental isolate bacterium Rhodococcus qingshengii strain FF[J].J Appl Microbiol,2019,127(5):1442-1453.
[6]NURFARAHIN A H,MOHAMED M S,PHANG L Y.Culture medium development for microbial-derived surfactants production-an overview[J].Molecules,2018,23(5):1049.
[7]VIVEK K G,POONAM S,RANJNA S,et al.Production of biosurfactants from agro-industrial waste and waste cooking oil in a circular bioeconomy:An overview[J].Bioresource Technol,2022,343:126059.
[8]姚汝华,周世水.微生物工程工艺原理[M].广州:华南理工大学出版社,2011:16-18.
[9]REIS C B L,MORANDINI L M B,BEVILACQUA C B,et al.First report of the production of a potent biosurfactant with α,β-trehalose by Fusarium fujikuroi under optimized conditions of submerged fermentation[J].Brazilian J Microbiol,2018,49:185-192.
[10]PIROG T,SOFILKANYCH A,SHEVCHUK T,et al.Biosurfactants of Rhodococcus erythropolis IMV Ac-5017: Synthesis intensification and practical application[J].Appl Biochem Biotech,2013,170:880-894.
[11]KUYUKINA M S,IVSHINA I B,PHILP J C,et al.Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction[J].J Microbiol Method,2001,46(2):149-156.
[12]IKHWANI A Z N,NURLAILA H S,FERDINAND F D K,et al.Preliminary study:optimization of pH and salinity for biosurfactant production from Pseudomonas aeruginosa in diesel fuel and crude oil medium[J].IOP Conf Ser: Earth Environ Sci,2017,58(1):012056.
[13]FRANZETTI A,GANDOLFI I,BESTETTI G,et al.Production and ap-plications of trehalose lipid biosurfactants[J].Eur J Lipid Sci Tech,2010,112(6):617-627.
[14]FONTES G C,RAMOS N M,AMARAL P F F,et al.Renewable resources for biosurfactant production by Yarrowia lipolytica[J].Brazilian J Chem Eng,2012,29:483-493.
[15]GOVARTHANAN M,MYTHILI R,SELVANKUMAR T,et al.Isolation and characterization of a biosurfactant-producing heavy metal resistant Rahnella sp.RM isolated from chromium-contaminated soil[J].Biotechnol Bioproc E,2017,22:186-194.
[16]BAZSEFIDPAR S,MOKHTARANI B,PANAHI R,et al.Overproduction of rhamnolipid by fed-batch cultivation of Pseudomonas aeruginosa in a lab-scale fermenter under tight DO control[J].Biodegradation,2019,30:59-69.
[17]KRETSCHMER A,WAGNER F.Influence of hyperbaric oxygen tension on the metabolism of Candida tropicalis and Rhodococcus erythropolis[J].Eur J Microbiol Biotechnol,1980,10:51-57.
[18]UCHIDA Y,MISAWA S,NAKAHARA T,et al.Factors affecting the production of succinoyl trehalose lipids by Rhodococcus erythropolis SD-74 grown on n-Alkanes[J].Agr Biol Chem,1989,53(3):765-769.
[19]张庆芳,迟乃玉.发酵工程技术[M].北京:北京师范大学出版社,2012:35-37.
[20]DAS A J,KUMAR R.Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its application in oil recovery from sand matrix[J].Bioresource Technol,2018,260:233-240.
[21]ESPUNY M J,EGIDO S,RODÓN I,et al.Nutritional requirement of a biosurfactant producing strain Rhodococcus sp.51T7[J].Biotechnol Lett,1996,18(5):521-526.
[22]MUTALIK S R,VAIDYA B K,JOSHI R M,et al.Use of response surface optimization for the production of biosurfactant from Rhodococcus spp.MTCC2574[J].Bioresource Technol,2008,99(16):7875-7880.
[23]MARQUÉS A M,PINAZO A,FARFAN M,et al.The physicochemical properties and chemical composition of trehalose lipids produced by Rhodococcus erythropolis 51T7[J].Chem Phys Lipids,2009,158(2):110-117.
[24]WHITE D,HIRD L,ALI S.Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp.,strain PML026[J].J Appl Microbiol,2013,115:744-755.
[25]宋丹丹.生物表面活性剂复配行为及在疏水性有机污染物修复中的应用[D].青岛:中国海洋大学,2013.