刺梨(Rosa roxburghii)是蔷薇科多年生落叶灌木缫丝花的果实,生长在海拔500~2 500 m的地区,分布于陕西、甘肃及西南(云贵川)等地区,其中贵州所产刺梨最为出名[1]。刺梨果肉中含有维生素C、P、B1、B2、K1等16种维生素,其中维生素C含量是苹果、梨等的500倍,维生素P含量是柑橘的120倍[2]。除此之外,刺梨还含有丰富的黄酮、有机酸、多糖、超氧化物歧化酶(superoxide dismutase,SOD)、多酚、三萜类、甾醇等生物活性物质,具有增强机体免疫力[3]、预防动脉粥样硬化[4]、抗疲劳[5-6]、α-葡萄糖苷酶抑制活性[7]、促消化[8]等多种功效。
刺梨具有药食两用属性,应用前景广阔,但是刺梨产品的开发和加工技术还处于初级阶段,精深加工产品较少[9-10]。这与其独特的酸涩感和刺梨鲜果较短的收获期[11]有关。目前,刺梨酒类产品研究多以刺梨果酒为主,深加工产品单一,刺梨多用于制成果汁、冲泡茶片、果脯类产品,对刺梨附加值提升有限。
白兰地是以葡萄或其他水果为原料,经发酵、蒸馏、陈酿、调配而成的蒸馏酒,酒精度一般为40%vol~43%vol[12]。本研究以刺梨汁为原料酿造刺梨酒,并经过蒸馏制备刺梨白兰地,考察发酵初始糖度、酵母菌添加量、发酵温度及初始pH对刺梨酒酒精度、总酸含量的影响,通过单因素试验及响应面试验优化刺梨酒发酵工艺。刺梨白兰地的开发旨在丰富刺梨深加工产品,增加刺梨产品附加值,促进刺梨产业发展。
1 材料与方法
1.1 材料与试剂
刺梨清汁(可溶性固形物含量7.85%,总酸含量12.25g/L,还原糖含量46 g/L):贵州省六盘水市某公司;RW果酒酿造酵母:安琪酵母有限公司;果胶酶(酶活40 000 U/g)、纤维素酶(酶活10 000 U/g):索莱宝生物科技有限公司;白砂糖(食品级):市售;柠檬酸、碳酸钾(均为分析纯):山东潍坊英轩实业有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
FA2004N精密电子天平:上海菁海仪器有限公司;DFD-700恒温水浴锅、6202高速粉碎机:常州澳华仪器有限公司;SPX-250B生化培养箱:上海琅玕实验设备有限公司;SB-400DTY型超声波清洗器:宁波新芝生物科技股份有限公司;722S可见分光光度计:上海菁华科技仪器有限公司;ZD-2A型自动电位滴定仪:上海大普仪器有限公司。
1.3 方法
1.3.1 刺梨白兰地加工工艺流程及操作要点

操作要点:
原料的筛选及预处理:选取无腐烂、病虫害,果实大、肉厚,充分成熟的新鲜刺梨,使用蒸馏水进行表面清洗后沥干,置于高速粉碎机中粉碎至果皮完全破裂。
酶解:向粉碎后的刺梨果浆中加入100 mg/L偏重亚硫酸钾和质量分数0.5%的柠檬酸,再加入0.05%的果胶酶与0.1%纤维素酶,50 ℃条件下酶解40 min[13-14],用100目、80目过滤袋过滤两次,取滤液得到刺梨清汁。
酸度、糖度调节:使用柠檬酸和碳酸钾调节刺梨清汁的初始pH值,使用白砂糖调节刺梨清汁的初始糖度。
酵母活化:称取10.0 g酵母粉溶解于100 mL、35 ℃温水中,静置20 min进行活化[15]。
接种发酵:将活化后的酵母按照一定接种量加入刺梨清汁中充分混匀,转入不锈钢发酵罐内,每罐5 L(装液量不超过总体积的60%),在一定温度下恒温发酵,当发酵液残糖<6 g/L时视为发酵结束[16-17]。
蒸馏:将过滤获得的猕猴桃酒置入蒸馏装置中,采用二次蒸馏法:一次蒸馏温度约95 ℃,收集10%vol~70%vol酒精度的蒸馏酒。二次蒸馏收集30%vol~70%vol酒精度的蒸馏酒,剩余的酒头与酒尾与预蒸馏的原酒混合,重复蒸馏[18-19]。
陈酿:将蒸馏酒放入储酒桶中满罐密封,于室温下(约25 ℃)陈酿45 d [20],即得刺梨白兰地。
1.3.2 分析检测
还原糖含量的测定:采用3,5-二硝基水杨酸法[21];总酸含量的测定:参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的电位滴定法[22];酒精度的测定:参照国标GB/T 11856—2008《白兰地》中的酒精计法[23];可溶性固形物含量的测定:参照国标GB/T 12143—2008《饮料通用分析方法》中的折光计法[24]。
1.3.3 刺梨酒发酵工艺优化
(1)单因素试验
初始糖度的确定:固定酵母添加量为600 mg/L,初始pH值为3.4,添加白砂糖调整刺梨清汁糖度分别为:18°Bx、20°Bx、22°Bx、24 °Bx、26 °Bx,在发酵温度26 ℃条件下发酵7 d。定期测定其总酸含量、酒精度,考察不同初始糖度对刺梨酒发酵的影响。
初始pH值的确定:固定酵母添加量为600 mg/L,用柠檬酸和碳酸钾调节初始pH值分别为:3.0、3.2、3.4、3.6、3.8,调糖至22°Bx,在发酵温度26 ℃条件下发酵7 d。定期测定总酸含量、酒精度,考察不同初始pH值对刺梨酒发酵的影响。
发酵温度的确定:固定酵母添加量为600 mg/L,初始pH值为3.4,调糖至22°Bx,在发酵温度分别为:22 ℃、24 ℃、26 ℃、28 ℃、30 ℃条件下发酵7 d。定期测定其总酸含量、酒精度,考察不同发酵温度对刺梨酒发酵的影响。
酵母添加量的确定:固定初始pH值为3.4,调糖至22°Bx,酵母添加量分别为:200mg/L、400mg/L、600mg/L、800mg/L、1 000 mg/L,在发酵温度26 ℃条件下发酵7 d。定期测定其总酸含量、酒精度,考察不同酵母添加量对刺梨原料酒发酵的影响。
(2)响应面试验
在单因素试验基础上,根据Box-Behnken试验设计,以初始糖度(A)、酵母添加量(B)、初始pH值(C)、发酵温度(D)四个单因素为自变量,以酒精度(Y)为响应值,Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

1.3.4 数据处理
每组试验设置3个平行,采用Excel 2016、Origin 2018、SPSS 19.0、Design-Expert 11.0等相关软件进行绘图及数据分析。
2 结果与分析
2.1 刺梨酒发酵工艺优化单因素试验
2.1.1 不同初始糖度对刺梨酒发酵的影响
由图1a和图1b可知,五组样液均在第4天之后趋于平稳,初始糖度为22°Bx原料酒在发酵结束时酒精度最高为9.97%vol,发酵前期速率较其他4组快,且残糖量较低;初始糖度为18°Bx、20°Bx两组样液发酵至4 d基本结束,溶液中还原糖未被充分利用,发酵结束后酒精度较其他三组样液低,原因是糖类物质偏低使得酵母菌后期生长所需碳源物质不足,酵母菌衰亡使得发酵速率下降;初始糖度为24°Bx、26°Bx前期发酵速率较慢,发酵结束后酒精度分别为9.60%vol、8.99%vol,可能是由于溶液渗透压偏高,酵母菌生长受到抑制所导致。由图1c可知,初始糖度对发酵过程中总酸含量的影响不大。综上,选取初始糖度20 °Bx、22°Bx、24°Bx进行响应面试验。
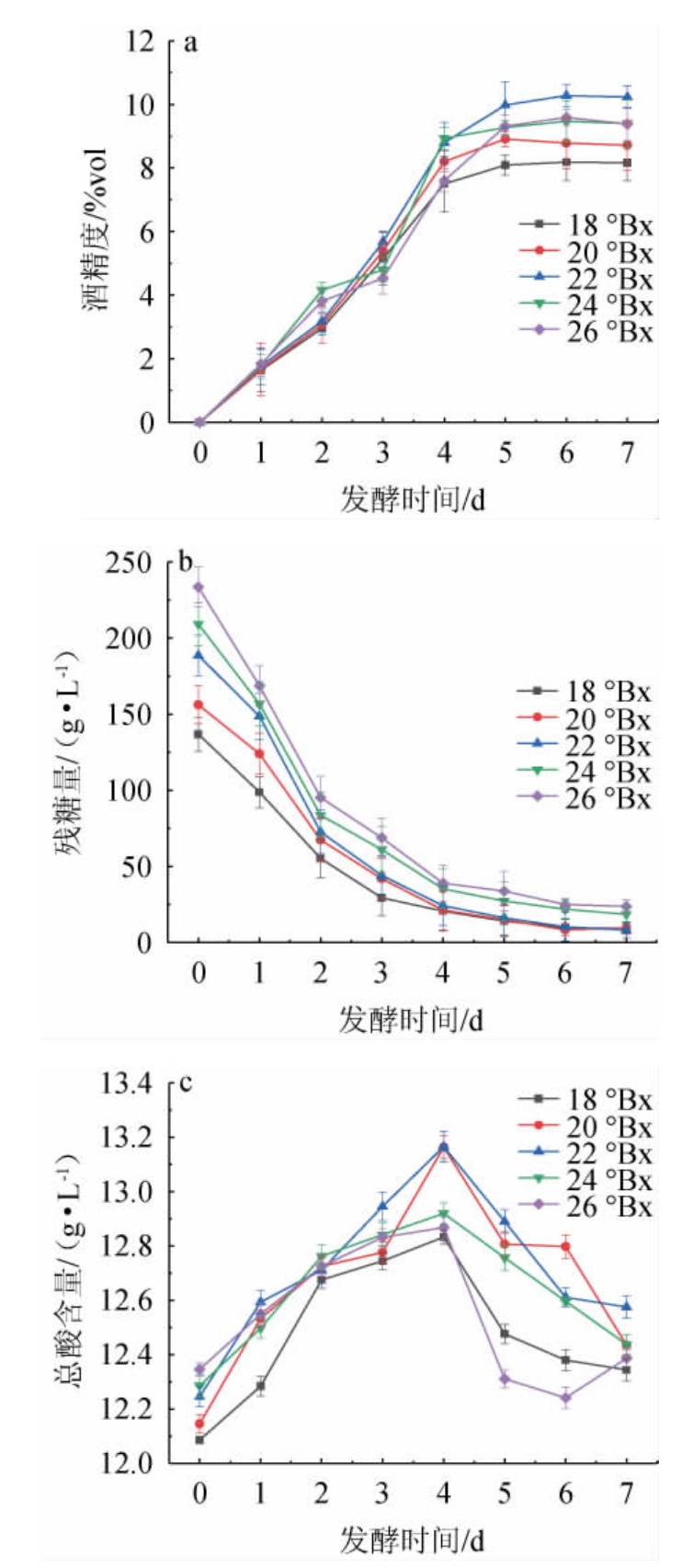
图1 不同的初始糖度对刺梨酒酒精度(a)、残糖量(b)及总酸含量(c)的影响
Fig.1 Effect of different initial sugar contents on alcohol content (a),residual sugar contents (b) and total acid contents (c) of Rosa roxburghii wine
2.1.2 不同初始pH值对刺梨酒发酵的影响
由图2a和图2b可知,五组样液发酵前4 d还原糖被酵母菌消耗速率快,发酵液酒精度上升速率也较快,发酵至6~7 d基本停止发酵。初始pH值为3.6时,样液残糖量最低,酒精度最高,分别为6.43 g/L、10.39%vol。初始pH值为3.0时,残糖量最高,酒精度也较低,分别为13.58 g/L、9.90%vol,其原因是由于低pH的环境会抑制酵母生命活动。由图2c可知,发酵过程中,总酸含量总体呈上升-下降-上升的波动趋势,并且发酵结束时与发酵初的总酸含量相差不大,这是因为发酵后期微生物代谢活动都比较缓慢,产酸减少,同时微生物也在将酸不断地转化成酯、醛、酮等其他物质并加以利用,使得总酸含量略有降低。综上,选取初始pH值为3.4、3.6、3.8进行响应面试验。
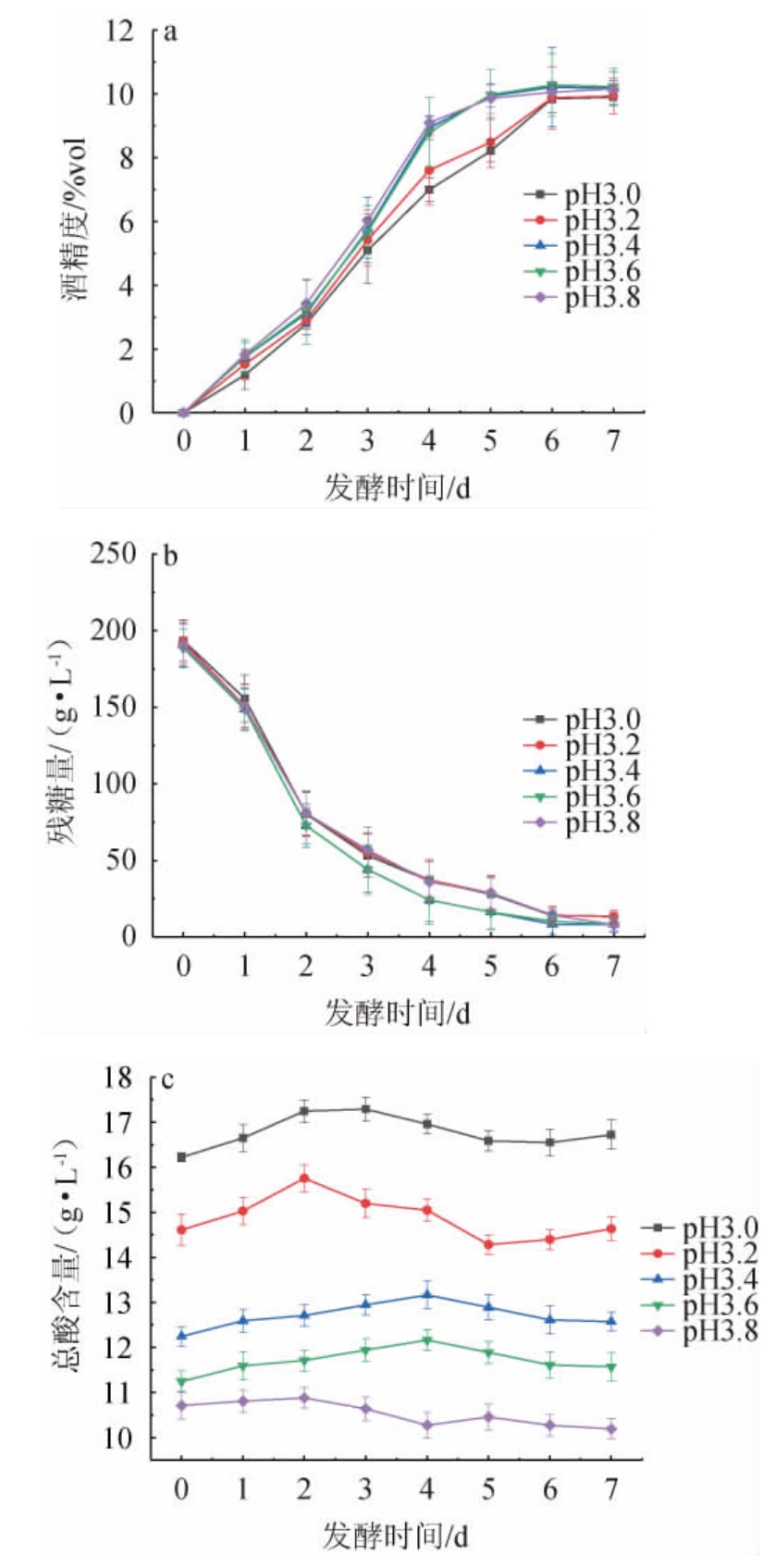
图2 不同的初始pH值对刺梨酒酒精度(a)、残糖量(b)及总酸含量(c)的影响
Fig.2 Effect of different initial pH on alcohol content (a),residual sugar contents (b) and total acid contents (c) of Rosa roxburghii wine
2.1.3 不同发酵温度对刺梨酒发酵的影响
由图3a和图3b可知,发酵温度为30 ℃的样品,在前3 d酒精度上升最快,但到达第4天样液酒精度趋于平衡,这是由于发酵温度过高,酵母菌前期急剧生长,消耗的糖类物质不能完全转换为酒精,发酵不平稳导致,并且酵母菌衰亡期也提前到来,导致最终酒精度只有9.83%vol;而发酵温度22 ℃、24 ℃两组相比发酵温度26 ℃、28 ℃两组发酵速率降低,酵母菌活性和发酵结束时酒精度较低,同时残糖量偏高。发酵温度26 ℃组样液,发酵液酒精度上升速率和残糖量消耗速率趋于平稳,最终发酵液酒精度为10.11%vol,发酵较其他几组彻底。由图3c可知,发酵结束时总酸含量与初始发酵液相差不大,大多在1.0 g/L范围内波动。综上,选取发酵温度24 ℃、26 ℃、28 ℃进行响应面试验。
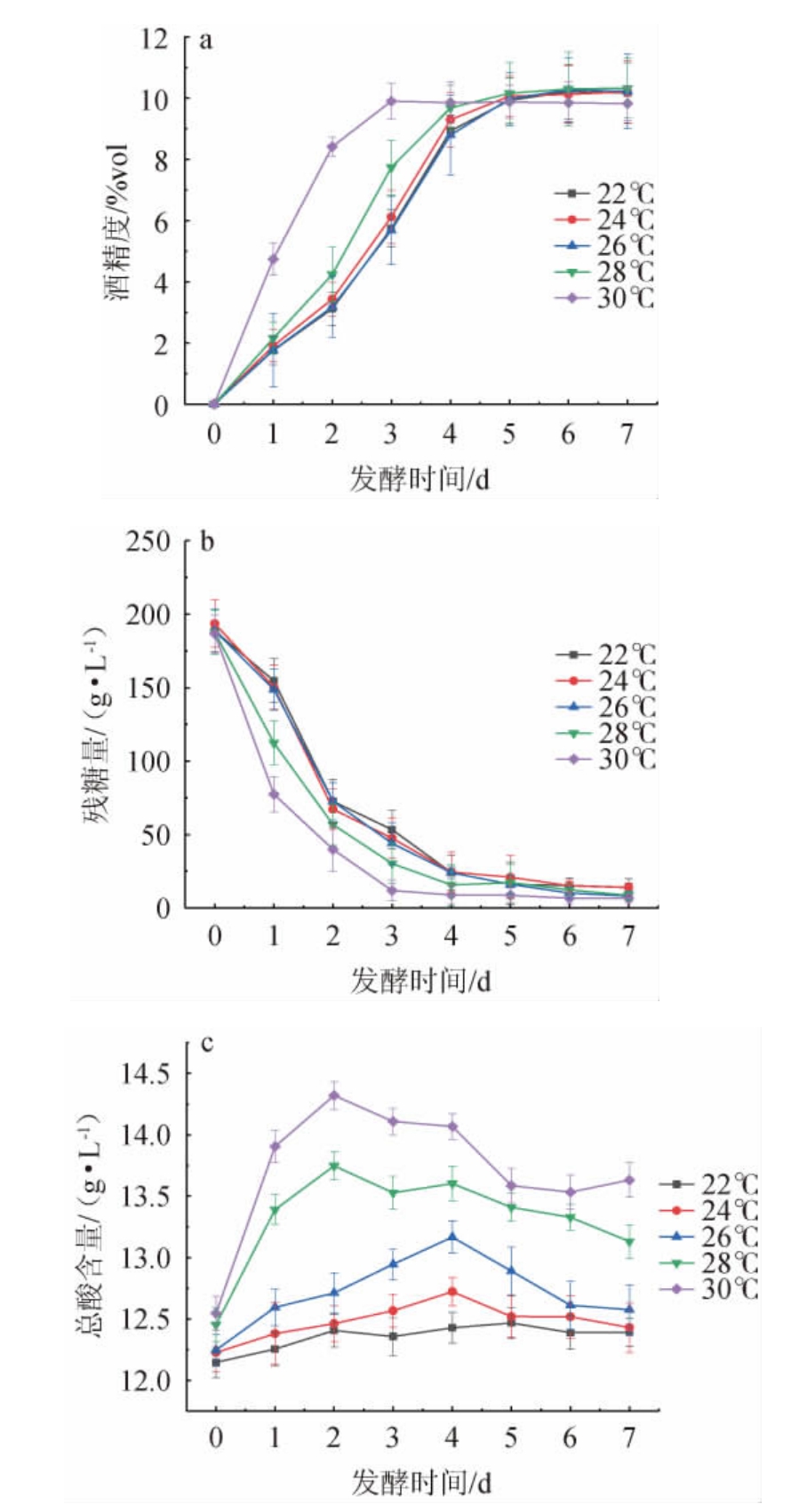
图3 不同的发酵温度对刺梨酒酒精度(a)、残糖量(b)及总酸含量(c)的影响
Fig.3 Effect of different fermentation temperature on alcohol content(a),residual sugar contents (b) and total acid contents (c) of Rosa roxburghii wine
2.1.4 不同酵母菌添加量对刺梨酒发酵的影响
由图4a和图4b可知,五组样液在发酵至第4 天酒精度趋于平缓,酵母添加量200 mg/L、400 mg/L两组样液酒精度较低,这是因为酵母菌添加量过少,糖类物质消耗不完全。酵母添加量为600 mg/L、800 mg/L、1 000 mg/L三组样液在发酵前期酒精度上升速率较快,且酒精度随着酵母添加量逐渐减小,这是因为酵母添加量过高,酵母菌利用糖类物质和其它养分,主要产生呼吸作用,产酒底物减少,导致产酒量少[25-26]。由图4c可知,原料酒的总酸含量呈现先上升后下降的趋势,这可能是由于发酵前4 d 微生物处于快速生长繁殖阶段,其代谢活动剧烈,使总酸含量快速上升[27]。发酵至第7天原料酒总酸含量与发酵0 d 原料酒变化不大均在1 g/L范围内波动。酵母添加量过少易使发酵不充分,酵母接种量过多易使发酵过快,从而导致酒精度下降、还原糖含量升高,直接影响酒的品质。综上,选取酵母添加量400 mg/L、600 mg/L、800 mg/L进行响应面试验。
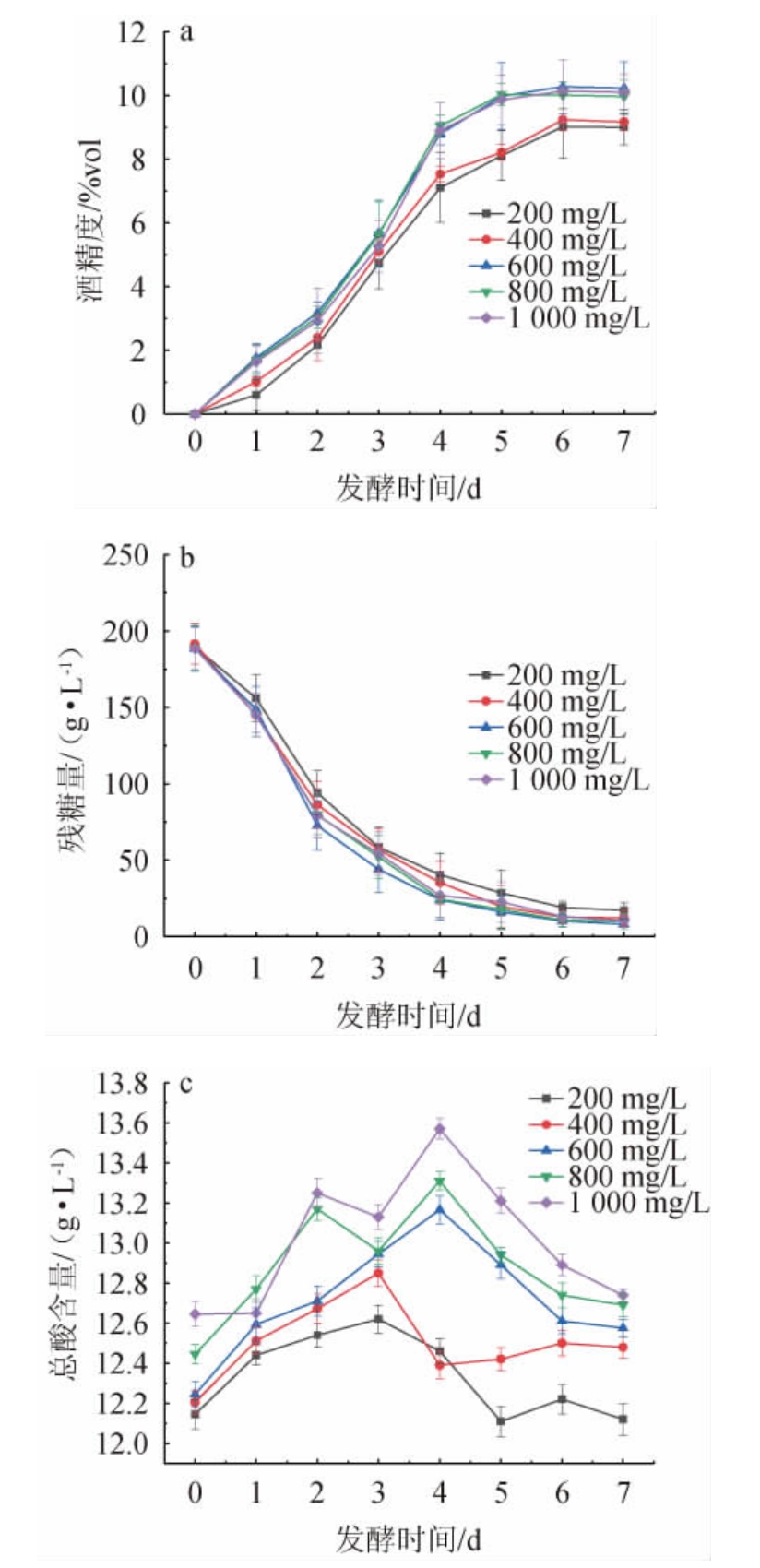
图4 不同的酵母添加量对刺梨酒酒精度(a)、残糖量(b)及总酸含量(c)的影响
Fig.4 Effect of different yeast addition on alcohol content (a),residual sugar contents (b) and total acid contents (c) of Rosa roxburghii wine
2.2 刺梨酒发酵工艺优化响应面试验
在单因素试验基础上,根据Box-Behnken试验设计,以酒精度(Y)为响应值,利用Design-Expert 11.0软件设计出29组试验,Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
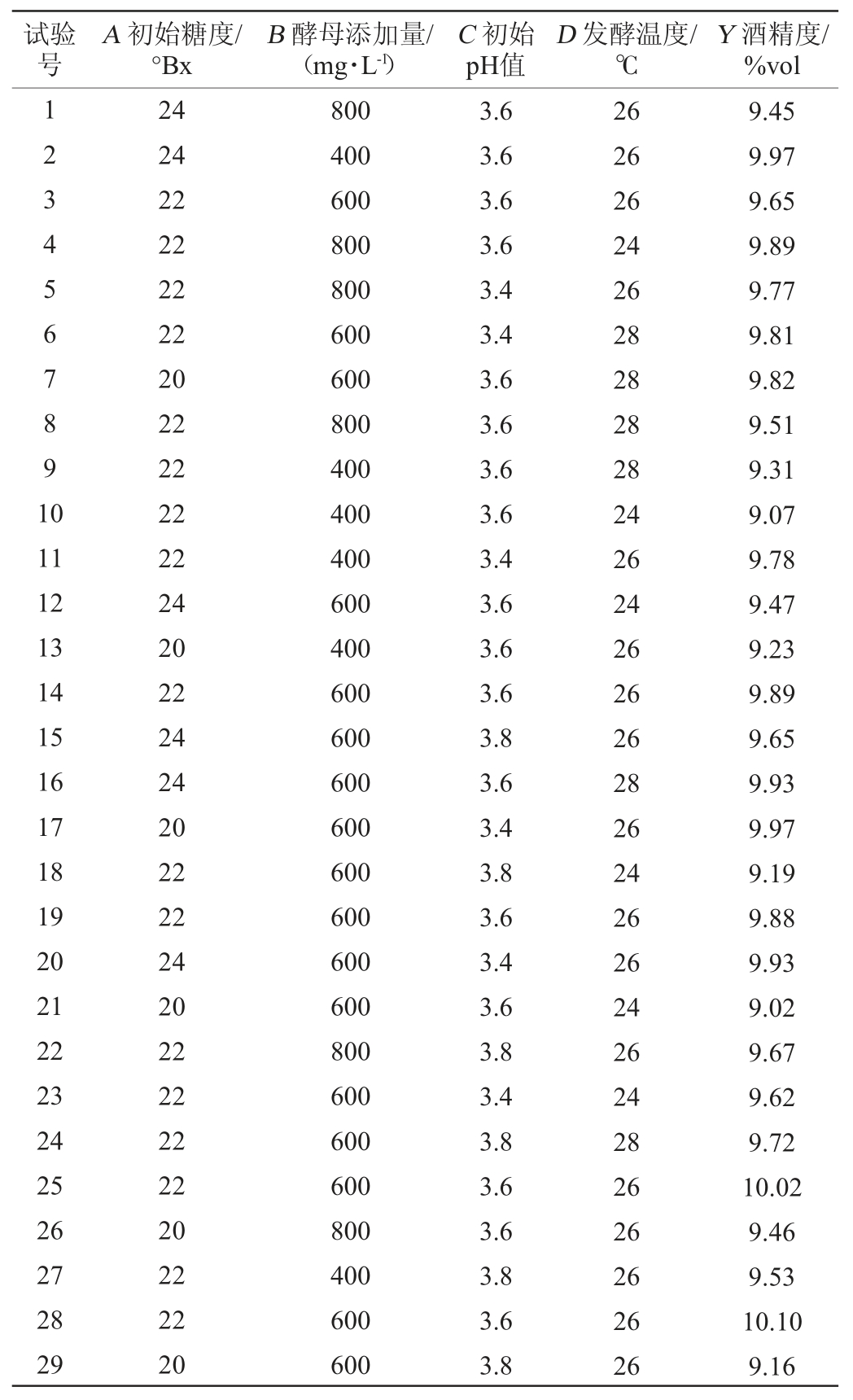
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
利用Design-Expect 11.0对表2结果进行分析,得到回归方程如下:

方差分析中3种因素对不同因变量影响的显著性由F检验判断,P值越小表明因素对因变量影响显著程度越高。由表3可知,模型P值=0.004<0.01,极显著,失拟项P值=0.079 2>0.05,不显著。决定系数R2=0.818 4,调整决定系数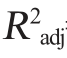 =0.636 8,证明该回归模型方程拟合度较好,误差小,该模型准确,可行性高,能用于本试验预测分析。由P值可知,一次项A、C以及二次项C2对刺梨酒中酒精度影响显著(P<0.05);一次项D以及二次项A2、B2、D2对刺梨酒中酒精度影响极显著(P<0.01)。由F值可知,4个因素对结果影响顺序为D>A>C>B。
=0.636 8,证明该回归模型方程拟合度较好,误差小,该模型准确,可行性高,能用于本试验预测分析。由P值可知,一次项A、C以及二次项C2对刺梨酒中酒精度影响显著(P<0.05);一次项D以及二次项A2、B2、D2对刺梨酒中酒精度影响极显著(P<0.01)。由F值可知,4个因素对结果影响顺序为D>A>C>B。
2.3 响应面分析
响应面图可以比较直观地表现出两变量对因变量的影响关系,其中,三维图的曲面坡度越陡峭则各因素对响应值的影响越大,表明两变量之间的交互作用显著[28-29]。发酵温度、初始糖度、酵母添加量、初始pH值间相互作用对酒精度影响的响应面及等高线见图5。
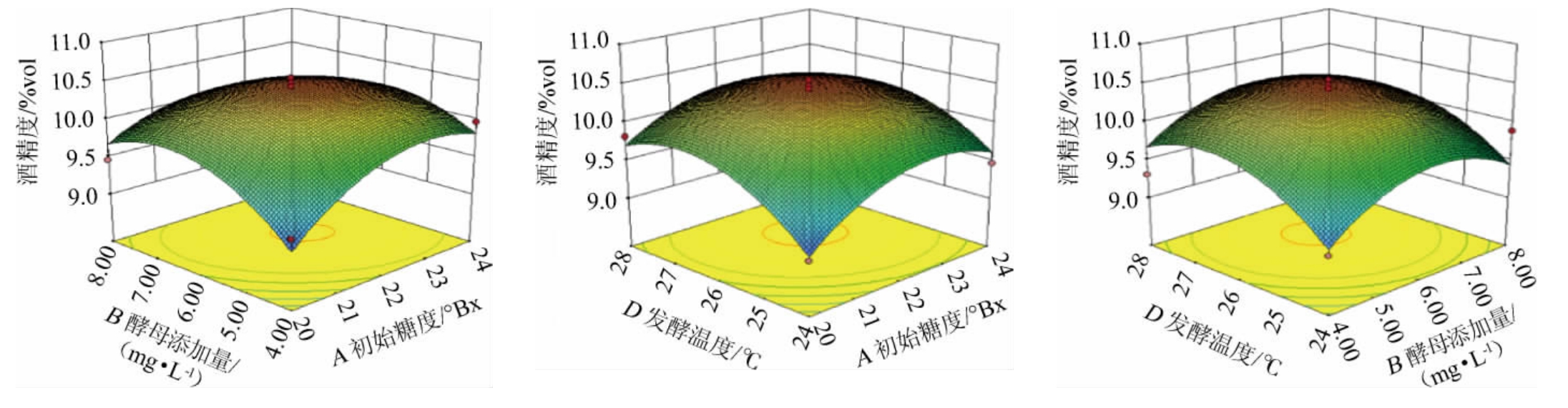
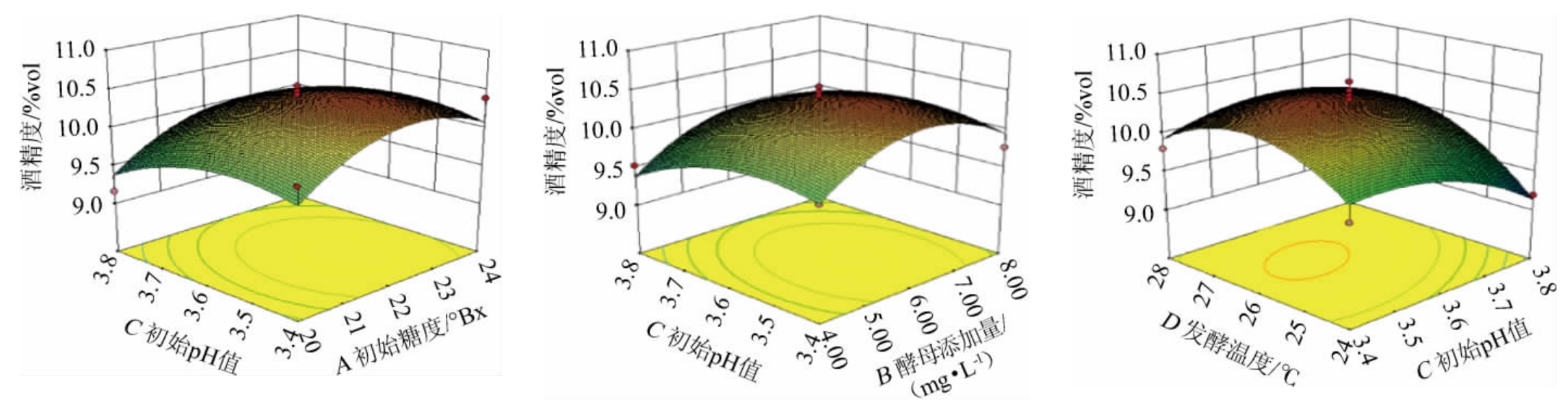
图5 各因素间交互作用对刺梨酒酒精度影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between various factors on alcohol content of Rosa roxburghii wine
由图5可知,初始糖度和酵母添加量(AB)、初始pH值和初始糖度(AC)、发酵温度和初始糖度(AD)、发酵温度和酵母添加量(BD)的响应面图坡度趋势陡峭,等高线趋于椭圆形,表明这四组交互作用对酒精度影响较大,这与方差分析结果一致。
2.4 验证试验
利用软件Design-Expert 11.0对回归方程进行计算,得到刺梨酒最佳发酵工艺条件为:初始糖度22.378°Bx,酵母菌添加量610 mg/L,发酵温度26.382 ℃,初始pH值为3.55。在此条件下通过方程求解得到刺梨酒酒精度预测值为10.562%vol。因实际操作存在局限,故将最佳发酵工艺条件调修正为初始糖度22°Bx、酵母菌添加量610 mg/L、发酵温度26 ℃、初始pH 值为3.6。在此优化条件下进行3次平行验证试验,得到刺梨酒酒精度实际值为10.35%vol。实际值和预测值拟合度高,具有实际意义。
3 结论
本研究采用单因素试验及响应面试验,优化刺梨汁白兰地原料酒的发酵工艺条件,确定了刺梨汁白兰地原料酒最佳发酵条件为:初始糖度为22°Bx、酵母菌添加量610mg/L、发酵温度26 ℃、初始pH值为3.6。在该优化条件下,得到刺梨酒酒精度为10.35%vol。刺梨原料酒经过蒸馏、调配后得到酒精度为43%vol的刺梨白兰地。
[1]刘易伟,杨舒清.贵州省刺梨发展现状分析[J].食品安全导刊,2020,265(6):148.
[2]MA Y X,ZHU Y,WANG C F,et al.The aging retarding effect of Long-Life CiLi'[J].Mech Ageing Dev,1997,96(1-3):171-180.
[3]李东,张小勤,蒋思峡,等.刺梨功能成分及其功能性食品研究进展[J].食品安全质量检测学报,2022,13(17):5730-5738.
[4]曾芳芳,罗自生.刺梨营养成分的研究进展[J].浙江农业科学,2015,56(11):1753-1757.
[5]曹晶晶,杨卫杰,曹轶.刺梨多糖的抗氧化和抗疲劳研究[J].中国中医基础医学杂志,2018,24(4):474-476,481.
[6]李贻,贺君,张鹏敏.体外模拟胃肠道消化下刺梨抗氧化成分的释放[J].现代食品科技,2020,36(2):102-107.
[7]陈庆,李超,黄婷,等.刺梨多糖的理化性质、体外抗氧化和α-葡萄糖苷酶抑制活性[J].现代食品科技,2019,35(11):114-119,253.
[8]涂永丽,周宏炫,谭书明,等.刺梨促消化功能研究[J].食品与发酵工业,2020,46(24):85-89.
[9]杨方红,杨邦祝,魏怡冰,等.贵州刺梨产业发展概述[J].中国食品,2022(14):130-132.
[10]赵雪花.贵州西部刺梨产业发展现状及建议[J].种子科技,2022,40(14):130-132.
[11]刘春梅,代亨燕,谢国芳,等.刺梨汁的澄清脱涩技术研究[J].食品工业科技,2010,31(2):237-239.
[12]郑福平,马雅杰,侯敏,等.世界6大蒸馏酒香气成分研究概况与前景展望[J].食品科学技术学报,2017,35(2):1-12.
[13]黄诚,尹红.湘西野生刺梨果酒加工工艺优化[J].食品科学,2012,33(24):16-20.
[14]谭书明,申世轩,丁筑红.刺梨干型全汁果酒加工技术研究[J].酿酒科技,2006(8):21-23.
[15]周元,张强,傅虹飞,等.猕猴桃果酒酵母的筛选及发酵工艺优化[J].西北农林科技大学学报(自然科学版),2014,42(12):151-160.
[16]李建芳,余鸿飞,丁慧,等.基于响应面法优化猕猴桃白兰地酿造工艺[J].中国酿造,2022,41(8):206-211.
[17]陈仪坤,张超,徐雷.贵州省刺梨资源开发利用及对策[J].现代营销(下旬刊),2020(10):164-165.
[18]胡亚康,何永艳,王发明.探讨不同工艺条件对猕猴桃果酒感官评价的影响[J].酿酒科技,2019(1):65-70.
[19]谢亚琼,张军翔.白兰地蒸馏技术研究进展[J].中国酿造,2022,41(7):1-5.
[20]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[21]孙洪浩,朱正军,邓元海,等.野生猕猴桃干酒酿造工艺研究[J].中国酿造,2014,33(3):62-66.
[22]丁奇,马立利,周阳,等.光度滴定法测定葡萄酒中的总酸[J].化学分析计量,2021,30(8):11-14.
[23]张阳阳,侯贺丽,王荣荣,等.桑葚米酒酿造工艺优化及其品质分析[J].食品科技,2021,46(11):103-108.
[24]何国庆,贾英民,丁立孝.食品微生物学[M].2 版.北京:中国农业大学出版社,2009:34-108.
[25]吴丽,谢小青,唐春红,等.复合菌种发酵条件对猕猴桃饮料抗氧化活性的影响[J].食品安全质量检测学报,2021,12(24):9514-9520.
[26]张晶,左勇,谢光杰,等.发酵条件对桑椹果酒中挥发酸的影响[J].食品工业科技,2018,39(1):117-121.
[27]赵驰,朱永清,董玲,等.李子果酒主发酵过程中理化指标及挥发性成分变化分析[J].中国酿造,2019,38(9):65-68.