雪莲菌发酵乳是我国牧区传统的发酵乳制品,由雪莲菌粒发酵而成。雪莲菌粒是一种乳白色、形状酷似花椰菜的天然发酵剂,是由酵母菌和乳酸菌组成的稳定微生物群落。多种菌相存在于多糖及蛋白质组成的基质中形成颗粒,并保持共生平衡的状态[1]。雪莲菌发酵乳具有醇香、起泡性,被誉为“香槟酸奶”,深受大众喜爱。雪莲菌粒及其发酵乳还具有多种功能活性。已有研究表明,雪莲菌具有抗癌[2-3]、抑菌[4]、降脂[5]等多种作用,特别是对肠道菌群的调节作用[6],近年来成为学术界的研究热点。但是,由于雪莲菌复杂的菌相及发酵过程的不可控性,影响了雪莲菌的贮藏稳定性,进一步探索适合雪莲菌粒的培养基以及贮藏条件,以保证雪莲菌菌相的稳定性至关重要,因此,阐明雪莲菌粒在不同培养基中的菌相组成以及菌群变化具有重要意义。
对于雪莲菌的培养条件,在先前的许多研究中通常以脱脂乳为培养基,GAO J等[7]通过响应面法优化得到雪莲菌粒的最优增殖条件,当脱脂乳浓度为41.6%,接种量为1.86%,30.05 ℃条件下静置培养20 h时,其生长速率比初始时提高了39.4%。此外,当使用乳清作为碳源培养雪莲菌粒时,培养时间在缩短的条件下生物量实现了更高的增长率,甚至较标准培养基增长了1.7倍[8]。DILEK KILIÇ A等[9]通过研究发现,在乳清中添加酵母提取物可以使雪莲菌粒的生物量有最大增加量。同时,利用分离乳清蛋白、改性乳清蛋白和菊粉组成的重组乳较脱脂乳培养的雪莲菌粒的生物量增加率达到了392%。对于雪莲菌的保藏,有研究表明,使用冷冻干燥法对雪莲菌粒进行保存可以使发酵产品的品质更好,而利用热干燥法保存的雪莲菌粒可以使其活菌数量维持的更好[4]。另外,雪莲菌粒的品质也受到了冷冻干燥过程中的各项操作参数的影响,有研究表明,当冷冻温度为-20 ℃,压力为0.6 mbar,冻干时间为15 h时,雪莲菌粒的残留水分含量低于6%,水分活度低于0.2,这更有利于雪莲菌粒的保存[10]。
脱脂乳培养基作为培养雪莲菌粒常用的培养基,在雪莲菌基质成分的研究中具有较大影响,而MRS肉汤培养基近些年来也开始用于雪莲菌粒的培养,但是雪莲菌菌相是否会受到培养基种类的影响还鲜有报道。不仅如此,雪莲菌粒中的微生态体系为动态平衡,不断的增殖培养与长期冷冻保藏条件下是否会发生菌群结构的变化也尚未可知。明确的菌相组成是雪莲菌粒相关研究的基础之一,因此,本研究通过对雪莲菌粒采用不同培养基进行冷冻保藏和连续培养,拟阐明其菌相结构变化,为其研究提供理论依据。
1 材料与方法
1.1 材料与试剂
雪莲菌粒:由本实验室保藏;灭菌脱脂乳:内蒙古伊利实业集团有限公司;MRS肉汤培养基:北京奥博星生物技术有限责任公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)裂解缓冲液:0.1 mol/L Tris-HCl,0.1 mol/L 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),1.5 mol/L NaCl,2%十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB),4%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),1% β-巯基乙醇,pH为8。
1.2 仪器与设备
DH3600电热恒温培养箱:天津市泰斯特仪器有限公司;SM530立式压力蒸汽灭菌锅:重庆雅马拓科技有限公司;SW-CJ-IF超净工作台:苏净集团苏州安泰空气技术有限公司;YP1002N电子天平:上海天美天平仪器有限公司;ABI GeneAmp9700型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:上海菲特科学器材有限公司。
1.3 方法
1.3.1 雪莲菌粒制备
将活化的雪莲菌粒分别接种到MRS肉汤培养基和脱脂乳中(接种量0.2 g/L),每种培养基制备两份,在28 ℃条件下恒温培养,每24 h更换一次培养基[11],连续培养3 d后,将一份MRS培养基培养(样本1)和一份脱脂乳培养(样本3)的雪莲菌于-80 ℃条件下冷冻保藏;将一份MRS培养基培养(样本2)和一份脱脂乳培养(样本4)的雪莲菌于28 ℃条件下继续培养。30 d后得到4个雪莲菌样本。
1.3.2 样品总DNA提取
参照杜佳峰等[5]的方法,利用SDS-CTAB法分别进行4个雪莲菌粒基因组总DNA的提取[12]。
1.3.3 细菌菌群高通量测序
以提取的雪莲菌总DNA为模板,利用细菌通用引物GC338F:5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGC-3'和518R:5'-ATTACCGCGGCTGCTGG-3'对细菌菌群16S rDNA的V3区进行扩增[13],后续测序等由上海美吉生物完成。
1.3.4 真菌菌群聚合酶链式反应-变性梯度凝胶电泳分析
以提取的雪莲菌总DNA为模板,利用真菌通用引物1TS1F:5'-CTTGGTCATTTAGAGGAAGTAA-3'和1TS2R:5'-GCTGCGTTCTTCATCGATGC-3'对模板进行扩增。预先制备1%琼脂糖凝胶,PCR扩增产物进入凝胶点样孔中进行电泳,电泳条件:200 V预电泳5 min,120 V电泳6 h,电泳缓冲液为1×TAE。电泳完成后使用凝胶成像系统进行成像,将其中呈现明亮条带的PCR产物进行聚合酶链式反应-变性梯度凝胶电泳(PCR-denaturing gradient gel electrophoresis,PCR-DGGE)分析。利用Quantity One软件对得到的PCRDGGE指纹图谱进行聚类分析,并将测序结果通过美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)序列比对,进行同源序列搜索[14-15]。
1.3.5 数据处理
测序完成后,将得到的原始数据利用O-verlap技术,将数据拼接过滤,得到需要的优质数据。使用Usearch软件根据不同的相似度水平对所有序列进行操作分类单元(operational taxonomic unit,OTU)划分,在97%的相似水平下的OTU进行生物信息统计分析。通过单样本的多样性分析(Alpha多样性)包括一系列统计学分析指数,使用R语言工具统计和作图进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 雪莲菌中细菌菌群分析
2.1.1 温度及培养基对雪莲菌粒细菌菌群多样性的影响
由表1可知,4个样品的文本覆盖率(coverage)值均>99.99%,证明测序结果具有参考性。样品3(灭菌脱脂乳中进行冷冻保藏的雪莲菌粒)的Chao1指数最高(18),具有最高的菌群丰度,样品2(在MRS培养基中进行连续培养的雪莲菌粒)的Shannon指数最高(1.44),具有最高的菌群多样性,而4组样品中,样品1(在MRS培养基中进行冷冻保藏的雪莲菌粒)的菌群丰度及多样性最低。
表1 雪莲菌粒在不同温度及培养基培养后细菌菌群多样性分析
Table 1 Bacterial flora diversity analysis of kefir grains after culture at different temperature and medium
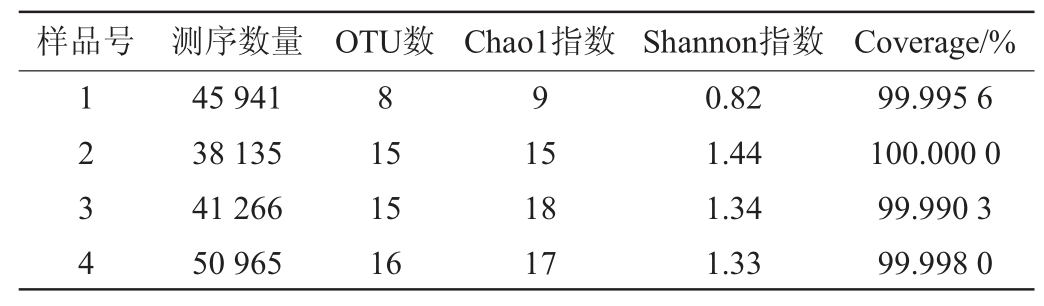
此外,对4组雪莲菌粒样品的OTU进行分析,结果见图1。由图1可知,经过MRS肉汤培养基培养的雪莲菌粒在冻藏前后有7个相同的菌种(OTU),冻藏后,检测出了1个与活化态雪莲菌粒不同的菌种(OTU),而活化态的雪莲菌粒中检测出了8个冻藏后的雪莲菌粒未检测出的菌种(OTU)。经过脱脂乳培养的雪莲菌粒在冻藏前后有13个相同的菌种(OTU),经过冻藏后,检测出了2个活化态的雪莲菌粒中未检测出的菌种(OTU),有3个菌种(OTU)未检测到。这可能是因为,雪莲菌粒中的有些细菌在冻藏时受到了低温以及培养液成分的影响,导致部分细菌的存活率大大降低。如酵母膏的存在会对德氏乳杆菌在冷冻保藏期间的存活率产生负面影响,从而使得其生物量大大减少以至于无法被检测到[16]。但是,在雪莲菌粒中仍然存在一些对低温的敏感度相对较低的细菌,比如植物乳杆菌等在低温的环境中仍然可以保持较好的活力。因此,在冻藏过程中,这些物种的生物量只会略微减少。相比较而言,在检测的过程中,这些对低温不敏感的物种就会被检测出来[17]。对于冻藏的雪莲菌粒来说,经过脱脂乳培养的雪莲菌粒同在MRS肉汤培养基中的雪莲菌粒进行比较,前者检测出了7个不同的菌种(OTU)。
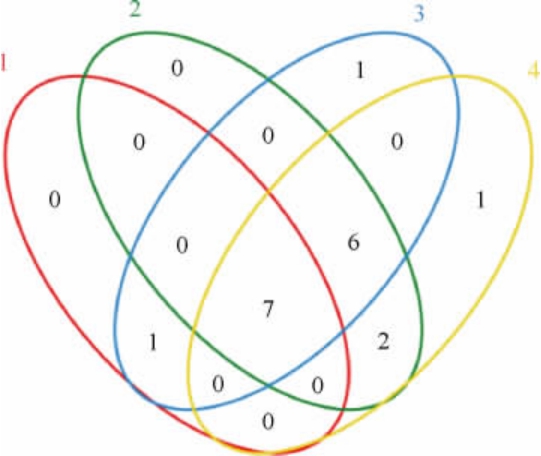
图1 雪莲菌粒在不同温度及培养基培养后细菌菌群OTU韦恩图
Fig.1 OTU venn diagram of bacterial flora of kefir grains after culture at different temperature and medium
以上结果表明,在28 ℃连续培养的雪莲菌具有更加丰富的细菌菌群结构,低温处理会降低雪莲菌粒菌群丰度及多样性。与MRS肉汤培养基相比,脱脂乳更有利于低温处理后的细菌菌群丰度及多样性的稳定。但对于28 ℃连续培养的雪莲菌粒,两种培养基对菌群组成的影响没有明显差异。
2.1.2 温度及培养基对雪莲菌粒细菌菌群组成的影响
由图2可知,在门分类水平上,雪莲菌粒的细菌菌群主要被分类为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroides)3个门。基于菌门组成进行层级聚类分析表明,同为冻藏或活化态的样品被分别聚类在一起。这表明与培养基种类相比,冻藏对细菌菌群组成的影响更加显著。冻藏后,变形菌门含量减少,脱脂乳培养基中变形菌门相对丰度由68.06%减少至38.48%,MRS肉汤培养基中变形菌门相对丰度由67.01%减少至32.67%,厚壁菌门相对丰度上升并成为优势菌门。这一现象可以解释为不同细菌对冻藏处理的敏感性有较大差异。此外,根据图2,活化状态的雪莲菌菌落组成中更多为变形菌门,相对丰度分别为67.01%、68.06%;而冻藏的雪莲菌菌群组成则更多为厚壁菌门,相对丰度分别为67.33%、61.51%。

图2 基于门水平不同温度及培养基培养后雪莲菌粒细菌分布
Fig.2 Bacteria distribution of kefir grains after culture at different temperature and medium based on phylum level
由图3可知,在属分类水平上,4个雪莲菌粒序列共鉴定出6个属,分别为醋酸杆菌属(Acetobacter)、乳杆菌属(Lactobacillus)、埃希氏-志贺氏菌属(Escherlchia-Shigella)、链球菌属(Streptococcus)、肠球菌属(Enlerococcus)、克雷伯氏菌属(Klebsiella)。相比于培养基的影响,温度对于雪莲菌粒的菌属组成影响更加显著,处于连续活化态的雪莲菌粒中具有丰富的菌属组成。而经过冻藏后,埃希氏-志贺氏菌属(Escherlchia-Shigella)、链球菌属(Streptococcus)、肠球菌属(Enlerococcus)及克雷伯氏菌属(Klebsiella)相对丰度显著下降,乳杆菌属(Lactobacillus)替代醋酸杆菌属(Acetobacter)成为优势菌属。这一结果表明,经过冻藏的雪莲菌粒中,乳杆菌属(Lactobacillus)和醋酸杆菌属(Acetobacter)保持了相对较高的生物活性,并且乳杆菌属(Lactobacillus)较醋酸杆菌属(Acetobacter)对低温的敏感度较小,这可能是由于多糖结构的保护[18-19]。而链球菌属(Streptococcus)、埃希氏-志贺氏菌属(Escherlchia-Shigella),肠球菌属(Enlerococcus)以及克雷伯氏菌属(Klebsiella)在低温的环境中容易失去生物活性。另外,在冻藏前MRS肉汤培养基和脱脂乳培养基中雪莲菌粒的醋酸杆菌属(Acetobacter)的相对丰度分别是44.43%、44.35%,而经过冻藏后的乳酸杆菌属(Lactobacillus)的相对丰度分别为32.87%、38.36%,相较于MRS培养基中冻藏后的醋酸杆菌属(Acetobacter)高,更接近于冻藏前的雪莲菌粒的醋酸杆菌属(Acetobacter)的相对丰度。
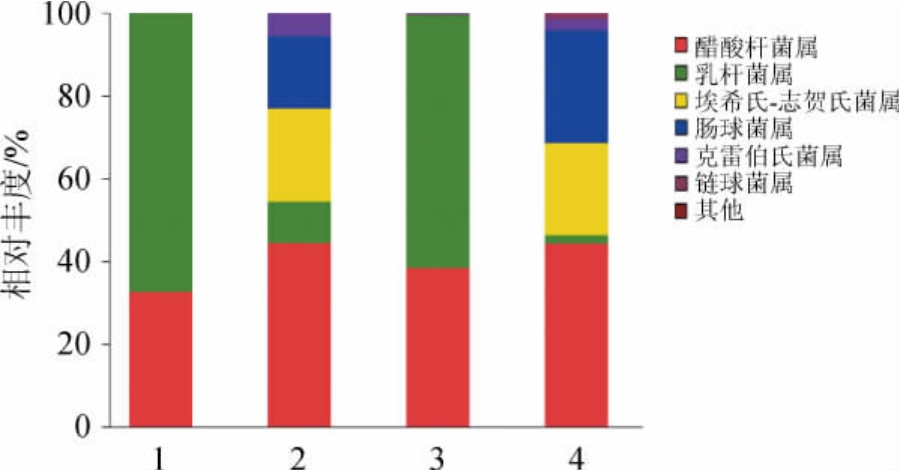
图3 基于属水平不同温度及培养基培养后雪莲菌粒细菌分布
Fig.3 Bacterial distribution of kefir grains after culture at different temperature and medium based on genus level
2.1.3 温度及培养基对雪莲菌粒细菌菌群的影响
不同温度及培养基培养后雪莲菌粒细菌主成分分析结果见图4。
图4 不同温度及培养基培养后雪莲菌粒细菌主成分分析
Fig.4 Principal component analysis of bacteria of kefir grains after culture at different temperature and medium
由图4可知,PC1的方差贡献率为86.39%,PC2的方差贡献率为12.65%,则可分析为PC1是导致差异的主要因素。与之前的分析结果一致,低温处理比培养基种类对雪莲菌细菌菌群组成有更大的影响。这可能由于雪莲菌粒为处于动态平衡的微生态体系,许多细菌受温度影响较大。薛蓓等[20]利用高通量测序技术分析了西藏不同海拔地区曲拉微生物多样性。研究发现,随着海拔的升高,温度的降低,微生物多样性在降低,并且在低温的情况下,乳杆菌属(Lactobacillus)成为了优势菌属。此外,有大量研究发现,部分乳酸菌具有很好的耐低温特性[21-22]。并且,WANG X X等[23]研究发现,产马乳酒乳杆菌在雪莲菌粒中最稳定,不受培养条件和时间的影响。不过,经过冻藏的雪莲菌粒中的肠球菌属(Enlerococcus)、链球菌属(Streptococcus)以及克雷伯氏菌属(Klebsiella)的含量显著下降[24]。这表明,冻藏后的雪莲菌粒可能需要更充足的活化处理以恢复其活化态下菌群结构,避免因菌群结构未恢复或尚不稳定对分析结果造成影响。
2.2 温度及培养基对雪莲菌真菌组成结构的影响
由图5可知,每一条泳道都代表了不同状态下的雪莲菌粒真菌的DGGE图谱,不同位置的条带代表了不同种属的微生物,而条带的灰暗程度在一定程度上可以反映出该微生物的丰富度,即条带显示出的颜色越深就表示该种属的真菌在雪莲菌粒样品中的相对含量越高。各样本所分离出来的条带略有不同。从4份样品的DGGE图谱上共标记出了14条特异性条带,其中条带①、②、⑥、⑨、⑩号颜色较深,因此,将这5条优势条带进行切胶回收测序,测序结果与NCBI上的BLAST进行比对,其结果见表2。
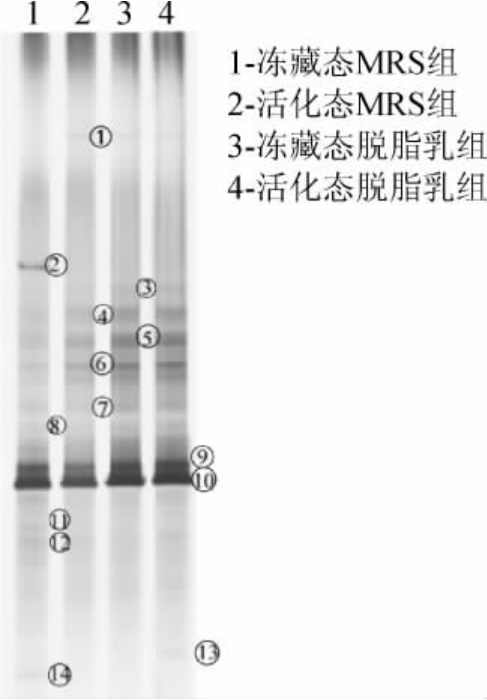
图5 不同温度及培养基培养后雪莲菌粒真菌DGGE指纹图谱
Fig.5 DGGE fingerprint of fungi of kefir grains after culture at different temperature and medium
表2 不同温度及培养基培养后雪莲菌粒优势条带切胶测序结果
Table 2 Sequencing results of dominant strip cutting glue of kefir grains after culture at different temperature and medium
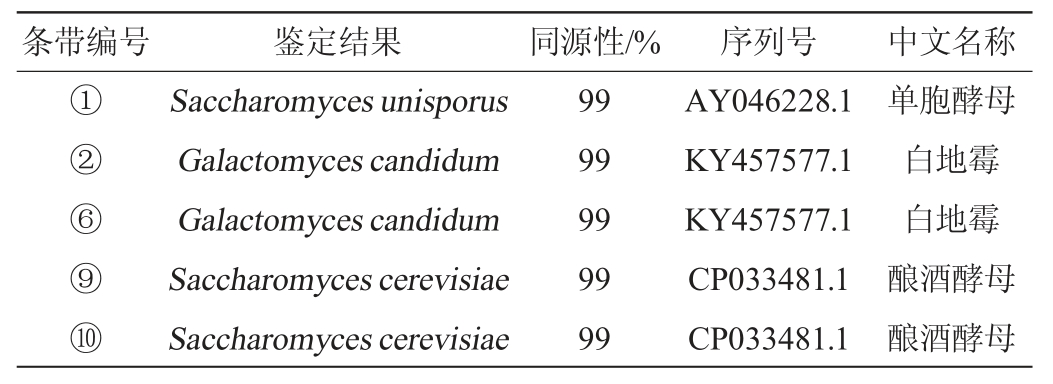
由表2可知,5条特异性条带的对比结果为2株酿酒酵母(Saccharomyces cerevisiae),1株单胞酵母(Saccharomyces unisporus),2株白地霉(Galactomyces candidum),并且,通过将测序的结果在GenBank数据库进行对比,发现其同源性均为99%。其中,酿酒酵母是主要的微生物,且存在于所有样本中,GUT A M等[25]在传统开菲尔粒中也分离出了酿酒酵母,温度和培养基对其无影响。根据条带结果显示温度和培养基影响了白地霉的分子质量。
使用Quantity One对数据进行分析,得到系统发育树聚类分析见图6。由图6可知,样品3和样品4距离最近相似度最高(95%);冻藏前后的MRS肉汤培养基相似度也较高,说明低温处理对于雪莲菌粒中的真菌菌群组成影响不明显。综上所述,培养基的选择较温度来讲,对雪莲菌真菌菌群组成影响更加明显。同时,组别1和组别4差异性最大,说明温度和培养基的叠加效应对雪莲菌真菌的组成结构影响是最大的。

图6 不同温度及培养基培养后雪莲菌粒真菌组成聚类树
Fig.6 Phylogenetic tree of fungi composition of kefir grains after culture at different temperature and medium
3 结论
本实验主要研究了低温处理及不同培养基对雪莲菌微生物菌群组成的影响。低温处理降低了雪莲菌菌群丰度及多样性(使其优势菌门由变形菌门变为厚壁菌门,优势菌属从醋酸杆菌属(Acetobacter)变为乳杆菌属(Lactobacillus))。在冷冻保藏期间,脱脂乳比MRS肉汤培养基更有利于维持雪莲菌粒菌相组成的稳定性。对于细菌菌群,冻藏前后的菌相组成具有显著差异(冻藏后的优势菌门为厚壁菌门,优势菌属为乳杆菌属(Lactobacillus);冻藏前的优势菌门为变形菌门,优势菌属为醋酸杆菌属(Acetobacter))。而对于真菌菌群,冻藏前的组别与冻藏后的组别之间未显示出清晰的聚集或分离,其中脱脂乳组冻藏前后相似度高达95%。这说明在脱脂乳培养条件下,温度对于真菌菌群组影响不显著。这为后续雪莲菌菌相研究提供参考。
[1]GAO W,ZHANG L W.Comparative analysis of the microbial community composition between Tibetan kefir grains and milks[J].Food Res Int,2019: 137-144.
[2]高洁.雪莲菌菌相分析及抗癌活性研究[D].杭州:浙江大学,2013.
[3]DE ALMEIDA BRASIEL P G,LUQUETTI S C P D,MEDEIROS J D,et al.Kefir modulates gut microbiota and reduces DMH-associated colorectal cancer via regulation of intestinal inflammation in adulthood offsprings programmed by neonatal overfeeding[J].Food Res Int,2022,152:110708.
[4]AL-MOHAMMADI A R,IBRAHIM R A,MOUSTAFA A H,et al.Chemical constitution and antimicrobial activity of Kefir fermented beverage[J].Molecules,2021,26(9):2635.
[5]杜佳峰.Viili发酵过程中微生物多样性及直投式发酵剂的研究[D].保定:河北农业大学,2019.
[6]VAN DE WOUW M,WALSH A,CRISPIE F,et al.Distinct actions of the fermented beverage kefir on host behaviour,immunity and microbiome gut-brain modules in the mouse[J].Microbiome,2020,8:67.
[7]GAO J,GU F Y,RUAN H.Culture conditions optimization of Tibetan Kefir grains by response surface methodology[J].Procedia Eng,2012,37:132-136.
[8]KARIM A,AIDER M.Comprehensive utilisation of electro-activated whey-based media in cell growth,metabolite production and aroma com-pounds synthesis using a starter culture originated from kefir grains[J].Int Dairy J,2022,126:105276.
[9]DILEK KILIÇ A,ELÇIN D,BIRSEN Ö,et al.Kefir grain biomass production: influence of different culturing conditions and examination of growth kinetic models[J].J Food Process Eng,2017,40(1):e12332.
[10]CONDE-ISLAS A Á,JIMÉNEZ-FERNÁNDEZ M,CANTU'-LOZANO D,et al.Effect of the freeze-drying process on the physicochemical and microbiological properties of Mexican Kefir grains[J].Processes,2019,7(3):127.
[11]赵丹.藏灵菇源乳酸菌与鸡源芽孢杆菌复合制剂的制备及应用评价[D].合肥:安徽农业大学,2020.
[12]周梦月.邢冉冉,王楠,等.6种食用香辛料基因组DNA提取方法比较[J].食品科学,2021,42(16):246-253.
[13]LIU T F,JIA T Z,CHEN J N,et al.Analysis of microbial diversity in Shenqu with different fermentation times by PCR-DGGE[J].Braz J Microbiol,2017,48(2):246-250.
[14]李希羽,高洁,李云姣,等.水果酵素自然发酵过程中优势菌群与有机酸变化规律分析[J].食品科学,2020,41(24):61-68.
[15]DEMIRCI T,AKIN N,ATIK D S,et al.Lactic acid bacteria diversity and dynamics during ripening of traditional Turkish goatskin Tulum cheese produced in Mut region assessed by culturing and PCR-DGGE[J].LWTFood Sci Technol,2021,138(5):110701.
[16]SHAO Y Y,GAO S R,GUO H L,et al.Influence of culture conditions and preconditioning on survival of Lactobacillus delbrueckii subspecies bulgaricus ND02 during lyophilization[J].J Dairy Sci,2014,97(3):1270-1280.
[17]ZHANG M,YAO M K,LAI T T,et al.Response of Lactiplantibacillus plantarum NMGL2 to combinational cold and acid stresses during storage of fermented milk as analyzed by data-independent acquisition proteomics[J].Foods,2021,10(7):1514.
[18]SARICA E,COS,KUN H.Effect of frozen storage on some characteristics of kefir samples made from cow's and goat's milk[J].Food Sci Technol Int,2022,28(2):157-168.
[19]TOMAR O,AKARCA G,ÇAGˇLAR A,et al.The effects of kefir grain and starter culture on kefir produced from cow and buffalo milk during storage periods[J].Food Sci Technol,2019,40(1):238-244.
[20]薛蓓,卢灏泽,薛洁.高通量测序技术分析西藏不同海拔地区曲拉微生物多样性[J].食品科学,2022,43(14):176-182.
[21]马少飞.西藏传统发酵牦牛肉制品中耐低温菌种的分离鉴定及应用研究[D].拉萨:西藏大学,2020.
[22]陈翠婷.耐低温乳酸菌分离筛选及其代谢产物抑菌性研究[D].哈尔滨:哈尔滨商业大学,2019.
[23]WAND X X,XIAO J Z,JIA Y S,et al. Lactobacillus kefiranofaciens,the sole dominant and stable bacterial species,exhibits distinct morphotypes upon colonization in Tibetan kefir grains[J].Heliyon,2018,4(6):e00649.
[24]MCAULEY C M,BRITZ M L,GOBIUS K S,et al.Prevalence,seasonality,and growth of enterococci in raw and pasteurized milk in Victoria,Australia[J].J Dairy Sci,2015,98(12):8348-8358.
[25]GUT A M,VASILJEVIC T,YEAGER T,et al.Characterization of yeasts isolated from traditional kefir grains for potential probiotic properties[J].J Funct Foods,2019,58:56-66.