酵母菌在酒类发酵生产中发挥着至关重要的作用,根据其发酵特性可分为酿酒酵母菌(Saccharomyces cerevisiae)和非酿酒酵母菌两大类[1]。非酿酒酵母菌是一类除酿酒酵母菌之外的其他类酵母菌的总称[2],最初是从发酵停滞或变质的酒及果实中分离得到,且与乙酸、乙醛、硫化氢等异味物质的产生有关,被认为是有害的菌株。但随着研究的不断深入,近年来发现一些非酿酒酵母可以调节酒类的风味物质组成,改善酒体品质特性[3]。一些非酿酒酵母菌可分泌多种水解酶类,如糖苷酶、蛋白酶、脂肪酶等,因而接种这些非酿酒酵母菌可有效调节发酵酒类的香气特性[4];而一些非酿酒酵母菌可以调节发酵酒类的酸类物质种类与含量、酒精度、甘油含量等理化参数,进而影响酒的丰富度和复杂性[5]。因而在酒类生产中接种非酿酒酵母菌,已成为一种普遍接受的方式[6]。
库尔勒香梨(Pyrussinkiangensis)属于蔷薇科(Rosaceae)梨属(Pyrus)新疆梨种植物。其果实汁多脆甜、皮薄肉细、香味独特、营养丰富,入选国家地理标志产品和中欧地理标志首批保护清单[7]。目前,对库尔勒香梨的研究主要集中在农艺性状[8]、保鲜贮藏[9]以及基因功能[10]等领域,而对库尔勒香梨微生物资源筛选、鉴定及性能研究鲜见报道。傅力等[11]从新疆库尔勒香梨酒精发酵液中分离到2株野生酵母菌XL1和XL2,对糖、酒精以及SO2具有较好的耐受性,但未对菌株进行鉴定,且并未研究其发酵性能。因而,对库尔勒香梨酵母菌的研究亟待加强。
对非酿酒酵母的研究已从葡萄和葡萄酒领域逐渐扩展到其他的水果和果酒,如桑葚酒[12]、柿子酒[13]、荔枝酒[14]、苹果酒[15]等。但作为中国新疆地区重要的特色水果,库尔勒香梨酵母菌的研究还比较匮乏,课题组前期对库尔勒香梨自然发酵过程中非酿酒酵母菌的多样性进行研究[16],并从中分离到一株产香较为浓郁的酵母菌株K6。基于此,本研究采用形态学观察与分子生物学方法对菌株K6进行鉴定,并对其生长特性、酿造环境耐受性、碳源代谢特性、产β-葡萄糖苷酶以及产硫化氢特性等发酵性能进行研究;最后,利用该菌株与商业化酿酒酵母X16混合发酵库尔勒香梨果酒,分析其对库尔勒香梨果酒香气特性的影响,以期为库尔勒香梨果酒生产提供潜在的优质酵母菌株,对改善库尔勒香梨果酒品质特性具有重要借鉴意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌株K6:分离于库尔勒香梨自然发酵液;商业化酿酒酵母(Saccharomyces cerevisiae)X16:法国LAFFORT公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[1]:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,pH自然,121 ℃高压蒸汽灭菌15 min,固体培养基中添加琼脂20 g/L。
WL营养琼脂培养基[1]:酵母浸粉4 g/L,蛋白胨5 g/L,葡萄糖50 g/L,琼脂20 g/L,储存液A(KH2PO4 13.75 g/L,KCl 10.625 g/L,CaCl2 3.125 g/L,MgSO4·7H2O 3.125 g/L)40 mL/L,储存液B(FeCl3 2.5 g/L,MnSO4 2.5 g/L)1 mL/L,储存液C(0.44 g溴甲酚绿溶于10 mL无菌蒸馏水和10 mL体积分数95%乙醇中)1 mL/L,pH自然,121 ℃高压蒸汽灭菌15 min。
1.1.3 试剂
葡萄糖(分析纯)、酵母浸粉、蛋白胨、琼脂粉(均为生化试剂)、苹果酸(分析纯):贵州博奥瑞杰生物科技有限公司;酵母菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNA Marker、聚合酶链式反应(polymerase chain reaction,PCR)Mixs:生工生物工程(上海)股份有限公司;对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenylβ-D-glucopyranoside,p-NPG)(分析纯):上海源叶生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
UH5300紫外分光光度计:日本日立公司;PHSJ-3F pH仪:上海仪电科学仪器股份有限公司;SZM体视显微镜:中国宁波舜禹仪器有限公司;T100 PCR仪:美国伯乐公司;ZD-85A型恒温摇床:常州朗越仪器制造有限公司;DHP-420型恒温培养箱:天津天泰仪器有限公司;GCMS-TQ8040 NX气相色谱-质谱联用(gas chromatograph-mass spectrometer,GC-MS)仪:日本岛津仪器有限公司。
1.3 方法
1.3.1 菌株K6的鉴定
形态观察:将菌株K6划线接种于WL营养琼脂培养基上,28 ℃倒置培养5 d。观察菌株K6的菌落形态特征和细胞显微形态,并拍照[1]。
分子生物学鉴定:采用基因组DNA提取试剂盒抽提菌株K6的基因组DNA,以其为模板,采用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')、NL4(5'-GGTCCGTGTTTCAAGACGG-3')对其26 S rDNA D1/D2区基因序列进行PCR扩增[17]。PCR扩增产物委托上海美吉生物医药股份有限公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的26S rDNA D1/D2基因序列,采用MEGA X软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.2 生长曲线的测定
将菌株K6接种至YEPD培养基中,28 ℃、180 r/min条件下振荡培养36 h,每4 h取样一次,于波长600 nm处测定其OD600nm值。以商业化的酿酒酵母X16为对照,每组平行重复测定3次。
1.3.3 酿造环境耐受性分析
将菌株K6以菌体浓度106 CFU/mL分别接种至含不同质量浓度葡萄糖(100g/L、150g/L、200g/L、250 g/L、300 g/L)、不同体积分数乙醇(3%、6%、9%、12%、15%)、不同质量浓度柠檬酸(15 g/L、20 g/L、25 g/L、30 g/L)及不同质量浓度SO2(50 mg/L、100 mg/L、150 mg/L、200 mg/L、300 mg/L)的YEPD培养基中,28 ℃、180 r/min条件下振荡培养36 h,然后于波长600 nm处测定OD600nm值。
1.3.4 碳源代谢特性
将菌株K6以108 CFU/mL接种于含2%不同碳源(葡萄糖、果糖、蔗糖、麦芽糖、乳糖、半乳糖、甘露糖、阿拉伯糖)的0.6%酵母浸粉溶液中,置于含杜氏小管的试管中,28 ℃恒温培养48 h,观察杜氏小管顶部是否有气泡。
1.3.5 产β-葡萄糖苷酶活性测定
将菌株K6接种于YEPD培养基中,28 ℃、180 r/min条件下振荡培养72 h。发酵液经3 000 r/min离心10 min,取上清液,采用p-NPG法测定菌株K6产β-葡萄糖苷酶活性[18]。β-葡萄糖苷酶活力单位(U)定义:在pH5.0、50 ℃条件下,1 min水解p-NPG产生1 μmol p-NP所需酶量。
1.3.6 产硫化氢活性测定
参考王优蓓等[19]的方法对菌株K6产硫化氢性能进行测定。
1.3.7 库尔勒香梨果酒的酿造工艺
库尔勒香梨→榨汁→成分调整(糖度)→接种→发酵→离心→成品
操作要点:取新鲜、成熟、无腐烂的库尔勒香梨,去核,榨汁。加入100 mg/L的偏重亚硫酸钾、20 mg/L的果胶酶处理12 h,加入白砂糖调整糖度至24°Bx,分成两组,置于2 L无菌三角瓶中,每组平行重复三次。第一组酿酒酵母组(酿酒酵母X16):单独接种终浓度为107 CFU/mL的酿酒酵母X16;第二组混合发酵组(菌株K6+酿酒酵母X16):同时接种终浓度为107 CFU/mL的酿酒酵母X16和108 CFU/mL的菌株K6。22 ℃静置发酵,检测糖度,直至糖度连续3 d不变,则发酵结束。发酵结束后4 000 r/min离心10 min得成品。
1.3.8 库尔勒香梨果酒基本理化指标的测定
参照GB/T15038—2006《葡萄酒、果酒通用分析方法》测定库尔勒香梨果酒的残糖量、酒精度、总酸含量和挥发酸含量[20]。
1.3.9 库尔勒香梨果酒挥发性香气成分分析
库尔勒香梨果酒发酵结束后,3 000 r/min离心10 min,取上清液,采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-GC-MS法测定挥发性香气成分[21]。查阅各挥发性香气成分阈值,计算各香气成分气味活性值(odour activity value,OAV)。
1.3.10 数据处理及统计分析数据结果以“平均值±标准差”表示,采用SPSS 21.0对数据进行单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果与分析
2.1 菌株K6的鉴定
2.1.1 形态观察
菌株K6的菌落及细胞形态见图1。由图1可知,菌株K6在WL营养琼脂培养基上的菌落呈白色,凸起,光滑,表面湿润,不透明,细胞显微形态为椭球状,出芽生殖。
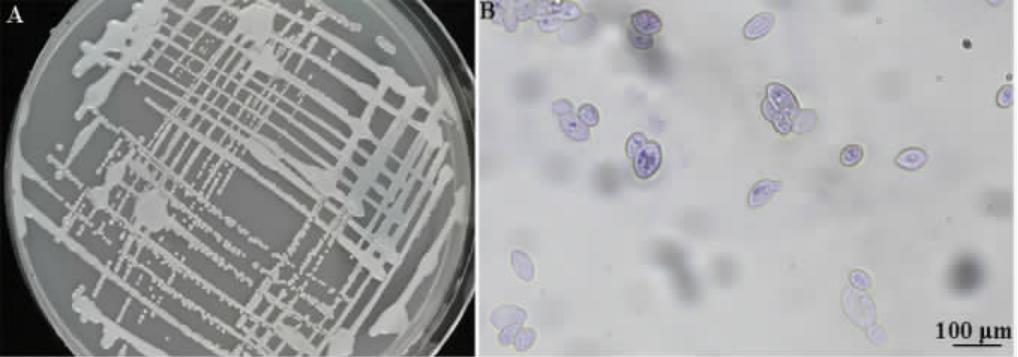
图1 菌株K6在WL营养琼脂上的菌落形态(A)和细胞形态(B)
Fig.1 Colony (A) and cell (B) morphology of strain K6 on WL nutrient agar medium
2.1.2 分子生物学鉴定
基于26S rDNA D1/D2区基因序列菌株K6的系统发育树见图2。由图2可知,菌株K6与中华梅奇酵母(Metschnikowia sinensis)聚于一支,同源性较高,达99.21%。结合形态观察,鉴定菌株K6为中华梅奇酵母(Metschnikowia sinensis)。

图2 基于26S rDNA D1/D2区域基因序列菌株K6的系统发育树
Fig.2 Phylogenetic tree of strain K6 based on 26S rDNA D1/D2 domain gene sequence
2.2 中华梅奇酵母K6的生长特性
以菌株X16为对照,M.sinensis K6的生长曲线见图3。由图3可知,M.sinensisK6的生长曲线包括延滞期、对数生长期、稳定期。其中,前4 h为延滞期,4~12 h为对数生长期,12 h后基本达到稳定期。在对数生长期,M.sinensis K6的OD600nm值高于对照酿酒酵母X16,但在稳定期,M.sinensis K6的OD600nm值低于对照酿酒酵母X16。因此,M.sinensis K6在对数生长阶段生长快于商业化酿酒酵母X16。
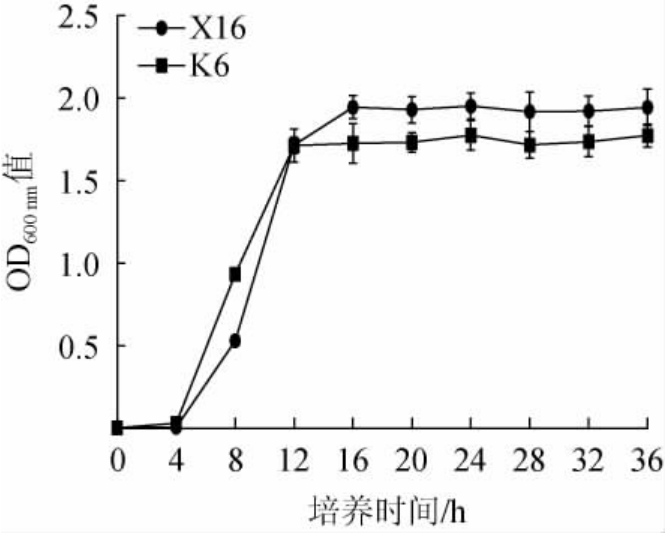
图3 中华梅奇酵母K6的生长曲线
Fig.3 Growth curve of the Metschnikowia sinensis K6
2.3 中华梅奇酵母K6对酿造环境的耐受性
为分析M.sinensis K6对酿造环境的耐受性,以菌株X16为对照,测定了其在不同含量葡萄糖、乙醇、二氧化硫以及柠檬酸处理下的生长情况,结果见图4。
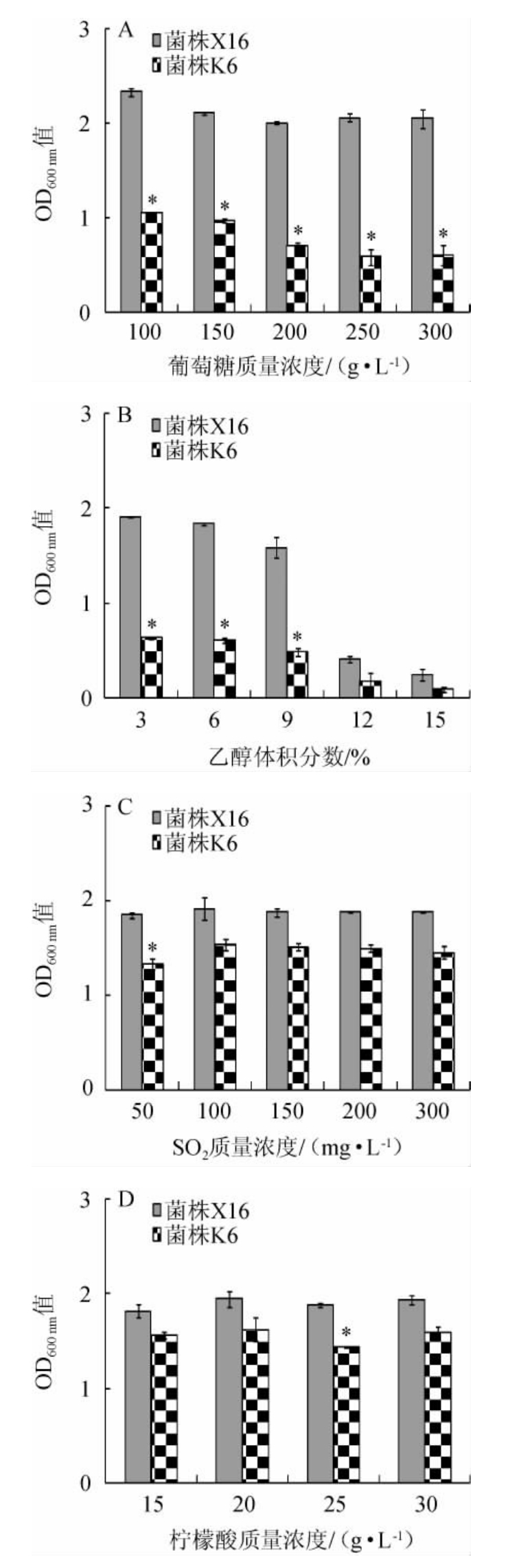
图4 中华梅奇酵母K6对酿酒环境的耐受性
Fig.4 Tolerance of Metschnikowia sinensis K6 to winemaking environment
“*”表示与酿酒酵母X16相比,差异显著(P<0.05)。下同。
由图4A可知,M.sinensis K6在质量浓度为100~300 g/L的葡萄糖处理下均可正常生长,但与商业化酿酒酵母X16相比,其在不同含量葡萄糖处理下的OD600nm值均显著性降低(P<0.05),葡萄糖耐受性低于商业化酿酒酵母X16。由图4B可知,在体积分数为3%~9%乙醇环境下,M.sinensis K6可以生长,但其OD600nm值均显著低于酿酒酵母X16(P<0.05),其乙醇耐受性低于商业化酿酒酵母X16;在体积分数为12%和15%环境下,M.sinensis K6的生长受到严重的抑制。由图4C可知,M.sinensis K6可耐受300 mg/L的二氧化硫,除50 mg/L的二氧化硫外,M.sinensis K6的OD600nm值与酿酒酵母X16无显著差异(P>0.05)。由图4D可知,M.sinensis K6可耐受质量浓度为30 g/L的柠檬酸,除25 g/L的柠檬酸外,在其他条件下,M.sinensis K6的OD600nm值与酿酒酵母X16无显著性差异(P>0.05)。
综上,M.sinensis K6可耐受300 g/L的葡萄糖,对乙醇较为敏感,乙醇耐受性较差,可耐受体积分数9%的乙醇,其葡萄糖及乙醇耐受性均不及商业化酿酒酵母X16,M.sinensis K6可耐受300 mg/L的二氧化硫和30 g/L的柠檬酸,具有较好的二氧化硫和柠檬酸耐受性。
2.4 中华梅奇酵母K6的碳源代谢特性
以菌株X16为对照,M.sinensis K6碳源代谢特性见表1。由表1可知,M.sinensis K6碳源代谢特性与酿酒酵母X16相似,可代谢一些常用的碳源,如葡萄糖、果糖和蔗糖,也可代谢一些不常用的碳源,如麦芽糖、乳糖、半乳糖、甘露糖和阿拉伯糖。因而,M.sinensisK6具有较为广谱的碳源利用特性。
表1 中华梅奇酵母K6的碳源代谢特性
Table 1 Carbon source metabolic characteristics of Metschnikowia sinensis K6
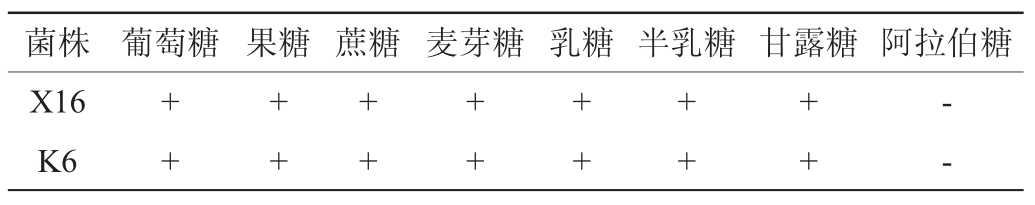
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.5 中华梅奇酵母K6产硫化氢性能分析
在酒类酿造中,菌体自溶分解可产生硫化氢,硫化氢具有臭鸡蛋味,对酒体风味具有不良影响[22-24]。硫化氢产生能力一般是由菌体本身遗传背景决定的,中华梅奇酵母K6的产硫化氢性能见图5。由图5可知,M.sinensis K6的滤纸片颜色与酿酒酵母X16的颜色较为一致,因而M.sinensis K6产硫化氢能力与酿酒酵母X16接近,说明具有较好的应用价值。
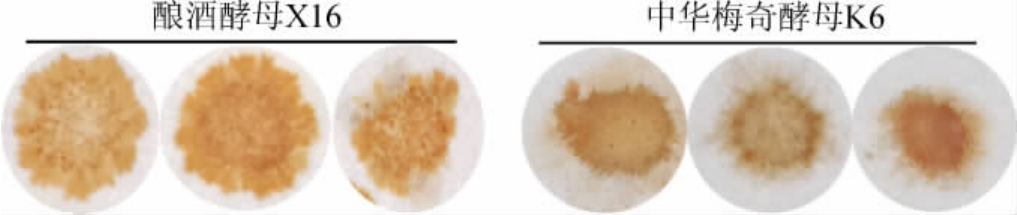
图5 中华梅奇酵母K6产硫化氢能力分析结果
Fig.5 Analysis results of sulphuretted hydrogen production ability of Metschnikowia sinensis K6
2.6 中华梅奇酵母K6产β-葡萄糖苷酶性能分析
β-葡萄糖苷酶是一类可水解含β-D-葡萄糖苷键底物的水解酶,能够释放出具有香气特性游离糖苷配体,促进香气物质的产生,被广泛用于果汁、果酒等食品领域的增香[25-26]。因此,对中华梅奇酵母K6产β-葡萄糖糖苷酶性能进行检测分析,结果发现,M.sinensis K6产β-葡萄糖苷酶活力为(29.82±0.02)U/L,显著高于酿酒酵母X16的(25.31±0.05)U/L(P<0.05),具有较好的产β-葡萄糖苷酶性能。
2.7 库尔勒香梨果酒的品质分析
2.7.1 库尔勒香梨果酒的基本理化指标
库尔勒香梨果酒的基本理化指标见表2。由表2可知,中华梅奇酵母K6与酿酒酵母X16作为混合发酵剂,可较好的完成库尔勒香梨果酒的发酵,其发酵的库尔勒香梨果酒的酒精度(12.91%vol)显著低于单独接种酿酒酵母X16发酵的库尔勒香梨果酒(13.66%vol)(P<0.05),而混合发酵组的残糖量(9.13 g/L)则显著高于酿酒酵母组(8.42 g/L)(P<0.05)。可能是在发酵过程中菌株K6与X16之间存在一定的相互作用,其具体原因还有待于做进一步的研究。此外,与酿酒酵母组酒样相比,混合发酵组酒样中总酸含量(3.9 g/L)显著降低(P<0.05),挥发酸含量(0.3 g/L)无显著差异(P>0.05),表明,混合接种M.sinensis K6与酿酒酵母可调节库尔勒香梨果酒的酸度。
表2 库尔勒香梨果酒基本理化指标的测定结果
Table 2 Determination results of basic physicochemical indicators of Pyrus sinkiangensis Yu wine

注:“*”表示差异显著(P<0.05)。下同。
2.7.2 库尔勒香梨果酒挥发性风味成分分析
为评价M.sinensis K6的果酒发酵性能,以酿酒酵母X16单独发酵的库尔勒香梨果酒作为对照,将菌株M.sinensis K6与酿酒酵母X16共同接种进行混合发酵库尔勒香梨果酒。采用SPME-GC-MS技术测定库尔勒香梨果酒中的挥发性香气成分,结果见表3。由表3可知,从两组库尔勒香梨果酒中共检测到33种挥发性化合物,包括13种酯类化合物、11种醇类化合物、3种酸类化合物和6种其他类化合物。酿酒酵母X16单独发酵的库尔勒香梨果酒中共检测到28种挥发性化合物,包括12种酯类化合物、11种醇类化合物、2种酸类化合物和3种其他类化合物;M.sinensis K6与酿酒酵母X16混合发酵的库尔勒香梨果酒中共检测到31种挥发性化合物,包括11种酯类化合物、11种醇类化合物、3种酸类化合物和6种其他类化合物。混合接种M.sinensis K6减少了库尔勒香梨果酒中挥发性酯类化合物的种类,增加了挥发性酸类和其他类化合物的种类。
表3 库尔勒香梨果酒中挥发性风味物质GC-MS分析结果
Table 3 Results of volatile flavor compounds in Pyrus sinkiangensis Yu wine analyzed by GC-MS

注:“/”表示未检出;“*”表示差异显著(P<0.05)。
与酿酒酵母组相比,混合接种M.sinensis K6发酵的库尔勒香梨果酒中挥发性酯类和其他类化合物的含量显著增加(P<0.05);挥发性酸类化合物和醇类化合物的含量没有显著差异(P>0.05)。因此,混合接种M.sinensis K6增加了库尔勒香梨果酒中挥发性酯类和其他类化合物的含量,有助于丰富酒类的复杂性和丰富度。
酯类物质是酒类中主要的呈香物质,通常具有花香和果香特性[27]。2种库尔勒香梨果酒中均检测到了乙酸乙酯、己酸乙酯、葵酸乙酯等9种挥发性酯类化合物。其中,乙酸乙酯、己酸乙酯、辛酸乙酯、葵酸乙酯为主要的酯类化合物。乙酸甲酯、辛酸甲酯为酿酒酵母X16单一菌株发酵的库尔勒香梨果酒中的特有酯类香气物质;而丙酸乙酯则为M.sinensis K6与酿酒酵母X16混合发酵的库尔勒香梨果酒的特有酯类香气物质。周文杰等[28]采用GC-MS/气相色谱-嗅味法(gas chromatography olfactometry,GC-O)结合化学计量学方法研究了库尔勒香梨酒的特征香气成分,结果从三种库尔勒香梨果酒中均检测到了己酸乙酯、辛酸乙酯类香气化合物,但其含量均低于本研究,可能是受不同的发酵工艺影响。乙酸乙酯是一类具有果香特性的化合物,普遍存在于各类发酵酒中,对酒体的呈香具有重要的作用[27]。陈计峦等[29]在库尔勒香梨果酒中发现乙酸乙酯为库尔勒香梨果酒中主要的挥发性酯类化合物,这与本研究的结果较为一致。本研究还发现,混合接种M.sinensis K6可提高库尔勒香梨果酒中乙酸乙酯的含量[(17.82±0.89)mg/L]。
酸类物质也是构成各类发酵酒香气物质的重要贡献者[30]。在2种库尔勒香梨果酒中均检测到乙酸和辛酸2种酸类化合物,这与陈计峦等[29]的研究结果较为一致。但其他研究者在库尔勒香梨果酒中检测到的其他酸类化合物与本研究所检测到的化合物具有一定的差异性,如周文杰等[28]还检测到了丁二酸,邓星星等[31]检测到了1-甲基-2-羟基苯甲酸,这可能与接种的酵母、发酵条件有关。此外,本研究还发现酿酒酵母X16单一菌株发酵的库尔勒香梨果酒中仅能检测到乙酸和辛酸2种挥发性酸类化合物。己酸为M.sinensis K6与酿酒酵母X16混合发酵的库尔勒香梨果酒中特有的挥发性酸类化合物。2种库尔勒香梨果酒中挥发性酸类化合物的总量无显著差别,但混菌发酵增加了己酸的含量。
醇类物质对发酵酒的香气特性具有重要影响,在酒精发酵过程中,由酵母菌代谢产生[32]。在2种库尔勒香梨果酒中均检测到11种醇类化合物,醇类化合物含量没有显著性差异(P>0.05)。
在酿酒酵母组仅检测到3种其他类化合物,而在混菌发酵组则检测到了6种其他类化合物。而且,混菌发酵组其他类化合物的含量也较酿酒酵母组显著增加(P<0.05)。因此,混菌发酵增加了库尔勒香梨果酒中其他类化合物的种类与含量,有助于提高果酒的丰富度。
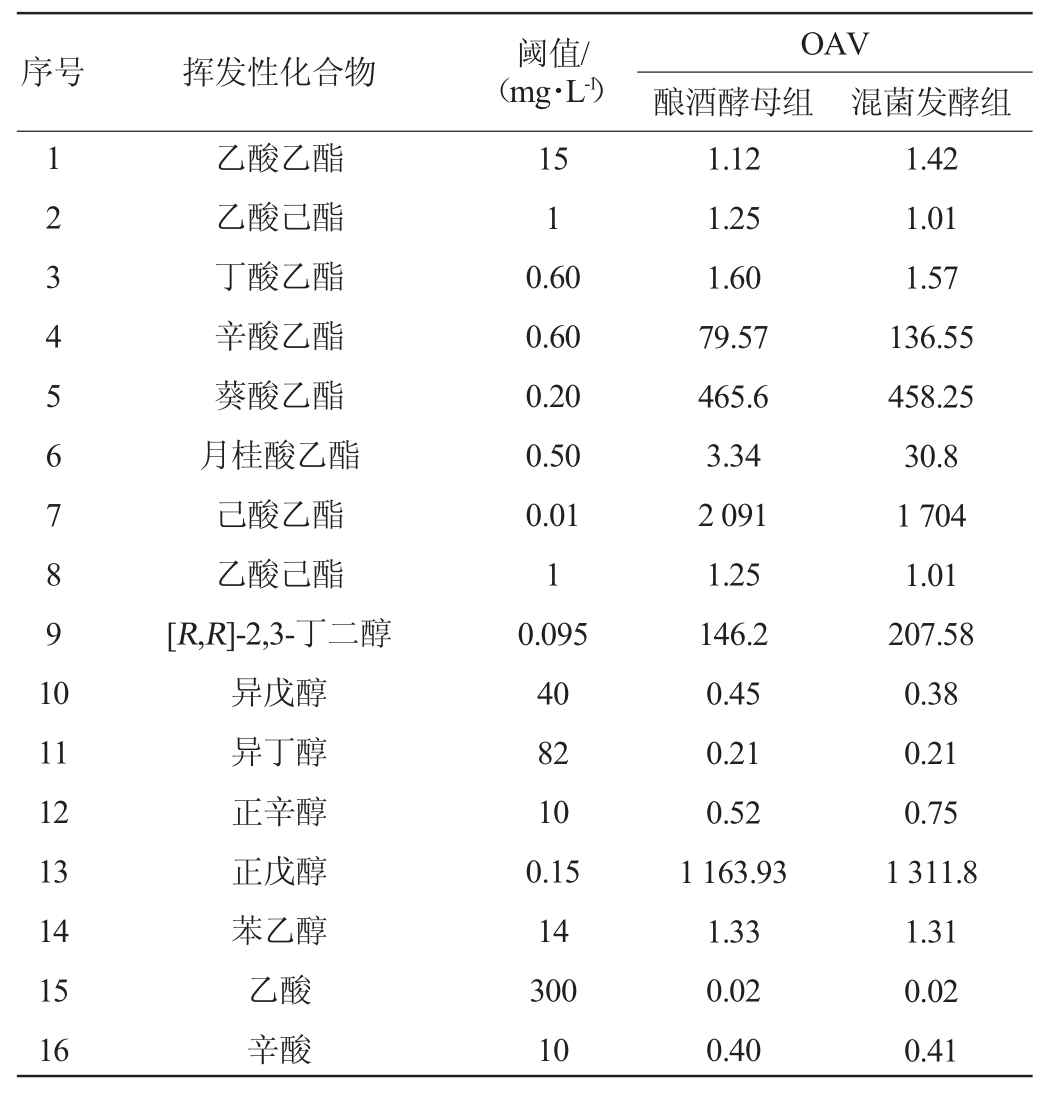
为进一步分析挥发性风味物质对酒体香气的贡献度,计算2种库尔勒香梨果酒中主要香气化合物的OAV。有研究表明,OAV>1时,该化合物对酒体香气有突出的贡献度,反之对酒体贡献度不突出[18]。库尔勒香梨果酒中16种主要挥发性化合物的OAV见表4。由表4可知,11种挥发性风味物质的OAV>1,5种挥发性风味物质的OAV<1。己酸乙酯的OAV最大,其次为正戊醇、葵酸乙酯和[R,R]-2,3-丁二醇,表明这些化合物对酒体香气贡献较大。
表4 库尔勒香梨果酒中香气化合物的气味活性值比较
Table 4 Comparison of odor activity values of aroma compounds in Pyrus sinkiangensis Yu wine
3 结论
本研究采用形态观察及分子生物学技术鉴定库尔勒香梨来源的非酿酒酵母K6为一株中华梅奇酵母(Metschnikowia sinensis),其在对数生长期的生长性能优于商业化酿酒酵母X16。M.sinensis K6的葡萄糖耐受性和乙醇耐受性不及酿酒酵母X16,二氧化硫耐受性、柠檬酸耐受性、碳源利用特性以及产硫化氢性能与酿酒酵母X16较为相似,产β-葡萄糖苷酶性能则高于酿酒酵母X16。与单独接种酿酒酵母X16相比,M.sinensis K6与酿酒酵母混合发酵可显著增加库尔勒香梨果酒中的挥发性酯类化合物和其他类化合物的含量,丰富其他类化合物的种类,调节库尔勒香梨果酒的香气品质。综上,M.sinensis K6生长性能和酿造环境耐受性能以及发酵性能良好,在特色库尔勒香梨果酒生产上具有一定的应用潜能。
[1]刘晓柱,李银凤,于志海,等.刺梨自然发酵过程中非酿酒酵母多样性分析[J].微生物学报,2020,60(8):1696-1708.
[2]MORATA A,ESCOTT C,BAÑUELOS M A,et al.Contribution of non-Saccharomyces yeasts to wine freshness[J].Biomolecules,2020,10(1):34.
[3]VEJARANO R,GIL-CALDERÓN A.Commercially available non-Saccharomyces yeasts for winemaking:Current market,advantages over Saccharomyces,biocompatibility,and safety[J].Fermentation,2021,7(3):171.
[4]BORREN E,TIAN B.The important contribution of non-Saccharomyces yeasts to the aroma complexity of wine:A review[J].Foods,2021,10(1):13.
[5]BASSO R F,ALCARDE A R,PORTUGAL C B.Could non-Saccharomyces yeasts contribute on innovative brewing fermentations?[J].Food Res Int,2016,86:112-120.
[6]LIU X,LI Y,ZHOU J,et al.Effects of co-inoculation and sequential inoculation of Wickerhamomyces anomalus and Saccharomyces cerevisiae on the physicochemical properties and aromatic characteristics of longan(Dimocarpus longan Lour.)wine[J].Qual Assur Saf Crop,2021,13(2):56-66.
[7]LIU Y,ZHANG Q,NIU H,et al.Prediction method for nutritional quality of Korla pear during storage[J].Int J Agr Biol Eng,2021,14(3):247-254.
[8]WANG Y,SU S,CHEN G,et al.Relationship between cuticular waxes and storage quality parameters of Korla pear under different storage methods[J].J Plant Growth Regul,2021,40(3):1152-1165.
[9]WANG Y,MAO H,LV Y,et al.Comparative analysis of total wax content,chemical composition and crystal morphology of cuticular wax in Korla pear under different relative humidity of storage[J].Food Chem,2021,339:128097.
[10]MAMAT A,TUSONG K,XU J,et al.Integrated transcriptomic and proteomic analysis reveals the complex molecular mechanisms underlying stone cell formation in Korla pear[J].Sci Rer-UK,2021,11(1):1-12.
[11]傅力,张华,叶红.库尔勒香梨酵母XL1和XL2发酵性能的研究[J].食品科学,2003,24(1):61-64.
[12]HU J,VINOTHKANNA A,WU M,et al.Tracking the dynamic changes of a flavor,phenolic profile,and antioxidant properties of Lactiplantibacillus plantarum-and Saccharomyces cerevisiae-fermented mulberry wine[J].Food Sci Nutr,2021,9(11):6294-6306.
[13]KWON S J,CHOI J S,YEO S H,et al.Fermentation characteristics of persimmon wine by the mixed culture of Pichia anomala JK04 and Saccharomyces cerevisiae Fermivin cells[J].Korean J Food Pres,2015,22(5):768-777.
[14]CHEN D,YAP Z Y,LIU S Q.Evaluation of the performance of Torulaspora delbrueckii, Williopsis saturnus,and Kluyveromyces lactis in lychee wine fermentation[J].Int J Food Microbiol,2015,206:45-50.
[15]XU Y,ZHAO G A,WANG L P.Controlled formation of volatile components in cider making using a combination of Saccharomyces cerevisiae and Hanseniaspora valbyensis yeast species[J].J Ind Microbiol Biot,2006,33(3):192-196.
[16]LI Y,HUANG Y,LONG H,et al.Biodiversity and oenological property analysis of non-Saccharomyces yeasts isolated from Korla fragrant pears(Pyrus sinkiangensis Yu)[J].Fermentation,2022,8:388.
[17]刘晓柱,李银凤,张远林,等.鲜食葡萄来源酵母菌的鉴定及其酿造学特性分析[J].中国酿造,2021,40(3):48-53.
[18]LIU X,LI Y,ZHAO H,et al.Oenological property analysis of selected Hanseniaspora uvarum isolated from Rosa roxburghii Tratt[J].Int J Food Eng,2020,17(6):445-454.
[19]王优蓓,肖凤,季雪傲,等.10种非酿酒酵母硫化氢产生能力及动态分析[J].中国酿造,2017,36(6):23-27.
[20]刘晓柱,赵湖冰,李银凤,等.一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J].食品与发酵工业,2020,46(8):97-104.
[21]马云青,孙佳勰,毕玉杰,等.不同酵母对干白葡萄酒发酵过程中香气变化的影响[J].中国酿造,2021,40(6):113-118.
[22]WANG H,WANG J,YANG S,et al.Highly selective and rapidly responsive fluorescent probe for hydrogen sulfide detection in wine[J].Food Chem,2018,257:150-154.
[23]FERREIRA V,FRANCO-LUESMA E,VELA E,et al.Elusive chemistry of hydrogen sulfide and mercaptans in wine[J].J Agr Food Chem,2017,66(10):2237-2246.
[24]PARK S K.Development of a method to measure hydrogen sulfide in wine fermentation[J].J Microbiol Biotech,2008,18(9):1550-1554.
[25]ZHANG Y,MIN Z,QIN Y,et al.Efficient Display of Aspergillus niger β-glucosidase on Saccharomyces cerevisiae cell wall for aroma enhancement in wine[J].J Agr Food Chem,2019,67(18):5169-5176.
[26]CUI C H,JEON B M,FU Y,et al.High-density immobilization of a ginsenoside-transforming β-glucosidase for enhanced foodgrade production of minor ginsenosides[J].Appl Microbiol Biot,2019,103(17):7003-7015.
[27]SONG R R,DUAN W P,ZHU X,et al.Effects of sequential inoculation with Torulaspora delbrueckii and Saccharomyces cerevisiae on aroma profile of dry red wine[J].Food Ferment Ind,2019,45(24):1-9.
[28]周文杰,张芳,王鹏,等.基于GC-MS/GC-O结合化学计量学方法研究库尔勒香梨酒的特征香气成分[J].食品科学,2018,39(10):222-227.
[29]陈计峦,吴继红,冯作山,等.库尔勒香梨酒的挥发性成分分析[J].酿酒科技,2005(3):87-89.
[30]刘晓柱,黎华,李银凤,等.接种异常威克汉姆酵母对空心李果酒理化特性及香气组分的影响[J].食品科技,2020,45(11):21-27.
[31]邓星星,张瑛,梁莉,等.谷胱甘肽添加量对库尔勒香梨酒品质的影响[J].中国酿造,2020,39(11):120-125.
[32]王鑫,梁艳英,李娜娜,等.杨凌地区主要葡萄蒸馏酒的香气成分分析[J].中国酿造,2018,37(7):161-167.