微生物胞外多糖(exopolysaccharides,EPS)是微生物分泌到细胞外的长链、高分子聚合物[1-2],是细菌、酵母菌、霉菌和放线菌等微生物在代谢过程中产生的具有生理功能和生物活性的聚合物[3],属于微生物的次级代谢产物,其优点为成本低、无毒和可生物降解[4]。此外,多项研究表明,微生物EPS还具有降低胆固醇、增强免疫力、抗肿瘤、抗病毒、抗氧化等功能,因而被应用于食品、医药等领域[5-6]。
产生胞外多糖的酵母菌株有多个,如红酵母属(Rhodotorula)[7]、锁掷孢酵母(Sporobolomyces)[8]、假丝酵母(Candida)和隐球菌(Cryptococcus)[9-10],多糖作为生物大分子,其结构复杂性远大于蛋白和核酸,功能性也比较复杂[11]。以往对多糖的应用仅限增稠剂,但是近年来越来越多的研究表明多糖具有一定的生理活性,如肠膜明串珠菌(Leu-conostoc mesenteroides)产生的胞外多糖,表现出比较强的免疫功能[12];多粘类芽孢杆菌(Paenibacillus polymyxa)产生的胞外多糖表现出更高的抗肿瘤的作用,除此之外还表现出较高的还原能力、对羟自由基和超氧阴离子的清除活性[13]。
目前,微生物EPS的研究主要集中在发酵条件优化、菌株选育和初步结构表征等方面[6,14]。在之前的研究中,具有高产EPS的菌株PFY49被分离出来并鉴定为近粉红锁掷孢酵母(Sporidiobolus pararoseus)[15-16]。本研究以S.pararoseus PFY49为供试菌株,通过发酵、提取和纯化得到PFY49 EPS,并对其热稳定性、乳化性、牛奶凝结能力,以及抗氧化活性、降糖活性、与胆汁酸的结合能力进行了体外评价,此外还探讨了锁掷孢酵母胞外多糖生物活性之间的相关性,为S.pararoseus PFY49 EPS的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
近粉红锁掷孢酵母(Sporidiobolus pararoseus)PFY49:本实验室分离自齐齐哈尔地区葡萄园土壤。
1.1.2 试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):北京酷来搏科技有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis-3-ethylbenzthiazoline-6-sulfonate,ABTS):北京康文生物技术有限公司;α-淀粉酶(5 U/mg)、α-葡萄糖苷酶(50 U/mg)、对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,PNPG):上海源叶生物科技有限公司;牛磺胆酸钠、甘氨酸酸钠、胆酸钠:上海麦克林生物化工有限公司;阿卡波糖:大连美伦生物科技有限公司;葡萄糖、硫酸铵、硫酸镁、氯化钙、磷酸氢二钾、氯化钠(均为分析纯):天津江天化工技术有限公司;其他试剂均为分析纯,由天津科密欧化学试剂有限公司提供。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)琼脂培养基、YPD液体培养基:青岛高科技工业园海博生物技术有限公司。
产糖培养基:葡萄糖17.50 g/L,硫酸铵2.00 g/L,硫酸镁1.80 g/L,氯化钙0.28 g/L,磷酸氢二钾0.24 g/L,氯化钠0.60 g/L。
1.2 仪器与设备
5804R台式高速大容量冷冻离心机、22331Hamburg高速离心机:德国艾本德公司;RE100-pro旋转蒸发仪:北京大龙兴创实验仪器公司;V-5000可见分光光度计:上海元析仪器有限公司;ELX800全自动酶标仪:美国Bio-Tek公司;FE28 pH计:梅特勒-托利多集团;HZQ-211C落地振荡器:上海一恒科学仪器有限公司;CX31光学显微镜:日本奥林巴斯公司;LC-18N-50D冷冻干燥机、DHP-9162电热恒温培养箱:上海力辰科技有限公司;UH5300紫外可见分光光度计:日本日立科学仪器有限公司;TGA-7热重分析仪:美国珀金埃尔默股份有限公司;AL204电子天平:梅特勒-托利多集团。
1.3 方法
1.3.1 多糖的提取和净化
多糖的提取参照文献[14]的方法略有改动。将活化后的菌株按5%(V/V)接种量接种至发酵产糖培养基中,装液量100 mL/250 mL、摇床转速210 r/min、28 ℃培养6 d。将发酵液4 ℃、12 000 g×离心10 min,向上清液中加入3倍体积分数95%的预冷乙醇,于4 ℃静置24 h后,4 ℃、12 000 g×离心10 min,用50 mL去离子水溶解沉淀,获得粗EPS。向粗EPS溶液加入50 mL 10%三氯乙酸脱蛋白,低温搅拌10 h,4 ℃、12 000 g×离心10 min去除蛋白。向上清液中再次加入3倍体积分数95%的预冷乙醇,4 ℃、12 000 g×离心10 min,随后将粗EPS溶解在100 mL去离子水中,置于透析袋中4 ℃透析2 d,透析袋的孔径为8~12 kDa,最后,使用Sephadex G-100凝胶色谱柱(1.6 cm×50 cm)以0.2 mL/min的流速纯化粗多糖,收集纯EPS,50 ℃旋转蒸发、冷冻干燥备用。
1.3.2 热稳定性研究
使用热重分析仪对S.pararoseus PFY49 EPS进行差示扫描量热分析(differential scanning calorimetry,DSC)、热重分析(thermo gravimetric analysis,TGA)和差示热重力分析(derivative thermogravimetric,DTG)测量[17]。取3 mg样品放入Al2O3坩埚,保护气(Ar2)以50 mL/min进行吹扫,以10 ℃/min的线性加热速率从30 ℃加热至800 ℃,同时用空坩埚作为对照,记录样品性质随温度升高的变化。
1.3.3 体外抗氧化活性的测定
通过自由基清除活性的测定来评价S.pararoseus PFY49 EPS的体外抗氧化活性,包括DPPH自由基(DPPH·)、ABTS自由基(ABTS+·)、羟基自由基(·OH)、亚硝基(NO2-)清除能力和总还原力(total reducing power,TRP)。参照文献[18],在测定之前,将样品溶解在去离子水中,使其最终质量浓度为0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.25 mg/mL、0.40 mg/mL、0.50 mg/mL、1.00 mg/mL和2.00 mg/mL。用去离子水作为空白对照和维生素C(vitamin C,VC)为阳性对照。用酶标仪在室温条件下测定DPPH·、ABTS+·、·OH、NO2-清除能力和TRP(OD700nm)。
1.3.4 体外降糖活性的测定
参照文献[19-20]的方法,以阿卡波糖为对照,考察S.pararoseus PFY49 EPS对α-淀粉酶和α-葡萄糖苷酶抑制能力评价其体外降糖活性。将EPS和阿卡波糖溶解在磷酸盐缓冲液(pH 6.9)中,使最终质量浓度为0.05 mg/mL、0.10mg/mL、0.20mg/mL、0.40mg/mL、0.60mg/mL、0.80mg/mL、1.00 mg/mL、1.50 mg/mL、2.00 mg/mL,将阿卡波糖和去离子水分别作为阳性对照和空白对照。在室温条件下,用酶标仪检测吸光度值(OD540nm值和OD405nm值),计算酶抑制能力。
1.3.5 体外胆汁酸结合能力的测定
参照文献[21-22]的方法,用磷酸缓冲溶液(pH=6.9)稀释胆汁酸原液和样品,其中包括牛磺胆酸钠(sodium taurocholate hydrate,STH,1 mg/mL)、甘氨酸酸钠(sodium glycocholate hydrate,SGH,1 mg/mL)和胆酸钠(sodium cholate,SC,1 mg/mL)。使用酶标仪测量OD387nm值,以不含胆汁酸的磷酸盐缓冲液作空白,胆汁酸结合能力由牛磺胆酸钠(y=2.635 5x+0.080 8,R2=0.997)、甘氨胆酸钠(y=2.865x+0.111 6,R2=0.990 6)、胆酸钠(y=2.068 3x+0.089 4,R2=0.999)的校准曲线估算。
1.3.6 乳化能力、持水性和水溶性的测定
参照文献[23]的方法对S.pararoseus PFY49 EPS的乳化能力进行测定,将2.5 mL的EPS溶液(1 mg/mL)与2.5 mL碳氢化合物或油混合(苯、二甲苯、石油醚、汽油、柴油、煤油、大豆油),总高度为(H0),室温保存,使用游标卡尺测量乳化层在12 h、24 h、36 h的高度(H1)。乳化能力按以下公式计算:
参照文献[24]的方法对S.pararoseus PFY49 EPS持水性和水溶性进行测定,将冻干后的EPS样品放入95 ℃的烘箱中干燥4 h,然后将干燥EPS样品(45 mg)放入空离心管中,加入0.5 mL去离子水,旋涡振荡使EPS完全溶解,12 000 r/min离心40 min。离心管和沉淀的质量记为M1。冻干后离心管和沉淀物的质量记为M2。持水性按以下公式计算:
称2 mL空离心管质量(M1),将EPS样品(45 mg)装入2 mL空心离心管中,然后加入0.5 mL去离子水,旋涡振荡使EPS完全溶解,12 000 r/min离心40 min。冻干后离心管和沉淀总质量记为M2。水溶性按以下公式计算:
1.3.7 数据处理
所有数据采用SPSS25.0进行统计分析。采用TBtools 1.087热图法对生物活性进行分析。使用Origin 2021对生物活性进行相关性分析。数据以“平均值±标准差”(n=3)报告,采用方差分析(analysis of variance,ANOVA)进行分析。
2 结果与分析
2.1 S.pararoseus PFY49 EPS热力学性质
热力学分析常用于分析样品的热稳定性,在分析进程中,散热与吸热常伴随着晶体的熔化及聚合物结构的改变[25]。S.pararoseus PFY49 EPS样品的热重分析结果见图1。
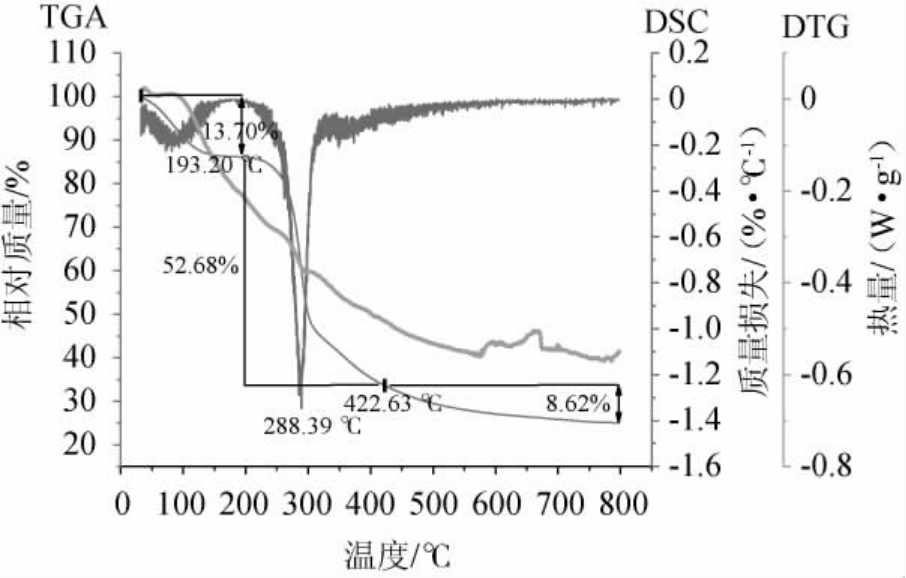
图1 近粉红锁掷孢酵母PFY49胞外多糖的DSC、TGA及DTG曲线
Fig.1 DSC,TGA and DTG curves of Sporidiobolus pararoseus PFY49 exopolysaccharides
由图1可知,TGA和DTG曲线测定晶体质量的变化,当从室温升高至800 ℃时,EPS一直损失质量,此过程中主要包括三个阶段:第一个阶段从起始温度至193.20 ℃,质量损失了13.7%,虫草头孢(Cordyceps cephalosporium)菌丝体的多糖在这一阶段质量损失为7.05%[26],这是由于破坏了EPS分子中羧基与水分子的结合,从而导致脱水及裂解[27];随后从193.2 ℃升温至422.63 ℃时,EPS结构和化学键遭到严重破坏[26],质量迅速流失,损失了初始质量的52.68%左右。第三阶段,随着温度的持续升高(422.63~800 ℃),由于多糖中存在一些复杂的分子结构,EPS的质量不再有所改变。
从DSC曲线可以看出,EPS的最大分解速率在288.39℃,这表明EPS具有较高的热稳定性。超过该温度,多糖的结构将遭到严重破坏且不能复原。菌株Lb.plantarum YW11分泌的多糖有与EPS相近的分解温度(287.7 ℃)[28]。由于EPS的分解温度高于乳制品加工过程中温度,因此EPS有可能用于乳品加工。
2.2 S.pararoseus PFY49 EPS抗氧化性
以VC为阳性对照,在0~2 mg/mL范围内测定了S.pararoseus PFY49 EPS的DPPH·、ABTS+·、·OH、NO2-清除能力,结果见图2。
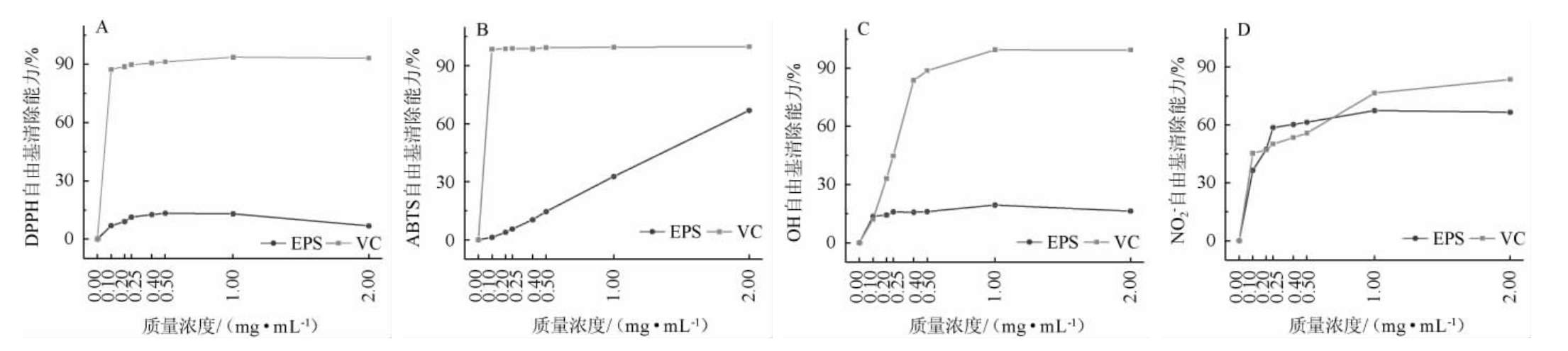
图2 近粉红锁掷孢酵母PFY49 EPS的抗氧化性
Fig.2 Antioxidant activities of Sporidiobolus pararoseus PFY49 EPS
由图2A可知,EPS对DPPH·清除率随着样品质量浓度的增加呈先增强后减弱的趋势,但始终显著低于VC的清除能力(P<0.05)。EPS质量浓度0.50 mg/mL时,清除率达到最大值(13.62±0.62)%。结果表明,菌株S.pararoseus PFY49 EPS具有一定的DPPH·清除能力,这可能是与多糖的氢离子给出能力有关。
由图2B可知,EPS对ABTS+·清除率随着样品质量浓度的增加而增强,但始终低于VC的清除能力(P<0.05)。EPS质量浓度为2.00 mg/mL时,清除率为(66.82±0.61)%。结果表明,菌株S.pararoseus PFY49 EPS具有一定的ABTS+·清除能力。
·OH是活性氧中最为危险而且活性最强的自由基,可以通过活体免疫作用产生,自由进入细胞膜,导致氧化应激损伤,尤其是对蛋白质造成破坏[29]。由图2C可知,EPS对·OH清除率随着样品质量浓度的增加呈先增强后减弱的趋势,但始终低于VC的清除能力(P<0.05)。EPS质量浓度为1.00 mg/mL时,清除率达到最大值(19.40±0.14)%。结果表明,EPS能通过给出电子或氢离子来清除·OH,而且一定范围内,自由基清除率与样品剂量有关。
亚硝酸盐离子(NO2-)在口腔中被共生菌转化为亚硝酸盐,随唾液进入胃腔,在酸性部位生成氮氧化物,增大患癌风险,同时可能引起其他疾病[30]。由图2D可知,EPS对NO2-清除率随着样品质量浓度的增加而增强,当质量浓度为0~0.20 mg/mL和约0.75~2.00 mg/mL时,EPS对NO2-清除能力低于VC,而当质量浓度为0.20~0.75 mg/mL时,EPS对NO2-清除能力高于VC,表明在一定质量浓度范围内EPS具有较强的NO2-清除能力。
TRP是评估样品抗氧化能力的重要指标。EPS和VC的吸光度值都随着剂量的增加而增大,VC和EPS质量浓度为2.00 mg/mL时,吸光度值分别为1.557±0.006和0.327±0.006,表明EPS有一定还原能力,但是显著低于VC的TRP(P<0.05)。
2.3 S.pararoseus PFY49 EPS体外降糖活性
α-淀粉酶是将长碳水化合物水解成短葡萄糖以便于在细胞内运输的关键酶,机体内过多的葡萄糖会引起血糖升高,因此,抑制α-淀粉酶的活性,可以阻断淀粉等碳水化合物在体内代谢产生葡萄糖,延迟小肠中碳水化合物的消化,从而降低餐后血糖水平[34]。EPS和阿卡波糖对α-淀粉酶、α-葡萄糖苷酶的抑制作用见图3。
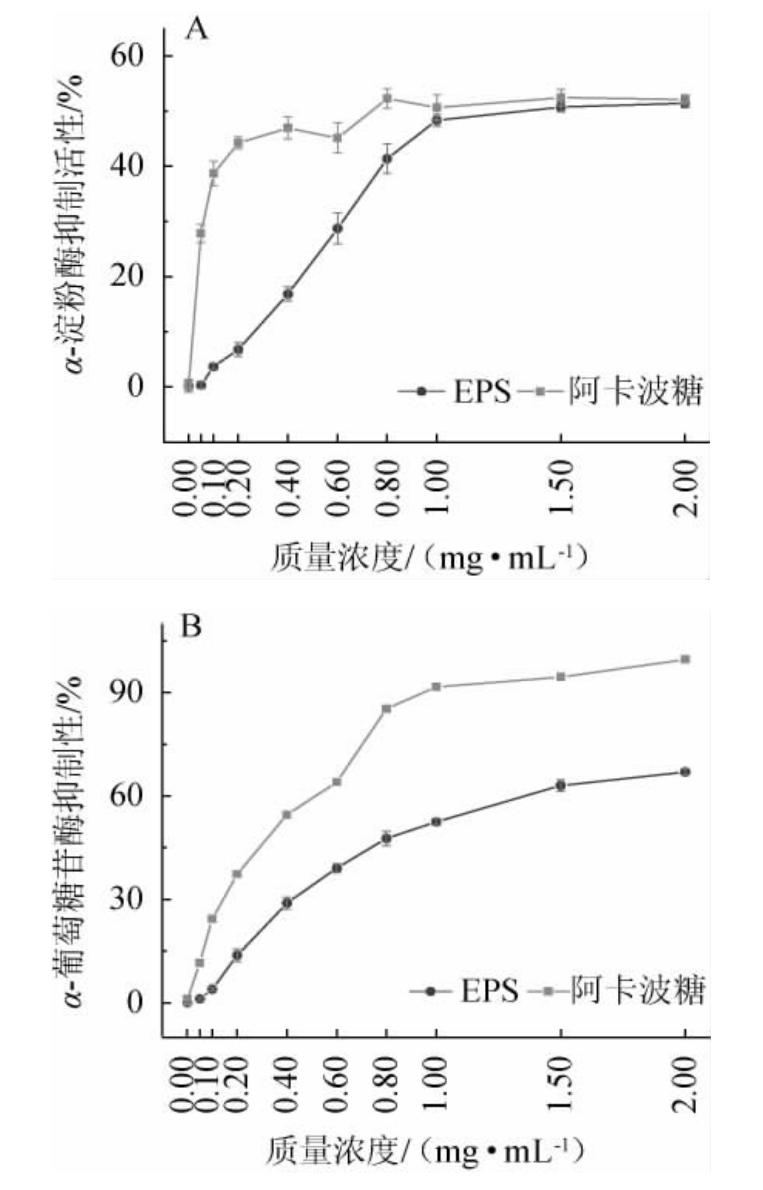
图3 近粉红锁掷孢酵母PFY49 EPS对α-淀粉酶(A)和α-葡萄糖苷酶(B)的抑制效果
Fig.3 Inhibitory effect of Sporidiobolus pararoseus PFY49 EPS on α-amylase (A) and α-glucosidase (B)
由图3A可知,EPS质量浓度与α-淀粉酶抑制效果成正比,当EPS质量浓度为0.05~2.00 mg/mL时,对α-淀粉酶的抑制率从0.37%增加至51.5%,当EPS质量浓度>1 mg/mL后,对α-淀粉酶的抑制趋于稳定,可见EPS对α-淀粉酶具有较强的抑制作用,可以作为α-淀粉酶抑制剂。
α-葡萄糖苷酶参与淀粉和糖原的代谢途径,可以释放葡萄糖,从而最终导致高血糖,因此,抑制葡萄糖苷酶活性,降低餐后血糖是治疗糖尿病的主要途径[35]。由图3B可知,EPS质量浓度与α-葡萄糖苷酶抑制效果成正比,当EPS质量浓度为0.05~2.00 mg/mL时,对α-葡萄糖苷酶的抑制率从1.14%增加至67.02%,但EPS对α-葡萄糖苷酶的抑制效果均低于同质量浓度的阿卡波糖,可见EPS对α-葡萄糖苷酶具有较强的抑制作用,可以作为α-葡萄糖苷酶的抑制剂。
虽然EPS对α-淀粉酶和α-葡萄糖苷酶的抑制活性都低于阿卡波糖,但是研究表明,阿卡波糖有一定的副作用和依赖性。因此,EPS具有多种治疗效果和副作用小的特点,可作为一种降糖药物的替代方法[36-37]。此外,EPS对α-葡萄糖苷酶的抑制活性优于对α-淀粉酶的抑制活性,这可能与阿卡波糖是α-葡萄糖苷酶的抑制剂有关,文献[20]也报道了类似的结果。
2.4 S.pararoseus PFY49 EPS体外胆汁酸结合能力
多糖与胆汁酸的结合能力通常用于体外评价其在降血脂方面的作用。由图4可知,EPS质量浓度分别为2.00mg/mL、0.60 mg/mL、1.50 mg/mL时与SC、STH和SGH结合能力最大,分别为(31.58±0.73)%、(32.62±1.31)%、(24.90±0.62)%。EPS与SC和SGH的结合能力与EPS质量浓度0.05~2.00 mg/mL范围内呈正相关,而EPS与STH的结合率呈现先升高后降低的趋势,在0~0.60 mg/mL范围内升高,在0.60~2.00 mg/mL范围内降低。研究结果表明[29],生物活性多糖(bioactive polysaccharides,BPS)-A由于分子质量较低、Gal含量较高、表面形态松散、具有多分支结构,具有较强的胆汁酸结合能力。此外,也有研究结果表明[22],BPS-I多糖的胆汁酸结合能力与糖醛酸、中性糖和多酚的含量相关,说明其化学成分与胆汁酸结合能力有关。综上所述,胆汁酸的结合能力受多种因素的影响,需要在后续实验中进一步探索。
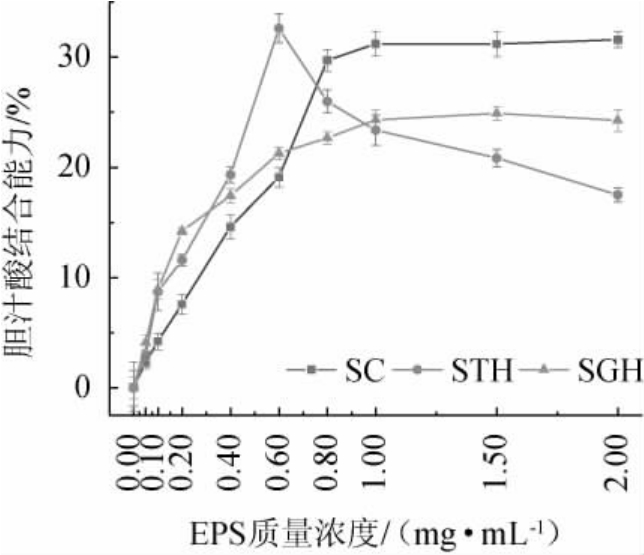
图4 近粉红锁掷孢酵母EPS体外胆汁酸结合能力
Fig.4 Bile acid binding abilities in vitro of Sporidiobolus pararoseus PFY49 EPS
2.5 S.pararoseus PFY49 EPS乳化能力、持水性和水溶性
S.pararoseus PFY49 EPS对不同油类(汽油、柴油、煤油、大豆油)和烃类(苯、二甲苯、石油醚)的乳化活性见图5。由图5可知,随着S.pararoseus PFY49 EPS反应时间的增加,EPS对油类和烃类化合物的乳化能力不同,乳化趋势为二甲苯>苯>大豆油>柴油>汽油>石油醚。汽油、煤油和石油醚随着反应时间的增加,乳化能力略有下降,柴油、豆油、苯、二甲苯表现为乳化能力增强。当EPS乳化时间为36 h时,大豆油、苯和二甲苯的乳化能力较强,分别为(49.2±3.15)%、(53.1±3.02)%、(56.9±0.39)%,表明EPS具有良好的乳化性能。R.babjevae EPS对葵花籽油具有乳化作用,且随着EPS含量的增加,其乳化活性也随之增加[38],与本研究结果相似。这些结果表明,在多糖的乳化过程中,多糖中的碳水化合物部分在水相中起着重要作用,所含蛋白质的疏水残基与油相反应形成乳液[39]。
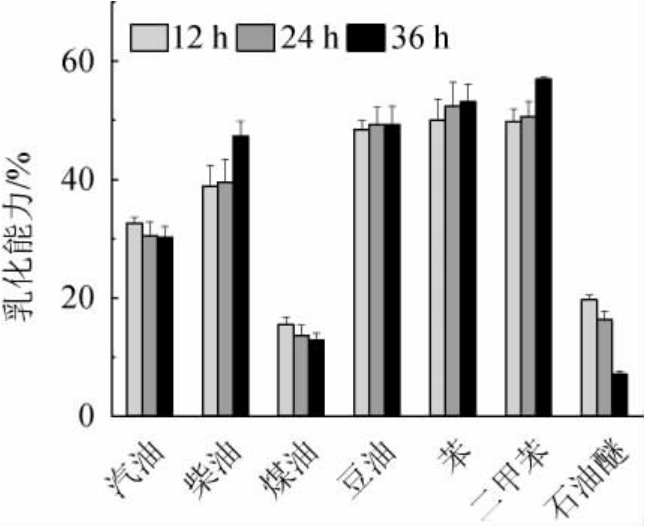
图5 近粉红锁掷孢酵母PFY49 EPS对不同油类和烃类的乳化活性
Fig.5 Emulsifying activities of Sporidiobolus pararoseus PFY49 EPS on different oils and hydrocarbons
S.pararoseus PFY49 EPS的持水性和水溶性分别为(530.00±50.74)%和(93.33±2.78)%。S.pararoseus PFY49 EPS的高持水性可能是由于其分子质量高、多孔性小,可以保持和锁住大量的水分子,此外,溶解度越高,在食品生产和工业生产中作为生物表面活性剂和稳定剂越有利[40]。
2.6 生物相关性分析
多糖具有多种生物活性,这些活性是协同促进还是相互抵消少有报道,因此,综合探究EPS的10种生物活性之间的相关性,结果见图6。
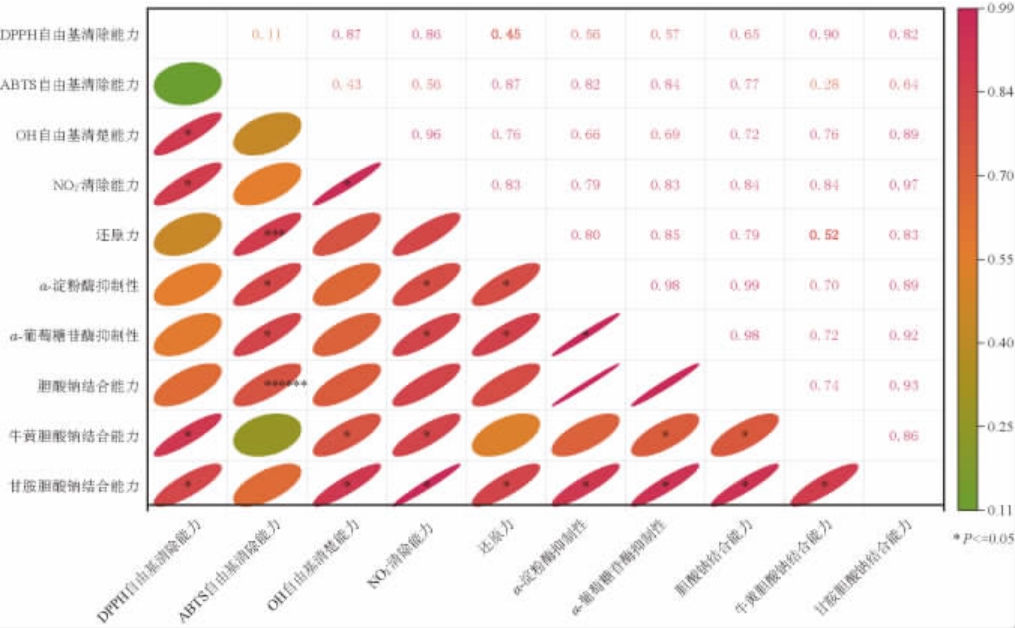
图6 胞外多糖的生物活性相关分析
Fig.6 Correlation analysis of bioactivities of exopolysaccharides
由图6可知,EPS清除DPPH·与ABTS+·能力相关性不显著(P>0.05),而与清除·OH和NO2-的能力呈显著正相关(P<0.05),说明S.pararoseus PFY49产EPS在清除DPPH·、·OH和NO2-的过程中具有协同促进作用;此外,TRP与清除ABTS+·、·OH和NO2-的能力呈显著正相关(P<0.05),说明TRP与清除ABTS+·、·OH和NO2-之间具有协同促进作用。
现代药理学研究表明,具有较强抗氧化能力的多糖可能在防治糖尿病[34]中发挥积极作用。由图7可知,EPS对α-淀粉酶和α-葡萄糖苷酶的抑制活性与清除ABTS+、NO2-的能力呈显著正相关(P<0.05),同时也与TRP呈显著正相关(P<0.05),但与清除DPPH自由基和·OH的能力相关性不显著(P>0.05),说明S.pararoseus PFY49产EPS的降糖能力与抗氧化活性之间存在显著的正相关关系。由此可以推断,具有较强抗氧化能力的多糖可能具有较好的降糖作用,这一结论与文献[29]的结果一致。
肥胖常伴有高血糖、高脂血症状,可见血糖与高血脂有一定的相关性。由图6可知,除EPS与TA的结合能力和EPS对α-淀粉酶的抑制活性无显著相关性外(P>0.05),EPS与CA、TG、GA的结合能力与EPS抑制α-淀粉酶、α-葡萄糖苷酶的能力呈显著正相关(P<0.05),说明S.pararoseus PFY49产EPS对糖脂代谢的干预存在协同作用,降低血糖的同时,促进血脂的降低。同时,EPS对CA、TG和GA的结合能力与EPS抗氧化活性(如·OH的清除能力)呈显著正相关(P<0.05)。这些结果表明,EPS的抗氧化、降糖和降血脂活性间存在协同促进作用。三者密切相关,这意味着清除体内活性氧自由基有望有效降低高血糖和高脂血症[21-22]。尽管一些研究得到了类似的结论,但这一过程的机理细节仍不清楚,需要进一步验证。
3 结论
本研究利用实验室前期分离得到的S.pararoseus PFY49为出发菌株,从该菌株发酵液中分离EPS并进行纯化,通过分析发现,S.pararoseus PFY49 EPS具有较高的热稳定性,TGA曲线显示EPS分解温度为288.39 ℃;EPS具有较好抗氧化性、乳化性能力、持水性和水溶性;同时,S.pararoseus PFY49产EPS具有良好的体外抗氧化能力、α-淀粉酶和α-葡萄糖苷酶抑制能力、胆汁酸结合能力,可以作为添加剂应用于食品和医药领域。除此之外,探索了PFY49 EPS的生物活性间的相关性,将有助于理解益生元和添加剂的作用机制,扩大其潜在的应用。
[1]SATPUTE S K,BANAT I M,DHAKEPHALKAR P K,et al.Biosurfactants,bioemulsifiers and exopolysaccharides from marine microorganisms[J].Biotechnol Adv,2010,28(4):436-450.
[2]张爱梅,于杰,韩雪英,等.高产胞外多糖沙棘根瘤内生细菌的筛选、鉴定及其发酵条件优化[J].食品工业科技,2019,40(19):81-88,93.
[3]刘汝冰,贾薇,蒋芸,等.微生物多糖WL-26深层发酵工艺的优化[J].工业微生物,2008,38(6):43-48.
[4]HAO Y,HUANG Y,CHEN J Y,et al.Exopolysaccharide from Cryptococcus heimaeyensis S20 induces autophagic cell death in non-small cell lung cancer cells via ROS/p38 and ROS/ERK signalling[J].Cell Prolif,2020,53(8):e12869.
[5]YADAV K L,RAHI D K,SONI S K.An indigenous hyperproductive species of Aureobasidium pullulans RYLF-10: influence of fermentation conditions on exopolysaccharide (EPS) production[J].Appl Biochem Biotechnol,2014,172(4):1898-1908.
[6]SEVEIRI R M,HAMIDI M,DELATTRE C,et al.Characterization of the exopolysaccharides from Rhodotorula minuta IBRC-M 30135 and evaluation of their emulsifying,antioxidant and antiproliferative activities[J].IRCS Med Sci,2019,23:381-389.
[7]马文锦,李梅林,王博,等.胶红酵母Rhodotorula mucilaginosa CM-1菌株的鉴定及胞外多糖的分离纯化[J].食品与发酵工业,2021,47(21):46-52.
[8]DIMITROVA S,PAVLOVA K,LUKANOV L,et al.Production of metabolites with antioxidant and emulsifying properties by Antarctic strain Sporobolomyces salmonicolor AL1[J].Appl Biochem Biotechnol,2013,169(1):301-311.
[9]孙晓萌.季也蒙假丝酵母(Candida guilliermind)胞外多糖的分离纯化及活性研究[D].大连:大连工业大学,2016.
[10]PAVLOVA K,PANCHEV I,KRACHANOVA M,et al.Production of an exopolysaccharide by Antarctic yeast[J].Folia Microbiol,2009,54(4):343-348.
[11]韩梅.锁掷酵母联产油脂和胞外多糖的研究[D].无锡:江南大学,2017.
[12]SATO T,NISHIMURA-UEMURA J,SHIMOSATO T,et al.Dextran from Leuconostoc mesenteroides augments immunostimulatory effects by the introduction of phosphate groups[J].J Food Prot,2004,67(8):1719-1724.
[13]LIU J,LUO J G,YE H,et al.Preparation,antioxidant and antitumor activities in vitro of different derivatives of levan from endophytic bacterium Paenibacillus polymyxa EJS-3[J].Food Chem Toxicol,2012,50(3-4):767-772.
[14]LIU L N,XU J J,DU R P,et al.The response surface optimization of exopolysaccharide produced by Saccharomyces cerevisiae Y3 and its partial characterization[J].Prep Biochem Biotechnol,2022,52(5):566-577.
[15]裴芳艺,薛迪,马岩石,等.锁掷孢酵母产胞外多糖发酵条件优化[J].中国酿造,2020,39(6):99-105.
[16]马岩石,刘韩,裴芳艺.产胞外多糖酵母菌的分离鉴定及其发酵条件优化[J].食品研究与开发,2020,41(14):68-76.
[17]PEI F Y,MA Y S,CHEN X,et al.Purification and structural characterization and antioxidant activity of levan from Bacillus megaterium PFY-147[J].Int J Biol Macromol,2020,161(15):1181-1188.
[18]PEI F Y,CAO X B,WANG X M,et al.Structural characteristics and bioactivities of polysaccharides from blue honeysuckle after probiotic fermentation[J].LWT-Food Sci Technol,2022,165:113764.
[19]WU M Q,LI W,ZHANG Y L,et al.Structure characteristics,hypoglycemic and immunomodulatory activities of pectic polysaccharides from Rosa setate x Rosa rugosa waste[J].Carbohydr Polym,2021,253:117190.
[20]GU S S,SUN H Q,ZHANG X L,et al.Structural characterization and inhibitions on α-glucosidase and α-amylase of alkali-extracted watersoluble polysaccharide from Annona squamosa residue[J].Int J Biol Macromol,2021,166:730-740.
[21]QIN H N,HUANG L,TENG J W,et al.Purification,characterization,and bioactivity of Liupao tea polysaccharides before and after fermentation[J].Food Chem,2021,353:129419.
[22]YAN J K,WU L X,QIAO Z R,et al.Effect of different drying methods on the product quality and bioactive polysaccharides of bitter gourd(Momordica charantia L.)slices[J].Food Chem,2019,271:588-596.
[23]KANAMARLAPUDI S L R K,MUDDADA S.Characterization of exopolysaccharide produced by Streptococcus thermophilus CC30[J].Biomed Res Int,2017,2017:4201809.
[24]XUE D,PEI F Y,LIU H N,et al.Evaluation of antioxidation,regulation of glycolipid metabolism and potential as food additives of exopolysaccharide from Sporidiobolus pararoseus PFY-Z1[J].Prep Biochem Biotechnol,2023,20:1-11.
[25]WANG Y P,LI C,LIU P,et al.Physical characterization of exopolysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet Kefir[J].Carbohydr Polym,2010,82(3):895-903.
[26]XIAO J,SUN J,YAO L Y,et al.Physicochemical characteristics of ultrasonic extracted polysaccharides from Cordyceps cephalosporium mycelia[J].Int J Biol Macromol,2012,51(1-2):64-69.
[27]LAKRA A K,DOMDI L,TILWANI Y M,et al.Physicochemical and functional characterization of mannan exopolysaccharide from Weissella confusa MD1 with bioactivities[J].Int J Biol Macromol,2020,143:797-805.
[28]ZHANG M,LAI T T,YAO M K,et al.Interaction of the exopolysaccharide from Lactobacillus plantarum YW11 with casein and bioactivities of the polymer complex[J].Foods,2021,10(6):1153.
[29]YAN J K,YU Y B,WANG C,et al.Production,physicochemical characteristics,and in vitro biological activities of polysaccharides obtained from fresh bitter gourd(Momordica charantia L.)via room temperature extraction techniques[J].Food Chem,2021,337:127798.
[30]OLAWUYI I F,LEE W Y.Structural characterization,functional properties and antioxidant activities of polysaccharide extract obtained from okra leaves(Abelmoschus esculentus)[J].Food Chem,2021,354:129437.
[31]叶广彬,陈源红,王长丽,等.假肠膜明串珠菌胞外多糖的分离纯化及其抗氧化特性研究[J].食品研究与开发,2019,40(3):31-37.
[32]邢瀚文.肠膜明串珠菌DRP105胞外多糖发酵条件优化及其性质研究[D].天津:天津大学,2018.
[33]JIANG J,GUO S X,PING W X,et al.Optimization production of exopolysaccharide from Leuconostoc lactis L2 and its partial characterization[J].Int J Biol Macromol,2020,159:630-639.
[34]WU J J,SHI S S,WANG H J,et al.Mechanisms underlying the effect of polysaccharides in the treatment of type 2 diabetes:A review[J].Carbohydr Polym,2016,144:474-494.
[35]杨玉洁,刘静宜,谭艳,等.多糖降血糖活性构效关系及作用机制研究进展[J].食品科学,2021,42(23):355-363.
[36]REN B B,CHEN C,LI C,et al.Optimization of microwave-assisted extraction of Sargassum thunbergii polysaccharides and its antioxidant and hypoglycemic activities[J].Carbohydr Polym,2017,173:192-201.
[37]FU X T,YANG H H,MA C L,et al.Characterization and inhibitory activities on α-amylase and α-glucosidase of the polysaccharide from blue honeysuckle berries[J].Int J Biol Macromol,2020,163:414-422.
[38]SEVEIRI R M,HAMIDI M,DELATTRE C,et al.Characterization and prospective applications of the exopolysaccharides produced by Rhodosporidium babjevae[J].Adv Pharm Bull,2020,10(2):254-263.
[39]侯楚楚.酪蛋白水解肽两亲性质的定量分析及其多糖接枝物的乳化性能研究[D].无锡:江南大学,2016.
[40]GAN L Z,LI X G,WANG H B,et al.Structural characterization and functional evaluation of a novel exopolysaccharide from the moderate halophile Gracilibacillus sp.SCU50[J].Int J Biol Macromol,2020,154:1140-1148.