山西老陈醋历史悠久,口感醇厚,余香绵长,它的酿造工艺主要包括:大曲制备、酒精发酵、醋酸发酵及熏醅[1-2]。山西老陈醋采用开放式的发酵条件自然富集了多种真菌和细菌,这使其酿造过程具有丰富多样的微生物群落[3]。在山西老陈醋发酵过程中复杂的微生物体系产生了多种代谢物质,这些物质糅合在一起,构建了山西老陈醋的风味、营养基础[4]。微生物的种类及活性是山西老陈醋生产中重要影响因素之一,其发酵过程中微生物群落的多样性及演替规律是解析山西老陈醋酿造机理的关键因素[5]。
多年来,研究人员采用传统分离培养法[6]、变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)[7]和高通量测序[8]非培养法对山西老陈醋中参与发酵的真菌菌群进行了分析,发现山西老陈醋中的真菌种类丰富,主要包括酿酒酵母(Saccharomyces)、假丝酵母属(Candida)、毛霉属(Mucor)、木霉属(Trichoderma)等。研究表明,在酒精发酵阶段霉菌和酵母菌起主导作用[9-11]。山西老陈醋中的霉菌主要来源于大曲,霉菌代谢产生丰富的酶系分解了谷物原料中的淀粉和蛋白质等,为后续其他微生物的生长提供碳源[12-13]。在酒精发酵阶段,酵母菌可将糖转为乙醇,为醋酸发酵时醋酸菌产生乙酸提供基础[14]。另外,乙醇还可与乙酸、乳酸等反应生成酯类物质,是山西老陈醋风味的重要来源[15]。
目前,多有报道单一醋厂山西老陈醋发酵过程菌群结构及多样性的变化,缺少不同地区多醋厂间山西老陈醋酿造过程中菌群结构及多样性差异的研究。本研究从山西省6个不同醋厂(编号为A~F)分别采集山西老陈醋酒精发酵、醋酸发酵初期、中期、末期的酒醪和醋醅样品,采用Illumina HiSeq高通量测序技术内源转录间隔区对其酿造过程中真菌菌群多样性进行解析,对比不同厂间山西老陈醋酿造过程中真菌群落结构的变化,对进一步揭示山西老陈醋酿造机理以及实现发酵过程的精准控制具有重要的理论及实践意义。
1 材料与方法
1.1 样品采集
山西老陈醋(酒精发酵初期、中期、末期的酒醪样品和醋酸发酵初期、中期、末期的醋醅样品):取自国标GB/T 19777—2013《地理标志产品山西老陈醋》中保护范围内的6个典型醋厂(山西紫林醋业有限责任公司(A)、山西福源昌老陈醋有限公司(B)、进财醋业有限公司(C)、四眼井老陈醋有限公司(D)、宁化府益源庆醋业有限公司(E)、山河醋业有限公司(F))。酒醪样品采集:从随机3个搅匀后的酒精发酵缸或发酵罐中各取300 mL酒醪混匀;醋醅样品采集:从随机3个翻醅后的醋酸发酵缸或从翻醅后的醋酸发酵池首、中间、尾部距离池边30 cm处各取300 g醋醅混匀。以上样品置于无菌密封袋中-80 ℃保存备用。酒精发酵初期、中期、末期分别编号为Ji、Jm、Je;醋酸发酵初期、中期、末期分别编号为Ci、Cm、Ce。
1.2 仪器与设备
5714R Eppendorf 离心机:艾本德(中国)有限公司;170-4406小型水平电泳系统、Universial Hood Ⅱ凝胶成像系统、T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;NanoDrop2000微量紫外可见光分光光度计:美国ThermoScientific公司。
1.3 实验方法
1.3.1 扩增子测序分析
采用Illumina MiSeq高通量测序技术分析山西老陈醋酿造过程中真菌菌群结构及多样性。参考文献[16]进行醋醅基因组的提取,采用微量紫外-可见光分光光度计检测提取的基因组,其OD260nm/280nm值在1.8~2.0范围内,则表明该基因组质量合格,可用于后续测序。
真菌DNA片段扩增及测序:以提取的基因组DNA为模板,加入真菌对应区域特异性引物、PCR Master Mix对真菌ITS1区域进行扩增,得到长度为200 kb左右的扩增片段。真菌对应区域特异性引物为:ITS1F:(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS1R:(5'-GCTGCGTTCTTCATCGATGC-3')。扩增产物送至北京百迈克进行文库构建及测序。
1.3.2 数据分析
使用FLASH v1.2.7软件,通过overlap关系对各样品的reads进行拼接,即可得到原始Tags数据(Raw Tags),使用Trimmomatic v0.33软件,对拼接得到的Raw Tags进行过滤,得到高质量的Tags数据(Clean Tags),再使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags),最终用于划分操作分类单元(operational taxonomic units,OTU)、计算Shannon和Simpson指数、Chao1和ACE指数,以评估样品α多样性。
2 结果与分析
2.1 山西老陈醋酿造过程中真菌群落α-多样性分析
由表1可知,在酒精发酵阶段,6个厂山西老陈醋真菌菌群丰度及多样性整体上均呈下降趋势,在酒精发酵前期,酒醪中营养物质丰富,酵母菌大量繁殖,随着发酵进行,酒醪中乙醇含量增加,微生物生长受到抑制,其数量下降[6,17]。在酒精发酵初期,C、E、F厂的真菌菌群操作分类单元(OTU)个数较高,分别为108个、110个、137个,其真菌菌群丰度也较高,Chao1指数分别为105.50、119.43、141.50,ACE指数分别为106.75、117.20、143.46,D、E、F厂的真菌菌群多样性较高,Shannon指数分别为2.46、2.32、3.02,Simpson指数分别为0.15、0.18、0.09。在酒精发酵中期和末期,E、F厂的真菌菌群OTU个数较高,分别为111个、130个和96个、90个,其真菌菌群丰度及多样性也较高,Chao1指数分别为120.17、134.67和96.33、90.25,ACE 指数分别为116.20、133.90和96.51、90.95,Shannon指数分别为1.87、2.78和2.02、2.54,Simpson指数分别为0.32、0.12和0.28、0.16。
表1 山西老陈醋酒精发酵和醋酸发酵阶段真菌菌群多样性
Table 1 Fungal community diversity in alcohol and acetic acid fermentation stage of Shanxi aged vinegar
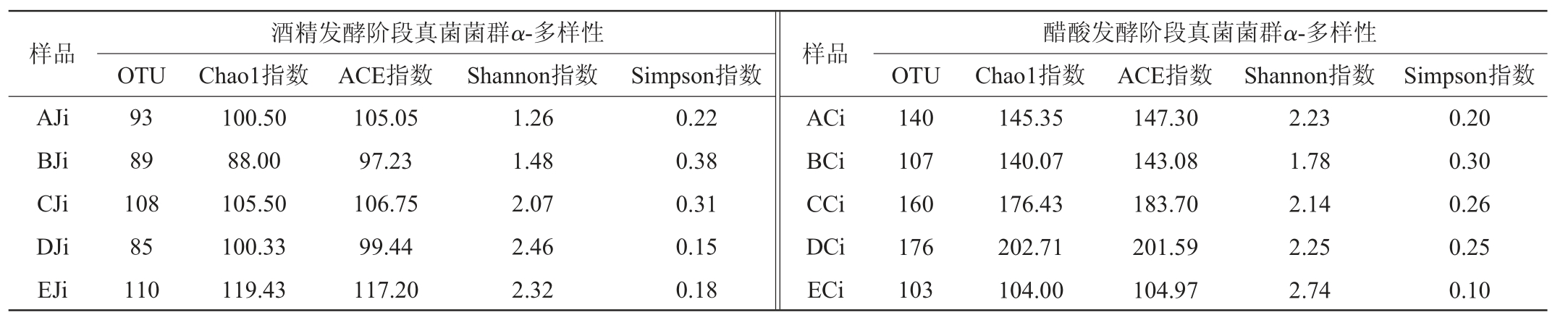
续表
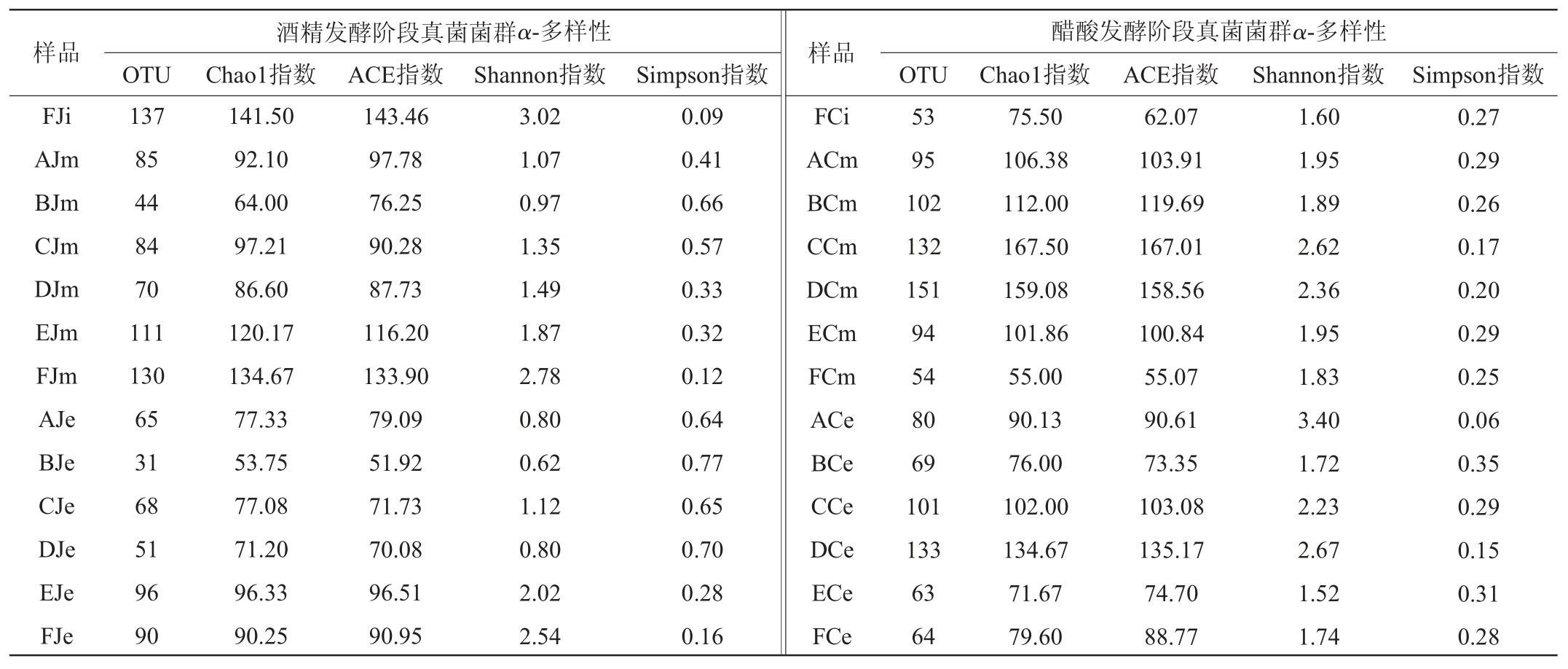
在醋酸发酵阶段,6个厂山西老陈醋的真菌菌群丰度整体上均呈下降趋势,这与张天震[8]研究结果一致。在醋酸发酵初期,A、C、D厂的OTU个数较高,分别为140个、160个、176个,其真菌菌群丰度也较高,Chao1指数分别为145.35、176.43、202.71,ACE指数分别为147.30、183.70、201.59,A、D、E厂的真菌菌群多样性较高,Shannon指数分别为2.23、2.25、2.74,Simpson指数分别为0.20、0.25、0.10。在醋酸发酵中期,C、D厂的OTU个数较高,分别为132个、151个,其真菌菌群丰度及多样性也较高,Chao1指数分别为167.50、159.08,ACE指数分别为167.01、158.56,Shannon指数分别为2.62、2.36,Simpson指数分别为0.17、0.20。在醋酸发酵末期,C、D厂的OTU个数及真菌菌群丰度仍较高,OTU分别为101个、133个,Chao1指数分别为102.00、134.67,ACE指数分别为103.08、135.17,A、D厂的真菌菌群多样性较高,Shannon指数分别为3.40、2.67,Simpson指数分别为0.06、0.15。
综上所述,E、F厂酒精发酵阶段的真菌菌群丰度及多样性均保持较高水平,在酒精发酵初期和中期,F厂的真菌菌群丰度及多样性均最高,酒精发酵末期,E厂真菌菌群丰度最高,F厂真菌菌群多样性最高。整体上C、D厂醋酸发酵阶段的真菌菌群丰度及多样性较高,在醋酸发酵初期,D厂真菌菌群丰度最高,E厂的真菌菌群多样性最高,在醋酸发酵中期,C厂的真菌菌群丰度及多样性均最高,在醋酸发酵末期,D厂的真菌菌群丰度最高,A厂的真菌菌群多样性最高。
2.2 山西老陈醋酿造过程中真菌菌群结构变化
2.2.1 酒精发酵阶段真菌菌群结构
通过高通量测序技术对6个不同醋厂酒精发酵前期、中期、末期酒醪样品进行测序,其真菌群落在门、属分类水平上的动态变化结果见图1。
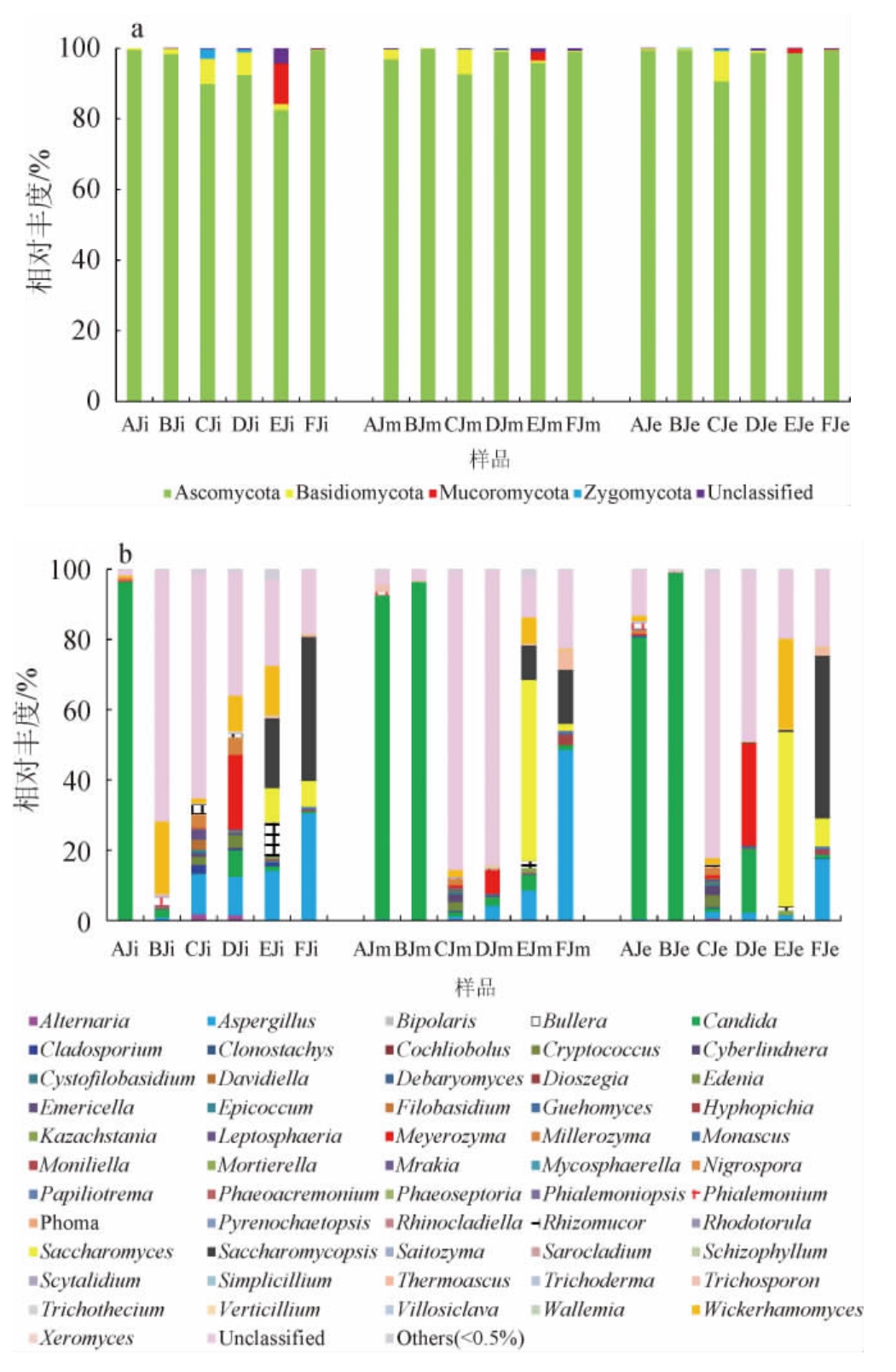
图1 山西老陈醋酒精发酵阶段真菌门和属相对丰度
Fig.1 Relative abundance of fungi phylum and genera in alcoholic fermentation stage of Shanxi aged vinegar
a为不同醋厂醋酸发酵真菌门水平群落相对丰度,b为不同醋厂醋酸发酵真菌属水平群落相对丰度;其他是指相对丰度<0.5%的真菌属。
由图1a可知,在6个不同醋厂的山西老陈醋酒精发酵阶段样品中共检测出4个真菌门,分别为:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota)和接合菌门(Zygomycota)。子囊菌门在整个酒精发酵阶段丰度最高,为各厂酒精发酵的优势真菌门,平均可占酒醪总真菌的96.25%。担子菌门和接合菌门的相对丰度较低,6个厂酒精发酵阶段样品中担子菌门和接合菌门的平均相对丰度分别为2.16%和0.26%,C厂的担子菌门在酒精发酵阶段分别为7.11%、7.09%和8.61%,高于其他5个醋厂。E和F厂中未检测到接合菌门,但毛霉菌门仅在这两个厂的样品中被检测到。黄润庭[18]在对湘西原香醋酿造过程的微生物群落的研究中发现,酒精发酵阶段子囊菌门的相对丰度较高,为65.33%。牟穰[19]对清爽型黄酒酿造过程微生物群落进行研究,发现麦曲和发酵液中主要真菌门为子囊菌门、担子菌门、接合菌门,发酵过程中优势菌门为子囊菌门,且发酵过程其相对丰度均>98%,优势菌属为曲霉属,其相对丰度在发酵过程中呈增加趋势。
由图1b可知,在6个不同醋厂的山西老陈醋酒精发酵阶段样品中共检测出56个真菌属,优势真菌属为假丝酵母属(Candida)、曲霉属(Aspergillus)、复膜孢酵母属(Saccharomycopsis)、酿酒酵母属(Saccharomyces)等,其平均相对丰度分别为27.99%、8.53%、7.40%、7.12%。在酒精发酵阶段,酵母菌为各厂的主要真菌,其可通过糖酵解途径生成乙醇,并且部分酵母菌还可分泌酶类,利用原料生成大量风味物质[20-21]。A、B厂在酒精发酵中期和末期时菌群结构较为相似,C、D厂在酒精发酵中期时菌群结构较为相似,E、F在酒精发酵初期时菌群结构较为相似。
假丝酵母属可通过葡萄糖代谢途径生成酯、酸、醛等风味物质[22]。A厂的假丝酵母属相对丰度较高,在酒精发酵阶段分别占总真菌的96.34%、92.10%、80.18%,整体上呈现下降趋势。B厂的假丝酵母属在酒精发酵初期相对丰度较低,仅为2.03%,但中、后期相对丰度上升,分别为96.40%、98.78%,A、B厂均以假丝酵母属为主要菌属。酿酒酵母属可通过代谢将葡萄糖转化为乙醇和CO2,是酒精发酵过程乙醇的主要来源[23],复膜孢酵母属可以分泌多种水解酶,如蛋白酶、纤维素酶、β-葡萄糖苷酶,促进了原料的分解以及风味物质的合成[24]。酿酒酵母属和复膜孢酵母属仅在E、F厂样品中被检测到,其相对丰度较高,属于这两个厂的优势菌属。在酒精发酵阶段,E的酿酒酵母属相对丰度呈先上升后下降趋势,分别占总真菌的9.77%、51.48%、49.76%,复膜孢酵母属则呈现下降趋势,分别占总真菌的19.84%、9.92%、0.63%。F厂的酿酒酵母属和复膜孢酵母属相对丰度在酒精发酵阶段均呈先下降后上升的趋势,相对丰度分别为:7.32%和41.00%、1.91%和15.42%、7.93%和46.32%。刘海坡等[25]采用三代测序技术分析了食醋酒精发酵过程微生物群落结构,发现该阶段主要真菌为酿酒酵母。DA H W等[26]对天然柿子醋发酵过程的微生物多样性进行了研究,结果表明,子囊菌门、担子菌门均在柿子醋醋酒精发酵和醋酸发酵过程中占优势,酒精发酵过程中酿酒酵母属、分枝孢子霉属、汉逊酵母菌属为主要菌属。
曲霉属可以代谢生成大量的糖化酶、蛋白酶[27],在糖化阶段及发酵过程有着重要作用。除了代谢生成丰富的酶系,一些霉菌还可以产生风味物质,如黄曲霉可利用木糖产生乙醇[28]。F厂的曲霉属相对丰度在酒精发酵阶段呈现先上升后下降的趋势,分别占总真菌的30.62%、48.66%和17.87%,明显高于其他醋厂,其次为E厂,其相对丰度分别为13.85%、8.53%和1.47%。李荣源等[29]采用高通量测序技术,对赤水晒醋各发酵阶段微生物群落进行了研究,发现在酒精发酵过程曲霉属和嗜热真菌属为优势真菌属。
2.2.2 醋酸发酵阶段真菌菌群结构
通过高通量测序技术对6个不同醋厂醋酸发酵前期、中期、后期醋醅样品进行测序,其真菌群落在门、属分类水平上的动态变化结果见图2。

图2 山西老陈醋醋酸发酵阶段真菌门和属相对丰度
Fig.2 Relative abundance of fungi phylum and genera in acetic acid fermentation stage of Shanxi aged vinegar
a为不同醋厂醋酸发酵真菌门水平群落相对丰度,b为不同醋厂醋酸发酵真菌属水平群落相对丰度;others是指相对丰度<0.5%的真菌属。
由图2a可知,在6个不同醋厂山西老陈醋醋酸发酵阶段共检测出4个真菌门:子囊菌门、担子菌门、毛霉菌门和接合菌门。子囊菌门在整个醋酸发酵阶段相对丰度最高,为各厂醋酸发酵的优势真菌门,平均可占醋醅总真菌的89.60%。各厂醋醅样品中担子菌门和接合菌门的平均相对丰度分别为:7.49%和0.04%。醋酸发酵前、中期A厂样品中的担子菌门分别占醋醅总真菌的45.44%、39.29%,明显高于其他5个醋厂。同酒精发酵阶段,E和F厂样品中仍未检测到接合菌门,毛霉菌门仅在这两个厂的样品中被检测到。
由图2b可知,6个不同醋厂山西老陈醋醋酸发酵阶段样品中共检测到56个真菌属,相对丰度较高的有链格孢霉属(Alternaria)、假丝酵母属(Candida)、分枝孢子霉属(Cladosporium)、曲霉属(Aspergillus)、酿酒酵母属(Saccharomyces)等,平均相对丰度分别为11.96%、10.76%、8.13%、6.81%、6.18%。相较于酒精发酵阶段,醋酸发酵阶段霉菌的相对丰度偏高。A、D厂在醋酸发酵中期菌群结构较为相似,C、D厂在醋酸发酵末期菌群结构较为相似,E、F厂在醋酸发酵过程中菌群结构较为相似。
链格孢霉属可通过代谢生成酚类、类固醇和含氮代谢物等[30],分枝孢子霉属可以分泌大量的纤维素酶[31],提高酿醋原料的利用率[32]。在醋酸发酵阶段,C厂醋醅中链格孢霉属的相对丰度明显高于其他5个醋厂,分别占总真菌的48.06%、10.26%、20.84%,呈先下降后上升的趋势。D和F厂醋醅中的分枝孢子霉属相对丰度较高,D醋醅中的分枝孢子霉属相对丰度整体上呈先下降后上升的趋势,分别占醋醅总真菌的44.01%、15.00%、23.34%,F厂醋醅中的分枝孢子霉属相对丰度整体呈下降趋势,分别占醋醅总真菌的20.05%、12.95%、5.02%。C和F厂醋醅中的曲霉属相对丰度较高,其整体上均呈先下降后上升的趋势,分别占醋醅总真菌的12.02%和15.48%、7.11%和14.43%、11.30%和32.53%。王宗敏[33]研究发现,镇江香醋醋酸发酵过程中曲霉属和链格孢霉属的相对丰度较大。李荣源等[29]研究表明,赤水晒醋醋酸发酵阶段优势真菌属为曲霉属和丝孢酵母属。
B厂的假丝酵母属在醋酸发酵阶段变化较大,其相对丰度分别为:60.09%、2.19%、47.68%,A、D厂中假丝酵母属的相对丰度变化趋势则与B厂相反,呈先上升后下降的趋势,在中期分别上升到34.43%和33.85%,后期又下降到1.39%和3.32%。同酒精发酵,酿酒酵母属仍仅在E和F厂的醋醅中被检测到,其在E厂醋酸发酵阶段的相对丰度较高,分别为34.26%、9.41%、48.94%。张永杰等[34]的研究表明,酿酒酵母和黑曲霉是醋醅中的优势真菌,发酵前期酿酒酵母的丰度显著高于发酵后期。
3 结论
对山西省不同地区6个醋厂山西老陈醋发酵过程中真菌菌群多样性进行研究,结果表明,在酒精、醋酸发酵阶段,6个厂真菌菌群丰度整体上均呈下降趋势,E、F厂酒精发酵阶段的真菌菌群丰度及多样性均保持较高水平,整体上C、D厂醋酸发酵阶段的真菌菌群丰度及多样性较高。山西老陈醋发酵过程中共检测出4个真菌门和56个真菌属,各醋厂在酒精发酵和醋酸发酵阶段优势菌门均为子囊菌门,酒精发酵阶段各厂优势属为假丝酵母属、曲霉属、复膜孢酵母属、酿酒酵母属等,醋酸发酵阶段优势真菌属为链格孢霉属、假丝酵母属、分枝孢子霉属、曲霉属、酿酒酵母属等。山西老陈醋酿造过程微生物种类繁多,对不同醋厂山西老陈醋的真菌菌落结构及多样性进行研究,有助于揭示山西老陈醋的酿造机理,对其品质及现代生物技术的提升有重要意义。
[1]TING X,BO Z,WEN H D,et al.Hepatoprotective efficacy of Shanxi aged vinegar extract against oxidative damage in vitro and in vivo[J].J Funct Food,2019,60(7):103448.
[2]TING X,JIN Z,JIA H Y,et al.Shanxi aged vinegar prevents alcoholic liver injury by inhibiting CYP2E1 and NADPH oxidase activities[J].J Funct Food,2018,47(6):575-584.
[3]YU Z,CUI M Z,XIAO W L,et al.Kinetics of predominant microorganisms in the multi-microorganism solid-state fermentation of cereal vinegar[J].LWT-Food Sci Technol,2022,159(4):113209.
[4]严蕊,王晓云.山西老陈醋传统酿造工艺写实记录[J].食品工程,2015,6(2):55-59.
[5]NIE Z,ZHENG Y,DU H,et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiol,2015,47(6):62-68.
[6]李雅茹.山西老陈醋源优良酵母菌和乳酸菌的筛选、互作及应用研究[D].晋中:山西农业大学,2019.
[7]刘聪.山西老陈醋醋醅中微生物多样性分析及高粱单宁对真菌生长的影响[D].太原:山西大学,2019.
[8]张天震.山西老陈醋微生物酿造机理及四大名醋指纹图谱差异性研究[D].晋中:山西农业大学,2019.
[9]孟燕华.利用高通量测序技术分析传统食醋酿造过程中的细菌多样性[D].太原:山西大学,2019.
[10]张天震,孙晓琪,刘丹彤,等.山西老陈醋大曲细菌群落结构及多样性研究[J].中国食品学报,2021,21(5):323-330.
[11]杨玲,刘春,彭佳伟,等.山西老陈醋和怀仁醋酒精发酵阶段细菌菌群多样性分析[J].中国酿造,2023,42(2):63-69.
[12]陈旭峰,刘丹彤,王佳丽,等.山西老陈醋大曲真菌群落结构及多样性分析[J].中国食品学报,2021,21(10):206-214.
[13]王佳丽.山西老陈醋大曲制备过程中微生物群落动态变化及优良霉菌的筛选[D].晋中:山西农业大学,2019.
[14]RA L N C,LISANDRO G S,MIGUEL A I.Performance of several Saccharomyces strains for the alcoholic fermentation of sugar-sweetened high-strength wastewaters:Comparative analysis and kinetic modelling[J].New Biotechnol,2016,33(9):874-882.
L N C,LISANDRO G S,MIGUEL A I.Performance of several Saccharomyces strains for the alcoholic fermentation of sugar-sweetened high-strength wastewaters:Comparative analysis and kinetic modelling[J].New Biotechnol,2016,33(9):874-882.
[15]KAI H,HONG Y Z,NATHALIA E,et al.The effects of cell-cell contact between Pichia kluyveri and Saccharomyces cerevisiae on amino acids and volatiles in mixed culture alcoholic fermentations[J].Food Microbiol,2022,103(11):103960.
[16]聂志强,韩玥,郑宇,等.宏基因组学技术分析传统食醋发酵过程微生物多样性[J].食品科学,2013,34(15):198-203.
[17]方冠宇.浙江玫瑰醋搅拌工艺及发酵过程中微生物与风味物质相关性研究[D].杭州:浙江工商大学,2018.
[18]黄润庭.湘西原香醋发酵过程微生物群落分析及其抗氧化作用探究[D].长沙:湖南农业大学,2016.
[19]牟穰.清爽型黄酒酿造微生物群落结构及其与风味物质相关性研究[D].无锡:江南大学,2015.
[20]黄魏,程平言,张健,等.酱香型白酒风味形成的影响因素及主体风味成分研究进展[J].酿酒科技,2020(4):85-93.
[21]戎梓溢,白茹,闫学娇,等.酱香型白酒酿造微生态中酵母菌的研究进展[J].食品研究与开发,2022,43(13):180-188.
[22]刘小改,马美荣,周林艳,等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造,2020,39(10):79-83.
[23]苏畅,马莹莹,杨建刚.扣囊复膜酵母在酿酒中的应用研究进展[J].食品研究与开发,2018,39(1):205-209,220.
[24]石馨,惠明,田青,等.异常威克汉姆酵母Y-1对模拟固态发酵白酒酒醅理化指标及风味的影响[J].中国酿造,2022,41(9):31-36.
[25]刘海坡,阚涛,刘彩霞.食醋酒精发酵阶段非挥发性风味物质及微生物群落结构解析[J].食品与发酵工业,2022,22(4):1654-1662.
[26]DA H W,MENG Y W,LU W C,et al.Changes and correlation of microo-rganism and flavor substances during persimmon vinegar fermentation[J].Food Biosci,2022,46(4):101565.
[27]LI P,LIN W F,LIU X,et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus,Pediococcus,Wickerhamomyces and Saccharomycopsis[J].Food Microbiol,2017,61:83-92.
[28]HUANG Y H,YI Z L,JIN Y L,et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese Nong-flavor liquor starter[J].Front Microbiol,2017,8:1747.
[29]李荣源,卢红梅,秦兴,等.高通量测序分析赤水晒醋各生产阶段微生物群落结构变化[J].食品科学,2020,41(24):78-86.
[30]LEE C,LI W,BANG S,et al.Secondary metabolites of the endophytic fungus Alternaria alternata JS0515 isolated from Vitex rotundifolia and their effects on pyruvate dehydrogenase activity[J].Molecules,2019,24(24):4450.
[31]李季蓉,杨红,刘晓辉,等.4株纤维酶产生菌的筛选及其酶活力测定[J].绿色科技,2019,12(24):215-217.
[32]申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[33]王宗敏.镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D].无锡:江南大学,2016.
[34]张永杰,崔宁波,张丽珍,等.基于DNA高通量测序分析生料酿醋过程中的真菌多样性[J].微生物学报,2020,60(7):1358-1369.