高盐稀态发酵是酱油的主要发酵方式之一,米曲霉(Aspergillus oryzae)将大豆等蛋白质含量高的原料分解,与不同浓度盐水混合持续数月到数年的酿造制成。A.oryzae生长的好坏影响酶的分泌与表达,将直接或间接影响酱油的感官及品质。盐胁迫培养A.oryzae,即使用含有不同盐浓度的马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基培养A.oryzae,米曲霉的干生物量与盐浓度成负相关,盐浓度达到15%时,生物量明显被抑制,生长60 h后基本进入稳定期[1]。同时发生相应的生理变化以适应环境胁迫[2]。在酱醪阶段,高浓度的盐会破坏细胞稳态,引起渗透和离子毒性,并干扰生物体的生理和生化过程。酱油中的关键基础酶主要由A.oryzae提供,蛋白酶与酱油独特风味的形成密切相关,降解碳水化合物类的酶可以为酱油带来更多的甜味[3-4]。蛋白质水解形成的多肽和氨基酸是美拉德反应的原料,也可能是形成的风味物质或风味前体。酱油大曲中蛋白酶活性与氯化钠浓度成负相关。这种现象导致了大豆蛋白的酶解所需时间的延长,从而延长了酱油的整体成熟时间[5]。盐可以抑制酱油中发酵有害菌生长,保证酱油食用安全性,但会抑制A.oryzae的正常生长,削弱蛋白酶活性,延长发酵周期[6]。在不改变酱油制作方式的前提下,有必要采取一定的方法提高原料的利用效率,缩短成熟过程的时间,提高最终酱油产品的质量。
本研究对A.oryzae在酱油发酵过程中的耐盐机制进行初步探索,解析在10%和20%的NaCl胁迫下A.oryzae转录组调控及蛋白组表达情况。采用理化分析以及微生物多样性检测方法,监测A.oryzae盐胁迫对酱醪发酵过程理化指标、微生物群落组成的影响。本研究可为揭示A.oryzae盐胁迫代谢机制以及A.oryzae盐胁迫对酱油发酵的影响奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
米曲霉(Aspergillus oryzae)As 3.042:天津科技大学菌种保藏中心;大豆、炒小麦:市售;种曲:广州致美斋食品有限公司。
1.1.2 化学试剂
17种氨基酸(天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、精氨酸(Arg)、赖氨酸(Lys)、酪氨酸(Tyr)、L-半胱氨酸(Cys)、缬氨酸(Val)、甲硫氨酸(Met)、苯丙氨酸(Phe)、异亮氨酸(Ile)、亮氨酸(Leu)、丙氨酸(Ala)、脯氨酸(Pro))混合标准溶液、α-淀粉酶活性酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒:北京索莱宝科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒:美国Thermo公司;16S核糖核酸(ribonucleic acid,RNA)引物、ITS RNA引物、TruSeq 脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶链式反应(polymerase chain reaction,PCR)样品制备试剂盒:北京诺禾致源科技股份有限公司;纤维素酶活性测定试剂盒:上海百生跃生物科技有限公司;E.Z.N.A
脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶链式反应(polymerase chain reaction,PCR)样品制备试剂盒:北京诺禾致源科技股份有限公司;纤维素酶活性测定试剂盒:上海百生跃生物科技有限公司;E.Z.N.A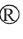 Soil DNAKit:美国奥美嘉生物技术公司。
Soil DNAKit:美国奥美嘉生物技术公司。
1.1.3 培养基
米曲汁培养基:参考ZHAO G Z等[7]的方法配制。121 ℃下灭菌20 min。
1.2 仪器与设备
Illumina NovaSeq 6000高通量测序仪:上海鲸舟基因科技有限公司;LDZM-80KCS-II立式压力蒸汽灭菌器:上海申安医疗器械厂;SupelcoA 300氨基酸分析仪:德国membra Pure GmbH公司;ZA220R4分析天平:上海赞维衡器有限公司;UV-1800紫外分光光度计:上海美谱达仪器有限公司;Varioskan LUX多功能酶标仪:赛默飞世尔科技公司;PHS-25型实验室pH计:上海电科学仪器股份有限公司。
1.3 方法
1.3.1 米曲霉培养
根据之前的研究所述[1],10%盐水条件是A.oryzae盐胁迫培养最优条件;此外,高盐稀态酱油通常使用20%盐水发酵,因此,实验组NaCl浓度设置为10%和20%,组别为10S和20S。米曲汁培养基中接种0.3 g/100 mL A.oryzae,28 ℃、120 r/min条件下振荡培养120 h。分别取0、24 h、36 h、48 h、72 h、96 h、120 h的100 mL培养液离心(8 000 r/min离心5 min)获得菌体,在105 ℃烘干至恒质量,测定菌体生物量。培养72 h后A.oryzae的生物量基本稳定,因此选用米曲汁培养基培养72 h时A.oryzae,离心(8 000 r/min离心5 min)获得菌体,在液氮存在的情况下研磨用于转录组和蛋白组分析。
1.3.2 大曲制作
原料为大豆和炒小麦。大豆与水按照料水比1∶5(g∶mL)于(28±5)℃条件下浸泡4 h,浸泡大豆与炒小麦按照质量比1∶1置于高压蒸汽灭菌锅中,连续通蒸汽10 min,然后121 ℃灭菌20 min。原料降温至37 ℃时接入0.3%的种曲,30 ℃培养8 h后进行一次翻曲,12 h后进行二次翻曲,36 h培养后完成大曲制作。
1.3.3 酱醪发酵
大曲和盐水按料水比1∶2(g∶mL)混合制成两组酱醪。实验组设置为①10S组:双阶段发酵(加入10%盐水预发酵发酵3 d,然后调节盐水浓度至20%,自然发酵90 d);②20S组:加入20%盐水(高盐稀态酱油发酵盐水浓度)自然发酵90d[8]。
1.3.4 转录组提取
按照HE B等[9]所述方法进行转录组测序。使用TRIzol(Invitrogen)方法从组织中提取总RNA。真核信使核糖核酸(messenger ribonucleic acid,mRNA)测序基于HiSeq平台。对特定时期特定真核组织或细胞的所有mRNA转录物进行测序。测序实验使用Illumina TruseqTM RNA sample prep Kit方法构建文库。基因表达水平是根据每千个碱基的转录每百万映射读取的片段(Fragments Per Kilobase of exon model per Million mapped fragments,FPKM)值测量。使用基因本体论(gene ontology,GO)(https://www.blast2go.com/)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路(https://www.kegg.jp/)注释差异表达的基因。
1.3.5 蛋白组提取
使用ZHAO G Z等[10]描述的方法确定蛋白质组。备用样品用液氮研磨成粉末。使用含有蛋白酶抑制剂的缓冲液(50 mmol/L Tris-HCl(pH 7.8)、0.3%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、200 mmol/L 二 硫 苏 糖 醇(dithiothreitol,DTT)、1 mmol/L苯甲磺酰氟(phenylmethanesulfonyl fluoride,PMSF)和1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA))从A.oryzae菌丝体中提取总蛋白。使用BCA蛋白检测试剂盒检测蛋白浓度。在还原、半胱氨酸烷基化和消化之后,根据标准程序进行蛋白质消化,并根据制造商的说明使用10-plex三聚硫氰酸(trithiocyanuric acid,TMT)试剂标记所得肽混合物。再用C18固相萃取脱盐后,将肽用于纳米液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析。所有鉴定的蛋白质使用KEGG进行注释。
1.3.6 酱醪理化性质测定
滤纸过滤发酵(0、3 d、6 d、10 d、20 d、40 d、60 d、90 d)酱醪,留滤液备用。发酵3 d的滤液用于测定酸性蛋白酶、中性蛋白酶、淀粉酶和纤维素酶。酸性蛋白酶和中性蛋白酶活参照GAO X等[11]的方法稍作修改:溶解在缓冲溶液中的2%酪蛋白作为酸性或中性蛋白酶的底物。缓冲系统是100 mmol/L乳酸钠缓冲液(pH 4.5)和100 mmol/L磷酸盐缓冲液(pH 7.2)。使用酶标仪在波长660 nm处监测上清液的吸光度值。蛋白酶酶活定义:在40 ℃条件下在1 mL反应溶液中每分钟释放1 μg酪氨酸的酶量为1个酶活单位(U/mL)。淀粉酶活性、纤维素酶活性:检测试剂盒测定;还原糖测定:采用3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)[12];可滴定酸、氨基酸态氮测定:采用甲醛滴定法[13]。游离氨基酸测定:采用氨基酸分析仪[14]。
1.3.7 微生物高通量测序
微生物高通量测序参考李树等[15-16]的方法,使用E.Z.N.A Soil DNA Kit从发酵5 d、10 d、30 d、60 d、90 d酱醪样品中提取微生物DNA。PCR系统扩增细菌16S rRNA V3-V4区基因序列和真菌ITS1区基因序列。细菌的引物是338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。真菌的引物是ITS1F(5'-CTTGGTTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')。根据Majorbio Bio-Pharm Technology Co.,Ltd.的标准方案,将纯化的扩增子在Illumina MiSeq平台上以等摩尔和配对末端测序(2×300)汇集。Quantitative Insights Into Microbial Ecology(QIIME,v1.8.0)用于处理测序数据[17]。此外,使用FLASH(v1.2.7,http://ccb.jhu.edu/software/FLASH/)组装成对末端读数[9]。通过UCLUST算法将高质量序列聚类为具有97%序列同一性的操作分类单元(operational taxonomic unit,OTU)。Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com/)用于细菌分类,NITE数据库(Release 5.0,https://unite.ut.ee/)用于真菌分类学[18]。
Soil DNA Kit从发酵5 d、10 d、30 d、60 d、90 d酱醪样品中提取微生物DNA。PCR系统扩增细菌16S rRNA V3-V4区基因序列和真菌ITS1区基因序列。细菌的引物是338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。真菌的引物是ITS1F(5'-CTTGGTTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')。根据Majorbio Bio-Pharm Technology Co.,Ltd.的标准方案,将纯化的扩增子在Illumina MiSeq平台上以等摩尔和配对末端测序(2×300)汇集。Quantitative Insights Into Microbial Ecology(QIIME,v1.8.0)用于处理测序数据[17]。此外,使用FLASH(v1.2.7,http://ccb.jhu.edu/software/FLASH/)组装成对末端读数[9]。通过UCLUST算法将高质量序列聚类为具有97%序列同一性的操作分类单元(operational taxonomic unit,OTU)。Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com/)用于细菌分类,NITE数据库(Release 5.0,https://unite.ut.ee/)用于真菌分类学[18]。
2 结果与分析
2.1 米曲霉盐胁迫发酵
基于转录组和蛋白质组的A.oryzae耐盐机制见图1。由图1a可知,在所有同时表达mRNA和蛋白质中,61.8%的mRNA和蛋白质水平存在显着差异。大多数(22.0%或964种蛋白质;第4和第6象限)仅显示蛋白质丰度的显著倍数变化,这意味着盐胁迫下大多数蛋白质的增加与转录或翻译无关。只有控制759种蛋白质表达的基因转录组发生了改变,而蛋白质没有受到影响。16.1%(658种蛋白质)的mRNA和蛋白质表达同时发生。由图1b可知,10S中A.oryzae的葡萄糖代谢强于20S,这有利于糖的转化利用,对维持盐胁迫下的生物活性有积极作用。α-淀粉酶基因在20S组中上调,耐盐微生物淀粉酶活性与盐浓度成正相关,盐可能促进A.oryzae对淀粉的初步水解[19]。β-葡萄糖苷酶在20S中表达量较高,促使纤维二糖或纤维寡糖在外切葡聚糖酶和内切葡聚糖酶的帮助下将纤维素分子水解成葡萄糖[20],而10S中的葡萄糖更容易经丙酮酸循环和三羧酸循环被代谢,葡萄糖的快速利用有利于A.oryzae生长。由图1c可知,基于KEGG Orthology(KO)功能分析差异表达基因(differentially expressed gene,DEG),差异通路集中在糖酵解、淀粉代谢、丙酮酸代谢、氮代谢、脂代谢的生物合成。之前的研究发现,钙调素在磷脂酰肌醇信号系统中表达,调节钙调神经磷酸酶(Calicineurin,CaN)信号通路以缓解A.oryzae的盐胁迫[21]。5'-磷酸吡哆醛合酶pdxT亚基(EC:4.3.3.6)的高表达促进了5-磷酸吡哆醛的合成。参与维生素B6代谢的基因表达可以增强A.oryzae对非生物胁迫的耐受性[22]。A.oryzae在10%盐浓度下糖代谢被促进,有利于A.oryzae生长。
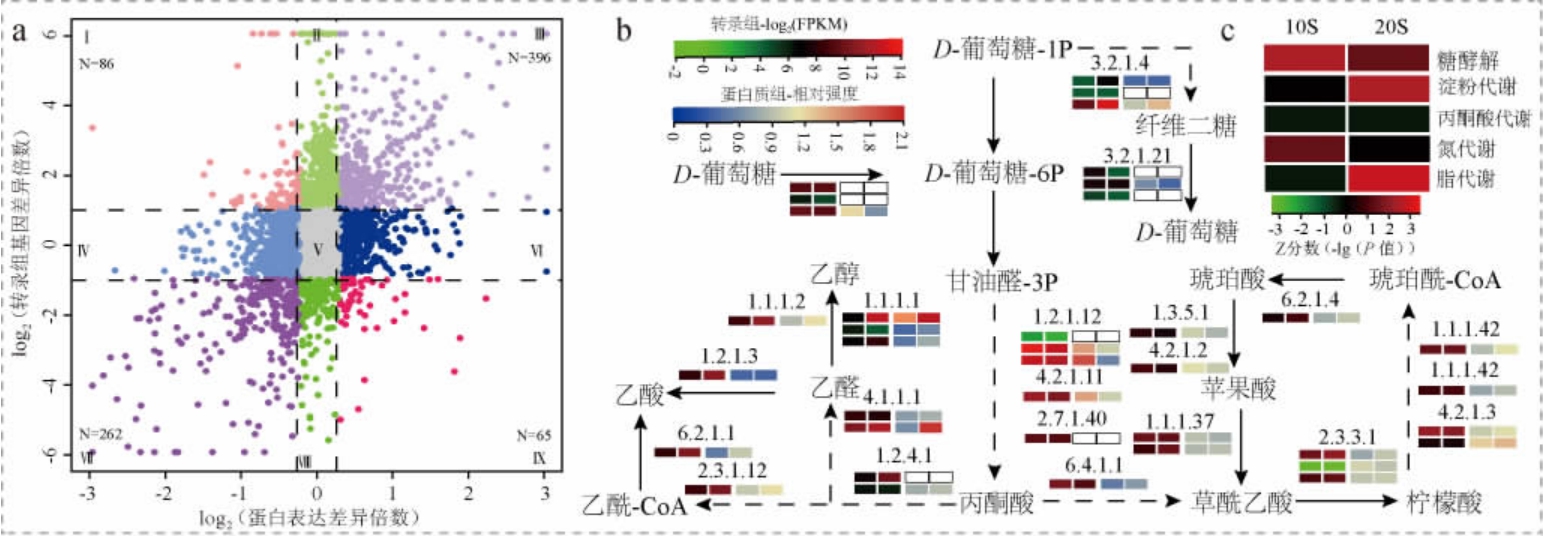
图1 米曲霉的转录组和蛋白组富集差异分析
Fig.1 Transcriptome and proteome enrichment differential analysis of Aspergillus oryzae
a:基于转录组-蛋白质组关联分析绘制的九象限图;b:中心碳代谢通路;c:差异基因KEGG代谢通路富集热图。
2.2 米曲霉盐胁迫对酱油发酵理化指标的影响
通过米曲汁培养试验,由表1可知,20%NaCl中A.oryzae的生物量明显低于10% NaCl。高浓度的NaCl会抑制酶活性[23]。
表1 酱油发酵过程中米曲霉的生物量测定结果
Table 1 Determination results of biomass of Aspergillus oryzae during soy sauce fermentation process
由表2可知,预发酵72 h时,酸性蛋白酶、中性蛋白酶活性在10%NaCl时更高,而淀粉酶和纤维素酶的酶活性两组差别不大。
表2 米曲霉的酶活性测定结果
Table 2 Determination results of enzyme activities of Aspergillus oryzae U/mL

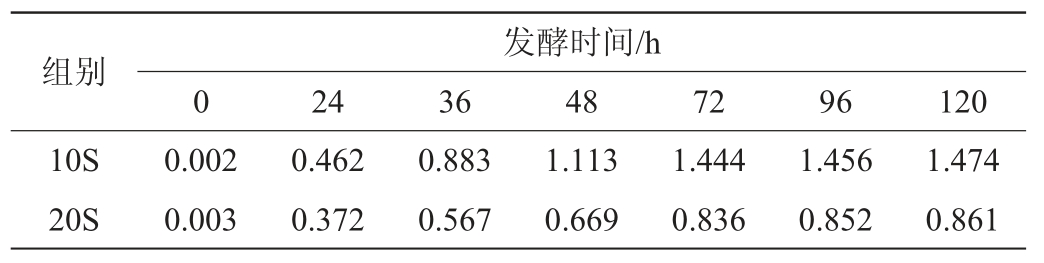
两种酱油发酵过程中的理化指标见图2。由图2可知,两组酱醪中的还原糖先增加后减少,总酸值均呈现上升趋势,pH呈现下降趋势,10S组的酸类物质生成更快。氮代谢集中在0~6 d,大豆蛋白主要被A.oryzae分泌的蛋白酶水解[24],10S组能快速增加氨基酸态氮,这对于后续发酵是有益的。氨基酸是酱油特殊风味的重要贡献者,也是各种挥发性风味化合物形成的潜在来源。
图2 酱油发酵过程中理化指标的变化
Fig.2 Changes of physical and chemical indexes during soy sauce fermentation process
a、b、c分别为10S组的总糖和还原糖、总酸和pH、总氮和氨基酸态氮;d、e、f分别为20S组的总糖和还原糖、总酸和pH、总氮和氨基酸态氮。
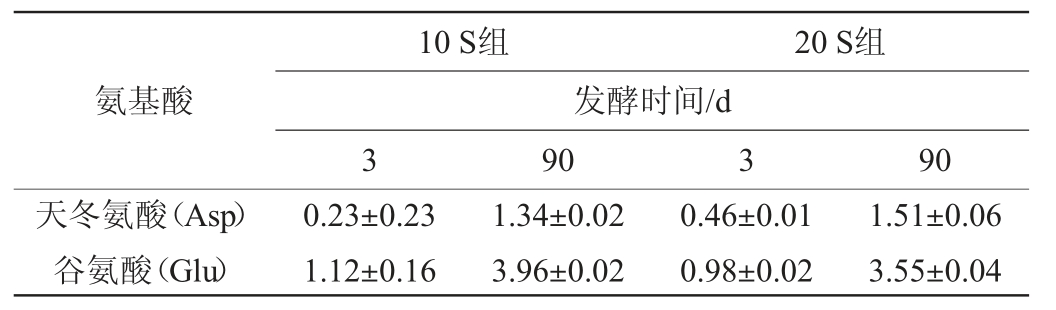
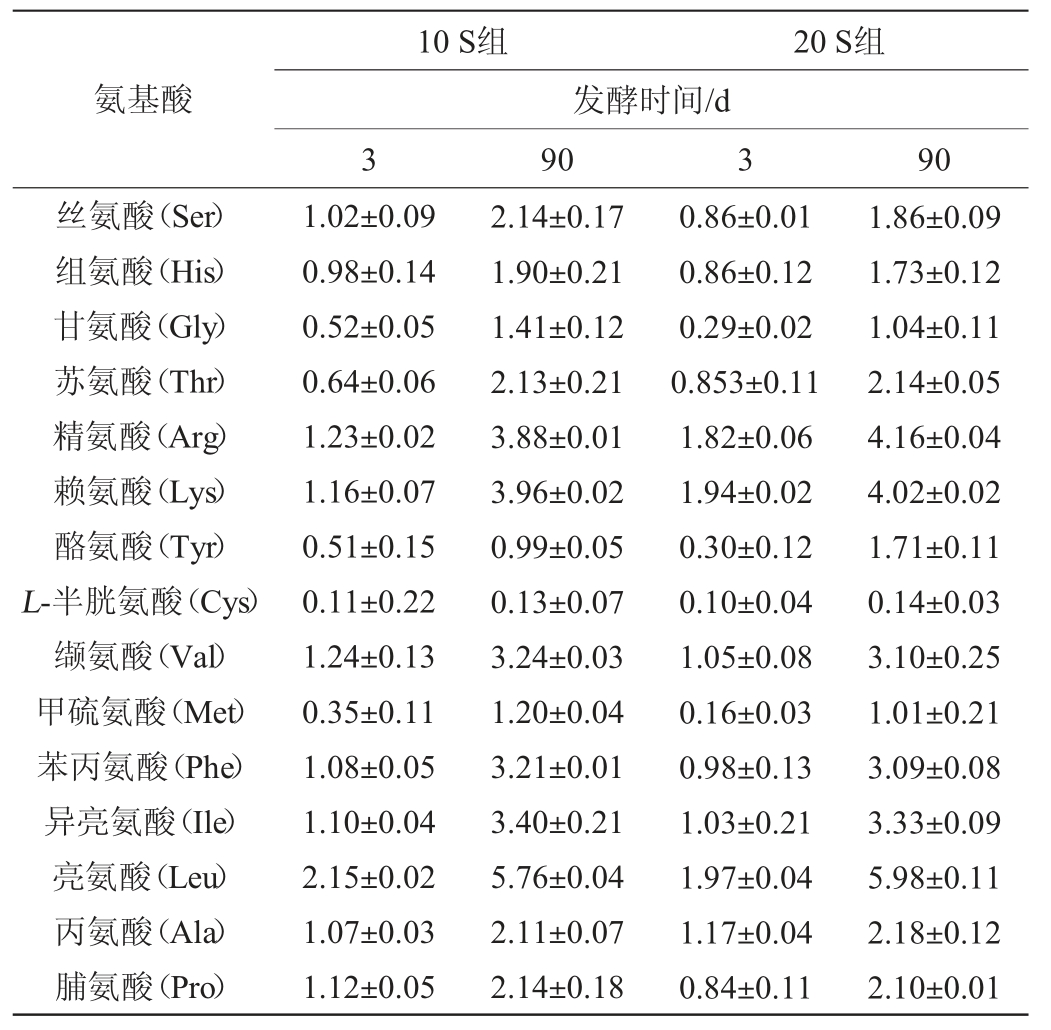
氨基酸分析结果见表3。缬氨酸的Strecker降解产生异丁醛和异戊醛等醛;芳香族氨基酸合成酚类物质;含硫氨基酸合成含硫化合物和呋喃;氨基酸和碳水化合物之间的美拉德反应会产生吡嗪[25]。由表3可知,在预发酵阶段,发酵3 d时10S组的游离氨基酸含量高于20S组,总游离氨基酸的增加主要因A.oryzae氨肽酶和蛋白酶的蛋白水解反应速率比氨基酸和挥发物或美拉德反应产物之间的转化速率更快。自然发酵开始,优势菌群的变化促进了氨基酸变化和风味化合物的形成[26]。在保证A.oryzae生物量的前提下,预发酵过程提高了A.oryzae的蛋白酶活性有助于在发酵过程中分解蛋白质。
表3 酱油发酵过程中氨基酸含量的测定结果
Table 3 Determination results of amino acid contents during soy sauce fermentation process g/L
续表
2.3 米曲霉盐胁迫对酱油发酵微生物多样性的影响
为了阐明A.oryzae在盐胁迫下是否对微生物群落造成影响,在发酵过程中收集了微生物悬浮液,测量了细菌和真菌的多样性,结果见图3。由图3可知,10S组的微生物演替弱于20S组,与10S组相比,20S组呈现出发酵延迟。经过预发酵后,发酵容易形成稳定的微生物群落,有利于酱油质量稳定。这可能与预发酵为优势微生物群创造更合适的生长环境有关。由图3a可知,10S组在菌群建立期(3 d)表现出最高的细菌属最多,而酱醪的高渗环境使耐盐微生物逐渐主导发酵环境。10 d时细菌多样性下降,耐盐优势细菌四球菌属(Tetragenococcus)和魏斯氏菌属(Weissella)占细菌相对丰度的90%以上。随后,微生物组成逐渐稳定,直至发酵结束。20S组细菌群落始终种类多样,发酵结束时,Tetragenococcus成为最主要的细菌。由图3b可知,10S组第3天,曲霉菌属是主要的真菌,之后接合酵母属(Zygosaccharomyces)成为主要真菌。20S的A.oryzae在发酵末期才褪去发酵优势,转换为Zygosaccharomyces。从多样性来看,预发酵促使A.oryzae集中供给所需酶,推动群落演替,缩短稳定群落的时间;而20S组可能需延长发酵时间以获得更稳定的微生物群落,完成发酵。
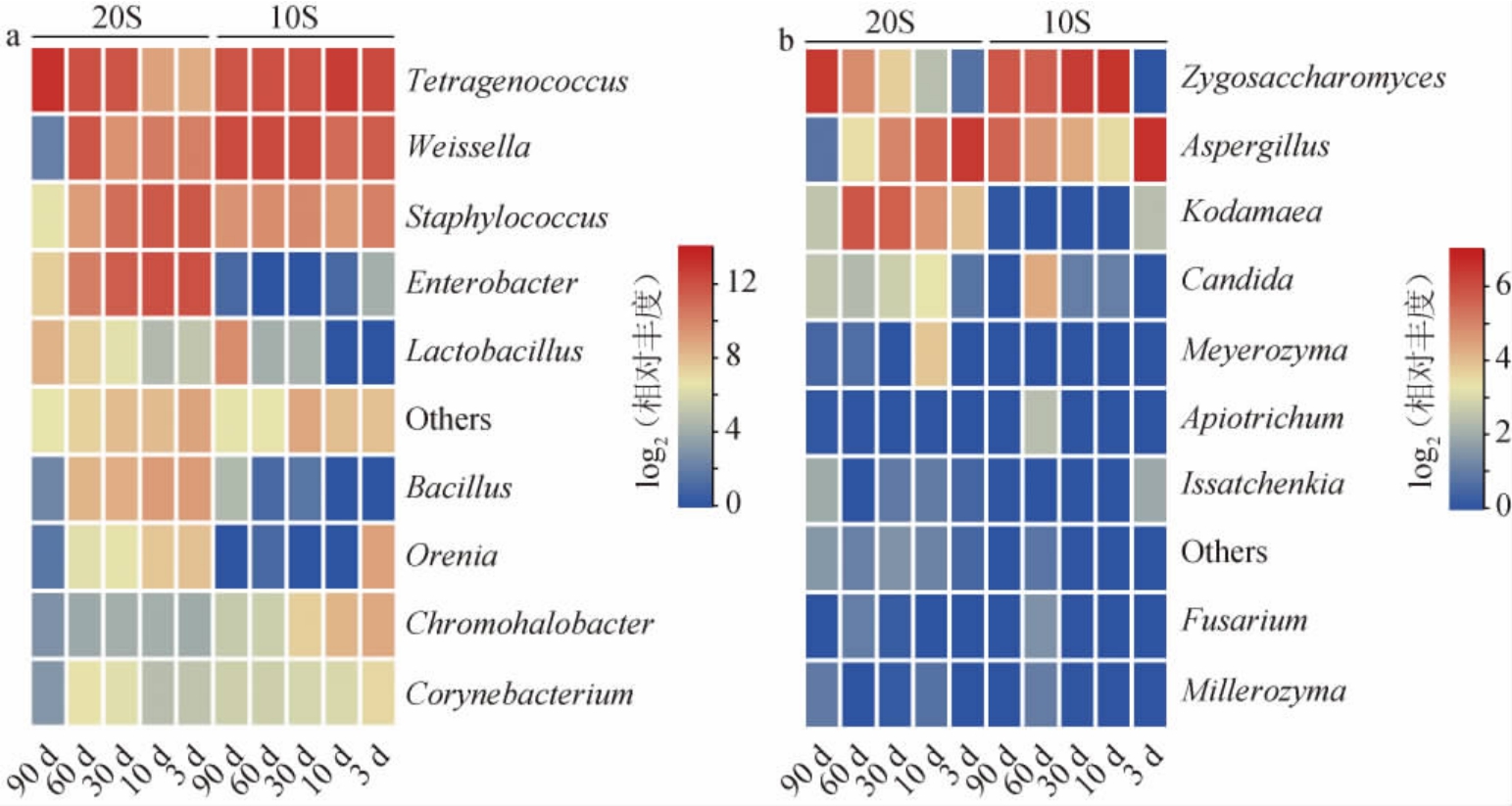
图3 基于属水平酱油发酵过程中细菌(a)和真菌(b)相对丰度变化
Fig.3 Changes of bacteria (a) and fungi (b) relative abundance based on genus level during soy sauce fermentation process
以模块化共发生网络可视化微生物菌群间的相互作用,结果见图4。由图4可知,10S组处于优势主导发酵生态位的Tetragenococcus、Weissella、Aspergillus、Zygosaccharomyces处于交互关联较弱的模块Ⅲ,他们之间相互影响小。因此,微生物菌群互作对于四个菌属演替影响小。高关联度的子囊菌门(Ascomycota)被认为是10S组核心发酵模块,这意味着非优势菌群以近亲协作共生的方式参与发酵,而优势菌群居于丰度优势可以通过单菌株代谢模式参与发酵。20S组模块化不明显,厚壁菌门(Firmicutes)作为主导菌群散布在模块Ⅱ和模块Ⅲ,与其他菌门相互交联,这意味着菌群间依赖性强,发酵状态受微生物组成影响强于理化因素。比较来看,10S组以真菌驱动发酵,20S组以细菌驱动,变形菌门在后者中丰度更高且与Tetragenococcus、Weissella、Staphylococcus、Bacillus、Lactobacillus、Zygosaccharomyces、Aspergillus存在较高关联度,Enterobacter在20S组前期具有发酵优势,可能存在发酵失败的风险。
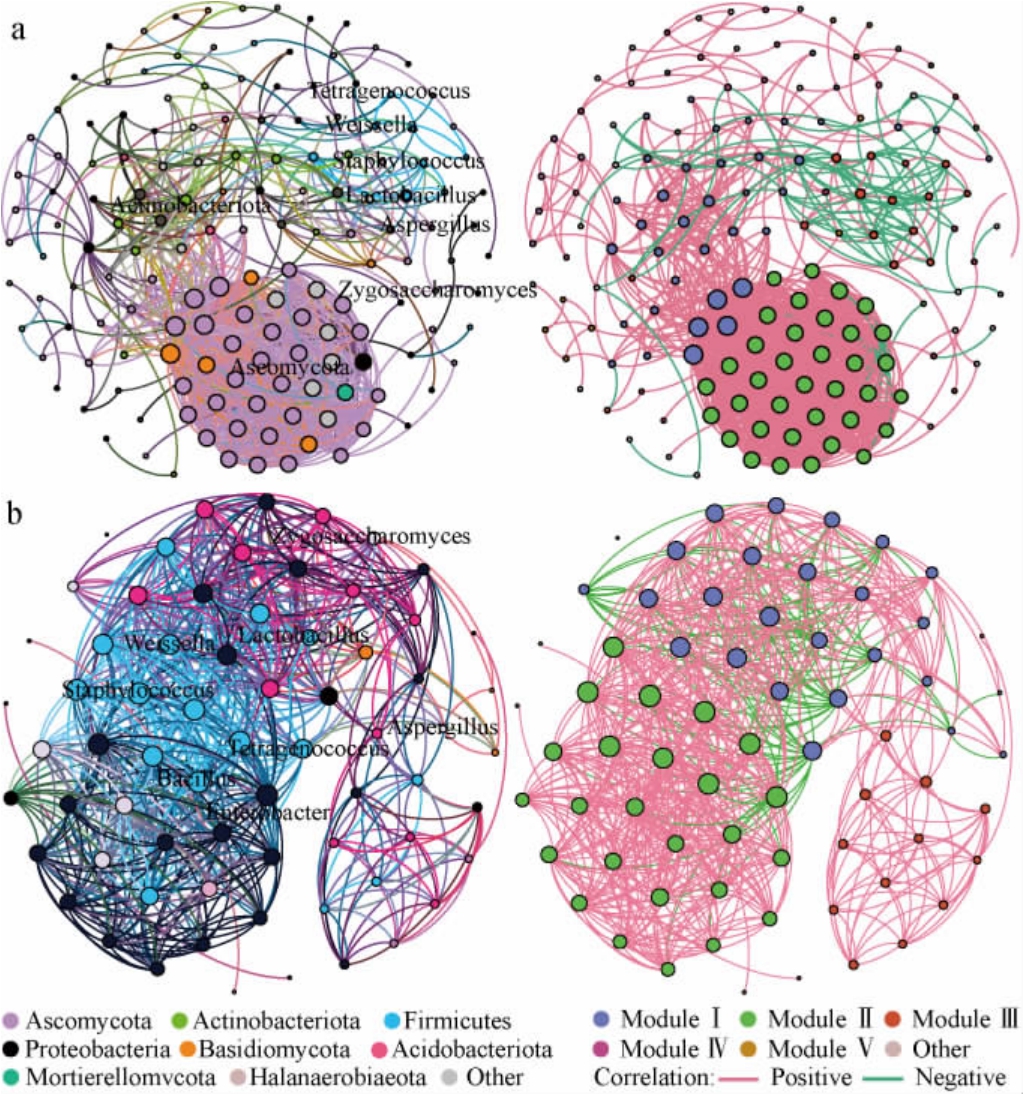
图4 酱油发酵微生物贡献网路比较
Fig.4 Comparison of microbial co-occurrence networks in soy sauce fermentation
3 结论
A.oryzae的预发酵可以在短时间内促进酱油中氨基酸态氮、有机酸的形成,以及促进还原糖的消耗;A.oryzae的预发酵调整了微生物群落结构,形成了更稳定的微生物群落以推动发酵过程。
[1]李浩然.盐胁迫下米曲霉的应答机制研究[D].南昌:江西科技师范大学,2019.
[2]SCHIMEL J,BALSER T C,WALLENSTEIN M.Microbial stress-response physiology and ITS implications for ecosysten function[J].Ecology,2007,88(6):1386-1394.
[3]倪海晴.提高酱油大曲酶活和改善酱油发酵效果的研究[D].无锡:江南大学,2010.
[4]路怀金.米曲霉的酶系特性及其对酱油风味品质影响研究[D].广州:华南理工大学,2020.
[5]SU N W,LEE M H.Purification and characterization of a novel salt-tolerant protease from Aspergillus sp.FC-10,soy sauce koji mold[J].J Ind Microbiol Biotechnol,2001,26(4):253-258.
[6]刘艳凤.米曲霉盐胁迫机制解析和耐盐蛋白酶分离纯化、酶学性质研究[D].无锡:江南大学,2018.
[7]ZHAO G Z,HOU L H,LU M F,et al.Construction of the mutant strain in Aspergillus oryzae 3.042 for abundant proteinase production by the N+ion implantation mutagenesis[J].Int J Food Sci Technol,2012,47(3):504-510.
[8]ZHOU X Y,GUO T,LU Y L,et al.Effects of amino acid composition of yeast extract on the microbiota and aroma quality of fermented soy sauce[J].Food Chem,2022,393133289.
[9]HE B,MA L,HU Z,et al.Deep sequencing analysis of transcriptomes in Aspergillus oryzae in response to salinity stress[J].Appl Microbiol Biotechnol,2018,102(2):897-906.
[10]ZHAO G Z,LIU C,LI S,et al.Exploring the flavor formation mechanism under osmotic conditions during soy sauce fermentation in Aspergillus oryzae by proteomic analysis[J].Food Funct,2020,11:640-648.
[11]GAO X,ZHANG J,LIU E,et al.Enhancing the taste of raw soy sauce using low intensity ultrasound treatment during moromi fermentation[J].Food Chem,2019,298:124928.
[12]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[13]ZHAO G,LI J,ZHENG F,et al.The fermentation properties and microbial diversity of soy sauce fermented by germinated soybean[J].J Sci Food Agr,2021,101(7):2920-2929.
[14]LI J,ZHAO A,LI D,et al.Comparative study of the free amino acidcompositions and contents in three different botanical origins of Coptis herb[J].Biochem Syst Ecol,2019,83:117-120.
[15]李树,刘冲,赵国忠,等.蘑菇酱油的细菌群落及挥发性风味特征[J].食品与发酵工业,2022,48(11):65-72.
[16]AI M,QIU X,HUANG J,et al.Characterizing the microbial diversity and major metabolites of Sichuan bran vinegar augmented by Monascus purpureus[J].Int J Food Microbiol,2019,292:83-90.
[17]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Meth,2010,7(5):335-336.
[18]ABARENKOV K,NILSSON R H,LARSSON K H,et al.The UNITE database for molecular identification of fungi-recent updates and future perspectives[J].New Phytol,2010,186(2):281-285.
[19]JOHNSON J,SUDHEER P D V N,YANG Y H,et al.Hydrolytic activities of hydrolase enzymes from halophilic microorganisms[J].Biotechnol Biopr Eng,2017,22(4):450-461.
[20]DÍAZ G G,SORIANO S J,AUGUR C,et al.Exopectinases produced by Aspergillus niger in solid-state and submerged fermentation: a comparative study[J].J Ind Microbiol Biotechnol,2001,26(5):271-275.
[21]MENDOZA I,QUINTERO F J,BRESSAN R A,et al.Activated calcineurin confers high tolerance to ion stress and alters the budding pattern and cell morphology of yeast cells[J].J Biol Chem,1996,271(38):23061-23067.
[22]BAGRI D S,UPADHYAYA D C,KUMAR A,et al.Overexpression of PDX-II gene in potato (Solanum tuberosum L.) leads to the enhanced accumulation of vitamin B6 in tuber tissues and tolerance to abiotic stresses[J].Plant Sci,2018,272:267-275.
[23]OREJANA F M,LISTON J.Agents of proteolysis and its inhibition in Patis(fish sauce)fermentation[J].J Food Sci,1982,47(1):198-203.
[24]LIANG Y,PAN L,LIN Y.Analysis of EXTRACELLULAR PROTEINS of Aspergillus oryzae grown on soy sauce koji[J].Biosci Biotechnol Biochem,2009,73(1):192-195.
[25]TOLDRÁ F,ARISTOY M C,FLORES M.Contribution of muscle aminopeptidases to flavor development in dry-cured ham[J].Food Res Int,2000,33(3):181-185.
[26]LIU Y,XU X L,ZHOU G H.Changes in taste compounds of duck during processing[J].Food Chem,2007,102(1):22-26.