“曲为酒之骨”,意为好酒有好曲[1]。大曲作为白酒酿造的粗酶制剂,其品质影响白酒的品质。然而,酒曲的生产是一种自然开放的固态发酵过程,需经过揭盖草帘、人工翻曲、开关门窗等一系列措施,人为地创造各种微生物生长所需的适宜环境,使自然环境中的各种微生物得以网罗富集,富集的微生物经过生长繁殖及代谢,形成了酒曲天然的酿酒粗酶制剂[2]。在白酒粮醅发酵过程中,酒曲利用自身富集的酶类将粮醅中大分子物质逐步降解为小分子物质,一部分小分子物质作为营养物质供后续演替变化的微生物生长代谢,另一部分可直接作为白酒呈香呈味物质的组成成分[3],故酒曲酶类直接影响白酒产品的品质。
大曲酶系的形成与霉菌密不可分,大曲中的霉菌可代谢产生各种酶类(如糖化酶、液化酶、蛋白酶、纤维素酶、果胶酶及酯化酶等),对大曲丰富酶系的形成具有重要贡献[4-7],大曲霉菌的相关研究受到广泛关注。李绍亮等[8]采用形态学结合分子生物学技术,分离鉴定了宋河高温大曲中的10株霉菌,并研究了霉菌的产酶性能结果发现,青霉属(Penicillium)、曲霉属(Aspergillus)、毛霉属(Mucor)和链格孢属(Alernaria)是宋河高温大曲的主要霉菌组成,且大部分霉菌具有代谢淀粉酶、蛋白酶、纤维素酶和酯化酶的功能。苏畅等[9]采用传统微生物培养技术,对泸州老窖不同时期浓香大曲中的霉菌进行分离鉴定,结果表明,大曲发酵过程中占优势的霉菌主要有红曲霉(Aspergillus ruber)、米根霉(Rhizopus oryzae)、微小根毛霉(Rhizomucor pusillus)等。朱治宇等[10]利用传统培养和18S rRNA基因测序方法,明确酱香大曲绝对优势霉菌属为横隔霉属(Lichtheimia)、曲霉属(Aspergillus)、青霉属(Penicillium)和嗜热子囊菌属(Thermoascus)。YANG H Y等[11]分离鉴定绍兴地区10种酒曲中的霉菌为横隔霉属(Lichtheimia)、曲霉属(Aspergillus)和根毛霉属(Rhizomucor),并明确了各霉菌属在不同地域酒曲中的分布情况。因此,酒曲菌群结构受大曲种类、制曲工艺、环境条件、地理位置、生产时期等多种因素的影响,不同来源大曲的霉菌种属及其结构组成也存在一定差异。目前,对于酒曲霉菌研究大多集中在南方酿酒产地,而北方酿酒产地尤其是河南产地鲜有报道,宋河中高温大曲是是河南地区酿酒大曲的典型代表,其霉菌组成未见报道。
本研究主要以不同储存期(4~7个月)的宋河中高温大曲为研究对象,采用形态学观察结合分子生物学技术对其进行鉴定,同时结合其理化指标确定宋河中高温大曲的最佳储存时间,以期为确定酒曲合理储存期提供科学依据,为河南地区中高温大曲霉菌的研究奠定基础。
1 材料与方法
1.1 材料与试剂
储存期为4、5、6、7个月的宋河中高温大曲和新曲:河南宋河酒业有限公司;Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')及ITS4(5'-TCCTCCGCTTATTGATATGC-3'):上海生工生物工程有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:广东中山百微生物技术有限公司;氯化钠、三羟甲基氨基甲烷、乙二胺四乙酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
FA1104精密电子天平:上海梅特勒集团;Zxdp电热恒温箱:上海智诚有限公司;MJX-250B-Z恒温培养箱:上海博迅实业医疗设备厂;CX31生物学显微镜:上海富莱光学科技有限公司;Labcycler聚合酶链式反应(PCR)仪:广州市华粤行仪器有限公司;DYY-BC电泳仪:北京市六一仪器厂;AI600超灵敏多功能成像仪:北京德泉兴业商贸有限公司;BCD-258WDPM冰箱:青岛海尔科技有限公司。
1.3 方法
1.3.1 霉菌的分离与纯化
分别取同一存储时间、不同存储位置(上、中、下)的大曲样品粉碎,过20目筛后称取10 g过筛曲粉加入90 mL无菌水中,25 ℃振荡混匀15 min,用无菌水进行梯度稀释,选取10-3、10-4、10-5三个稀释度,吸取菌液100 μL进行PDA平板涂布,待菌液完全渗透到PDA培养基后,将平板28 ℃倒置培养3 d。无菌条件下,挑取菌落特征明显不同的霉菌单菌落划线进行纯化,连续划线3次,直至获得纯种菌落,然后按照PDA培养基首字母P、储存月份和挑取菌株序号的形式对菌株编号,用25%~30%的甘油-80 ℃冰箱保藏。
1.3.2 霉菌的鉴定
形态学观察:采用透明胶带法制取霉菌样本,在干净的载玻片上滴一滴美兰染液,用透明胶带粘取培养基上的菌丝,将其放在染液上并固定,用普通光学显微镜的高倍镜对霉菌菌丝进行观察,记录霉菌菌丝形态特征,根据霉菌菌落特征及菌丝有无横隔、有无孢子囊、孢囊梗及孢子形状等特征并结合《微生物分类学》手册[12]对分离菌株进行形态学观察。
分子生物学鉴定:在已灭菌的离心管中加入500 μL氯化钠-三羟甲基氨基甲烷-乙二胺四乙酸缓冲液清洗菌体,然后12 000 r/min离心5 min,弃去上清,向离心管中加入100 μL三羟甲基氨基甲烷-乙二胺四乙酸缓冲液重悬菌体,菌悬液沸水浴10 min后冰浴10 min,12 000 r/min离心5 min,上清液中含有该霉菌基因组。以提取的霉菌基因组DNA为模板,采用ITS1、ITS4为引物进行PCR扩增,PCR扩增体系(40 μL):Taq Master Mix 20 μL,ITS1、ITS4各1 μL,DNA模板2 μL,加入双蒸水(ddH2O)16 μL补足。PCR扩增条件:94 ℃预变性4 min、94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,循环28次,72 ℃修复延伸10 min。然后将PCR扩增产物送至上海生物工程有限公司进行测序,测序结果拼接后上传至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取序列相似性>97%的菌株,采用MEGA7.0软件中的邻接(neighborjoining,NJ)法构建系统发育树。
1.3.3 大曲样品的理化指标检测
糖化力、发酵力、液化力、酯化力、酸度、水分的检测参考QB/T 4257—2011《酿酒大曲通用分析方法》。
2 结果与分析
2.1 霉菌的分离纯化及形态学观察
不同储存期宋河中高温大曲样品中分离霉菌的菌落与细胞特征见图1,不同储存期宋河中高温大曲样品中分离霉菌的形态特征描述见表1。由图1和表1可知,从不同储存期的宋河中高温大曲中共分离获得22株霉菌菌株,菌株P401和P601菌丝有横隔,无孢子囊,分身孢子梗呈帚状,初步判定为青霉属(Penicillium)。菌株P402、P407、P602、P603、P604、P605、P608和P614有横隔,无孢子囊,顶囊呈球形,初步判定为曲霉属(Aspergillus)。菌株P403、P408、P501、P506、P509、P607及P613无横隔,有孢子囊,菌落呈白色蛛网状,初步判定为毛霉属(Lichtheimia)。菌株P405、P502、P611及P612有横隔,无孢子囊及孢子囊梗,菌丝有颜色,初步判定为枝孢菌属(Cladosporium)。菌株P610有横隔,无孢子囊,链状分生孢子,菌落暗黑色,初步判定为链格孢属(Alternaria)。其中,从储存期为4个月的宋河中高温大曲中分离到6株霉菌(分别命名为P401、P402、P403、P405、P407、P408),储存期为5个月的宋河中高温大曲中分离到4株霉菌(分别命名为P501、P502、P506、P509),储存期为6个月的宋河中高温大曲中分离到12株霉菌(分别命名为P601、P602、P603、P604、P605、P607、P608、P610、P611、P612、P613、P614)。
表1 不同储存期宋河中高温大曲样品中分离霉菌的形态特征
Table 1 Morphological characteristics of mould isolated from Songhe medium-high temperature Daqu with different storage periods
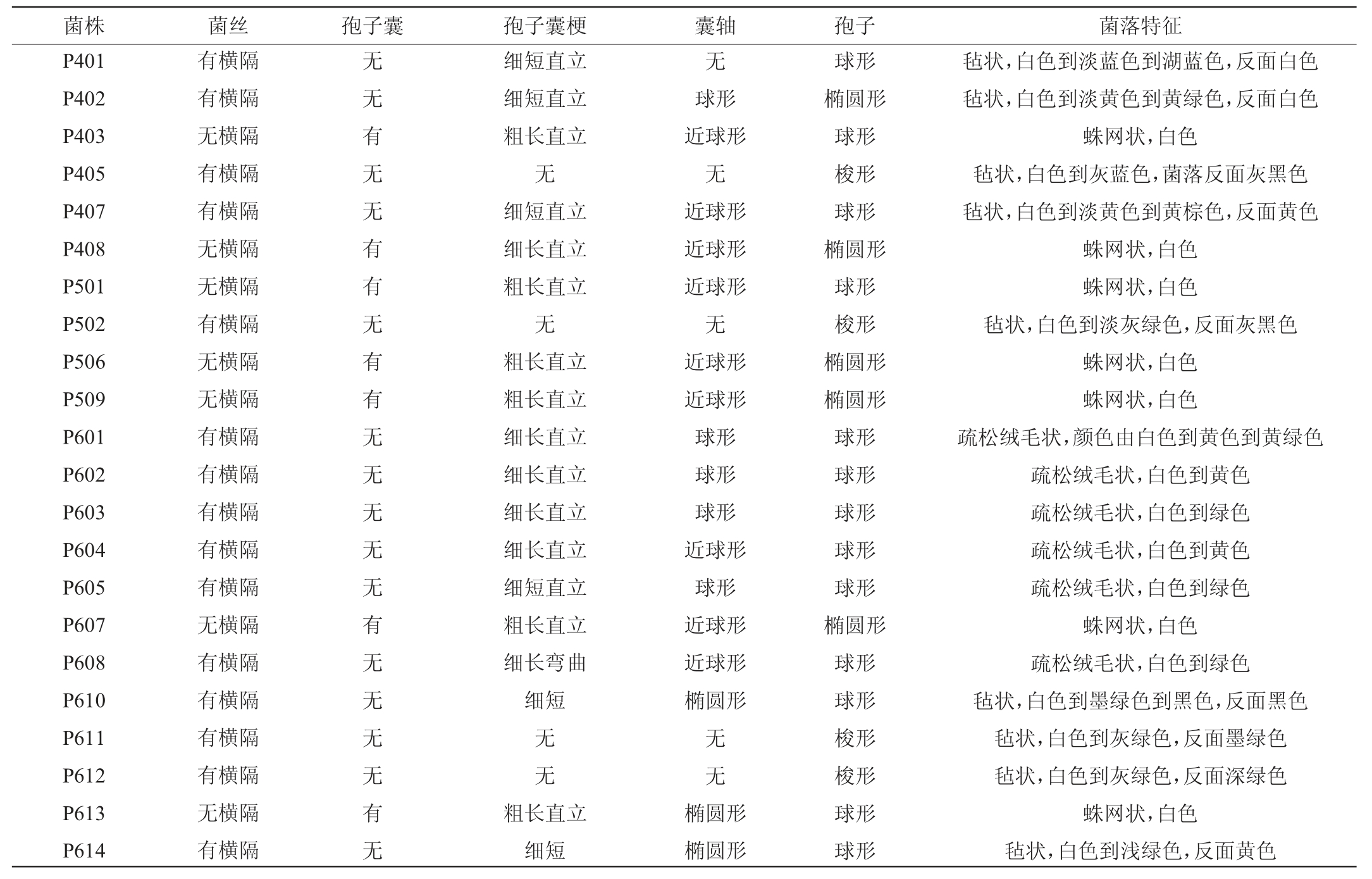

图1 不同储存期宋河中高温大曲样品中分离霉菌的菌落与细胞特征
Fig.1 Colony and cell characteristics of mould isolated from Songhe medium-high temperature Daqu with different storage periods
2.2 霉菌的分子生物学鉴定
提取霉菌的DNA后,用引物ITS1和ITS4代表霉菌菌株ITS基因扩增后的PCR产物琼脂糖凝胶电泳结果见图2。由图2可知,各霉菌菌株扩增条带明亮,均无杂带出现,PCR扩增产物长度均在400~1 000 bp之间,符合测序要求。
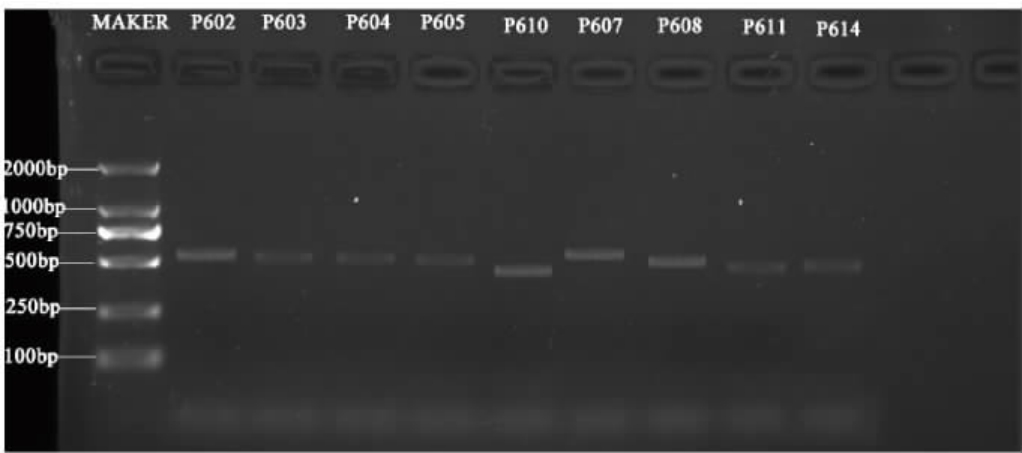
图2 代表霉菌菌株ITS基因PCR扩增产物电泳结果
Fig.2 Electrophoresis results of ITS gene PCR amplification product of representative mould strains
2.3 分离菌株的系统发育树分析
PCR扩增产物委托上海生物工程有限公司进行测序,测序结果经拼接提交至NCBI数据库,经过BLAST程序进行同源序列比较与分析,基于ITS序列构建分离菌株的系统发育树,结果见图3。
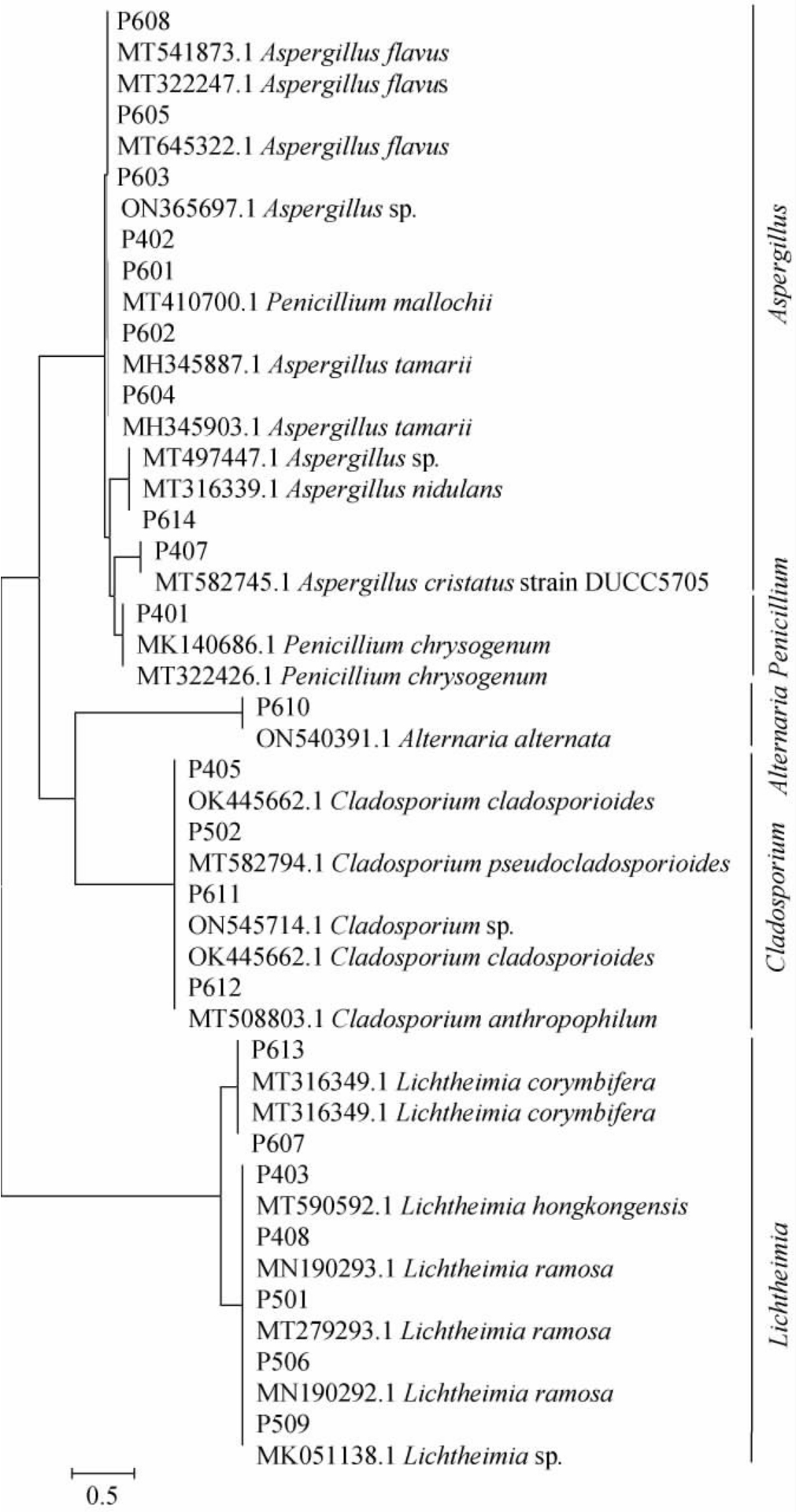
图3 基于ITS基因序列筛选菌株的系统发育树
Fig.3 Phylogenetic tree of screened strains based on the ITS gene sequences
由图3可知,菌株P608、P605、P603与黄曲霉(Aspergillus flavus)聚于一支,亲缘关系最近,序列相似性为100%,结合形态学特征与分子生物学鉴定结果,菌株P608、P605、P603被鉴定为黄曲霉(A.flavus);同理,菌株P602、P604被鉴定为溜曲霉(Aspergillus tamarii),菌株P614被鉴定为构巢曲霉(Aspergillus nidulans),菌株P407被鉴定为冠突曲霉(Aspergillus cristatus),菌株P402为曲霉菌(Aspergillus sp.),菌株P601被鉴定为锦葵青霉(Penicillium mallochii),菌株P401被鉴定为产黄青霉(P.chrysogenum),菌株P610被鉴定为链格孢菌(A.alternata),菌株P405、P611被鉴定为枝状枝孢菌(C.cladosporioides),菌株P502被鉴定为假枝孢枝孢霉(C.pseudocladosporioides),菌株P612被鉴定为嗜酸枝孢菌(C.anthropophilum),菌株P607、P613被鉴定为伞枝横梗霉(L.corymbifera),菌株P403被鉴定为香港横梗霉(L.hongkongensis),菌株P408、P501、P506被鉴定为多枝横梗霉(L.ramosa),菌株P509被鉴定为横梗霉(Lichtheimia sp.)。
由图3亦可知,储存4个月的宋河中高温大曲中鉴定到5种霉菌,为产黄青霉(P.chrysogenum)、冠突曲霉(A.crista tus)、枝状枝孢菌(C.cladosporioides)、香港横梗霉(L.hongkongensis)及多枝横梗霉(L.ramosa)。储存5个月的宋河中高温大曲中鉴定到2种霉菌,为假枝孢枝孢霉(C.pseudocladosporioides)、多枝横梗霉(L.ramosa),储存6个月的宋河中高温大曲中鉴定到8种霉菌,为黄曲霉(A.flavus)、溜曲霉(A.tamarii)、构巢曲霉(A.nidulans)、Penicillium mallochii、链格孢菌(A.alternata)、枝状枝孢菌(C.cladospo rioides)、嗜酸枝孢菌(C.anthropophilum)及伞枝横梗霉(L.corymbifera)。可见,储存期为6个月的宋河中高温大曲霉菌种类最为丰富,不同存储期的宋河中高温大曲中均含有枝孢属(Cladosporium)和横梗霉属(Lichtheimia)的霉菌,黄曲霉属(Aspergillus)和青霉属(Penicillium)的霉菌仅存在于存储期为4个月和6个月的宋河中高温大曲样品中,而链格孢属(Alternaria)仅在存储期为6个月的宋河中高温大曲中发现。
2.4 不同储存期宋河中高温大曲理化指标检测结果
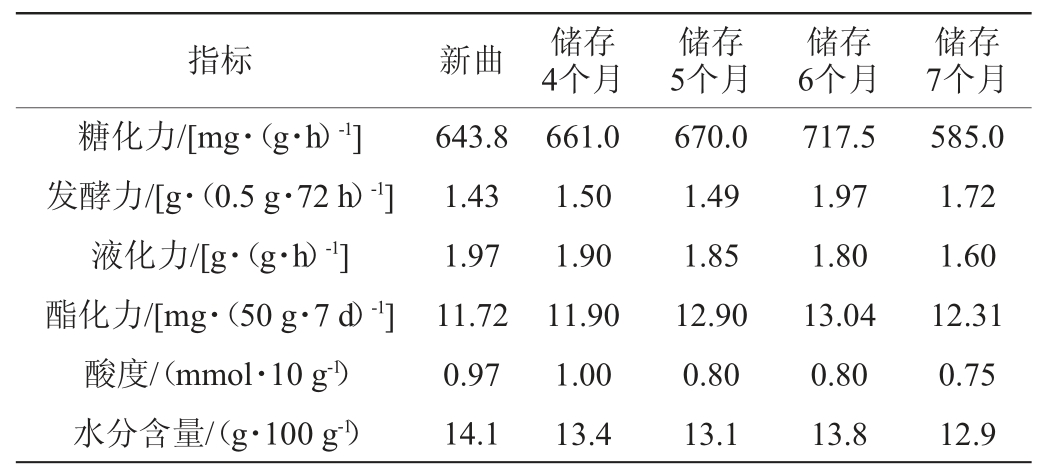
对新曲及存储期分别为4、5、6、7个月的宋河中高温大曲的糖化力、发酵力、液化力、酯化力、酸度及水分含量进行检测,测定结果见表2。由表2可知,宋河中高温大曲在储存时间为4~6个月时,糖化力、发酵力、酯化力逐渐增加,在储存6个月时达到最大值,分别为717.5 mg/(g·h)、1.97 g/(0.5 g·72 h)、13.04 mg/(50 g·7 d),当储存7个月时,糖化力、发酵力、酯化力逐渐下降;储存时间为4~7个月时,液化力、酸度及水分含量整体呈下降趋势,其中糖化力、发酵力、酯化力的增加在一定程度上可提高白酒的产量和质量,综合考虑,宋河中高温大曲在储存6个月时有助于提高曲酒的产量和质量。
表2 不同储存期酒曲理化指标检测结果
Table 2 Determination results of physicochemical indexes of Jiuqu with different storage periods
大曲中的霉菌可代谢产生淀粉酶、纤维素酶、酯化酶、蛋白酶等各种酶类。横梗霉属(Lichtheimia)和枝孢菌属(Cladosporium)是宋河中高温大曲的主要霉菌,其中横梗霉属(Lichtheimia)的多枝横梗霉(L.ramosa)、香港横梗霉(L.hongkongensis)和伞枝横梗霉(L.corymbifera)具有产生淀粉酶、脂肪酶的特性,枝孢菌属(Cladosporium)的枝状枝孢菌(C.cladosporioides)可产生纤维素酶。黄曲霉(A.flavus)可产生液化型淀粉酶、蛋白酶,溜曲霉(A.tamarii)可产糖化酶,冠突曲霉(A.cristatus)可产脂肪酶,这些酶与大曲糖化力密切相关。另外,黄曲霉(A.flavus)还具有合成己酸乙酯的能力,且部分青霉属(Penicillium)可产生酯化酶,这对大曲酯化力有一定的影响。储存6个月的宋河中高温大曲中存在黄曲霉(A.flavus)、溜曲霉(A.tamarii)枝状枝孢菌(C.cladosporioides)及伞枝横梗霉(L.corymbifera)等,霉菌种类最为丰富,这可能是储存6个月的宋河中高温大曲糖化力和酯化力最高的原因。
2.5 讨论
霉菌是酿酒大曲中的主要真菌类群之一。本研究发现横梗霉属(Lichtheimia)和枝孢菌属(Cladosporium)存在于储存4、5、6个月的宋河中高温大曲中。其中,在宋河中高温大曲中鉴定到的多枝横梗霉(L.ramosa)、香港横梗霉(L.hongkongensis)和伞枝横梗霉(L.corymbifera)均为横梗霉属(Lichtheimia)微生物,它们均为白酒酿造过程中常见微生物[12],具有产生淀粉酶、脂肪酶的特性[13];且伞枝横梗霉(L.corymbifera)对甾族化合物具有转化作用,对蛋白的分解能力强[14]。枝孢菌属的枝状枝孢菌(C.cladosporioides)具有代谢阿魏酸酯酶的功能,同时可产生包括生物碱类、聚酮类、大环内酯类、甾体和萜类等生物活性物质,还可产生高活性的纤维素酶[15-17]。假枝孢枝孢霉(C.pseudocladosporioides)能够产生葡聚糖酶,具有生物防治剂的潜力[18]。有文献报道,南方大曲(如四川、湖南等地域大曲霉菌)以曲霉属(Aspergillus)、横梗霉属(Lichtheimia)、毛霉菌属(Mucor)和根毛霉菌属(Rhizomucor)为主导,少有枝孢菌属(Cladosporium)[19]。因此,枝孢菌属(Cladosporium)与横梗霉属(Lichtheimia)是宋河大曲主要霉菌。
除了横梗霉属(Lichtheimia)和枝孢菌属(Cladosporium),本研究在宋河中高温大曲中还鉴定到黄曲霉(A.flavus)、溜曲霉(A.tamarii)、冠突曲霉(A.cristatus)及青霉属(Penicillium)等。黄曲霉(A.flavus)是中高温大曲中最为常见的曲霉属菌种,是一种小型丝状腐生真菌[20],具有产生液化型淀粉酶、蛋白酶及合成己酸乙酯的能力[21],但其中一些种具有产黄曲霉毒素的能力,尤其是黄曲霉毒素B,具有极强的毒性,能引起人和家畜家禽严重中毒以至死亡,且致癌能力很强[22]。溜曲霉(A.tamarii)具有代谢产生糖化酶、中性蛋白酶及产甘露醇、曲酸等特性[23]。冠突曲霉(A.cristatus)产脂肪酶的活性较高,同时具有产生抗氧化活性物质的能力[24]。青霉菌(Penicillium sp.)往往认为是白酒酿造过程中的污染菌和有害菌,会产生霉味和苦味,给白酒质量带来不利影响。然而,也有研究发现青霉菌中的产黄青霉(P.chrysogenum)可产生谷胱甘肽转移酶和有机酸如葡萄糖酸、柠檬酸等[25],部分青霉菌具有代谢纤维素酶、蛋白酶及酯化酶的能力[26]。但大部分的青霉菌可以产生青霉素,会抑制大曲中其他有益微生物的生长。因此,青霉菌在大曲生产中的数量组成,需要合理控制。
本研究从6个月存储的大曲中还分离到了1株链格孢菌(A.alternata)和1株构巢曲霉(A.nidulans)。有研究发现,链格孢菌可以高产纤维素酶,开发成为生防制剂,甚至一些链格孢菌可产生长春碱、紫杉醇等抗癌药物[27],而目前关于构巢曲霉(A.nidulans)功能作用的研究较为少见,有待进一步探索。
酿酒大曲中的霉菌是产生各种水解酶和酯化酶的主要微生物,其中水解酶的活力直接影响白酒的产量,酯化酶的种类和活性关系到白酒的质量和风格[28],因此,大曲糖化力、发酵力、酯化力是衡量大曲质量的重要理化指标。由不同存储期的宋河中高温大曲中鉴定到的霉菌结果可知,存储期为6个月的宋河中高温大曲中霉菌种类最为丰富,且由理化指标测定结果可知,宋河中高温大曲在储存6个月时糖化力和酯化力最高,这可能与此储存阶段丰富的霉菌种类有关,有利于提高曲酒的产量和质量。因此,宋河中高温大曲的最佳存储期为6个月。
3 结论
本研究采用传统的微生物培养技术从储存期为4、5、6个月的宋河中高温大曲分别获得6株、4株、12株共22株霉菌,经分子生物学鉴定获得5个不同属的14种不同霉菌,枝孢菌属(Cladosporium)和横梗霉属(Lichtheimia)存在于储存4、5、6个月的宋河中高温大曲中。存储期为6个月的宋河中高温大曲中鉴定到的霉菌种类最为丰富,含有5个不同属的8种不同霉菌,且该存储期的宋河中高温大曲糖化力、发酵力和酯化力最高,因此,储存6个月的宋河中高温大曲的品质较高。
[1]康承霞,张宿义,马蓉,等.浓香型白酒大曲微生物研究进展[J].酿酒科技,2017(5):88-92.
[2]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[3]朱治宇,黄永光.基于高通量测序对茅台镇酱香白酒主酿区霉菌菌群结构多样性的解析[J].食品科学,2021,42(8):150-156.
[4]周斐成,吴生文,朱庆圣,等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造,2019,38(4):58-64.
[5]WANG X D,BAN S D,QIU S Y.Analysis of the mould microbiome and exogenous enzyme production in Moutai-flavor Daqu[J].J I Brewing,2018,124:91-99.
[6]DENG Y K,HUANG D,HAN B L,et al.Correlation: between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Front Microbiol,2021,12:1-15.
[7]印丽,邱树毅,曹文涛,等.酱香型白酒核心产区大曲及分离霉菌酶活分析[J].现代食品科技,2021,37(3):1-8.
[8]李绍亮,李学思,侯小歌,等.宋河酒曲中主要霉菌的鉴定及其产酶特性的研究[J].酿酒,2016,43(6):24-29.
[9]苏畅,窦晓,叶新,等.基于ITS4/5 rRNA区序列对不同时期大曲中霉菌的分离与鉴定[J].现代食品科技,2018,34(3):54-58,211.
[10]朱治宇,黄永光.茅台镇酱香白酒不同轮次主酿区可培养霉菌种群结构多样性[J].食品科学,2020,41(22):184-192.
[11]YANG H Y,PENG Q,ZHANG H B,et al.The volatile profiles and microbiota structures of the wheat Qus used as traditional fermentation starters of Chinese rice wine from Shaoxing region[J].LWT-Food SciTechnol,2022,154:112649.
[12]向玉萍,邱树毅,曹文涛,等.酱香型白酒核心产区大曲中霉菌的分离及鉴定[J].食品与发酵科技,2021,57(2):56-65.
[13]郑自强,卫春会,张立伟.等.中高温大曲中霉菌的分离及其麸曲制备[J].现代食品科技,2022,38(1):165-172.
[14]徐占成,唐清兰,刘孟华,等.剑南春大曲曲药真菌群落结构的分析[J].酿酒,2015,42(4):13-16.
[15]刘双平,周志磊,孟祥勇,等.产阿魏酸酯酶的枝状枝孢霉筛选、发酵特性及在黄酒中应用研究[J].食品与生物技术学报,2018,37(8):793-801.
[16]何军,安凤秋,张兴,等.枝状枝孢菌(Cladosporium cladosporioides)发酵产酶培养基的响应面法优化[J].浙江大学学报(农业与生命科学版),2010,36(1):56-61.
[17]董锦润,李靖,陈玉惠,等.枝孢属真菌次生代谢产物中化学成分及其生物活性的研究进展[J].中草药,2021,52(19):6076-6087.
[18]TORRES D E,ROJAS-MARTÍNEZ R I,ZAVALETA-MEJÍA E,et al.Cladosporium cladosporioides and Cladosporium pseudocladosporioides as potential new fungal antagonists of Puccinia horiana Henn.,the causal agent of chrysanthemum white rust[J].PloS one,2017,12(1):e0170782.
[19]ZOU W,ZHAO C Q,LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Front Microbiol,2018(9):671.
[20]LIU J J,CHEN J Y,FAN Y,et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].J Sci Food Agr,2018,98(1):113-121.
[21]YAN S B,CHEN X S,GUANG J Q.Bacterial and fungal diversity in the traditional Chinese strong flavour liquor Daqu[J].J I Brewing,2019,125(4):443-452.
[22]张帅,马秀灵,李恒,等.郫县豆瓣加工过程中黄曲霉毒素B1的变化及关键控制点研究[J].中国酿造,2018,37(1):108-111.
[23]周庆伍,汤斌,李安军,等.基于纯种分离技术对古井贡酒桃花曲微生物进行分离鉴定的研究[J].酿酒科技,2016(3):37-41.
[24]周国庆,谭玉梅,王亚萍,等.响应面法优化“金花”菌培养基配方[J].山地农业生物学报,2018,37:27-32.
[25]BARREIRO C,GARACÍA-ESTRADA C.Proteomics and Penicillium chrysogenum: Unveiling the secrets behind penicillin production[J].J Proteomics,2019,198:119-131.
[26]刘鸿.青霉和链霉菌在浓香型大曲酒发酵中作用的研究[D].武汉:湖北工业大学,2011.
[27]谢红艳.我国部分区域链格孢属(Alternaria nees)真菌的资源调查与形态和分子鉴定研究[D].贵阳:贵州大学,2006.
[28]肖冬光.白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技,2022(9):17-24.