白酒是一种起源于中国的传统发酵酒精饮料,通常经自然发酵获得,在国内外享有很高的声誉,是中国饮食档案的重要组成部分[1]。中国白酒的主要技术特征是酒曲酿酒,酒曲作为酿酒的糖化发酵剂与生香剂,受微生物菌群的影响和相互作用,品种众多[2]。大曲则是酒曲的典型代表,小麦是其主要原料,在酿造过程中常作为微生物制剂、酶制剂等[3]。
霉菌作为大曲中主要的菌种之一,产生的糖化酶可将淀粉中的α-1,4糖苷键和α-1,6糖苷键切断,促使小麦中的淀粉转化成可发酵性糖[4],促进酯类物质形成,其代谢产物会赋予白酒一定的风味[5]。因此,产糖化酶能力是评判酒曲质量的重要指标之一,而直接在酒曲中添加商品糖化酶制剂则会引起淀粉水解快、发酵速度快、酒质下降等问题[6]。故此,筛选出以霉菌代谢产生糖化酶的菌株,不影响正常的发酵过程,且对提高白酒品质具有重要意义。近年来,关于不同香型[7-8]、不同酒曲[9-10]中高糖化力霉菌产酶能力的研究较多,然而,涉及清香型大曲中高糖化霉菌的筛选及其风味物质的研究较少。
本研究通过传统培养分离方法从清香型大曲中分离和筛选高糖化力霉菌,采用形态观察及分子生物学技术对其进行菌种鉴定,并采用顶空固相微萃取结合气质联用法(headspace solid phase microextraction-gas chromatographymass spectrometrometry,HS-SPME-GC-MS)探究其代谢物中的挥发性风味物质,为其在清香型白酒生产中的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清香型大曲:北京顺鑫农业股份有限公司牛栏山酒厂。
1.1.2 试剂
葡萄糖、淀粉、酵母浸粉、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;NaCl、NaOH、(NH4)2SO4、I2、碘化钾、乙酸钠、冰乙酸、柠檬酸、柠檬酸钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、结晶苯酚、Na2SO3、酒石酸钾钠等(均为分析纯):国药集团化学试剂有限公司;三氯甲烷、异丙醇、氯仿、醋酸钾、无水乙醇(均为分析纯):北京化工厂;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS):上海生工生物工程有限公司;乳酸酚棉蓝染色液:青岛高科技工业园海博生物技术有限公司;乙酸正戊酯(色谱纯):上海安谱实验科技股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:宝日医生物技术有限公司;琼脂粉(生化试剂):北京索莱宝科技有限公司;真菌DNA提取试剂盒、Taq PCR Master Mix、聚合酶链式反应(polymerase chain reaction,PCR)产物回收纯化试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
酵母氮源基础(yeast nitrogen base,YNB)培养基:青岛高科技工业园海博生物技术有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[11]:马铃薯(去皮)200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH值自然,含氯霉素(25 mg/mL),115 ℃高压蒸汽灭菌30 min。PDA液体培养基中不添加琼脂。
筛选培养基[12]:可溶性淀粉2.5 g/L,葡萄糖2.5 g/L,琼脂15 g/L,115 ℃高压蒸汽灭菌30 min后添加YNB培养基6.7 g/L。
麸皮培养基[13]:麸皮10 g,蒸馏水15 mL,121 ℃高压蒸汽灭菌1 h,重复两次灭菌。
1.2 仪器与设备
DT-2002A型电子天平:常熟市佳衡天平仪器有限公司;BSC-1000A2生物安全柜:上海博讯医疗生物仪器股份有限公司;C1000快速梯度基因扩增仪、Powerpac Basic基础型水平电泳仪、GelDoc XR+BIO-RAD全自动凝胶成像仪:美国Bio Rad公司;Centrifuge 5424离心机:德国EPPENDORF(艾本德)股份公司;SPX-430型生化培养箱:宁波江南仪器厂;Infinite 200 Pro多功能微孔板酶标仪:奥地利Tecan有限公司;ZEISS正置生物显微镜Primo Star:卡尔蔡司(上海)管理有限公司;Agilent 7890B气相色谱(gas chromatography,GC)仪(配带火焰离子化检测器(flameionization detector,FID)、DVB/CAR/PDMS萃取头(2 cm~50/30 μm)、HP-5MS石英毛细管色谱柱(30 m×0.25 mm×0.50 μm):美国安捷伦公司。
1.3 方法
1.3.1 大曲中霉菌的分离纯化
将大曲曲块粉碎后四分法混合均匀,过40目筛。称取10 g 大曲溶于加有灭菌玻璃珠的90 mL无菌水中,充分振荡30 min,按10倍梯度系列稀释至10-6,将稀释液涂布于PDA培养基,置于28 ℃下恒温培养2~3 d,挑选单菌落纯化,重复操作3次,转移至PDA液体培养后,-80 ℃甘油保藏[14]。
1.3.2 高糖化力霉菌的筛选
初筛:将分离纯化后的菌株呈“品”字型均匀接种于筛选培养基上,28 ℃培养2~3 d,向培养皿中加入适量碘液染色。静置,测定透明圈直径大小(D)和菌落直径大小(d),并计算水解圈(hydrolysis circle,HC)值(HC=D/d),选择HC值较大的菌株进行复筛。
复筛:将初筛得到的菌株经斜面活化后,用无菌去离子水稀释至孢子数为107 CFU/mL,按0.3%(V/V)的接种量接种于麸皮培养基中,28 ℃培养72 h,测定糖化力,筛选具有高糖化力的菌株。
1.3.3 糖化力的测定
采用DNS试剂法测定糖化力[15]。
1.3.4 高糖化力霉菌的鉴定
形态学鉴定:采用插片法对复筛霉菌的菌落形态及显微形态结构进行观察,参考《真菌鉴定手册》[16]及相关文献[17],初步确定菌株分类。
分子生物学鉴定:采用SDS-酚氯仿抽提法[18]提取复筛菌株的DNA,以其为模板,采用引物β-tublinlα-F(5'-TTCC CCCGTCTCCACTTCTTCATG-3')和β-tublinlα-R(5'-GACGAGATCGTTCATGTTGAACTC-3')对复筛菌株的β-微管蛋白基因BenA进行PCR扩增[19]。PCR扩增体系:引物β-tublinlα-F和β-tublinlα-R均1 μL,模板(基因组)2 μL,Taq PCR Master Mix 25 μL,超纯水21 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性1 min,53 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检验合格后,委托北京爱科嘉生物科技有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源序列搜索,选取同源性较高的模式菌株的BenA基因序列,采用Mega5.1软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 纯种麸曲的制备
将筛选得到的霉菌接种到PDA液体培养基中,30 ℃培养至孢子数为106 CFU/mL后,按照5%(V/V)的接种量接种于麸皮培养基中,以未接种霉菌的空白麸皮培养基作为对照,30 ℃恒温培养72 h得到纯种麸曲[20]。
1.3.6 挥发性风味成分分析[21]
样品前处理:称取2.00 g麸曲置于20 mL顶空瓶中,加入10 μL乙酸正戊酯(10 mg/L)作为内标,60 ℃水浴平衡20 min,顶空萃取吸附30 min,进行GC-MS分析。
GC条件:不分流进样模式,载气为高纯度氦气(He)(纯度>99.999%),流速1.0 mL/min,进样温度250 ℃,热解吸5 min;升温程序:初始50 ℃保持2 min,以12 ℃/min的升温速度升至300 ℃,保持10 min。
MS条件:全扫描模式(SCAN),质量扫描范围45~450 amu;电子电离(electron ionization,EI)源,电子能量70 eV;传输线、离子源和四极杆的温度分别设置为250 ℃、230 ℃和150 ℃。
定性定量分析:使用Wiley数据库鉴定每种化合物,选择正负匹配度>800的化合物;采用内标法定量。
1.3.7 数据处理
所有统计分析均使用SPSS 23.0软件进行,并采用单因素方差分析比较均值,P<0.05水平上的数据具有显著性差异;利用Origin 2019软件绘制离子色谱图;采用R语言(pheatmap包)[22]绘制挥发性成分聚类热图。所有样品重复测定3次,结果用“平均值±标准差”表示。
2 结果与分析
2.1 高糖化力霉菌的分离及筛选
2.1.1 分离及初筛结果
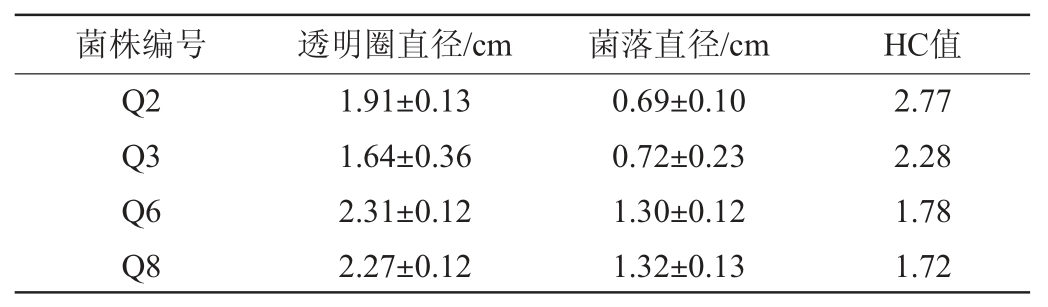
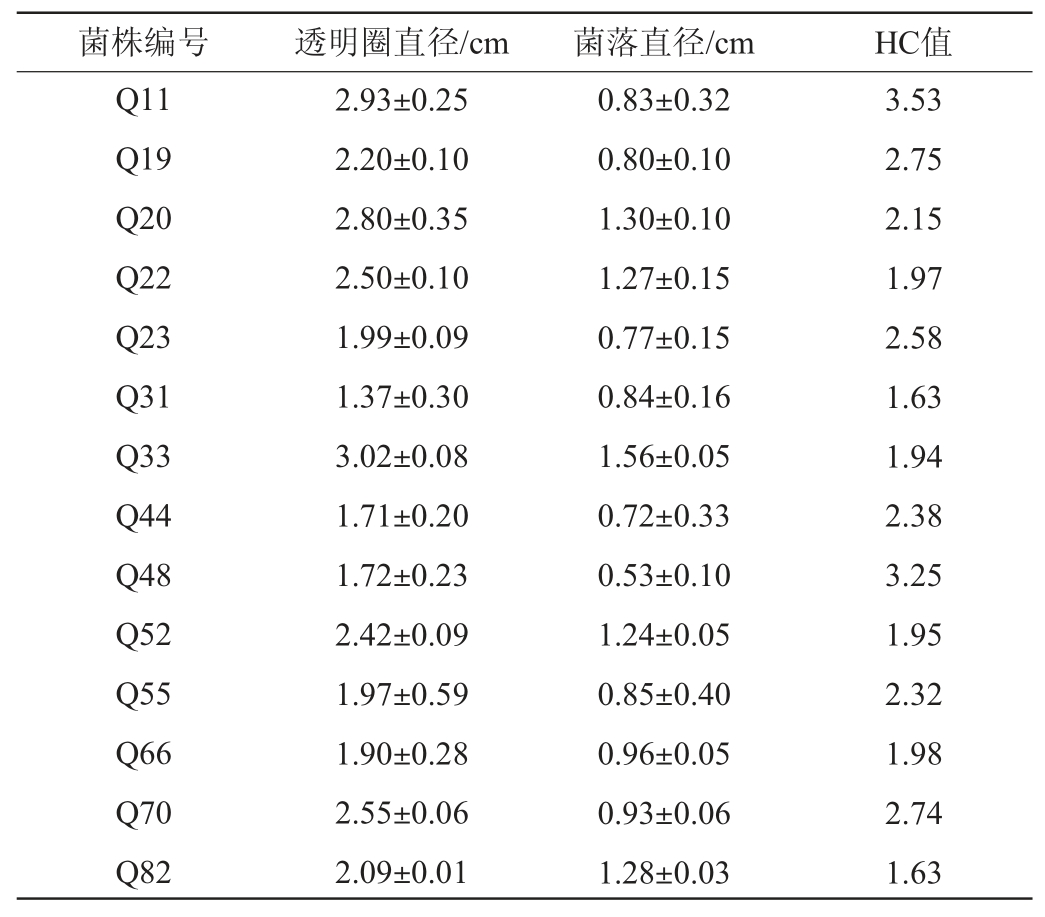
通过分离纯化,从清香型大曲中共分离得到85株霉菌,编号为Q1~Q85,利用初筛培养基对其进行初筛,结果发现,18株菌株的HC值≥1.6,其HC值见表1。由表1可知,5株霉菌(Q11、Q48、Q2、Q19和Q70)的HC值>2.7,因此,将其作为初筛菌株进行糖化力的测定。
表1 分离菌株的HC值
Table 1 HC value of isolated strains
续表
2.1.2 复筛结果
将初筛得到的5株霉菌菌株接种到麸皮培养基制成麸曲,并测定其糖化力,结果见图1。
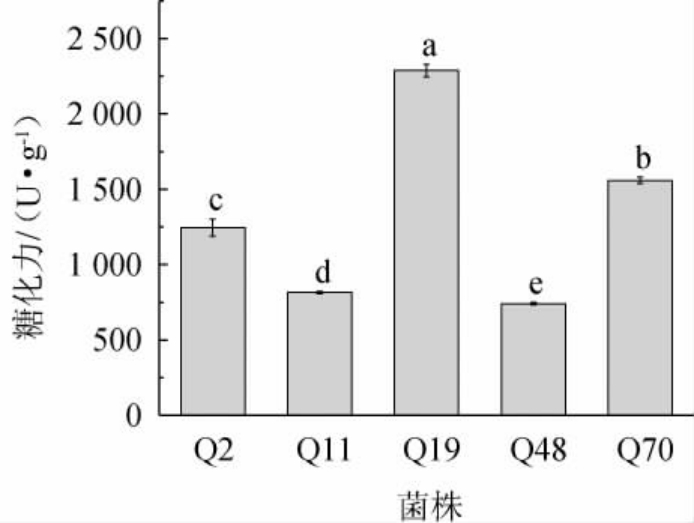
图1 初筛菌株的糖化力测定结果
Fig.1 Determination results of saccharifying power of primary screening strains
不同字母表示差异显著(P<0.05)。
由图1可知,5株霉菌的糖化力均>700 U/g,其中菌株Q19的糖化力最高,为2 288.17 U/g,显著高于其他菌株的糖化酶活力(P<0.05)。
2.2 高糖化力霉菌的菌种鉴定
2.2.1 形态学鉴定
5株霉菌菌株的菌落及细胞形态见图2。由图2可知,菌株Q2的菌落表面为黄褐色、粉末状,中心絮状、白色、褶皱突起,反面为黄色,圆形,干燥;分生孢子头呈放射状,孢子呈链状布满顶囊。菌株Q11的菌落表面为黄白色,中心呈淡黄色、褶皱凸起,菌落边缘呈黄褐色,反面为黄色,圆形且干燥;分生孢子头顶囊球形,小梗双层,第一层长,布满顶囊表面,呈放射状排列。菌株Q19的菌落表面为灰褐色,菌落中心呈灰白色,四周呈沟壑状分布,正反面颜色一致,干燥;分生孢子头顶囊近球形、黑褐色、呈放射状排列,孢子呈链状、布满顶囊,分生孢子梗较长,表面光滑、无隔。菌株Q48的菌落表面为灰褐色,呈密集菌丝分布,菌落边缘呈褐色,反面无色;分生孢子顶囊近球形或多室球形,孢子部分贴合顶囊,分支根系发达粗壮。菌株Q70的菌落表面为灰褐色,菌落中心呈白色,四周呈沟壑状分布,正反面颜色一致,干燥;孢子囊呈球形或椭圆形,4~8株成束,孢子梗直立、较长。
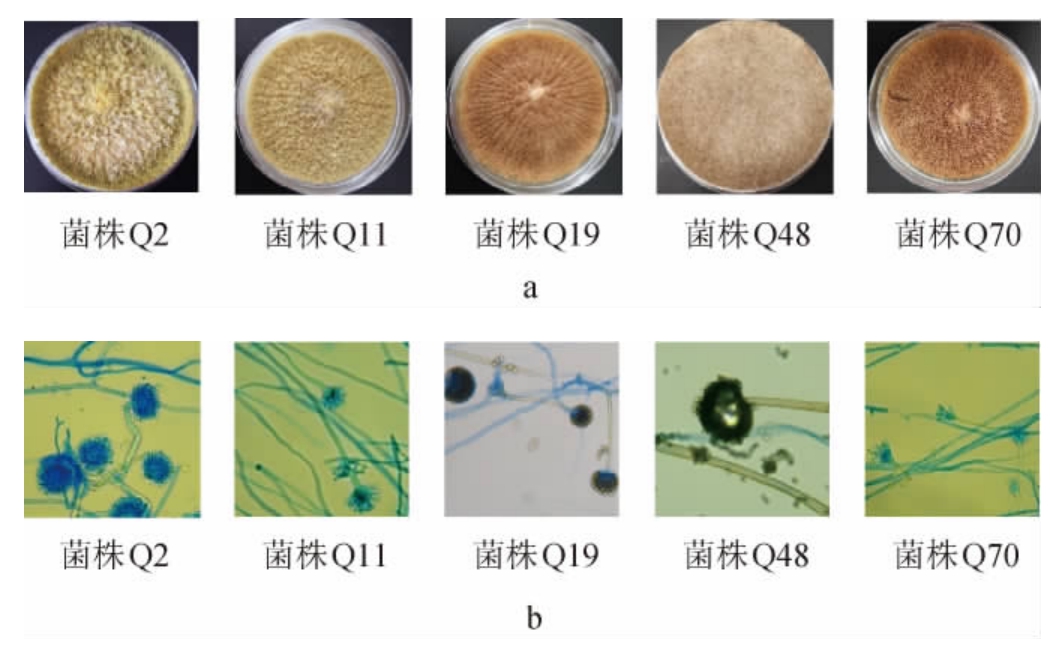
图2 5株霉菌菌株的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of 5 strains of mold
2.2.2 分子生物学鉴定
由于ITS区基因不能对曲霉属的物种进行有效区分[23],因此,本研究基于β-微管蛋白基因构建系统发育树,结果见图3。由图3可知,菌株Q70和Q19与黑曲霉(Aspergillus niger)聚在同一分支,亲缘关系最近;菌株Q11和Q2与米曲霉(Aspergillus oryzae)聚在同一分支,亲缘关系最近;菌株Q48与米根霉(Rhizopus oryzae)聚在同一分支,亲缘关系最近。结合形态观察,鉴定菌株Q70和Q19为黑曲霉(Asper-gillus niger),菌株Q11和Q2为米曲霉(Aspergillus oryzae),菌株Q48为米根霉(Rhizopus oryzae)。

图3 基于β-微管蛋白基因5株霉菌菌株的系统发育树
Fig.3 Phylogenetic tree of 5 strains of mold based on β-tubulin gene
2.3 挥发性物质风味物质分析
2.3.1 GC-MS分析结果
采用5株霉菌制备纯种麸曲,采用GC-MS检测麸曲中的挥发性风味成分,GC-MS分析总离子流色谱图见图4,分析结果见表2。
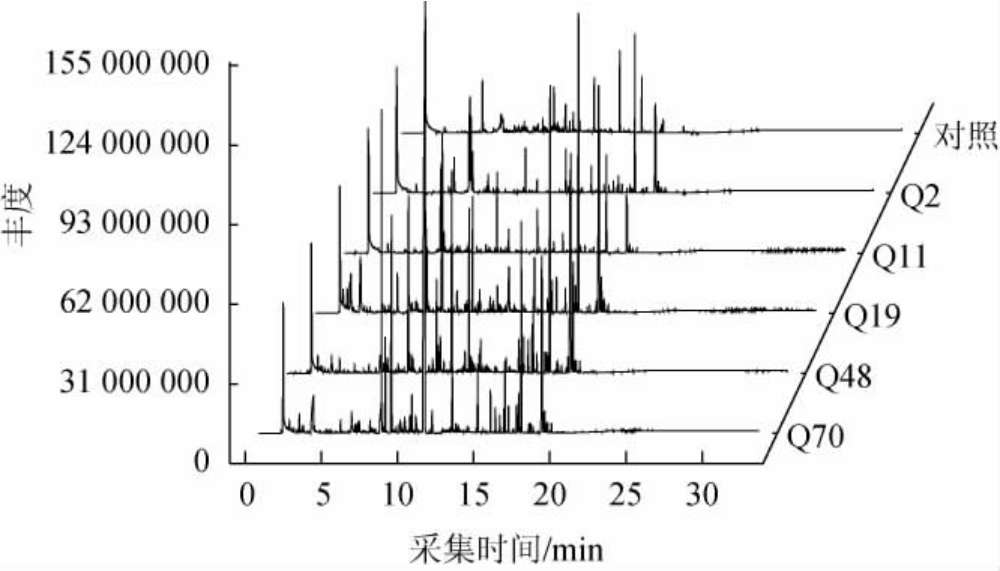
图4 麸曲中挥发性风味成分GC-MS分析总离子流色谱图
Fig.4 Total ions chromatogram of volatile flavor components in Fuqu analyzed by GC-MS
表2 麸曲中挥发性风味成分GC-MS分析结果
Table 2 Results of volatile flavor components in Fuqu analyzed by GC-MS

续表

注:“N.D”表示未检出。
由表2可知,从对照麸曲和5株霉菌制备的纯种麸曲样品中共检测出44种挥发性物质,包括醇类(6种)、酯类(18种)、醛酮类(9种)、芳香类(11种),其中酯类物质种类最多,且含量最高,对清香型白酒增香起到重要作用[24]。对照麸曲、菌株Q2、Q11、Q19、Q48和Q70纯种麸曲样品中分别检测出12、19、16、31、21和17种挥发性物质,菌株Q2纯种麸曲中醇类(28.083 mg/kg)和醛酮类物质含量(10.030 mg/kg)最高,菌株Q48纯种麸曲中酯类(156.991 mg/kg)和芳香类物质含量(48.848 mg/kg)最高。相关研究表明[25],白酒中醇类、酯类、醛酮类和芳香类等众多微量呈香物质是决定白酒风格和质量优劣的关键,这与本研究结果相似。
2.3.2 聚类分析结果
为直观比较5株霉菌制备得纯种麸曲中挥发性成分的差异,使其特征物质可视化,将44种挥发性成分的相对含量作为变量进行聚类分析,并绘制热图,结果见图5。热图中方块颜色由蓝到黄代表挥发性成分含量在该样品中所占比重增大。
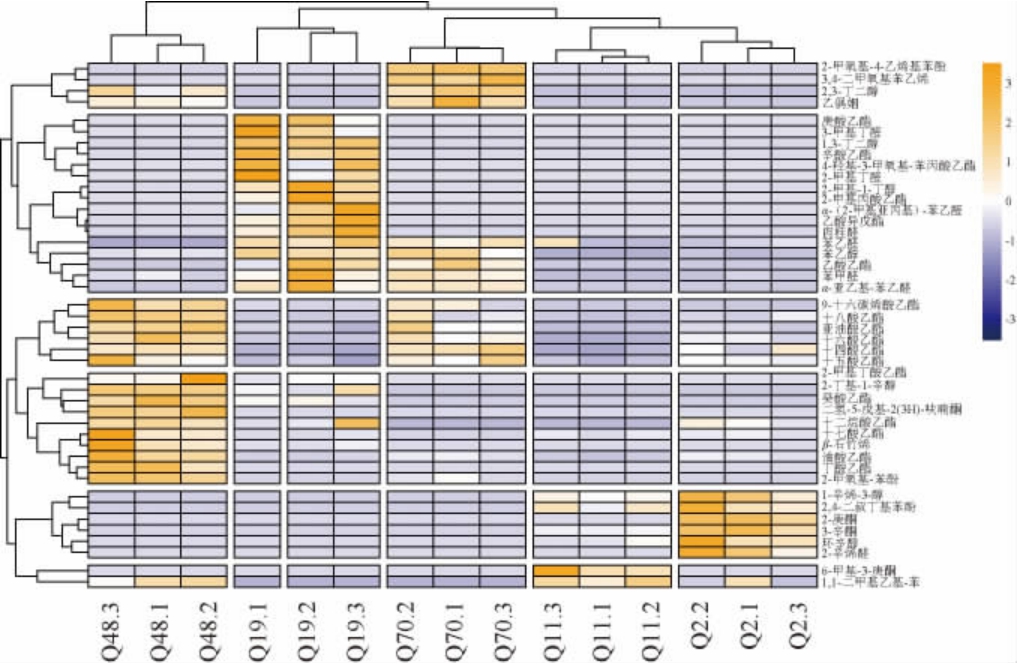
图5 5株霉菌制备的纯种麸曲中挥发性化合物含量变化的聚类分析热图
Fig.5 Cluster analysis heat map of volatile compounds content change of pure Fuqu prepared by 5 strains of mold
由图5可知,5株霉菌制备的纯种麸曲挥发性成分各有不同。菌株Q19和Q48制备的纯种麸曲中挥发性风味物质较为丰富且含量较高,表明这两株菌在清香型白酒中具有更大的应用潜力,可以作为后续重点研究菌株。菌株Q2和Q11制备的纯种麸曲中1-辛烯-3-醇含量较高,其含有蘑菇味、薰衣草香气和玫瑰香气,在威士忌[26]、酱香型白酒[27]中也作为重要的芬香化合物。菌株Q19制备的纯种麸曲中苯乙醇含量较高,据报道,苯乙醇不仅在五谷类酒体中有重要贡献[28],还是黑曼罗(Negroamaro)葡萄酒中的重要化合物[29];菌株Q48和Q70制备的纯种麸曲中十四酸乙酯、十六酸乙酯、十八酸乙酯、油酸乙酯和亚油酸乙酯等高沸点乙酯类化合物含量较高,此类物质在丢糟、黄水等白酒发酵副产物中检出较多[30-31],虽对香味有一定的贡献,但是过量则会引起酒体浑浊[21]。
此外,菌株Q48制备的纯种麸曲中还检出了2-甲氧基-苯酚、2-甲氧基-4-乙基苯酚等酚类化合物,而酚类化合物则是白酒中的重要呈香呈味物质[32],其中4-乙基苯酚呈烟熏味,对人体自由基的清除有较强能力,被认为是白酒中的健康因子[33];菌株Q70制备的纯种麸曲中检出醛酮类化合物乙偶姻,乙偶姻是传统发酵食品中重要香气成分四甲基吡嗪生物合成的前体物质,是多种微生物糖代谢的中间产物[34-35],具有特殊的奶油香气,是白酒微量风味的重要组成成分。
从5株霉菌制备的纯种麸曲中还检出许多其他微量成分,虽然其浓度较低,但对于白酒的风味前体和风味成分形成也有很大的影响。霉菌产生的挥发性风味物质差异较大的原因,可能主要在于这些霉菌之间的酶活性质差异比较明显。如米根霉(Rhizopus oryzae)具有高产糖化型淀粉酶的能力[36],米曲霉(Aspergillus oryzae)生成丰富的水解酶系,如蛋白酶系和多糖分解酶系[37],黑曲霉(Aspergillus niger)有多种活力较强的酶系[38],这些酶类可以促进酸、酯、芳香类等化合物的形成,使白酒具有独特风味。
3 结论
本研究从清香大曲中共分离纯化得到85株霉菌,通过筛选获得5株高糖化力的霉菌,经鉴定,菌株Q2、Q11为米曲霉(Aspergillus oryzae)、菌株Q19、Q70为黑曲霉(Aspergillus niger),菌株Q48为米根霉(Rhizopus oryzae),其中黑曲霉(Aspergillus niger)Q19的糖化酶活力最高,达2 288.17 U/g。采用5株霉菌制备纯种麸曲,并采用HS-SPME-GC-MS测定其挥发性风味物质成分。结果表明,从5株霉菌的代谢物中共检测出44种挥发性风味物质,包括醇类物质6种、酯类物质18种、醛酮类物质9种、芳香类物质11种。通过聚类分析发现,这些菌株产生的风味物质差异较大,菌株Q19和Q48的挥发性风味物质较为丰富且含量较高,菌株Q2和Q11中1-辛烯-3-醇含量较高,菌株Q19中苯乙醇含量较高,菌株Q48和Q70中十六酸乙酯和亚油酸乙酯等高沸点酯类化合物含量较高。本研究结果有助于确定特色功能菌株,获得不同霉菌代谢产物生成挥发性风味的能力,为后续菌种复配、改善基酒品质提供了基础参数。
[1]ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:History,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[2]陈孝,温承坤,巩园园,等.酒曲的研究进展[J].中国酿造,2019,38(10):7-11.
[3]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[4]贾瑞博,胡荣康,周文斌,等.米曲霉(Aspergillus oryzae FAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业,2016,42(11):71-76.
[5]成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[6]王旭亮,王异静,王德良,等.白酒发酵高糖化性能霉菌的筛选及鉴定[J].酿酒科技,2012(9):22-28.
[7]谢玉球,时晓,周二干,等.洋河大曲中糖化酶高产霉菌的筛选鉴定及固态发酵条件优化[J].酿酒科技,2016(4):39-42.
[8]冯瑞章,庞建义,王涛,等.浓香型白酒产糖化酶菌株筛选及产酶条件研究[J].中国酿造,2013,32(10):81-84.
[9]鲁珍,刘家扬,谌馥佳,等.高温大曲中高产糖化酶菌株的筛选鉴定及固态发酵条件优化[J].湖南农业科学,2016(4):1-4.
[10]刘茗铭,周阳子,袁乐梅,等.酒曲中高产糖化酶霉菌的筛选及其固态发酵产酶条件优化[J].食品与发酵工业,2018,44(10):118-123.
[11]倪海斌,彭奎,王超凯,等.藏曲高产糖化酶霉菌的筛选及其产酶条件优化[J].食品与发酵科技,2022,58(2):31-37.
[12]蔡万华,丁少鹏,叶蕊芳,等.利用96孔板和酿酒酵母生长圈复合筛选高产管囊酵母[J].酿酒科技,2011(4):36-38.
[13]潘菲,董彪,刘婷,等.黑曲霉Aspergillus niger NCUF413.1对特香型白酒酿造出酒率和风味的影响[J].食品与发酵工业,2020,46(1):23-29.
[14]郑自强,卫春会,张立伟,等.中高温大曲中霉菌的分离及其麸曲制备[J].现代食品科技,2022,38(1):165-172.
[15]马歌丽,魏泉增,张志刚.分光光度法测定大曲糖化酶活力探讨[J].中国酿造,2008,27(17):69-71.
[16]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979:129-135.
[17]凌启波,梁英杰.常见真菌的形态学特征和常用染色方法[J].临床与实验病理学杂志,2003,19(5):554-557.
[18]王勇.牛栏山二锅头酵母菌多样性研究及其代谢产物分析[J].中国酿造,2019,38(3):28-34.
[19]余烨颖,赵以桥,曾昱龙,等.β-微管蛋白联合ITS序列在金花菌鉴定中的应用[J].茶叶通讯,2020,47(2):255-261.
[20]王晓勇,荆旭,赵恒山,等.应用响应面法对产糖化酶菌株M1制曲工艺的优化研究[J].酿酒,2019,46(5):79-83.
[21]张鸣宇,罗莉莎,高特,等.本土美极梅奇酵母对玫瑰香葡萄酒降醇及香气的影响[J].中国酿造,2023,42(1):133-141.
[22]高江婧,任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.
[23]HUBKA V,KOLARIK M,KUBATOVA A,et al.Taxonomic revision of Eurotium and transfer of species to Aspergillus[J].Mycologia,2013,105(4):912-937.
[24]郝飞龙.山西清香型白酒特征香气成分发觉及感官、智能仪器综合分析[D].晋中:山西农业大学,2018.
[25]黎攀,李沙,刘雄,等.HS-SPME-GC-MS研究大曲发酵过程中挥发性成分动态变化[J].现代食品科技,2016,32(4):271-276.
[26]POISSON L,SCHIEBERLE P.Characterization of the most odor-activecompounds in an American Bourbon whisky by application of the aroma extract dilution analysis[J].J Agr Food Chem,2008,56(14): 5813-5819.
[27]FAN W,QIAN M C.Characterization of aroma compounds of Chinese"Wuliangye"and"Jiannanchun"liquors by aroma extract dilution analysis[J].J Agr Food Chem,2006,54(7):2695-2704.
[28]杜静怡,朱婷婷,黄明泉,等.清香型志都五谷酒关键香气成分分析[J].食品科学,2021,42(2):185-192.
[29]CAPONE S,TUFARIELLO M,SICILIANO P.Analytical characterisation of Negroamaro red wines by'Aroma Wheels'[J].Food Chem,2013,141(3):2906-2915.
[30]杨瑞,周江.白酒生产副产物黄水及其开发利用现状[J].酿酒科技,2008(3):90-92.
[31]宋柯,杜岗,刘念.白酒发酵副产物丢糟、黄水、底锅水中提取香味成分在酒用香料中的应用[J].酿酒科技,2008(6):82-84.
[32]史冬梅,王松,赵东瑞,等.GC-MS/SIM法检测103种白酒中6种酚类化合物[J].中国食品学报,2019,19(4):235-248.
[33]黄蕴利,黄永光,郭旭.白酒中的主要生物活性功能成分研究进展[J].食品工业科技,2016,37(15):375-379.
[34]ZHU B F,YAN X.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].J Ind Microbiol Biot,2010,37(8):815-821.
[35]陈诗佳,李玲玲,陈叶福,等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技,2018(10):114-119.
[36]NGO THI PHUONG DUNG N T P.Defined fungal starter granules for purple glutinous rice wine[D].Wageningen:Wageningen University,2004.
[37]李诗雯.米曲霉蛋白酶系协同水解大豆蛋白的研究[D].武汉:湖北工业大学,2015.
[38]TARI C.Optimization of a growth medium using a statistical approach for the production of an alkaline protease from a newly isolated Bacillus sp.L21[J].Process Biochem,2006,41(3):659-665.