酱香型白酒是中国四大基本香型白酒之一,具有酱香突出,幽雅细腻,酒体醇厚,回味悠长,空杯留香的独特酒体风格,在国内外具有巨大的消费市场[1]。高温堆积发酵是酿造酱香型白酒的核心工艺,在其发酵过程中可以为酒醅富集大量微生物,并为窖池发酵提供大量酶类资源和各类风味物质[2]。贵州天然溶洞常年20 ℃,通风条件良好,洞内有沉积风干型黏土,相对封闭的生态环境下形成了利于2 000多种微生物菌群繁衍和生长的酿酒“微环境”。洞酿酱香型白酒就是在其独有生态环境下,融合茅台高温大曲和堆积发酵的传统工艺,开创了恒温缓慢发酵的原生态生产工艺。
酱香型白酒生产过程中共进行八次堆积发酵,九次蒸馏,七次取酒,其中三、四、五轮次原酒品质最好,被称为“大回酒”[3]。不同轮次高温堆积发酵过程中酒醅微生物的结构存在着显著差异,而微生物群落结构以及其挥发性代谢物的变化对酱酒的生产品质有重大影响[4]。张瀚之等[5]研究了不同轮次堆积发酵酒醅真菌群落结构多样性,发现第四轮次有9个优势真菌属,包含嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)等;WANG W H等[6]应用高通量测序技术探究酱香型白酒第五轮次微生物群落结构多样性,发现其堆积发酵酒醅中3个优势细菌属分别为乳杆菌属(Lactobacillus)、海洋芽孢杆菌属(Oceanobacillus)和枝芽孢菌属(Virgibacillus);韩兴林等[7]从酱香白酒堆积发酵酒醅中共检测出83种挥发性代谢物。白酒酿造过程中温度、湿度、通风条件等对于酿造微生物的群落结构及其挥发性代谢物十分关键,目前,酱香型白酒多以在人工建造厂房中酿造为主,鲜有在天然溶洞酿造并探究其微生物群落结构与挥发性代谢物相关性的研究报道。
因此,本研究以洞酿酱香型白酒第四轮次堆积发酵酒醅和出窖酒醅为研究对象,采用高通量测序技术以及顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术分别进行微生物群落及挥发性代谢物差异分析,并结合多元统计分析揭示酒醅微生物与挥发性代谢物的动态变化,以及微生物菌群之间和微生物与挥发性代谢物之间的相关性,为提升洞酿酱香型白酒的品质奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
从贵州省某酒业公司采集洞酿酱香酒第四轮次堆积发酵0 h、24 h、48 h及窖池发酵37 d的酒醅样品(出窖酒醅),编号分别为SF-0h、SF-24h、SF-48h、SF-37d。采集方法参照左乾程等[8]的方法,每个样品均采集于酒醅上、中、下层,每层分别采集中间一点以及四周边缘四个点,将其混合后作为一个层面的酒醅样品,然后将三个层面的酒醅样品混合均匀后作为一个样品以消除取样误差,样品混合均匀后立即用无菌袋密闭包装,置于-80 ℃条件下冷冻保藏。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国MP Biomedicals公司;琼脂糖(分析纯):西班牙Biowest公司;FastPfu聚合酶:北京全式金生物技术股份有限公司;AxyPrep DNA凝胶回收试剂盒:美国Axygen公司;TruSeqTM DNA样品制备试剂盒;美国Illumina公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Trace1300-TSQ8000气相色谱-质谱联用仪:美国Thermo Fisher Scientific公司;DYY-6C电泳仪:北京市六一仪器厂;ABI GeneAmp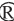 9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;Illumina Miseq MISEQ测序仪:美国Illumina公司;QL-901旋涡混合器:海门其林贝尔仪器制造有限公司。
9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;Illumina Miseq MISEQ测序仪:美国Illumina公司;QL-901旋涡混合器:海门其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 DNA抽提和PCR扩增
使用FastDNA SPIN Kit试剂盒对样本中总DNA进行抽提,以其为模板,采用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACNNGGGTATCTAAT-3')PCR扩增细菌的16S rRNA V3-V4区基因序列,采用引 物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增真菌的ITS1-ITS2区基因序列。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,细菌29个循环,真菌35个循环;最后72 ℃延伸10 min,在4 ℃进行保存。PCR扩增体系(20 μL):5×FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2 μL,上下游引物(5 μmol/L)各0.8 μL,FastPfu聚合酶0.4 μL,DNA模板10 ng。
1.3.2 Illumina Miseq高通量测序
使用2%琼脂糖凝胶回收PCR扩增产物,利用AxyPrep DNA Gel Extraction Kit对PCR扩增产物进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST进行检测定量。根据Illumina MiSeq平台标准操作规程对纯化后的扩增片段进行测序,将纯化后的扩增片段构建PE 2×300的文库。
1.3.3 挥发性代谢物测定[9]
顶空固相微萃取:准确称取1 g酒醅样品与10 μL环己酮内标溶液(20 μg/mL)混合,并加入2 g氯化钠和5 mL纯净水,放入20 mL顶空瓶,用聚四氟乙烯(poly tetra fluoro ethylene,PTFE)隔膜密封。然后将样品在60 ℃平衡20 min,并将50/30 μm DVBboxen/Carboxen/PDMS萃取头插入顶空瓶中,在40 ℃振摇80 min以提取和吸附挥发性风味化合物。
气相色谱条件:DB-WAX毛细管柱(30 m×0.25 mm,0.25μm),无分流模式,载气为高纯氦气(He),流速1.0 mL/min,升温程序为40 ℃保持5 min,然后以5 ℃/min升至150 ℃,保持3 min,最后以5 ℃/min升至240 ℃,保持5 min。
质谱条件:电子电离(electron ionization,EI)源,电子能量为70 eV,传输线温度为280 ℃,离子源温度为230 ℃,扫描范围为50~450 m/z,扫描速率为1 scan/s。
定性定量分析:数据采集后与美国国家标准与技术研究院(national institute of standards and technology,NIST)数据库对比,保留匹配度>800的化合物;采用内标法对挥发性代谢物进行半定量。
1.3.4 统计分析
利用IBM SPSS Statistics 26分析实验数据;利用QIIME计算微生物多样性;采用Origin 2018绘图;使用SIMCA 14.1软件建立偏最小二乘-判别分析(partial least squares-discriiminate analysis,PLS-DA)模型;利用Cytoscape 3.9.1软件绘制微生物属与挥发性风味物质间的相关性网络图。
2 结果与分析
2.1 酒醅中微生物菌群的Alpha多样性分析
洞酿酱香型白酒第四轮次发酵过程中酒醅微生物菌群的Chao1指数曲线和Shannon指数曲线见图1。由图1可知,基于细菌和真菌的Chao1指数曲线和Shannon指数曲线先升高后趋于平缓,表明测序结果已足以反映样品微生物多样性,能满足生物信息学后续分析要求。
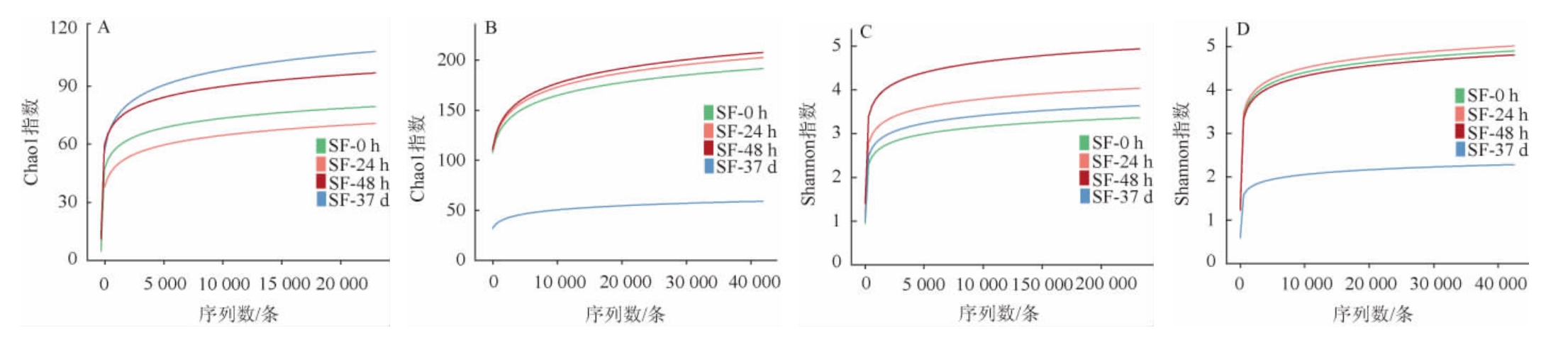
图1 酒醅发酵过程中真菌(A、C)和细菌(B、D)的Chao1指数曲线和Shannon指数曲线
Fig.1 Chao1 index curves and Shannon index curves of fungi (A,C) and bacteria (B,D) during fermented grains fermentation
采用高通量测序技术对洞酿酱香型白酒第四轮次发酵酒醅中的微生物群落丰富度及多样性进行检测分析,结果见表1。由表1可知,针对真菌菌群而言,酒醅堆积发酵24 h时,Chao1指数最低,为70.33±13.65;堆积发酵48 h时,Chao1指数上升为93.33±28.36,真菌菌群丰富度大幅度升高;窖池发酵37 d时,Chao1指数最高,为106.33±10.50,说明出窖酒醅中真菌群落丰富度高于堆积发酵酒醅。堆积发酵0 h时,Simpson指数(0.70±0.05)和Shannon指数(3.16±0.29)最低;堆积发酵24 h和48 h时,Shannon指数(3.80±0.24、4.64±1.24)和Simpson指数(0.89±0.02、0.86±0.16)均较高;窖池发酵37 d时,Shannon指数(3.42±0.17)和Simpson指数(0.82±0.01)均降低,说明堆积发酵过程中,真菌群落多样性整体呈现先增加后减少的趋势,窖池发酵后真菌群落多样性有所下降。针对细菌菌群而言,在堆积发酵阶段,细菌群落的丰富度随着发酵时间的延长而升高,多样性无太大差别。酒醅堆积发酵48 h时,Chao1指数(205.73±45.92)最高,细菌群落丰富度最高;堆积发酵24 h时,Simpson指数(0.92±0.01)和Shannon指数(4.72±0.12)最高,细菌群落多样性最高。窖池发酵37 d时,酒醅Chao1指数(59.00±3.00)以及Simpson指数(0.62±0.03)和Shannon指数(2.15±0.17)均最低,其细菌群落丰富度和多样性最低,可能是因为窖内发酵过程处于高温厌氧环境,抑制了大多数细菌的生长繁殖[10]。
表1 酒醅发酵过程中微生物菌群Alpha多样性分析结果
Table 1 Analysis results of Alpha diversity of microbial flora in during fermented grains fermentation

为了对不同发酵阶段酒醅样品中微生物群落组成差异进行分析,绘制韦恩图,结果见图2。由图2可知,在真菌群落中,窖池发酵37 d时,酒醅中特有的真菌操作分类单元(operational taxonomic units,OTUs)数和OTUs总数均为最高,分别为168个和239个,而堆积发酵24 h时,特有的真菌OTUs数和OTUs总数均为最低,分别为94个和151个,说明出窖酒醅真菌菌群多样性与丰富度较堆积发酵酒醅更高。从细菌群落来看,堆积发酵0 h、24 h、48 h时,酒醅中特有的细菌OTUs数分别为127个、170个、179个,数值接近且逐渐增高,窖池发酵37 d时,酒醅中特有的细菌OTUs数降低为46个。堆积发酵0 h、24 h、48 h时,酒醅中细菌OTUs总数分别为314个、368个、368个,无明显差异,窖池发酵37 d时,酒醅中细菌OTUs总数明显下降,为107个,说明在堆积发酵阶段细菌丰富度与多样性相差不大,但在窖池发酵37 d后明显下降,这与表1分析结果类似。
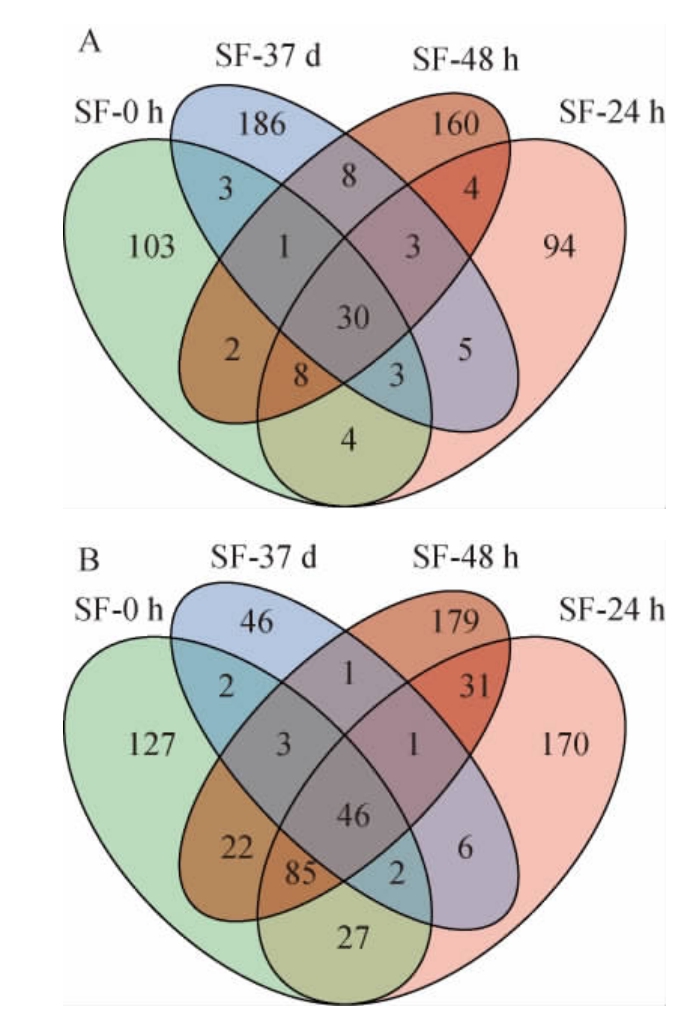
图2 酒醅发酵过程中真菌(A)和细菌(B)OTUs的韦恩图
Fig.2 Venn diagram of OTUs of fungi (A) and bacteria (B) during fermented grains fermentation
2.2 酒醅中微生物群落结构分析
2.2.1 基于门水平微生物群落结构分析
基于门水平,酒醅样品中真菌及细菌的菌群结构见图3。
图3 基于门水平酒醅样品真菌(A)及细菌(B)菌群结构分析结果
Fig.3 Analysis results of fungi (A) and bacteria (B) flora structure of fermented grains samples at phylum level
others:平均相对丰度<0.1%的其他菌门。
由图3可知,在门水平上共检测出6个优势菌门(平均相对丰度>0.1%),其中真菌门2个,分别为子囊菌门(Ascomycota)和担子菌门(Basidiomycota);细菌门4个,分别为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)。所有样品的真菌群落都以子囊菌门为绝对优势菌门,其相对丰度均>95%,这与DAI Y J等[11]的研究结果一致。细菌群落方面,所有样品的真菌群落都以厚壁菌门为绝对优势菌门,且在各个发酵阶段相对丰度均>94%,此结果与孙利林等[10]的研究结果类似。
2.2.2 基于属水平微生物群落结构分析
基于属水平,对酒醅样品中真菌及细菌的菌群结构进行分析,结果见图4。
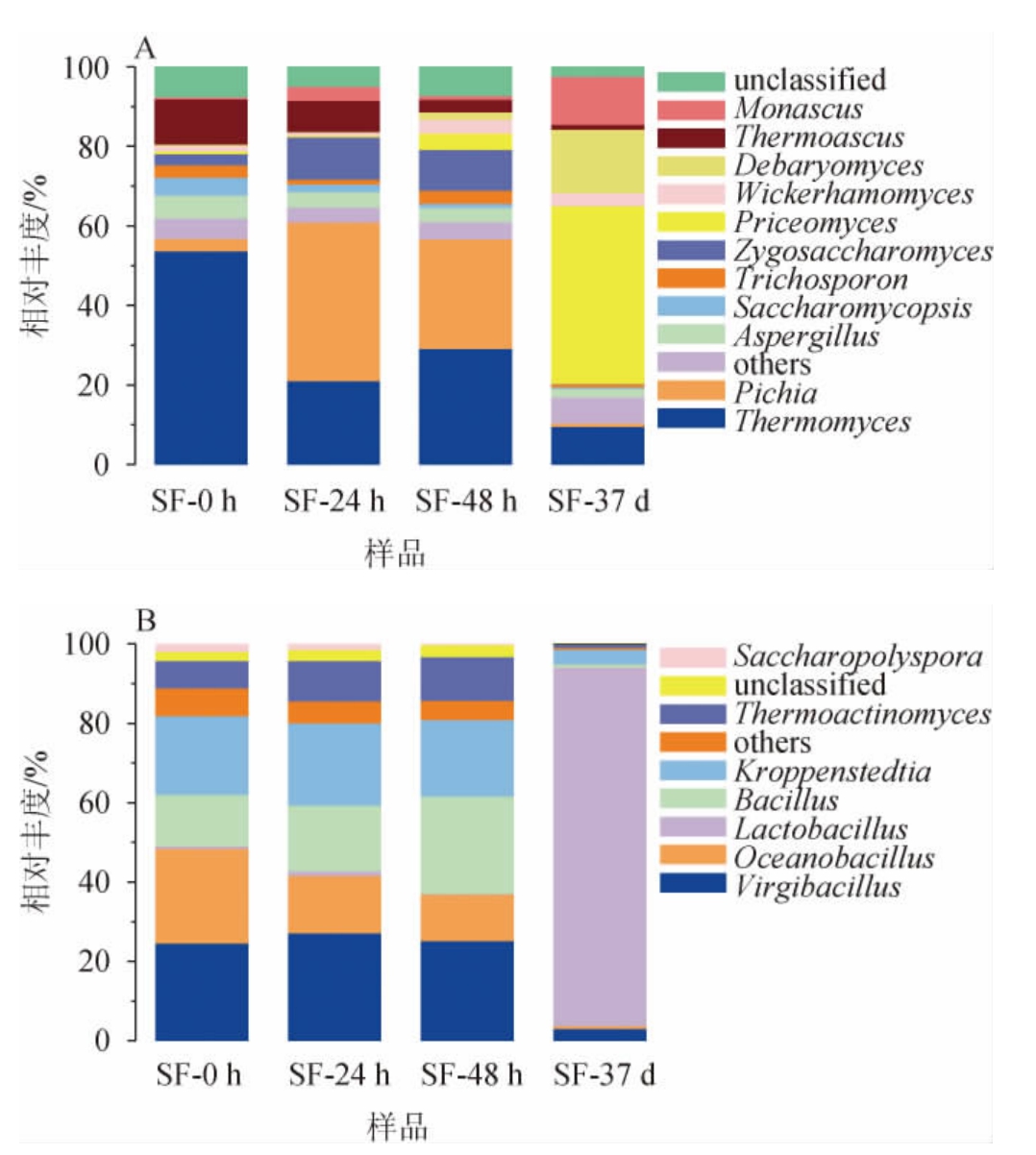
图4 基于属水平酒醅样品真菌(A)及细菌(B)菌群结构分析结果
Fig.4 Analysis results of fungi (A) and bacteria (B) flora structure of fermented grains samples at genus level
others:平均相对丰度<1%的其他菌属。
由图4A可知,从酒醅中共检测出81个真菌属,包括11个优势真菌属(平均相对丰度>1%),分别为嗜热真菌属(Thermomyces)、毕赤酵母属(Pichia)、曲霉属(Aspergillus)、复膜孢酵母属(Saccharomycopsis)、毛孢子菌属(Trichosporon)、接合酵母属(Zygpsaccharomyces)、Priceomyces、威克汉姆酵母属(Wickerhamomyces)、德巴利氏酵母属(Debaryomyces)、热子囊菌属(Thermoascus)、红曲霉属(Monascus)。其中,嗜热真菌属在堆积发酵0 h、24 h、48 h时相对丰度均较高,分别为53.67%、21.05%、29.12%。嗜热真菌属和热子囊菌属都是高温大曲和堆积发酵酒醅中的常见真菌群,其在高温下生长繁殖产生多种耐热水解酶有利于糖化发酵,从而对白酒酱香风味的形成起到重要作用[12-13]。霉菌在堆积发酵中也发挥着关键作用,它们可以产生淀粉酶,将原料高粱中的淀粉物质降解为葡萄糖和麦芽糖等可发酵糖,这些糖类是后续酒精发酵和风味产生的物质基础[14-15]。曲霉属在堆积发酵0、24 h、48 h时的相对丰度分别为5.85%、3.87%、3.69%,其可有效分解淀粉,增加发酵过程中糖分含量,促进白酒发酵[16],红曲霉属可产生大量酯酶,提高己酸乙酯的合成,有助于白酒风味化合物的合成[17]。酵母菌是白酒发酵过程中最重要的微生物群体,其主要影响白酒的口感和风味特征[18]。毕赤酵母属在堆积发酵24 h和48 h时相对丰度较高,分别为39.88%、27.51%。毕赤酵母属为耐高温酵母菌,是酒醅发酵过程中产乙醇和产酯的功能菌,其可能来自发酵环境也可能来自于大曲中[19-20]。接合酵母属堆积发酵24 h和48 h时相对丰度分别为10.62%、10.32%,其是酱香型白酒生产的重要菌株,影响着多种风味物质的合成,并影响着白酒的产酒率及酒质[21-22]。Priceomyces和德巴利氏酵母属主要存在于出窖酒醅中,相对丰度分别为44.79%和15.93%。威克汉姆酵母属在发酵48 h和37 d时相对丰度均较高,分别为3.54%、3.27%,其是重要的生香酵母属[5],具有高酸度耐受性及产酯能力[23]。环境对酱香型白酒发酵过程中的真菌群落结构发挥着决定性的调控作用[24]。与孙利林等[25]在传统发酵环境中的第四轮次酒醅相比,溶洞恒温恒湿的发酵环境使酒醅优势酵母数量和种类增多,优势霉菌数量及种类减少。
由图4B可知,从酒醅样品中共鉴定出215个细菌属,包括7个优势细菌属,分别为枝芽孢菌属(Virgibacillus)、海洋芽孢杆菌属(Oceanobacillus)、乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、克罗彭斯特菌属(Kroppenstedtia)、高温放线菌属(Thermoactinomyces)、糖多孢菌属(Saccharopolyspora)。枝芽孢菌属在堆积发酵0 h、24 h、48 h时的相对丰度分别为24.58%、27.04%、25.11%,其具有耐高温特性,在白云边白酒发酵剂及发酵过程[26]和玉米黄酒[27]等发酵产品中都有发现,具有高蛋白酶活性,能产生发酵性糖和氨基酸,与酿酒过程中一些风味化合物的生成呈正相关。海洋芽孢杆菌属在堆积发酵0 h、24 h、48 h时的相对丰度较高,分别为23.87%、14.57%、11.84%。海洋芽孢杆菌属通常分布于深海环境、发酵食品环境,可用于一些工业酶制剂生产,该菌属是酱香型白酒生产过程的功能微生物,但具体的酿造功能还有待深入研究[28-29]。芽孢杆菌属在堆积发酵0、24 h、48 h时的相对丰度分别为12.93%、16.53%、24.54%,芽孢杆菌属是堆积发酵过程中酱香风味主要的贡献菌群,可以改善白酒的风味特征,如香气强度、芝麻味、醇厚度和丰满度[30]。克罗彭斯特菌属堆积发酵0、24 h、48 h时的相对丰度分别为19.80%、20.80%、19.19%。克罗彭斯特菌属为多种香型白酒酿造大曲的优势菌属,据研究报道其可能与大曲的产香机理有着紧密的联系[31]。窖池发酵37 d时,乳杆菌属占据绝对优势,相对丰度高达90.35%,这与WANG L等[32]的研究结果一致。窖池发酵过程处于高温厌氧环境,乳杆菌属能很好的适应这种环境,因此是酱香型白酒窖内发酵过程中最常见的重要微生物菌群,其在维持传统发酵食品中微生态发酵系统的稳定性方面起着重要作用[33],并且可以通过代谢产生乳酸等有机酸,创造一个酸度较低的环境,抑制病原菌在酿造过程中的繁殖[34]。
2.3 优势菌属之间的相关性分析
基于Pearson算法解析酒醅样品中优势菌属之间的相关性,结果见图5。
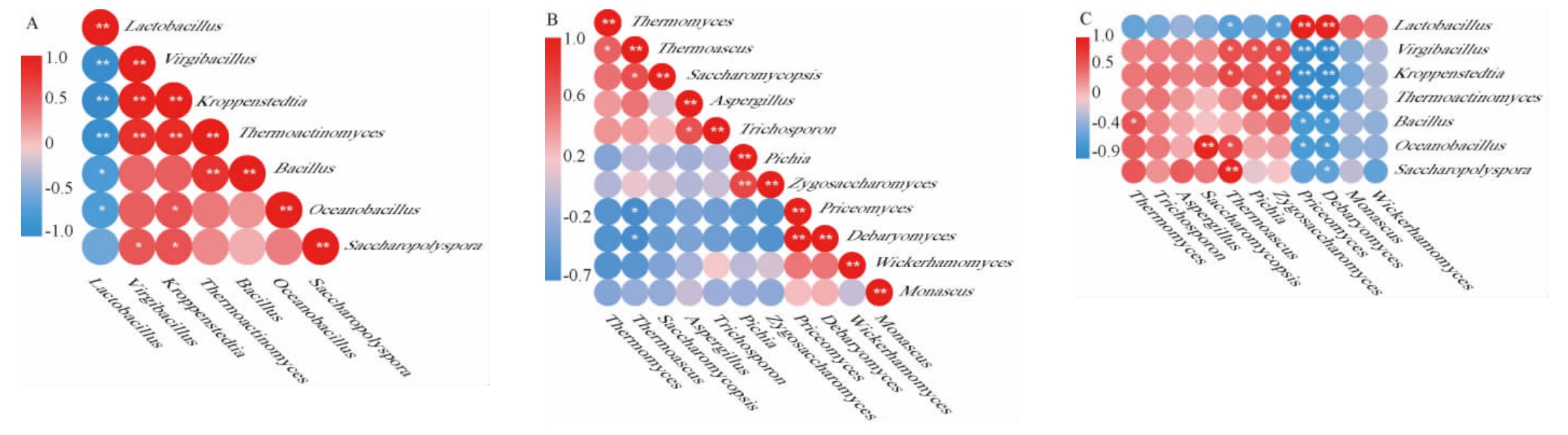
图5 酒醅样品中细菌属间(A)、真菌属间(B)及细菌属与真菌属间(C)的相关性分析热图
Fig.5 Heat map of correlation analysis among bacteria (A),fungi (B) and bacteria and fungi (C) in fermented grains samples
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01),红色表示正相关,蓝色表示负相关。
由图5A可知,7个优势细菌属之间共有15对呈正相关,6对呈负相关。其中乳杆菌属与其他细菌属均呈现负相关,特别是与枝芽孢菌属、克罗彭斯特菌属、高温放线菌属呈现极显著负相关(P<0.01)。此外,枝芽孢菌属、海洋芽孢杆菌属、芽孢杆菌属、克罗彭斯特菌属、高温放线菌属、糖多孢菌属之间均呈现正相关。尤其是枝芽孢菌属与克罗彭斯特菌属、高温放线菌属,克罗彭斯特菌属与高温放线菌属之间呈极显著正相关(P<0.01)。由图5B可知,11个优势真菌属之间共有20对呈正相关和35对呈负相关。其中,Priceomyces与德巴利氏酵母属呈极显著正相关(P<0.01),毕赤酵母属与接合酵母属呈极显著正相关(P<0.01)。而热子囊菌属与Priceomyces、德巴利氏酵母属之间呈显著负相关(P<0.05)。由图5C可知,优势细菌属与优势真菌属之间共有46对呈正相关,31对呈负相关。其中热子囊菌属与糖多孢菌属,复膜孢酵母属与海洋芽孢杆菌属,德巴利氏酵母属、Priceomyces与乳杆菌属呈极显著正相关(P<0.01)。德巴利氏酵母属、Priceomyces均与枝芽孢菌属、克罗彭斯特菌属、高温放线菌属呈极显著负相关(P<0.01),这可能与窖池发酵阶段枝芽孢菌属、克罗彭斯特菌属、高温放线菌属减少有关。特别注意,乳杆菌属与大多数真菌属和细菌属均呈现拮抗作用,可能是因为其在白酒发酵过程中产生乙醇、乙酸、乳酸等重要风味物质,可改变生态环境,抑制其他不耐高酸、高醇环境微生物的生长[35]。
2.4 酒醅中挥发性代谢物分析
利用HS-SPME-GC-MS对发酵酒醅进行检测,结果共检测出55种挥发性物质,将各类挥发性代谢物的种类以及含量绘制成堆叠柱形图,结果见图6。
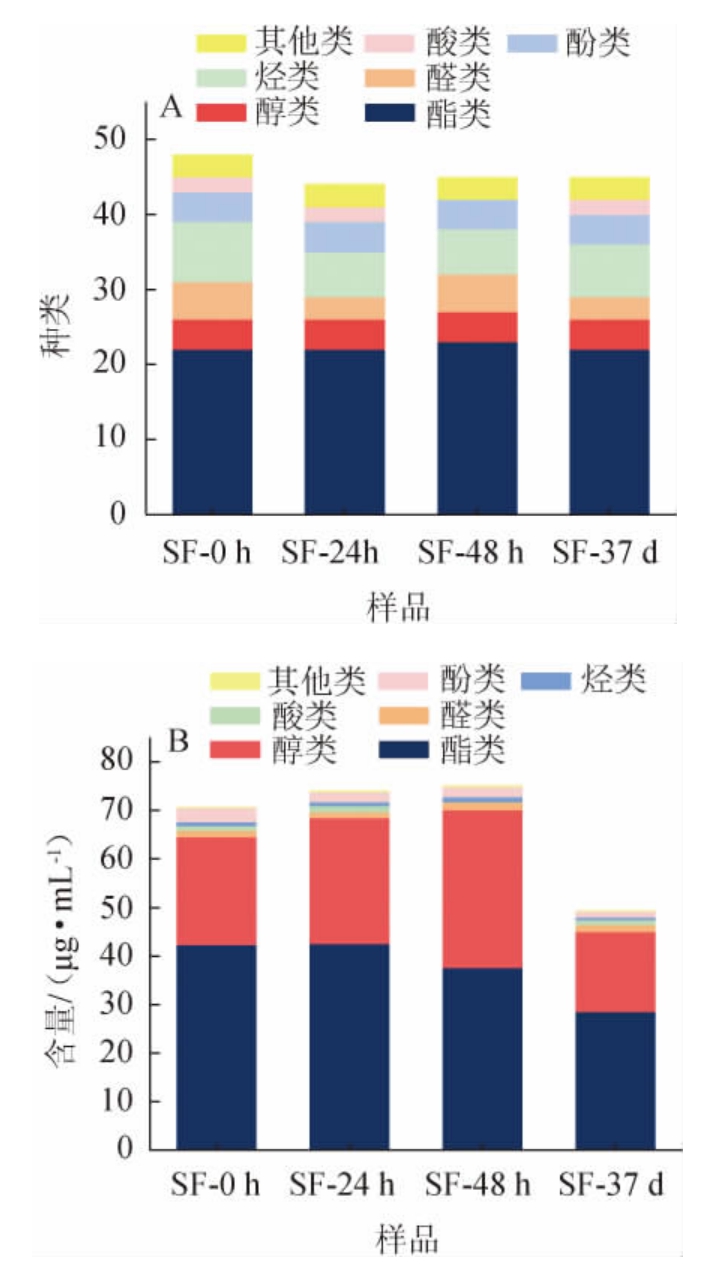
图6 酒醅样品中挥发性代谢物种类(A)及含量(B)的测定结果
Fig.6 Determination results of volatile metabolites types (A) and contents (B) in fermented grains samples
由图6可知,整个发酵过程中共检测到25种酯类、4种醇类、6种醛类、10种烃类、4种酚类、2种酸类以及4种其他类物质。挥发性代谢物总含量在堆积发酵0~48 h的过程中不断上升,但窖池发酵37 d时,挥发性物质总含量明显降低,第四轮次整个发酵阶段均是酯类物质和醇类物质占主导地位。
为了更好的研究各类挥发性风味物质含量变化特征,根据挥发性风味物质的含量绘制热图,结果见图7。

图7 酒醅样品挥发性代谢物组成分析热图
Fig.7 Heat map of volatile metabolite composition analysis of fermented grains samples
由图7可知,本研究共检出25种酯类,占所检出主要挥发性物质的55.99%。在白酒酿造过程中酯类物质主要由酸类和醇类酯化反应以及微生物的代谢形成,对白酒的风味有特殊贡献[36]。乳酸乙酯(柔和果香)、正己酸乙酯(水果香)、丁二酸二乙酯(花香、水果香)、苯乙酸乙酯(玫瑰花香、桂花香、洋槐花香)、乙酸苯乙酯(玫瑰花香、蜜果味香)、棕榈酸乙酯(苹果香味)、亚油酸乙酯(果香、花香)、油酸乙酯(鲜花香)是发酵过程的主要酯类物质[1]。这些酯类物质含量在堆积发酵0 h、24 h、48 h差别不大,在窖池发酵37 d后有所降低,但L-乳酸乙酯(甜香、水果香、青草香)[1]在窖池发酵37 d后与堆积发酵相比却大幅度上升。乳酸乙酯、棕榈酸乙酯和亚油酸乙酯是含量最高的3种酯类,乳酸乙酯是酱香型白酒的主体酯类,棕榈酸乙酯和亚油酸乙酯都是高沸点酯,对于白酒的香味具有一定贡献[37]。
醇类物质是形成酒体爽口的重要成分,适量的高级醇可增加酒香和酒体的甜度[38]。异戊醇、糠醇、苯甲醇、苯乙醇是酒醅样品中主要的高级醇,其中苯乙醇含量最高,其在堆积发酵过程中呈上升趋势,在窖池发酵37 d后含量有所下降。苯乙醇是一种具有玫瑰蜂蜜味的化合物,赋予酒体厚重感,是酯类的前驱物质,可由酵母细胞通过苯丙酮酸或Ehrlich途径生成[36]。
此外,酸类、醛类物质含量虽然不高,但是对于酱香型白酒的香气也有贡献。己酸和丁酸是白酒中常见的酸类物质,其有酸败和干酪味[39]。苯甲醛具有苦杏仁、樱桃以及坚果香,可作为食用香料用于杏仁、浆果、奶油、樱桃等香精中[40],也可作为酒用香精用于朗姆、白兰地等酒中[41]。
2.5 优势菌属与挥发性代谢物之间的相关性
发酵酒醅中挥发性代谢物质的产生与微生物活动密切相关,因此,为了评估酒醅优势微生物属与挥发性代谢物间的关系,利用Pearson相关系数(|R|>0.7和P<0.05)对其进行相关性分析,结果见图8。

图8 优势真菌属(A)及细菌属(B)与挥发性代谢物间相关性分析结果
Fig.8 Correlation analysis results of dominant fungi genera (A),bacteria genera (B) and volatile metabolites
由图8A可知,有10个优势真菌属与挥发性代谢物显著相关(P<0.05)。其中热子囊菌属和复膜孢酵母属与多种酯类呈现正相关,对酯类的生成有一定的影响。热子囊菌属与正己酸乙酯、己酸丁酯、十四酸乙酯、月桂酸乙酯、乳酸乙酯等酯类呈正相关,仅与乳酸异戊酯呈负相关。热子囊菌属在发酵过程中能产生多种酶类,对酱香风味的形成起重要作用[12]。复膜孢酵母属与2,4-二叔丁基苯酚、月桂酸乙酯、十四酸乙酯、十五酸乙酯、十九烷、糠醛呈正相关,复膜孢酵母属是酒药香气的主要产生菌[42],对白酒风味的形成具有重要贡献。此外,嗜热真菌属与糠醇、2,4-二叔丁基苯酚等呈正相关,与苯甲醛和乳酸异戊酯呈负相关。Priceomyces与L-乳酸乙酯、乙酰丙酸乙酯等呈正相关,与苯乙酸乙酯、2,6-二甲基吡嗪等呈负相关。
由图8B可知,有7个优势细菌属与挥发性代谢物显著相关(P<0.05)。高温放线菌属、乳杆菌属和克罗彭斯特菌属分别与21、24、19种挥发性代谢物具有相关性,对白酒风味形成影响较大。高温放线菌属与乙酸苯乙酯、苯乙醇、2,6-二甲基吡嗪等呈正相关。高温放线菌属可产蛋白酶和纤维素酶,蛋白酶可将蛋白质降解为氨基酸,氨基酸作为前体物质经酶促反应合成各种各样的香味物质,对白酒风味有重要影响[43]。乳杆菌属与L-乳酸乙酯呈现正相关,乳杆菌属为窖池发酵阶段优势菌属,可发酵糖形成乳酸,后经酯化作用生产L-乳酸乙酯。克罗彭斯特菌属与多种酯类呈正相关,如棕榈酸乙酯、辛酸乙酯、3-苯丙酸乙酯等,与L-乳酸乙酯、茴香脑等呈负相关。此外枝芽孢菌属与2,6-二甲基吡嗪、棕榈酸乙酯、苯乙酸乙酯等呈正相关,与乙酰丙酸乙酯、DL-2-羟基-4-甲基戊酸乙酯等呈负相关。
3 结论
本研究以洞酿酱香型白酒第四轮次发酵酒醅为研究对象,采用高通量测序技术结合代谢组学技术分析其微生物群落结构及挥发性代谢产物,并揭示属水平上微生物菌群之间和微生物与挥发性代谢物之间的关联性。高通量测序结果表明,发酵酒醅中共有11个优势真菌属,包括嗜热真菌属、毕赤酵母属、曲霉属等;有7个优势细菌属,包括枝芽孢菌属、海洋芽孢杆菌属、乳杆菌属等。微生物菌群间相关性分析结果显示,优势细菌属之间有15对呈正相关,6对呈负相关;优势真菌属之间有20对呈正相关和35对呈负相关,优势细菌属与优势真菌属之间有46对呈正相关,31对呈负相关。GC-MS分析发现,酒醅发酵过程中共检测出55种挥发性代谢物,其中起主导作用的为酯类和醇类。微生物与挥发性代谢物之间的相关性分析结果表明,真菌属中热子囊菌属、复膜孢酵母属与多种酯类呈正相关,对酯类的生成有一定的影响;细菌属中高温放线菌属、乳杆菌属、克罗彭斯特菌属均与近20种挥发性代谢物具有相关性,其对洞酿酱香型白酒风味形成具有较大影响。本研究为提升洞酿酱香型白酒的品质提供新参数。
[1]何东梅,马宇,黄永光,等.机械化酱香型轮次基酒风味结构及特征酯类化合物解析[J].食品科学,2021,42(10):269-275.
[2]HUANG Y,WANG Y,YAN X.Purification and characterisation of an acid protease from the Aspergillus hennebergii HX08 and its potential in traditional fermentation[J].J I Brewing,2017,123(3):432-441.
[3]王云胜,辛健康,陈银翠,等.酱香白酒第七轮次堆积发酵过程中细菌群落的动态变化[J].基因组学与应用生物学,2022,41(6):1244-1253.
[4]王源,李微微,李秀婷,等.北京地区酱香型白酒第六轮次堆积发酵中细菌群落多样性分析[J].食品科学技术学报,2022,40(3):68-76.
[5]张瀚之,席德州,王欢,等.酱香型白酒机械化酿造不同轮次堆积发酵酒醅真菌群落结构多样性研究[J].中国酿造,2021,40(12):64-69.
[6]WANG W H,XU Y Q,HUANG,H Q,et al.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J].Food Res Int,2021,150(Pt A):110741.
[7]韩兴林,尚柯,王德良,等.酱香白酒堆积发酵过程中代谢风味生成规律的分析[J].酿酒,2018,45(4):37-44.
[8]左乾程,黄永光,朱家合,等.清酱香型白酒冬季发酵细菌群落演替及堆积过程细菌来源解析[J].食品科学,2021,42(12):145-152.
[9]王涵钰.玉米酒发酵过程中微生物多样性及风味品质研究[D].贵阳:贵州大学,2021.
[10]孙利林,李立郎,胡萍,等.酱香型白酒第四轮次酒酿造过程中细菌多样性分析[J].中国酿造,2020,39(5):35-39.
[11]DAI Y J,TIAN Z G,MENG W G,et al.Microbial diversity and physicochemical characteristics of the Maotai-flavored liquor fermentation process[J].J Nanosci Nanotechno,2020,20(7):4097-4109.
[12]JAIN K K,DEY T B,KUMAR S,et al.Production of thermostable hydrolases(cellulases and xylanase)from Thermoascus aurantiacus RCKK:a potential fungus[J].Bioproc Biosyst Eng,2015,38(4):787-796.
[13]赵驰,苏伟,母应春,等.不同原料对酱香大曲微生物群落结构及多样性的影响[J].食品科学,2022,43(10):133-141.
[14]WANG C L,SHI D J,GONG G L.Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008,24(10):2183-2190.
[15]WU Z Y,ZHANG W X,ZHANG Q S,et al.Developing new sacchariferous starters for liquor production based on functional strains isolated from the pits of several famous Luzhou-flavor liquor brewers[J].J I Brewing,2012,115(2):111-115.
[16]LIU C,GONG X,ZHAO G,et al.Liquor flavour is associated with the physicochemical property and microbial diversity of fermented grains in waxy and non-waxy sorghum(Sorghum bicolor)during fermentation[J].Front Microbiol,2021,12:618458.
[17]LENG Y W,XU Y.Improvement of flavour compound synthesis in a mixed culture system at high temperature by solid-state fermentation[J].J I Brewing,2015,121(4):609-613.
[18]XU Y,JI K.15-Moutai(Maotai):production and sensory properties[M].London:Woodhead Publishing,2012:315-330.
[19]张春林,杨亮,李喆,等.酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究[J].中国酿造,2021,40(11):31-36.
[20]ZHANG H X,WANG L T,YU W,et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J].Int J Food Microbiol,2021,336:108898.
[21]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biot,2015,42(12):1601-1608.
[22]许焰,吴群,徐岩.酱香型白酒酿造主要功能菌株对拜耳接合酵母的作用[J].微生物学通报,2018,45(1):42-53.
[23]YOU L,WANG S,ZHOU R P,et al.Characteristics of yeast flora in Chinese strong-flavoured liquor fermentation in the Yibin region of China[J].J I Brewing,2016,122(3):517-523.
[24]王琳,胡小霞,黄永光.环境因子对茅台镇不同轮次酿造环境细菌群落结构多样性的影响[J].食品科学,2022,43(8):150-157.
[25]孙利林,李立郎,胡萍,等.酱香型白酒第四轮次酒酿造过程中真菌多样性分析[J].中国酿造,2019,38(11):24-30.
[26]XIONG X,HU Y,YAN N,et al.PCR-DGGE analysis of the microbial communities in three different Chinese"Baiyunbian"liquor fermentation starters[J].J Microb Biot,2014,24(8):1088-1095.
[27]REN Q,SUN L,SUN Z,et al.Bacterial succession and the dynamics of flavor compounds in the Huangjiu fermented from corn[J].Arch Microbiol,2020,202(2):299-308.
[28]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[29]YUMOTO I,HIROTA K,NODASAKA Y,et al.Oceanobacillus oncorhynchi sp.nov.,a halotolerant obligate alkaliphile isolated from the skin of a rainbow trout(Oncorhynchus mykiss),and emended description of the genus Oceanobacillus[J].Int J Syst Evol Micr,2005,55: 1521-1524.
[30]CUI K X,WU Q,XU Y.Biodegradation of ethyl carbamate and urea with Lysinibacillus sphaericus MT33 in Chinese liquor fermentation[J].J Agr Food Chem,2018,66(6):1583-1590.
[31]栾春光,郝建国,江伟,等.不同工艺清香型大曲理化指标差异与微生物菌群结构的相关性研究[J].酿酒,2021,48(2):43-48.
[32]WANG L,WANG Y Y,WANG D Q,et al.Dynamic changes in the bacterial community in Moutai liquor fermentation process characterized by deep sequencing[J].J I Brewing,2015,121(4):603-608.
[33]ZHANG W Q,SI G,DU H,et al.Directional design of a starter to assemble the initial microbial fermentation community of Baijiu[J].Food Res Int,2020,134:109255.
[34]CAPPELLO M S,ZAPPAROLI G,LOGRIECO A,et al.Linking wine lactic acid bacteria diversity with wine aroma and flavour[J].Int J Food Microbiol,2016,243:16-27.
[35]DE A,MARIA C,MARIA C N,et al.Functional proteomics within the genus Lactobacillus[J].Proteomics,2016,16(6):946-962.
[36]姜丽.黑糯米酒发酵过程中微生物多样性及风味品质研究[D].贵阳:贵州大学,2020.
[37]刘奕霏,廉哲,梁鲁宁,等.GC-MS测定白酒中棕榈酸乙酯、油酸乙酯及亚油酸乙酯[J].刑事技术,2016,41(2):111-115.
[38]蒋洋,张翠英,李于,等.酒类风味物质对人体乙醇代谢影响的研究进展[J].食品科学,2021,42(15):242-250.
[39]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Enec,2019,84(1-3):6-18.
[40]胡军,余邦林,姬凌波,等.基于SHS-GC-MS和GC-IMS的对两种雪茄烟挥发性香味成分的分析与研究[J].中国烟草学报,2023,29(2):111-121.
[41]周洪江,刘晓露,姜文广,等.烟台产区三个葡萄品种原白兰地香气成分及感官特征的对比[J].中国酿造,2022,41(8):44-50.
[42]NGA B H,CHIU L L,KOH S I,et al.Occurrence of genetic segregation in a putative haploid strain of Endomyces fibuliger met by spontaneous sectoring of protoplast fusants[J].World J Microb Biot,1994,10(4):465-471.
[43]吴海锋,张瑾,陆祖军,等.酱香型白酒大曲细菌与蛋白酶研究进展[J].广西师范大学学报(自然科学版),2022,40(5):398-405.