酱香型白酒作为中国四大典型香型代表之一,因其“酱香突出,幽雅细腻,醇厚协调,回味悠长,空杯留香持久”的特点受到广大消费者的青睐[1]。1959年起,国家轻工部发酵所牵头开展茅台酒异地生产试验,全国各地酒厂纷纷学习茅台,发展酱香,国内山东、湖南、广西等地开始了酱香白酒的生产[2]。由于酿造环境的影响,致使酱酒产品呈现显著的地域特点[3-4]。其中贵州省是酱香型白酒的第一大产区,其酒体风格特征表现为“酱香浓郁,焦糊香为主,甜蜜香为辅,整体呈现复合花果香,酱中带陈”的特点[5];四川省作为酱酒第二大产区,其酒体风格表现为“以曲香、陈香为主线,酸味为辅,有着舒适的粮香,酒体醇甜突出,滋味丰富”[6];而相较于贵州、四川等产区酱香型白酒,在湖南、山东等产区生产的酱香型白酒的风味物质有所不同[5]。同时有大量研究证实,酱香型白酒的风味物质主要是在酿造过程中由微生物代谢产生,而环境微生物群落的种类和丰度的差异显著影响酱香型白酒的风味[3]。贵州省酱香型白酒产区与湖南省酱香型白酒产区虽同属亚热带季风湿润气候,但两个产区的地形地貌、气候变化、水资源等具有较大的差异,从而造成环境微生物的差异。因此分析不同地区酱香型白酒酿造过程中微生物的差异,对了解其不同产区酒的品质特征差异具有重要的意义。
近年来,随着人们对于白酒酿造微生物的不断研究,白酒的相关风味功能菌群成为研究热点,通过研究发现微生物代谢活动与白酒风味紧密相关。王鹏等[7]通过高通量测序分析和顶空固相微萃取与气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatograph-mass spectrometry,HS-SPME-GC-MS)技术分别对白酒风味和白酒酿造微生物群落进行研究发现,白酒酿造过程中的核心微生物群对白酒风味的演变具有显著相关性。张春林等[8]采用高通量测序及HS-SPME-GC-MS技术分别对茅台镇酱香型白酒二轮次堆积发酵酒醅风味和微生物群落结构进行研究发现,芽孢杆菌属、裸胞壳属、海洋芽孢杆菌属等微生物属是酱香型白酒堆积过程中的重要微生物,其中芽孢杆菌属是对风味贡献最大的一个微生物属,其与乙酸乙酯、异戊醇、糠醇等风味物质的形成正相关,与乳酸乙酯、苯乙醇、1-辛烯-3-酮等风味物质的形成负相关;裸胞壳属、海洋芽孢杆菌等微生物也影响着风味物质的形成。JIN Y等[9]以高温大曲为研究对象,通过应用冗余和代谢组学分析了主要微生物与风味成分的关系,认为假丝酵母属、曲霉属等真核微生物与酯类生成相关,红曲霉属和假丝酵母属利用苯丙氨酸代谢产生苯乙醇,芽孢杆菌与吡嗪类化合物生成相关。
目前虽然对白酒相关风味及功能菌群开展了一些研究,但对于湖南产区酱香型白酒的相关研究鲜有报道。因此,本研究采用高通量测序及HS-SPME-GC-MS技术,对湖南地区酱香型白酒1~6轮次出窖酒醅及各轮次基酒进行研究,全面分析湖南地区酱香型白酒各轮次酒醅细菌群落结构、轮次酒风味物质组成及微生物与风味物质之间的相关性。以期通过对湖南地区酱香型白酒微生物及风味的研究,为了解湖南地区酱香型白酒的品质与酿造微生物之间的关系提供一定的数据支撑和参考,也为酱香型白酒风味地域性差异的内在机制提供参考。
1 材料与方法
1.1 材料与试剂
酱香型白酒样品:湖南省湖南武陵酒有限公司(28.14°N,106.18°E),2020年-2021年1~6轮次出窖酒醅及轮次基酒。脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega BioTek公司;AxyPrep DNA凝胶回收试剂盒:美国AXYGEA公司;rTaq DNA聚合酶试剂盒、DNA Marker:北京全式金生物技术有限公司;引物合成:生工生物工程(上海)股份有限公司;乙酸乙酯等83种风味物质标准品(纯度均≥98.0%):上海阿拉丁生化科技股份有限公司;乙醇(色谱纯):上海安谱实验科技股份有限公司;Milli-Q超纯水:美国Millipore公司。
1.2 仪器与设备
ABI Gene AmpR 9700型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司;DYY-8C型高压电泳仪:北京六一仪器厂;JS-680C凝胶成像仪:上海培清科技有限公司;Illumina MiSeq测序平台:上海美吉生物医药科技有限公司;QuantiFlourTM-ST蓝色荧光定量系统:美国Promega公司;GC-2010气相色谱仪、QP2010 Plus气相色谱-质谱联用仪:日本岛津公司;ZB-WAX plus(60 m×0.25 μm×0.25 mm)色谱柱:美国Phenomenex公司;SPME 萃取头(DVB/CAR/PDMS,2 cm,50/30 μm):美国Supelco公司。
1.3 方法
1.3.1 样品处理
酒醅:酒醅样本的采集从1~6轮次窖池发酵工序中同一位置进行,分别在酒醅的上、中、下层三层采用5点取样法进行取样,每轮次酒醅共计15个取样位点。将上述采样位点的样品等质量混匀后,置于无菌自封袋中,-80 ℃保存备用。
轮次酒:在对酒醅跟踪取样的同时,对相应生产轮次所产的轮次酒进行采样。取500 mL密闭容量瓶分别对6个轮次新蒸酒取样,每个样品取4瓶,于避光阴凉处贮存备用。
1.3.2 酒醅样品DNA提取及16S rDNA 测序分析
采用E.Z.N.A. Soil DNA Ki(tD5625-01)进行样品提取。完成基因组DNA抽提后,使用1%琼脂糖凝胶电泳检测基因组DNA,用NanoDrop2000进行浓度的检测。使用细菌的16S rDNA通用引物对样品所提取的DNA进行PCR扩增,16S rDNA V3-V4可变区引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3),每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFlourTMST蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。再利用Illumina MiSeq进行测序分析。
Soil DNA Ki(tD5625-01)进行样品提取。完成基因组DNA抽提后,使用1%琼脂糖凝胶电泳检测基因组DNA,用NanoDrop2000进行浓度的检测。使用细菌的16S rDNA通用引物对样品所提取的DNA进行PCR扩增,16S rDNA V3-V4可变区引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3),每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFlourTMST蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。再利用Illumina MiSeq进行测序分析。
1.3.3 高通量测序
采用Illumina高通量测序技术,基于Illumina MiSeq测序平台,委托上海美吉生物医药科技有限公司分别对细菌V3-V4高变区序列进行测序分析。
1.3.4 轮次酒中挥发性化合物分析
(1)前处理
醇、醛、酸、酯、酮类组分采用直接进样法:吸取样品于10.0 mL容量瓶中,加入0.1 mL叔戊醇、乙酸正戊酯、2-乙基丁酸三内标混合使用液并定容后混匀,用气相色谱仪测定。
酚类、吡嗪类、呋喃类组分采用HS-SPME法:准确量取2 mL样品至10 mL 容量瓶中,加入经煮沸并冷却至室温(25 ℃)的超纯水,定容至刻度后混匀。取5 mL 稀释后的样品于20 mL 顶空瓶中,加入10 μL 2-甲氧基-3-甲基吡嗪内标溶液、1.8 g NaCl 和磁力转子,用具聚四氟内垫的盖子密封后,磁力搅拌至NaCl 溶解。于50 ℃水浴中平衡10 min后,插入SPME萃取头保温吸附50 min,然后转移至进样口,解吸5 min。
(2)仪器条件
直接进样气相色谱条件:进样口温度250 ℃,进样量1.0 μL,分流比20∶1。升温程序为初温35 ℃,保持1 min,以3.0 ℃/min升到70 ℃,然后以3.5 ℃/min升到180 ℃,再以15 ℃/min升到210 ℃,保持5 min。载气为高纯氮气(N2)(纯度>99.999%),流速1.0 mL/min。氢火焰离子化检测器温度250 ℃。
HS-SPME气相色谱条件:进样口温度250 ℃;柱流量1.2 mL/min;不分流进样;载气为高纯氦气(He)(纯度>99.999%)。升温程序为初始温度50 ℃保持6 min,以4 ℃/min升至100 ℃保持1 min,再以2 ℃/min 升至105 ℃,然后以20 ℃/min升至250 ℃保持5 min,总程序时间34.25 min。
质谱条件:电子电离(electronic ionization,EI)源,电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;溶剂延迟时间5 min;选择离子监测(selected ion monitoring,SIM)扫描模式。
1.3.5 数据及图像处理
采用SPSS 20.0软件计算微生物与风味化合物之间的Spearman相关系数(ρ),然后选取|ρ|>0.8且P<0.05的作为互作对象。使用Gephi 0.9对微生物和风味化合物之间的相互关系进行可视化。
2 结果与分析
2.1 Apha多样性分析
利用Illumina Miseq高通量测序平台对湖南地区1~6轮次发酵酒醅样本进行测序分析,共从细菌16S rRNA V3-V4序列中获得了569 302个有效基因序列,平均每个样本94 884条有效序列,测序数据处理结果见表1。由表1可知,所有样品操作分类单元(operational taxonomic unit,OTU)的覆盖率均>98.87%,说明各轮次样品文库的覆盖率足够大,样品中的序列基因基本被全部检出,测序结果能体现样品中细菌菌群多样性的真实情况。
表1 测序数据统计处理
Table 1 Statistical process of sequencing data
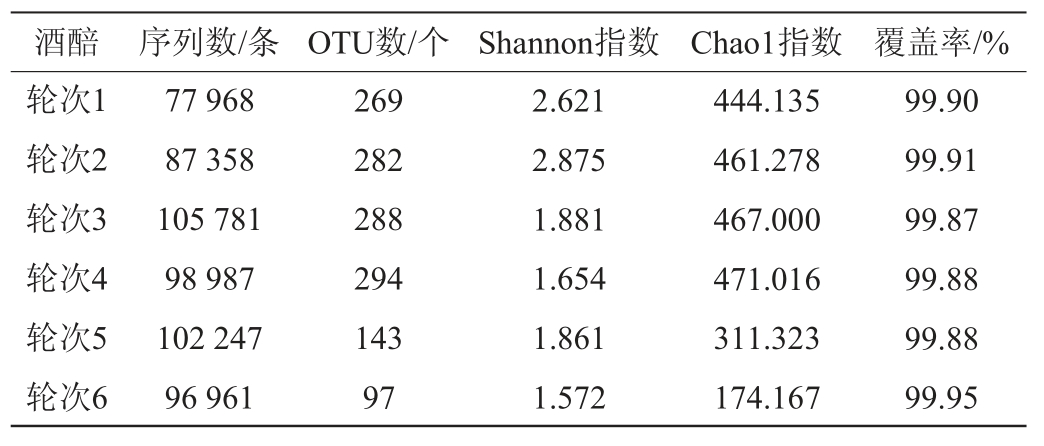
通过USEARCH将标签分组成具有97%相似性的OTU,各轮次酒醅样品共得到1 075个OTU,其中4轮次的OTU数最高为294,5、6轮次的OTU数较其他轮次相对较低。基于OTU聚类分析结果,对不同轮次窖池发酵酒醅样品进行Alpha多样性分析,选取Chao1指数和Shannon指数,对群落物种组成的多样性及丰富度进行综合评价[10]。其中Shannon指数反映样品群落多样性,Shannon指数值越小代表样品中的细菌群落丰度的均匀性越低;Chao1指数反映样品群落的丰富度,Chao1数值越大代表样品中的物种数越丰富。由表1可知,1、2轮次酒醅样品的Shannon指数和Chao1指数相对较高,说明1、2轮次酒醅样品细菌多样性和丰富度较高,后从3轮次开始Shannon指数降低,且3、4、5、6轮次基本一致,说明从3轮次开始细菌群落的丰度均匀性降低,但保持在一个相对稳定的范围;3、4轮次Chao1指数相对较高,从5轮次开始Chao1指数逐渐下降,说明从5轮次开始物种丰富度逐渐减少。戴奕杰等[11]对贵州产区酱香型白酒各轮次出窖酒醅细菌群落结构研究发现,贵州产区酒醅样品中细菌群落的Shannon指数(3.20~3.72)和Chao1指数(463.23~619.14)均高于本研究Shannon指数(1.52~2.80)和Chao1指数(174.167~471.016)。而WANG L C等[12]对四川产区酱香型白酒4~7轮次窖内发酵细菌群落结构研究发现,四川产区酒醅样品中细菌群落的Shannon指数(0.510~0.866)和Chao1指数(103.11~140.00)均低于本研究。这表明,湖南产区酱香型白酒发酵酒醅细菌群落的种类数量和均匀性相较于贵州产区相对较低,但高于四川产区。
2.2 细菌群落结构组成
为更深入探究湖南地区酱香型白酒各轮次酒醅样品在各分类水平的组成情况,对不同轮次发酵酒醅样品中细菌菌群结构的门水平、属水平进行分析。基于门水平细菌菌群结构见图1。由图1可知,湖南地区各轮次发酵酒醅样品中共检出25个门。根据各菌门的相对丰度,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为各个轮次中共有的优势细菌门(相对丰度>1%)。其中,厚壁菌门(Firmicutes)为第一优势菌门,在各轮次样品中相对丰度为86.70%~98.29%;其次是变形菌门(Proteobacteria),相对丰度为1.51%~10.86%。胡小霞等[13]利用高通量测序技术分析了贵州省产区酱香型白酒一轮次窖池发酵酒醅中细菌群落组成,结果显示窖池发酵酒醅中优势细菌门为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),厚壁菌门(Firmicutes)占绝对主导地位(平均相对丰度为98.01%);孙利林等[14]对贵州产区酱香型白酒第四轮次酿造过程中窖内酒醅细菌群落结构组成进行分析,结果显示窖内酒醅共16个门,其中最重要的细菌是厚壁菌门(Firmicutes),其相对丰度为35%以上,其次是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)等;戴奕杰等[11]同样分析了贵州省酱香型白酒各轮次出窖酒醅细菌群落组成,发现优势菌门主要为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),其中厚壁菌门(Firmicutes)相对丰度约为42%,变形菌门(Proteobacteria)相对丰度约为46%。由此可见,湖南地区酱香型白酒窖池发酵酒醅样品优势菌门与其他产区基本相似,但具有一定的差异,厚壁菌门(Firmicutes)相对丰度较高,而变形菌门(Proteobacteria)相对丰度较少。
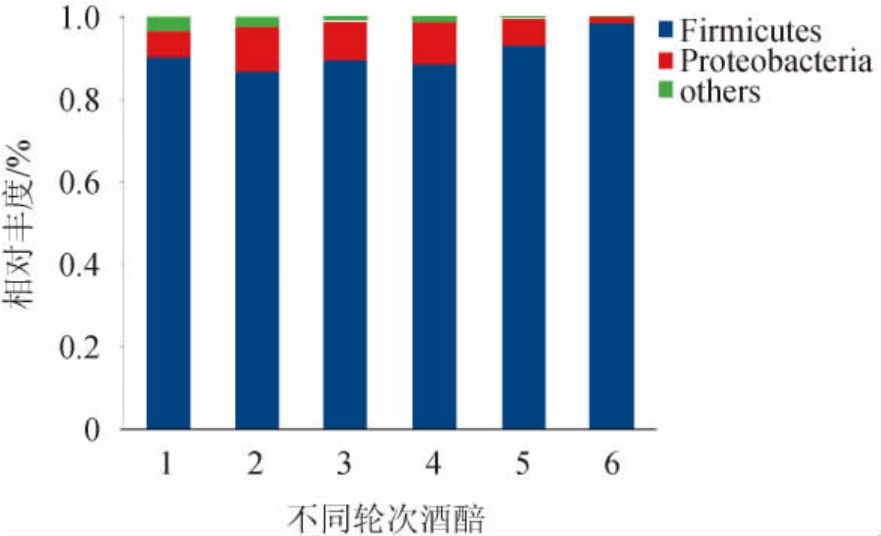
图1 基于门水平湖南地区酱香型白酒不同轮次酒醅样品中主要细菌群落结构
Fig.1 Main bacterial community structure of different rounds of fermented grains samples of sauce-flavor Baijiu in Hunan area based on phylum level
others:相对丰度<1%的其他菌门。
基于属水平细菌菌群结构见图2。由图2可知,湖南地区酱香型白酒各轮次发酵样品中共检测出308个属,相对丰度较高的菌属为乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、劳尔氏菌属(Ralstonia)和芽孢杆菌属(Bacillus)。将单轮次相对丰度>1%的细菌属定义为该轮次的优势菌属,各个轮次窖内发酵优势菌属见表2。由表2和图2可知,1轮次共检出171个属,优势菌属共有4个,包括乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、克罗彭斯特菌属(Kroppenstedtia)、和小球菌属(Pediococcus),其中以乳杆菌属(Lactobacillus)为绝对优势菌属其相对丰度为81.80%,其次是醋杆菌属(Acetobacter),相对丰度为5.28%。2轮次共检测出198个菌属,优势菌属共有5个,包括乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)、小球菌属(Pediococcus)和苍白杆菌属(Ochrobactrum),其中乳杆菌属(Lactobacillus)和醋杆菌属(Acetobacter)相对丰度与1轮次基本相同。3、4、5轮次被称为“大回酒”,其所产酒质量最好,出酒率最高,其香气特征较为相似[15]。3、4、5轮次依次检出137、151和85个菌属,其中3、4轮次优势菌属共有3个,包括乳杆菌属(Lactobacillus)(相对丰度为86.46%~88.06%)、醋杆菌属(Acetobacter)(相对丰度为1.97%~6.53%)和劳尔氏菌属(Ralstonia)(相对丰度为6.62%~6.11%)。5轮次优势菌属共有4个,包括乳杆菌属(Lactobacillus)(相对丰度为90.64%)、醋杆菌属(Acetobacter)(相对丰度为2.40%)、劳尔氏菌属(Ralstonia)(相对丰度为3.70%)和芽孢杆菌属(Bacillus)(相对丰度为1.04%),由此结果显示,3、4、5轮次其细菌菌群结构也较为相似。6轮次共检出62个属,优势菌属共有2个,包括乳杆菌属(Lactobacillus)(相对丰度为96.13%)和醋杆菌属(Acetobacter)(相对丰度为1.30%)。湖南地区窖内发酵样品中各轮次共有的优势菌属主要为乳杆菌属(Lactobacillus)和醋杆菌属(Acetobacter)。
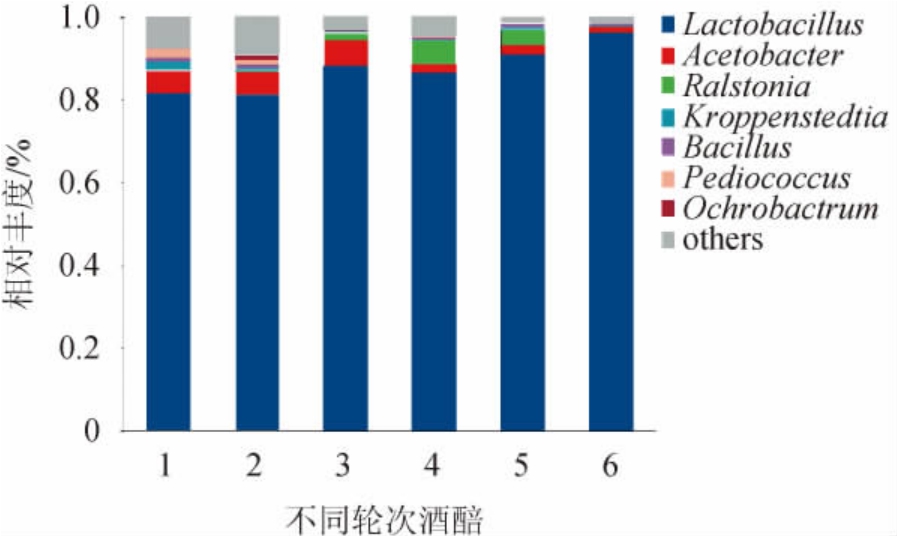
图2 基于属水平湖南地区酱香型白酒不同轮次酒醅样品中主要细菌群落结构
Fig.2 Main bacterial community structure of different rounds of fermented grains samples of sauce-flavor Baijiu in Hunan area based on genus level
others:相对丰度<1%的其他菌属。
表2 酱香型白酒不同轮次酒醅样品中的优势菌属
Table 2 Dominant bacteria genera in different rounds of fermented grains samples of sauce-flavor Baijiu

相较于其他产区,湖南地区酱香型白酒各轮次发酵样品中优势细菌属与其他产区的菌属组成基本相似,但相对丰度存在一定的差异。胡小霞等[13]研究发现,贵州产区酱香型白酒1轮次窖池发酵酒醅样品中,平均相对丰度>1%的菌属只有乳杆菌属(Lactobacillus),其平均相对丰度为79.42%;WANG L C等[12]研究发现,四川产区酱香型白酒4~7轮次窖内发酵酒醅样品中优势细菌属为乳杆菌属(Lactobacillus)和芽孢杆菌属(Bacillus),而乳杆菌属(Lactobacillus)在各轮次相对丰度约为90%左右。而湖南地区酱香型白酒中乳杆菌属(Lactobacillus)在1轮次相对丰度为81.80%,且各轮次平均相对丰度为87.41%。戴奕杰等[11]研究发现,贵州产区酱香型白酒各轮次窖内发酵酒醅样品中Escherichia-Shigella相对丰度较高,而在湖南地区Escheri-chia-Shigella相对丰度<1%。Escherichia-Shigella是一种典型的环境微生物,可能是由于贵州产区环境等更适合Escherichia-Shigella细菌的生长。也进一步说明由于不同产区温度、湿度及环境中微生物情况造成不同产区酱香型白酒微生物群落情况具有一定的差异,这也可能是造成不同产区酱香型白酒风味差异的主要原因之一。
2.3 各轮次酱香型白酒风味物质含量特征
通过HS-SPME-GC-MS 技术分别对湖南地区酱香型白酒酒醅蒸馏得到的轮次基酒中风味物质含量进行分析,结果见表3。
表3 不同轮次基酒挥发性风味物质含量检测结果
Table 3 Determination results of volatile flavor components contents in different rounds of base liquor

续表

续表
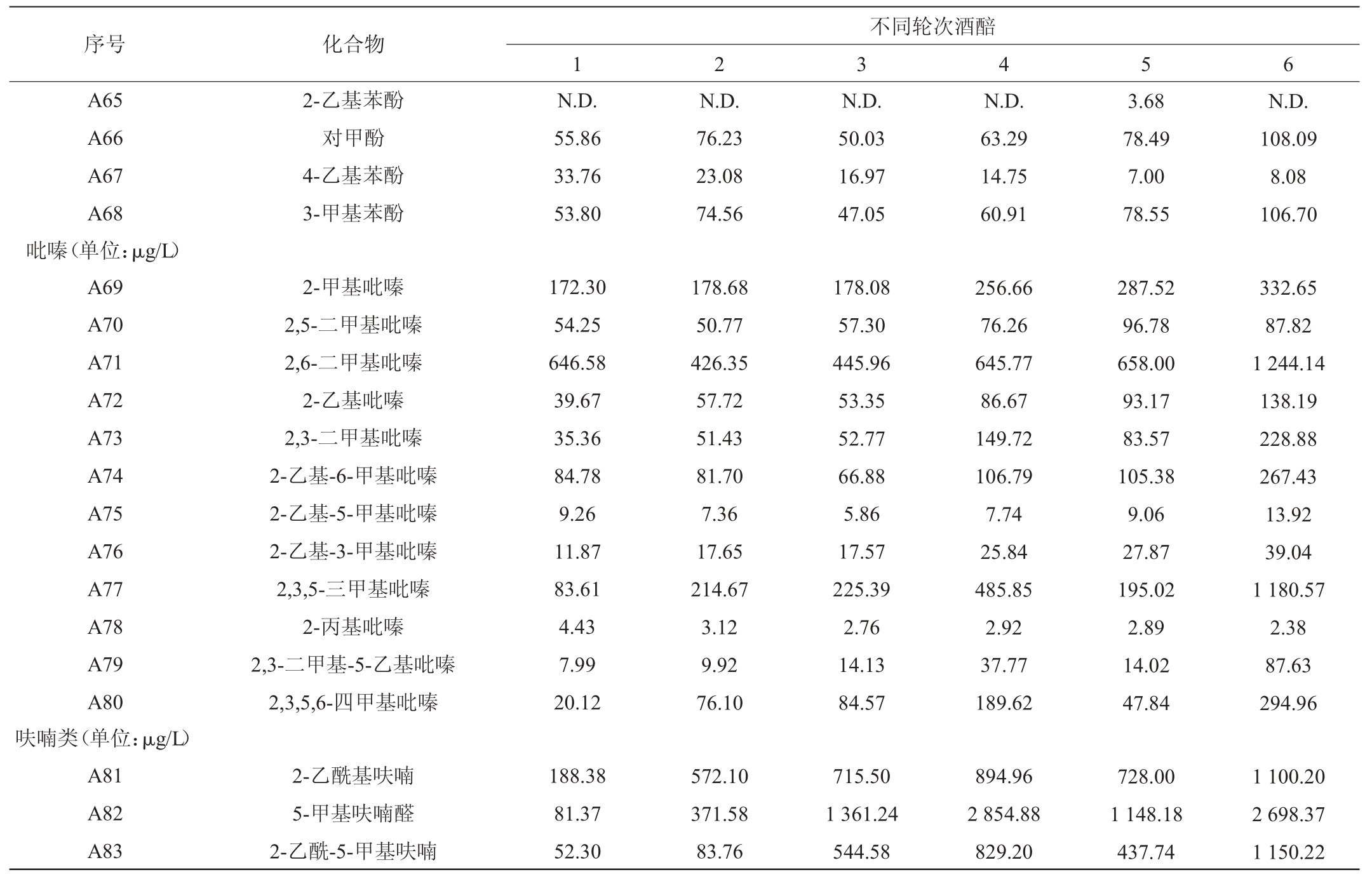
注:“N.D.”表示未检出。
由表3可知,不同轮次基酒中共检出83种风味物质,其中包含酯类23种、酸类9 种、酮类3种、醛类8 种、醇类14 种、酚类11种、吡嗪类12种和呋喃类3 种。通过分析发现,湖南地区不同轮次基酒中酯类、醇类和醛类是重要且丰富的风味化合物。该结果与何冬梅等[16]对贵州地区酱香型白酒轮次酒风味物质成分结果相近,但湖南地区轮次酒风味物质含量较贵州地区具有一定的差异。同时通过对整个实验数据进行分析发现,3、4、5轮次基酒各风味物质含量及种类较高,且含量达到相对平衡,使酒体各风味物质之间较协调。
湖南地区1~6轮次基酒样品中共检出酯类23种,其中共有酯类13种,大部分酯类呈先上升后下降趋势,四大酯类(己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯)均被检出,其中以乳酸乙酯及乙酸乙酯的含量最高。乳酸乙酯在1轮次含量较低,但随后急剧增加,在3轮次基酒中可达到3 380.83 mg/L后呈逐渐下降趋势;乙酸乙酯在1轮次基酒中为8 688.11 mg/L,2轮次基酒中为9 060.45 mg/L后逐渐下降,并在第3、4、5轮次基酒样品中含量相差不大。该结果与戴奕杰等[17-18]对贵州地区酱香型白酒轮次酒风味物质的研究结果相似,但较贵州地区相比,湖南地区轮次酒酯类物质含量具有一定的差异。
湖南地区1~6轮次基酒样品中醇类含量较高的主要包括甲醇、正丙醇、异丁醇、正丁醇和3-甲基丁醇,其中含量最高的醇类为正丙醇。这几种醇类物质随着伦次的增加整体呈现先减少后增加的趋势,该结果与余硕文等[18-19]对贵州地区和山东地区酱香型白酒轮次酒风味物质的研究结果相似。同时通过对整个轮次样品整体分析发现3、4、5轮次基酒的醇类含量相差不大,但明显低于其他几个轮次。生产实践证明,3、4、5轮次是酱香型白酒生产过程中的“大回酒”轮次,其为产量最高、质量最优的3个轮次,因此也说明甲醇、正丙醇、异丁醇、正丁醇和3-甲基丁醇与“大回酒”轮次产优质酒密切相关。在醛类中共检测出8种醛类,含量较高的有乙醛、乙缩醛、糠醛和异戊醛,其中乙醛和乙缩醛呈先上升后下降的趋势,异戊醛呈先下降后上升的趋势,而糠醛则呈现波浪式变化趋势,该结果与李东等[6]研究结果基本一致。有研究发现糠醛有类似杏仁味,带焦香,是酱香白酒焦香风味物质的来源之一。结果表明,湖南地区各轮次酒样品中糠醛的含量为0~434.80 mg/L,平均含量为143.71 mg/L,余硕文等[18]分析了贵州地区君丰酱香型白酒轮次酒风味物质,发现轮次酒中糠醛的含量为38.06~345.98 mg/L,平均含量为113.00 mg/L,说明湖南地区酱香型白酒焦香风味成分中糠醛含量略高于贵州地区君丰酱香型白酒。酮类物质包括丙酮、2-丁酮和3-羟基-2-丁酮,其中3-羟基-2-丁酮的含量相对较高,且随着轮次的增加呈现先增加后减少的趋势。
轮次基酒中检出12种吡嗪类,其中2,3,5-三甲基吡嗪、2,6-二甲基吡嗪、2-甲基吡嗪和2,3,5,6-四甲基吡嗪含量相对较高。不同轮次基酒间相比,除2,5-二甲基吡嗪和2-丙基吡嗪外,各吡嗪类组分均为六轮次基酒中含量最高。吡嗪类化合物风味阈值较低,气味特征较明显,主要具有坚果香、烘烤香和焦香等怡人风味,并对其他香味有明显的衬托叠加和烘托作用。
2.4 相关性分析
为进一步研究湖南地区酱香型白酒风味物质与酒醅微生物之间的相关性,找出风味物质与微生物之间的相互关系,将所有样品中检测到的83种风味物质与在属水平选取的丰度前10的细菌属作为变量,采用Spearman相关性分析研究微生物与风味之间的关联性,使用Gephi 0.9软件构建微生物与风味物质之间相关性网络图,结果见图3。
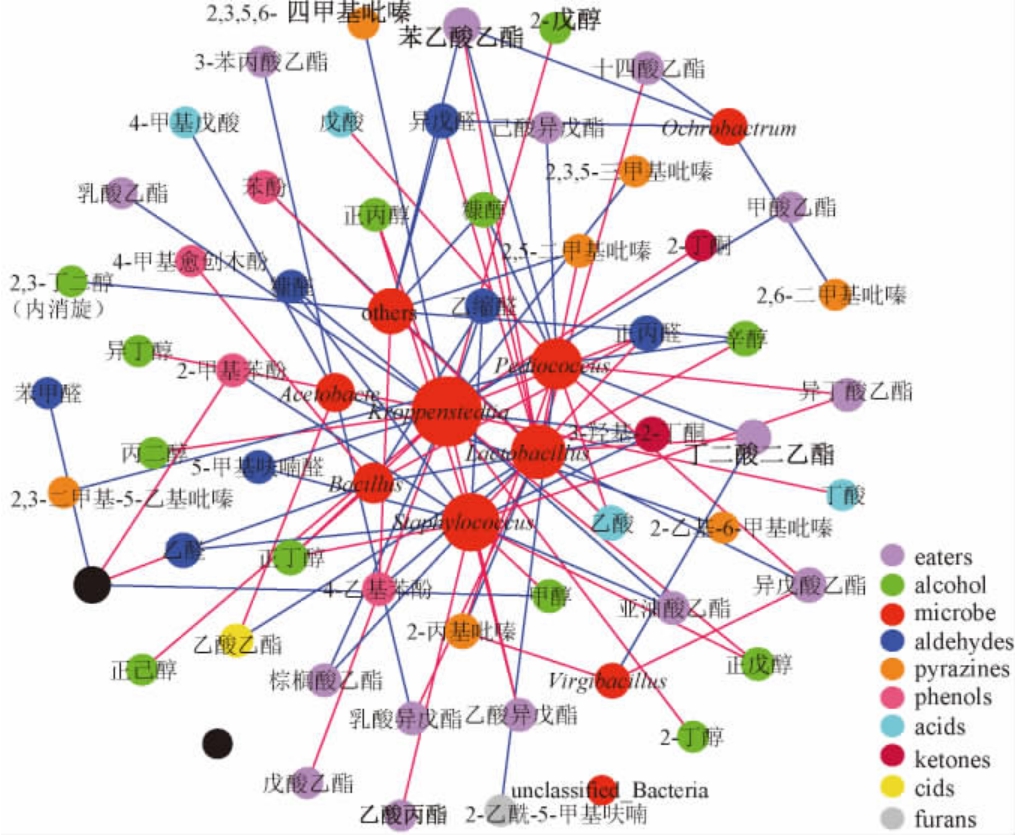
图3 风味物质与属水平微生物群落相关性分析
Fig.3 Correlation analysis between flavor compounds and microbial community at genus level
红色线代表正相关;蓝色线代表负相关。
由图3可知,克罗彭斯特菌属(Kroppenstedtia)是连接数最大的一个属,与23个风味化合物具有显著相关性,其中包含大部分的酯类(乳酸乙酯、甲酸乙酯等)、醇类(正丙醇、异丁醇等)、醛类(糠醛、正丙醛、乙缩醛等)和还有少量的酸类(丁酸)和吡嗪类(2,3,5-三甲基吡嗪等)。克罗彭斯特菌属属于高温放线菌科(Thermoactinomycetaceae),主要分布于环境及土壤中,有研究表明,在酱香型白酒中高温大曲[20]及酱香型白酒高温堆积酒醅[21]中,该属为主要菌属,但其具体功能未见报道。葡萄球菌属(Staphylococcus)与16个风味化合物具有相关性,主要包括酯类(乙酸丙酯、乙酸异戊酯等)、醛类(乙醛、糠醛、正丙醛等)、醇类(甲醇、正丙醇、正丁醇等)和酚类(2-甲基苯酚)。乳杆菌属(Lactobacillus)与14个风味化合物具有相关性,主要包括大部分酯类(乙酸乙酯、乳酸异戊酯)和少量的醇类(糠醇、辛醇)、酸类(乙酸)、醛类(异戊醛)、酚类(苯酚)和吡嗪类(2,5-二甲基吡嗪)等。乳杆菌属中的乳酸杆菌对白酒风味有较大的影响,是白酒酿造过程中的核心微生物[22],有研究表明,L.actobacillus能够促进白酒中酯类物质的形成,如果在发酵过程中缺少这种菌,则会导致发酵之后,且产出的白酒中酯类化合物含量也较低[23]。芽孢杆菌属(Bacillus)与6个风味化合物具有相关性,主要包括醛类(乙醛、乙缩醛等)、醇类(正丁醇)和少量的酮类和酚类化合物。芽孢杆菌属的枯草芽孢杆菌和地衣芽孢杆菌能够产生典型的酱香风味,气质分析发现这两株菌代谢产生了许多与酱香香气相关的风味化合物,对酱香型白酒品质至关重要[24]。醋杆菌属(Acetobacter)与5个风味化合物具有相关性,其主要与酯类(乙酸丙酯、乳酸异戊酯等)和少量的酸类(4-甲基戊酸)和吡嗪类(2-乙基-6-甲基吡嗪)相关。醋杆菌属是白酒酿造过程中重要的发酵微生物,其能氧化葡萄糖或乙醇生成乙酸,进而促进乙酸乙酯、乙酸异戊酯等酯类,进而对酒体风味具有积极的作用,另外,醋杆菌属还能够产生细菌纤维素[25]具有氧化乙醇生成乙酸并进一步氧化乙酸生成二氧化碳的能力[26]。此外,小球菌属(Pediococcus)、unclassified Bacteria、Ochrobactrum和Virgibacillus与风味物质也有很大的联系(连接数分别为12、4、4、3)。因此根据分析,总体上与风味成分相关性较强的微生物主要有克罗彭斯特菌属(Kroppenstedtia)、葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、小球菌属(Pediococcus)、芽孢杆菌属(Bacillus)和醋杆菌属(Acetobacter),上述6种微生物可能是影响湖南地区酱香型白酒风味物质的主要微生物种类。
3 结论
本研究采用高通量测序技术对湖南地区酱香型白酒发酵酒醅细菌群落结构多样性进行分析,各轮次中共检出25个门,308个属,优势菌门为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria);在属水平上不同轮次发酵酒醅样品中细菌菌群在数量及结构上多样性特征明显,但核心菌群种类基本一致,湖南地区各轮次中相对丰度较高的优势菌属分别是乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、劳尔氏菌属(Ralstonia)和芽孢杆菌属(Bacillus),其中乳杆菌属(Lactobacillus)和醋杆菌属(Acetobacter)为各轮次共有的优势菌属。相较于其他产区,湖南地区酱香型白酒各轮次发酵样品中细菌群落结构、优势菌门种类和数量,群属丰度等方面存在一定的差异。同时,采用顶空固相微萃取-气相色谱-质谱联用(HS-SPME-GC-MS)对湖南地区酱香型白酒各轮次基酒挥发性风味物质进行了测定,共检出83种风味物质,其中包含酯类23种、酸类9种、酮类3种、醛类8种、醇类14种、酚类11种、吡嗪类12种和呋喃类物质3种。通过微生物与风味物质的相关性分析,结果发现与风味物质关联性较强的微生物为克罗彭斯特菌属(Kroppenstedtia)、葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、小球菌属(Pediococcus)、芽孢杆菌属(Bacillus)和醋杆菌属(Acetobacter),上述6种微生物可能是影响湖南地区酱香型白酒的主要风味物质。相较于其他产区,湖南地区酱香型白酒发酵酒醅样品细菌群落结构、优势菌门种类数量、群属丰度及轮次基酒风味物质等方面存在一定的差异。本研究结果为深入了解湖南地区酱香型白酒的品质与酿造微生物之间的关系提供一定的数据支撑和参考,并为不同产区白酒酿造的特性差异提供理论依据。
[1]FAN W L,XU Y,QIAN M C.Identification of aroma compounds in Chinese"Moutai" and "Langjiu" liquors by normal phase liquid chromatography fractionation followed by gas chromatography/olfactometry[M]//Flavor chemistry of wine and other alcoholic beverages.American Chemical Society,2012:303-338.
[2]钟方达.酱香型白酒生产现状分析及思考[J].酿酒科技,2009(11):123-127.
[3]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[4]FANG C,DU H,JIA W,et al.Compositional differences and similarities between typical Chinese Baijiu and western liquor as revealed by mass spectrometry-based metabolomics[J].Metabolites,2018,9(1):2-18.
[5]张健,范奇高,陆伦维,等.浅析酱香型白酒发展现状及趋势思考[J].中国酿造,2022,41(4):234-238.
[6]李东,胥春平,严志勇,等.四川酱酒风味成分与风格的探讨[J].酿酒,2016,43(1):39-42.
[7]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[8]张春林,杨亮,李喆,等.酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究[J].中国酿造,2021,40(11):31-36.
[9]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and mi-crobial communities: a metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[10]袁帅.用16S r DNA V4区高通量测序分析两种酒糟细菌多样性[D].贵阳:贵州师范大学,2014.
[11]戴奕杰,田志强,黄家岭,等.酱香型白酒生物化学及微生物学研究进展[J].酿酒科技,2016(3):100-105.
[12]WANG L C,ZHONG K,LUO A M,et al.Dynamic changes of volatile compounds and bacterial diversity during fourth to seventh rounds of Chinese soy sauce aroma liquor[J].Food Sci Nutr,2021,9(7): 3500-3511.
[13]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[14]孙利林,李立郎,胡萍,等.酱香型白酒第四轮次酒酿造过程中细菌多样性分析[J].中国酿造,2020,39(5):35-39.
[15]杨大金,蒋英丽,陈小林,等.酱香单次酒风格质量、香味组分特点与作用及工艺对其影响[J].酿酒科技,2004(4):35-37.
[16]何东梅.基于风味组学对贵州酱香轮次基酒风味结构的解析[D].贵阳:贵州大学,2021.
[17]戴奕杰,李宗军,田志强,等.酱香型白酒的轮次酒以及“二次制曲”过程中的风味物质分析[J].食品研究与开发,2019,40(19):24-32.
[18]余硕文,佘荣书,韩兴林,等.君丰大曲酱香白酒出池酒醅特性与各轮次基酒风味相关性分析[J].中国酿造,2022,41(7):64-70.
[19]韩兴林,潘学森,刘民万,等.云门酱香型白酒风味特征的分析研究[J].酿酒科技,2014(10):6-8.
[20]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[21]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
[22]杜如冰,吴群,徐岩.基于三步荧光定量PCR技术揭示不同产区白酒酿造系统中Lactobacillus sp.的分布特征[J].微生物学通报,2020,47(1):1-12.
[23]PANG X N,HAN B Z,HUANG X N,et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Sci Rep,2018,8(1):1-12.
[24]柳习月,朱琪,杨帆,等.蛋白组学揭示苯丙氨酸代谢对酱香大曲风味影响[J].食品科技,2021,46(8):1-6.
[25]胡建颖,吴佳婧,王昕怡,等.产纤维素菌株的分离鉴定及产量相关性[J].微生物学通报,2019,46(1):93-102.
[26]夏凯,朱军莉,梁新乐.醋酸菌耐酸机理及其群体感应研究新进展[J].微生物学报,2017,57(3):321-332.