益生菌(probiotics)在联合国粮农组织/世界卫生组织(Food&Agriculture Organization/World Health Organization,FAO/WHO)定义中是指能定植于人体肠道的活性微生物,通过摄入足够数量,对宿主健康起到有益作用[1-2],对于维持人体及动物肠道菌群平衡发挥着重要作用,具有改善肠道菌群结构、增强机体免疫系统、降低胆固醇和血压、降低氧化应激和餐后血糖等多种功效[3-5]。植物乳杆菌(Lactobacillus plantarum)是最广为人知的乳杆菌种之一,是一种公认的益生菌[6-7],其可以从各种来源分离得到,如蔬菜、肉、乳制品、葡萄酒等,同时也存在于胃肠道中并发挥重要作用[8-9]。植物乳杆菌具有优良的益生特性,被广泛应用于发酵食品中,能够产生多种抑菌物质,具有比较优良的抑菌性能,在食品保鲜、拮抗致病菌、改善人体健康中具有潜在的应用前景,逐渐成为研究的热点[10-12]。
随着人们对益生菌的广泛关注,市场涌现出种类繁多的益生菌制剂,主要以粉剂、颗粒剂、胶囊和片剂等固体形式居多[13],益生菌粉属于其中的粉剂类别之一,其中添加益生菌菌种有几种、十几种甚至二十多种,其中植物乳杆菌是常见的添加菌之一。目前益生菌的分离鉴定是现行标准GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》,利用传统的涂片镜检和碳水化合物生化反应方法对标准中的6种乳杆菌和嗜热链球菌进行鉴定,其中存在约10%的可能性植物乳杆菌与干酪乳杆菌和鼠李糖乳杆菌生化试验结果相同,导致传统生化方法对这3种乳杆菌的鉴定实用性和可操作性受到较大限制。另外由于菌株活性严重影响生化反应结果,致使鉴定问题更为难上加难[14-15],另外益生菌粉剂中添加益生菌种类较多,添加量也不明确,从而导致益生菌在分离上也存在很大的难题,因此研究和开发快速精准的检测和鉴定方法非常重要。
实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-fqPCR)技术在菌种鉴定中已得到广泛应用。肖其胜等[16]根据双歧杆菌属16S rRNA基因的保守区序设计特异性引物和探针,建立一种鉴定食品中双歧杆菌属的实时荧光聚合酶链式反应检测方法,能准确、快速检测食品中双歧杆菌属细菌。刘艳艳等[17]基于猪链球菌的gdh基因和猪多杀性巴氏杆菌的plpE基因,设计2对特异引物及TaqMan探针,以细菌16S rRNA基因设计通用引物及探针,建立了一种能同时检测猪链球菌和猪多杀性巴氏杆菌的多重实时荧光定量PCR检测方法,能够用于2种病原菌的同时检测。孙畅等[18]建立植物乳杆菌和副干酪乳杆菌标准菌株的实时荧光定量PCR检测方法的标准曲线,得出相关系数R2分别为0.994 3和0.999 6,表明线性关系较好,可进行发酵豆乳中2种菌株含量的检测。实时荧光定量PCR检测方法还应用于检测单增李斯特菌[19]、蜡样芽孢杆菌[20]、克罗诺杆菌[21]、嗜热链球菌[22]、动物双歧杆菌乳亚种[23]、植物乳杆菌[24-25]等。
本研究选取植物乳杆菌(Lactobacillus plantarum)16S rRNA基因,设计特异性引物和Taqman探针,建立植物乳杆菌的实时荧光定量PCR检测方法,并且对益生菌粉中的益生菌不经过平板培养分离,而是直接对样品进行脱氧核糖核酸(deoxyribonucleic acid,DNA)提取,利用RT-fqPCR技术对植物乳杆菌进行快速鉴定。该方法不仅能避免因菌种多样性和单一菌种添加数量不确定在培养分离过程中的丢失现象,同时也能快速精准对植物乳杆菌进行鉴定,填补目前益生菌粉样品未标明单一菌种数量及活菌数的实际检测需求的空缺,更具有时效性和实际可操作性,同时也能在多种干扰菌的存在下检测到植物乳杆菌,相比传统方法大大缩短了植物乳杆菌的鉴定时长,并且具有灵敏度高、特异性强、操作简便等优点。对益生菌粉中益生菌的鉴定起到积极推动的作用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本试验所用的乳杆菌属标准菌株共18株(其中有6种标准内菌株共9株),双歧杆菌属标准菌株共5株和1株嗜热链球菌(为标准内菌株):分别来源于美国典型菌种保藏中心(American type culture collection,ATCC)、中国工业微生物菌种保藏管理中心(China center of industrial culture collection,CICC)、中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC)三家菌种保藏中心,本试验所用的24株菌信息详见表1。
表1 本试验所用的菌株信息
Table 1 Information of strains used in the experiments
续表
1.1.2 样品
从某大型超市购买12种含有植物乳杆菌(L.plantarum)的益生菌粉。其中原料样品类型1种,成品类型益生菌粉制剂11种;含有活菌数标记的有10种,无标记的有2种;添加菌种数量<10种的有5种,菌种数量10~20种的有6种,菌种数量>20种的有1种,样品具体信息见表2。
表2 本试验所用的样品信息
Table 2 Information of simples used in the experiments
续表

1.1.3 试剂
细菌基因组DNA快速提取试剂盒:广州迪澳生物科技有限公司;TaqMan TM Gene Expression Master Mix:美国Applied Biosystems公司;特异性引物和探针:生物工程(上海)股份有限公司。
1.1.4 培养基
MRS培养基:美国BD公司。
1.2 仪器与设备
SPX-250B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;QuantStudio7Flex实时荧光定量PCR仪:美国Applied Biosystems公司;Nano Drop微观核酸蛋白定量仪:美国赛默飞世尔科技公司。
1.3 方法
1.3.1 引物探针设计及实时荧光定量PCR
从美国国家生物技术信息中心(national center of biotechnology information,NCBI)GenBank数据库中获取植物乳杆菌以及其他乳杆菌种和双歧杆菌种的16S rRNA基因序列,使用Clustal W进行基本局部比对搜索工具(basic local alignment search tool,BLAST)数据比对,选取特异性的片段,采用软件Primer Express 3.0.1设计引物探针,并在NCBI上Primer Blast验证引物特异性,并由生工生物工程(上海)股份有限公司合成,引物探针序列见表3。
表3 植物乳杆菌引物探针
Table 3 Primers probes of Lactobacillus plantarum

PCR扩增体系(25 μL):2×Master mix 12.5 μL,引物对(LP 16S-F和LP 16S-R)(10 μmol/L)各1 μL,探针(LP 16S-P)(10 μmol/L)0.5 μL,模板DNA 1 μL,双蒸水(ddH2O)9 μL。PCR扩增程序:50 ℃、2 min;95 ℃预变性10 min;95 ℃变性5 s,60 ℃退火延伸40 s,同时收集FAM荧光信号,进行40个循环;4 ℃保存反应产物。
结果判读:实时荧光定量PCR扩增曲线指数期明显,扩增产物的荧光信号达到设定的荧光阈值时所对应的扩增循环数(cycle threshold,Ct)。Ct值<35可直接判定为阳性;Ct值为35~40判定为可疑,需要重复一次实验,如再次扩增后Ct值仍<40时,则判定结果为阳性,如再次扩增后Ct值仍≥40时,则判定结果为阴性;Ct值>40判定为阴性。
1.3.2 菌株的活化及DNA模板的制备
将植物乳杆菌和其他20株标准菌株接种于MRS琼脂平板36 ℃培养箱培养72 h进行活化,转接两代后挑取活化好的菌株单菌落按照试剂盒说明书方法提取基因组DNA,作为实时荧光定量PCR的DNA模板,-20 ℃保存备用。
1.3.3 特异性检测
使用所设计的引物和探针对4株植物乳杆菌和其他20株标准菌株的DNA模板进行实时荧光定量PCR扩增,以无菌水作为空白对照,参照1.3.1的实时荧光定量PCR条件及判读结果,验证植物乳杆菌的特异性,每个反应设置2个平行。
1.3.4 灵敏度检测
对所提取的植物乳杆菌CICC 6076 的DNA溶液进行浓度测定,通过10倍梯度稀释成7个梯度质量浓度的DNA溶液,分别为100 ng/μL、10 ng/μL、1 ng/μL、0.1 ng/μL(100 pg/μL)、0.01 ng/μL(10 pg/μL)、0.001 ng/μL(1 pg/μL)、0.000 1 ng/μL(0.1 pg/μL)。取上述DNA模板进行实时荧光定量PCR检测,同时设置空白对照(无菌水)、阳性对照(质量浓度为100 ng/μL植物乳杆菌CICC 6076 的DNA溶液)和阴性对照(质量浓度为50 ng/μL嗜热链球菌CICC6063的DNA溶液),参照1.3.1的实时荧光定量PCR条件及判读结果,进行灵敏度的检测,每个反应设置3个平行。
1.3.5 抗干扰实验
选用嗜热链球菌做为干扰因子,探究嗜热链球菌对植物乳杆菌的实时荧光定量PCR检测过程中的影响。将植物乳杆菌CICC6076的4个连续稀释梯度的质量浓度的DNA溶液与嗜热链球菌的DNA溶液按照体积为1∶1的比例进行混合,使植物乳杆菌DNA终质量浓度分别是10ng/μL、1ng/μL、0.10 ng/μL、0.01 ng/μL,嗜热链球菌DNA终质量浓度为10 ng/μL,分别设置空白对照(无菌水)、阴性对照(质量浓度为50 ng/μL嗜热链球菌CICC6063的DNA溶液)和阳性对照(植物乳杆菌CICC 6076 的DNA溶液),参照1.3.1反应条件及判读结果进行实时荧光定量PCR检测,每个反应设置3个平行。
1.3.6 实际样品检测
选取以上购买的12种益生菌粉制剂,每种称取0.1 g于1.5 mL的EP管中,水洗2次,然后按照基因组提取试剂盒说明书进行DNA提取。以植物乳杆菌的DNA模板作为阳性对照,同时设置阴性和空白对照,参照1.3.1的实时荧光定量PCR条件及判读结果,进行样品检测,每个反应设置2个平行。
2 结果与分析
2.1 引物探针的特异性分析
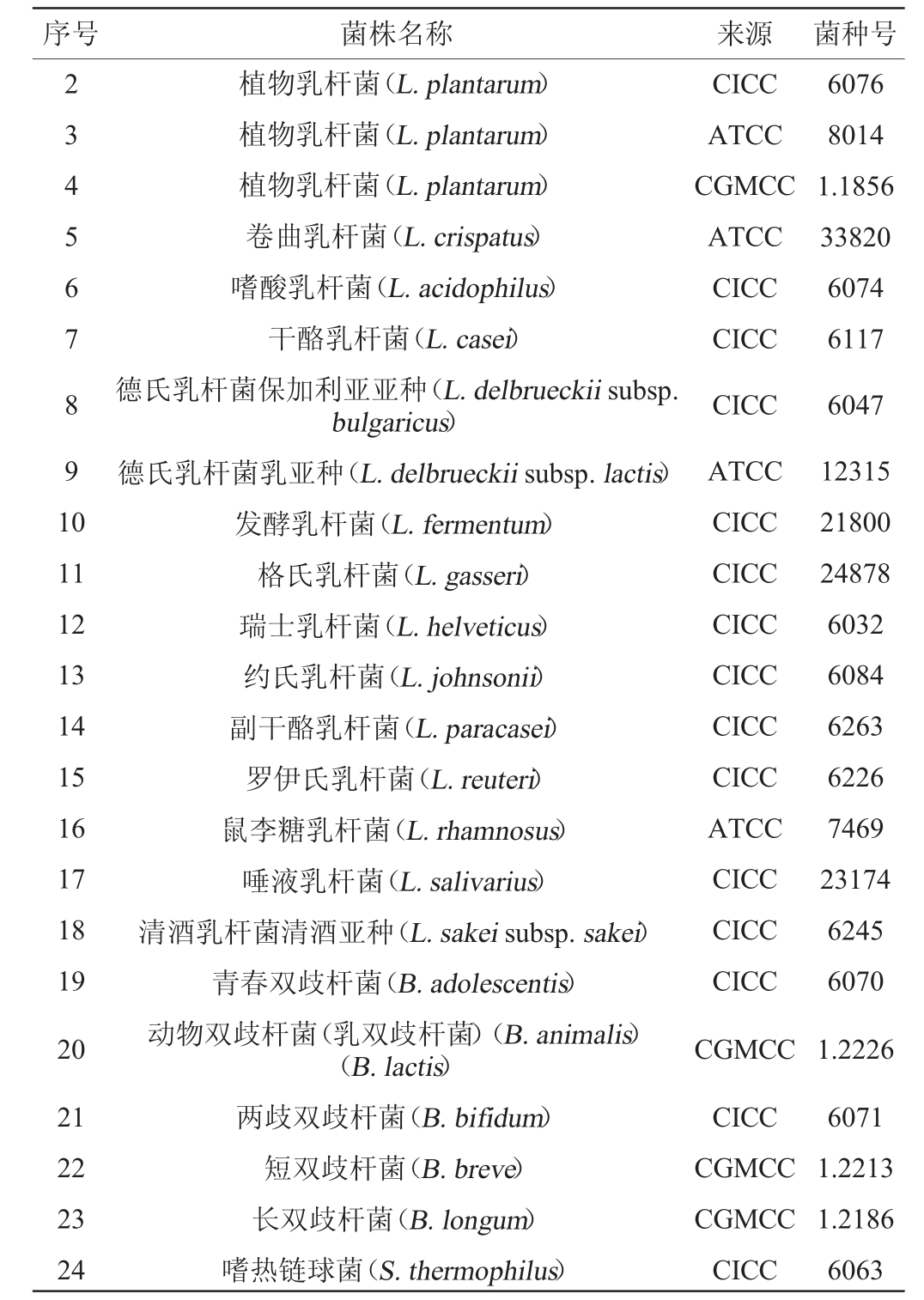
使用所设计的引物探针对4株植物乳杆菌和其他20株标准菌株同时进行扩增,验证引物探针的特异性,试验结果见图1。由图1可知,该方法可以特异性扩增出植物乳杆菌CICC6076、ATCC8014、CICC6009和CGMCC1.1856,平均Ct值分别为18.92、19.05、21.11和23.15,而对其他14株乳杆菌属标准菌株,5株双歧杆菌属标准菌株和1株嗜热链球菌的DNA成分均无特异性扩增。说明所设计的引物探针有较强的特异性。
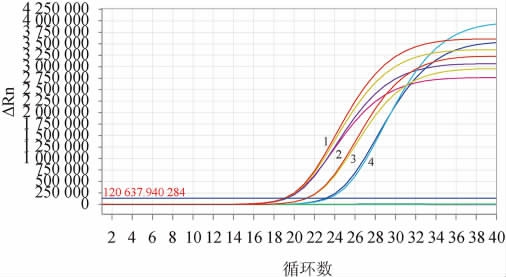
图1 实时荧光定量聚合酶链式反应扩增法鉴定植物乳杆菌特异性实验结果
Fig.1 Results of the specificity tests for Lactobacillus plantarum identification by RT-fqPCR amplication method
1~4分别表示植物乳杆菌CICC6076、ATCC8014、CICC6009、CGMCC1.1856。
2.2 引物探针的灵敏度
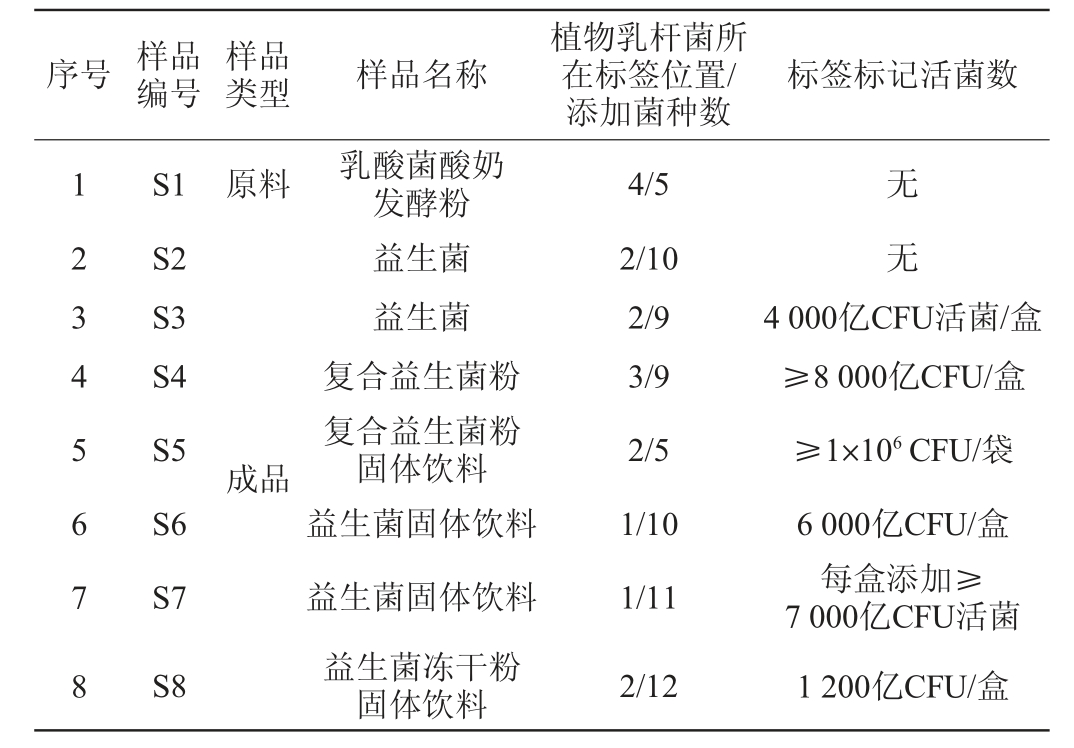
使用所设计的引物和探针对7种不同质量浓度的植物乳杆菌DNA溶液进行15次实时荧光定量PCR检测,验证其灵敏度,结果见图2。
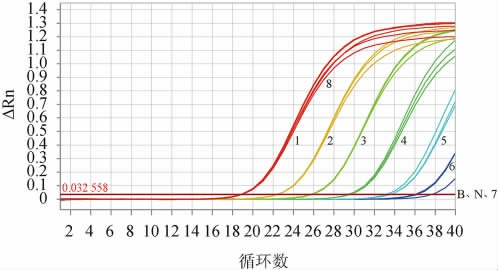
图2 实时荧光定量聚合酶链式反应扩增法鉴定植物乳杆菌灵敏度实验结果
Fig.2 Results of sensitivity tests for Lactobacillus plantarum identification by RT-fqPCR amplication method
1~8分别表示植物乳杆菌CICC 6076 的DNA溶液质量浓度分别为100 ng/μL、10 ng/μL、1 ng/μL、0.1 ng/μL、0.01 ng/μL、0.001 ng/μL、0.000 1 ng/μL、阳性对照,B表示空白对照,N表示阴性对照。
由图2可知,质量浓度为0.01 ng/μL(10 pg/μL)时,Ct值<35可以稳定扩增,质量浓度为0.1 ng/μL(1 pg/μL)时,Ct值为35~40仍然可以稳定扩增。本研究建立的实时荧光定量PCR方法可以检测出0.001 ng/μL(1 pg/μL)质量浓度的植物乳杆菌DNA溶液,即该方法的灵敏度为1 pg/μL。
2.3 抗干扰能力试验结果
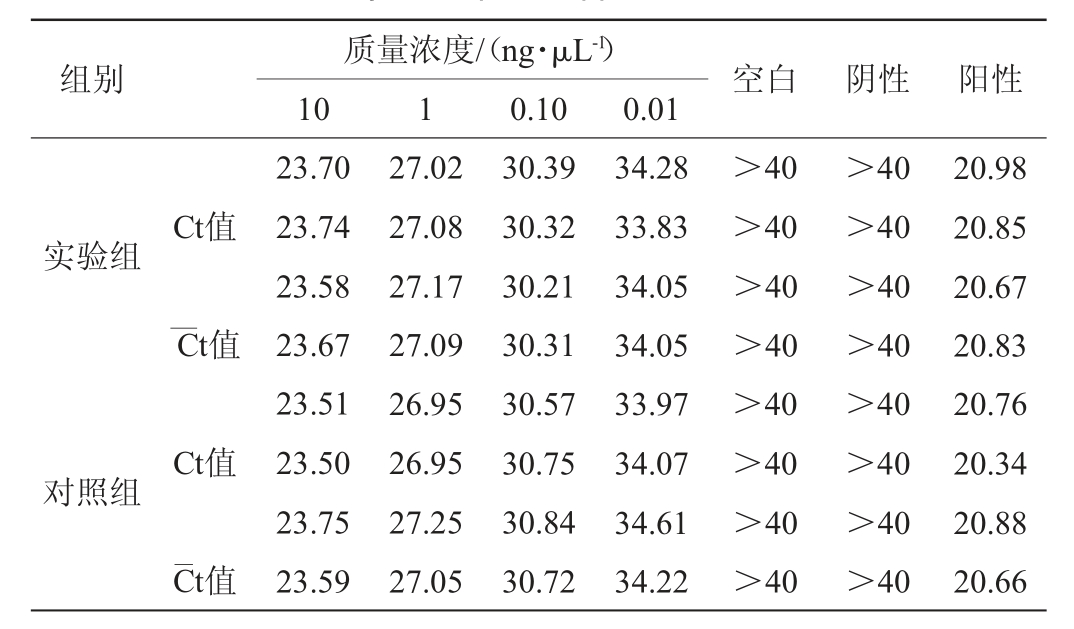
抗干扰能力试验结果见表4。由表4可知,植物乳杆菌DNA质量浓度为0.01~10 ng/μL的实时荧光定量PCR扩增Ct值重复性较好,均无显著变化,不受DNA质量浓度为10 ng/μL的嗜热链球菌影响。因此,植物乳杆菌的实时荧光定量PCR检测方法具有很好的抗干扰能力。
表4 实时荧光定量聚合酶链式反应扩增法鉴定植物乳杆菌抗干扰实验结果
Table 4 Results of anti-interference tests for Lactobacillus plantarum identification by RT-fqPCR application method
2.4 实际样品检测结果
12种益生菌粉制剂的植物乳杆菌检测结果分别见图3和表5。
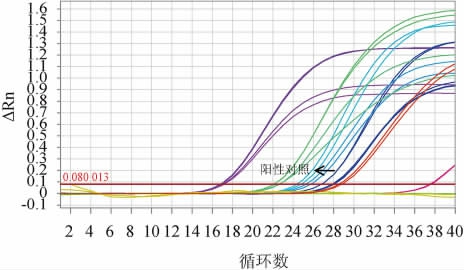
图3 实时荧光定量聚合酶链式反应扩增法鉴定益生菌粉样品中植物乳杆菌
Fig.3 Identification of Lactobacillus plantarum in probiotic powder samples by RT-fqPCR application method
阳性对照为植物乳杆菌CICC 6076,其余扩增曲线按照Ct值先后顺序依次为S7、S11、S3、S12、S4、S8、S5、S10、S1、S9及空白对照和阴性对照。
表5 益生菌粉样品中植物乳杆菌实时荧光定量聚合酶链式反应检测结果
Table 5 Detection results of Lactobacillus plantarum in probiotic powder samples by RT-fqPCR
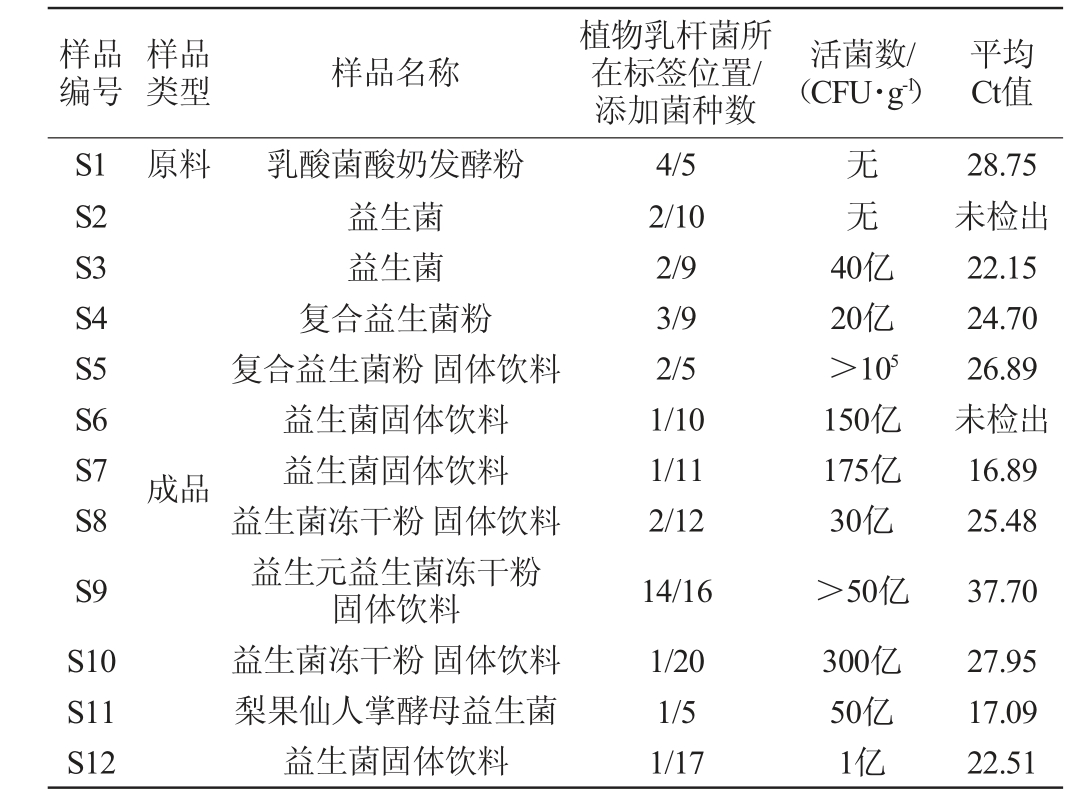
由图3和表5可知,其中有9种益生菌粉样品的Ct值均<30.0,可以直接判定样品为阳性,即含有植物乳杆菌。益生菌粉S9的Ct值为37.70,重复实验后Ct值为37.56,判定样品为阳性,即含有植物乳杆菌。样品S2和S6的Ct值>40,判定为阴性,即不含植物乳杆菌。
益生菌粉制剂样品S2和S6中未能检测到植物乳杆菌的原因存在以下几种可能:①在DNA提取液中S2最后的DNA洗脱液呈浅棕色,S6的DNA溶液不透明,且离心难以去除,干扰了RT-fqPCR的检测;②可能两种益生菌粉中添加的植物乳杆菌的量很少,提取的DNA样本中植物乳杆菌的DNA质量浓度未达到1 pg/mL;③产品中确实未添加植物乳杆菌。
3 结论
本研究选用植物乳杆菌的16S rRNA基因设计引物探针,同时在12种益生菌粉检测中得到很好的应用,样品不经过平板培养分离菌种而是直接提取样品的DNA,其中有10种益生菌粉检测到植物乳杆菌。此方法不仅能避免因菌种多样性和单一菌种添加数量不确定在培养分离过程中的丢失现象,同时也能快速精准对植物乳杆菌进行鉴定,填补目前益生菌粉样品未标明单一菌种数量及活菌数的实际检测需求的空缺,更具有时效性和实际可操作性,同时也能在多种干扰菌的存在下检测到植物乳杆菌,相比传统方法大大缩短了植物乳杆菌的鉴定时长,并且具有灵敏度高、特异性强、操作简便等优点。对益生菌粉中益生菌的鉴定起到积极推动的作用。
[1]SWANSON K S,GIBSON G R,HUTKINS R W,et al.The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics[J].Nat Rev Gastroenterol Hepatol,2020,17(11):687-701.
[2]Food and Agriculture Organization of the United Nations/World HealthOrganization.Guidelines for the evaluation of probiotics in food[R].Ontario:FAO/WHO,2002.
[3]ASHAOLU T J.Immune boosting functional foods and their mechanisms:A critical evaluation of probiotics and prebiotics[J].Biomed Pharmacother,2020,130:110625.
[4]ASLAM M,SADIQ M,MEHMOOD T.Assessment of maternal health services utilization in Pakistan: the role of socio-demographic characteristics[J].Asian Biomed,2020,14(1):3-7.
[5]陈健芬,宋云云,孙东方,等.可量化的益生菌与茶多酚复配模型的抑菌机理及其在牙膏中的功效研究[J].口腔护理用品工业,2022,32(4):4-11.
[6]刘倩颖.基于RT-PCR技术对植物乳杆菌耐盐分子机理的研究[D].沈阳:沈阳农业大学,2014.
[7]WASSENAAR T M,KLEIN G.Safety aspects and implications of regulation of probiotic bacteria in food and food supplements[J].J Food Protect,2008,71(8):1734-1741.
[8]KIM Y,RYU B H,KIM J,et al.Characterization of a novel SGNH-type esterase from Lactobacillus plantarum[J].Int J Biol Macromol,2017,96:560-568.
[9]MARTINO M E,BAYJANOV J R,CAFFREY B E,et al.Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats[J].Environ Microbiol,2016,18(12):4974-4989.
[10]王鸿蕉,蔡昀洁,岳明祥,等.植物乳杆菌的抑菌性能及其影响因素研究进展[J].食品研究与开发,2022,43(14):212-218.
[11]王瑶,李琪,李平兰.植物乳杆菌LPL-1产细菌素发酵培养基优化[J].农业机械学报,2018,49(9):311-317.
[12]姜林娟,郑志,朱绍辉,等.益生菌植物乳杆菌、鼠李糖乳杆菌、罗伊乳杆菌对医院常见致病病原菌的抑菌作用[J].新乡医学院学报,2022,39(6):501-506.
[13]庾庆华,祝丽君,陈东波.益生菌制剂产品质量的关键因素探究[J].现代食品,2022,28(15):128-132,152.
[14]周雅宁.乳酸菌的鉴定方法及在食品工业中的应用[J].数码世界,2017,145(11):56.
[15]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.35—2016 食品安全国家标准食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2016.
[16]肖其胜,杨捷琳,杨惠琴,等.实时荧光PCR法鉴定食品中双歧杆菌[J].食品科学,2016,37(20):177-182.
[17]刘艳艳,吕婷婷,吴家强,等.猪链球菌和猪多杀性巴氏杆菌多重实时荧光PCR方法的建立[J].微生物学通报,2022,49(12):5112-5125.
[18]孙畅,安彬,杨柳,等.发酵豆乳主要乳酸菌实时荧光定量PCR检测方法的建立[J].大豆科学,2020,39(3):464-471.
[19]黄翠,单宏,李莉莉,等.实时荧光PCR法与国标法检测单增李斯特菌比较[J].黑龙江农业科学,2023,343(1):57-61.
[20]马琳琳,刘珍,马腾州,等.实时荧光PCR技术快速检测食品中的蜡样芽孢杆菌[J].理化检验-化学分册,2022,58(12):1461-1465.
[21]王青龙,张跃川,周燕霞,等.实时荧光PCR鉴定婴幼儿配方食品中克罗诺杆菌的研究[J/OL].中国食品卫生杂志:1-9[2023-02-10].http://kns.cnki.net/kcms/detail/11.3156.R.20220902.1730.004.html.
[22]王青龙,貌达,周燕霞,等.实时荧光定量PCR法鉴定发酵乳中嗜热链球菌[J].中国酿造,2022,41(7):149-154.
[23]王青龙,貌达,周燕霞,等.实时荧光定量PCR法鉴定婴幼儿配方乳粉中动物双歧杆菌乳亚种[J].中国酿造,2022,41(6):224-230.
[24]韩之皓,郭帅,黄天,等.叠氮溴化丙锭结合实时荧光定量PCR技术检测发酵乳中植物乳杆菌P-8活菌数[J].食品与发酵工业,2019,45(1):183-189.
[25]马丹,杨彬彬,陶文靖,等.叠氮溴化丙锭-qPCR法定量检测植物乳杆菌[J].食品安全质量检测学报,2021,12(12):4867-4875.