酒泥是葡萄酒产业中一种主要的废弃物,是葡萄酒经过倒罐后留在发酵罐底部的沉淀物,主要由酿酒酵母、多酚、多糖和有机酸组成[1]。据统计,每生产100 t的葡萄酒,就会产生2.5~4.0 t的葡萄酒泥[2]。酒泥作为酒厂的酿酒废弃物,通常与其他葡萄园副产物一起用于堆肥或者作为动物饲料等[2]。酒泥中含有多种天然抗氧化剂,这些抗氧化剂来源于葡萄,在酿酒过程中只有一部分转移到葡萄酒,其余仍然保留在酒泥中[3]。多酚是酒泥抗氧化活性的重要来源之一,包括花青素、白藜芦醇、单宁和槲皮素等,上述生物活性成分具备多种有益功能,如抗氧化、抗菌、抗炎症等[4]。
作为一种食品加工新技术,超微粉碎通过压缩空气将原料高速喷射到研磨腔室中,通过颗粒之间的碰撞以及研磨腔表面对原料的剧烈冲击来达到粉碎的目的[5-6]。有研究表明,超微粉碎技术可以通过降低颗粒尺寸来增加活性成分的溶解度[7]。因此相较于普通粉碎而言,超微粉碎技术可以获得更小粒径的原料,并且具备更强的分散性和溶解性。
近些年来,对于葡萄酒泥中酚类成分的提取工艺已有多项研究,包括有机溶剂萃取、微波、超声波、脉冲等技术[8-11],而鲜见有关超微粉碎技术在多酚提取的研究工作[12]。因此,本研究以赤霞珠葡萄酒泥为原料,采用超微粉碎辅助超声波提取技术,探究多酚提取的最佳工艺参数及其抗氧化性能,以期为葡萄酒泥多酚的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
赤霞珠葡萄酒酿造过程中产生的酒泥废弃物:宁夏青铜峡西鸽酒庄;无水乙醇、水杨酸(均为分析纯):西陇科学股份有限公司;没食子酸标准品(纯度>98%)、福林酚:源叶生物有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度≥97%)、2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonate),ABTS)(>98%):德国Sigma-Aldrich公司;硫酸亚铁、过氧化氢(均为分析纯):索莱宝科技有限公司;超纯水(电阻率18.2 MΩ·cm):由Milli-Q超纯水系统产生。
1.2 仪器与设备
6B-Ⅰ型贝利微粉机:济南倍力粉体技术工程有限公司;Cary60 UV-Vis分光光度计:美国Agilent Technologies公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;KH-500DE数控超声波清洗器:昆山禾创有限公司;ZEN360003060120粒度仪:英国马尔文仪器有限公司。
1.3 方法
1.3.1 葡萄酒泥烘干粉碎
取新鲜葡萄酒泥3 500 r/min离心20 min,将沉淀40 ℃烘干。采用两种方法粉碎,参考WEI N[13]的方法测量其粒度。
普通粉碎:将烘干后的酒泥粉碎过800目筛,粒径70 μm左右。
超微粉碎:将烘干后的酒泥在-20 ℃条件下超微粉碎15 min后过100目筛,粒径为32 μm 左右。
1.3.2 葡萄酒泥多酚的提取
普通提取:将烘干后的酒泥粉碎过800目筛,粒径70 μm左右,按照一定的料液比加入乙醇-水溶液,混合后置于超声波清洗器中超声处理(300 W),提取一定时间后,6 000 r/min离心15 min,即可获得葡萄酒泥多酚提取液[14]。
超微粉碎辅助超声波提取:将烘干后的酒泥在-20 ℃条件下超微粉碎15 min后过100目筛,粒径为32 μm 左右,按照基础条件(超声功率300 W、提取温度50 ℃、提取时间20 min、液料比1∶30(g∶mL)、乙醇体积分数50%)得到葡萄酒泥多酚提取液。
1.3.3 葡萄酒泥多酚的测定
多酚的测定参考Folin Ciocalteus法[15]。得到多酚的标准曲线回归方程:y=0.769 8x+0.011 9,R2=0.999 2。
测定葡萄酒泥样品的吸光度值,计算多酚的质量浓度,并由下式计算葡萄酒泥多酚得率。
1.3.4 葡萄酒泥多酚超声提取条件优化单因素试验
称取5 g超微粉碎酒泥进行多酚提取,分别考察不同提取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)、超声时间(30 min、40 min、50 min、60 min、70 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL))以及乙醇体积分数(35%、45%、55%、65%、75%)对酒泥中多酚提取的影响。
1.3.5 葡萄酒泥多酚超声提取条件优化Box-Behnken试验设计
根据Box-Behnken设计原理,考察提取温度(A)、超声时间(B)、料液比(C)、乙醇体积分数(D)对多酚得率的影响。响应面优化试验设计见表1。
表1 葡萄酒泥多酚提取条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for extraction conditions optimization of polyphenols from wine lees

1.3.6 葡萄酒泥多酚抗氧化活性分析
葡萄酒酒泥提取物的抗氧化性能通过DPPH自由基(DPPH·)、ABTS自由基(ABTS+·)和羟基自由基(·OH)清除率进行评价,并将3个指标进行Min-Max标准化后加和计算抗氧化综合评价值[16]。
DPPH自由基清除率按照参考文献[17]的方法测定。
式中:A1为试验组吸光度值;A2为对照组吸光度值;A0为空白组吸光度值。
ABTS自由基清除率根据参考文献[18]的方法进行测定。
式中:A1为试验组吸光度值;A0为空白组吸光度值。
羟基自由基清除率参考文献[19]的方法测定。
式中:A1为试验组吸光度值;A0为空白组吸光度值。
1.3.7 数据处理
采用Microsoft Excel 2013 处理数据,Design-Expert 13.0.1.0进行响应面优化,Origin 2021b作图。
2 结果与分析
2.1 葡萄酒泥多酚超声提取条件优化单因素试验
2.1.1 不同提取温度对多酚得率的影响
温度对多酚的影响表现在高温易使酚类化合物分解,而适宜的温度有助于酚类物质溶出[21-22]。由图1可以看出,随提取温度的升高,葡萄酒泥多酚得率呈先升高后降低的趋势;在提取温度为50 ℃时,葡萄酒泥多酚得率达到最高,为0.968%。因此选择葡萄酒泥多酚最佳提取温度为50 ℃。
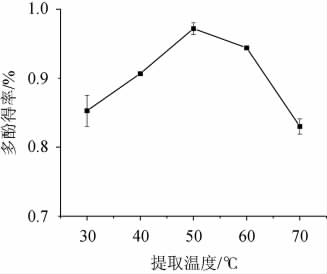
图1 提取温度对多酚得率的影响
Fig.1 Effect of extraction temperature on polyphenols yield
2.1.2 不同超声时间对多酚得率的影响
由图2可知,随提取时间的增加,葡萄酒泥多酚得率呈先升高后降低的趋势;在提取时间为50 min时,葡萄酒泥多酚得率达到最高,为0.845%。提取时间过长造成酒泥提取量减少,可能与超声波提取时间过长导致酚类物质结构遭到破坏有关。也有可能是提取一段时间后,溶剂中的多酚含量基本达到平衡,随着提取时间的增加,酒泥内其他黏性杂质(如多糖成分)溶出,将多酚化合物粘在酒泥固体颗粒上,从而多酚得率略有下降[23]。因此选择葡萄酒泥多酚最佳提取时间为50 min。
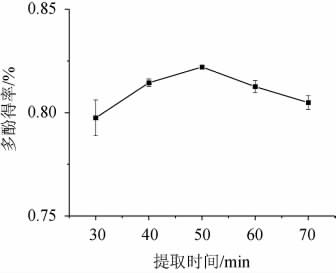
图2 提取时间对多酚得率的影响
Fig.2 Effect of extraction time on polyphenols yield
2.1.3 不同料液比对多酚得率的影响
由图3可知,随着料液比的增加,多酚得率呈先升高后降低的趋势。当料液比为1∶30(g∶mL)时,酒泥提取物中的多酚得率达到最大值。乙醇-水溶液的用量越大,多酚化合物在原料和溶剂之间的浓度差就越大,样品与溶剂接触的表面积增大,越是有利于物质传递的进行[24]。但当溶剂用量达到一定程度后,多酚得率增加缓慢或出现降低。可能的原因为:①乙醇-水溶液过多吸收超声波能量,使得超声波传播时,与酒泥颗粒发生散射时衰减降低。②多酚的溶出已经达到饱和,提高料液比会增加其他杂质的溶出,酒泥提取物中多酚的含量不再增加,反而是出现下降的现象[25]。因此考虑用料成本以及提取效果等因素,提取赤霞珠酒泥时,料液比设置在1∶30(g∶mL)较为适宜。
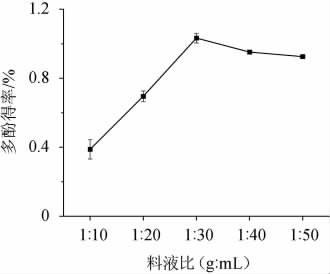
图3 料液比对多酚得率的影响
Fig.3 Effect of material to liquid ratio on polyphenols yield
2.1.4 不同乙醇体积分数对多酚得率的影响
由图4可知,乙醇体积分数在35%~55%时,提取物中多酚含量增加,在乙醇体积分数55%时,提取赤霞珠酒泥的多酚含量显著高于其他,而在乙醇体积分数>55%之后,多酚含量明显降低。原因可能是,随着乙醇体积分数逐渐提高,其他醇溶性物质也被提取出来,从而导致酚类化合物溶出量下降[26-27]。根据乙醇溶液对多酚的影响,选择乙醇体积分数55%为宜。
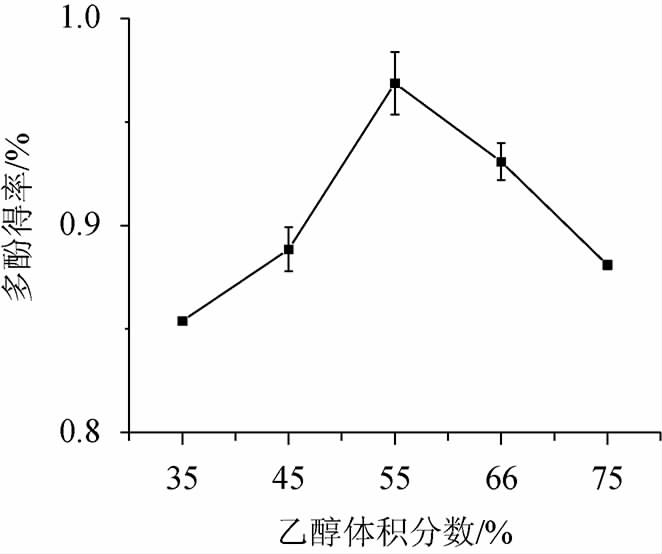
图4 乙醇体积分数对多酚得率的影响
Fig.4 Effect of ethanol volume fraction on polyphenols yield
2.2 葡萄酒泥多酚超声提取条件优化响应面试验结果
2.2.1 葡萄酒泥多酚提取条件优化响应面试验设计及结果响应面试验结果与分析见表2,方差分析见表3。
表2 葡萄酒泥多酚提取条件优化响应面试验结果与分析
Table 2 Results and analysis of response surface tests for extraction conditions optimization of polyphenols from wine lees
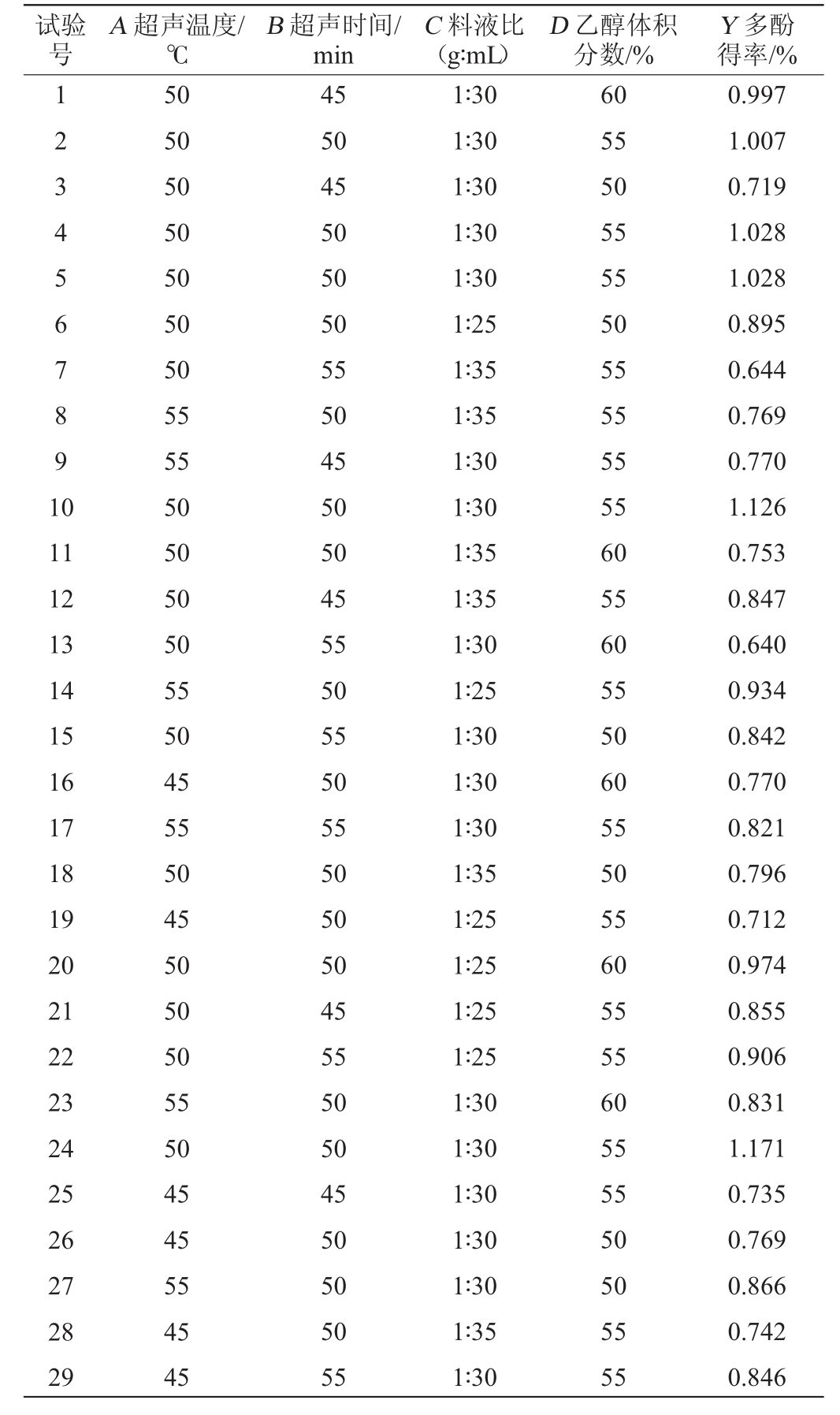
表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:P<0.05表示对结果影响显著;P<0.01表示对结果影响极显著。
运用Design-Expert 13.0.1.0软件对表2数据进行回归分析和拟合,得出二次多项式回归方程如下:
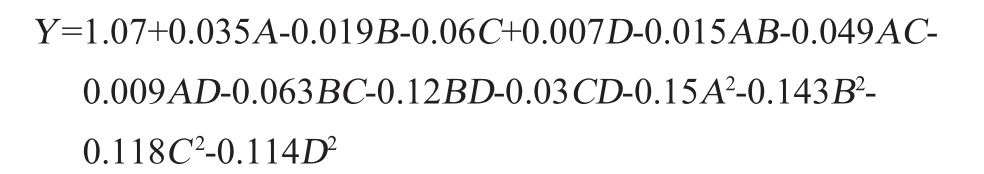
由表3可知,建立的回归模型F=7.44(P<0.001),表明该模型具有显著性差异和统计学意义。而失拟项不显著(P>0.05),则说明试验数据误差较小,P值越小,则相应变量的显著程度越高。由P值可知,一次项A、C,交互项BC、BD,二次项A2、B2、C2、D2对葡萄酒泥多酚得率影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。由F值可知,4个因素对于多酚得率的影响顺序为C>A>B>D。
2.2.2 各因素间交互作用响应面分析
利用Design Expert 13.0.1.0软件获得各因素间交互作用对酒泥中多酚提取率影响的3D响应曲面及等高线,结果见图5。
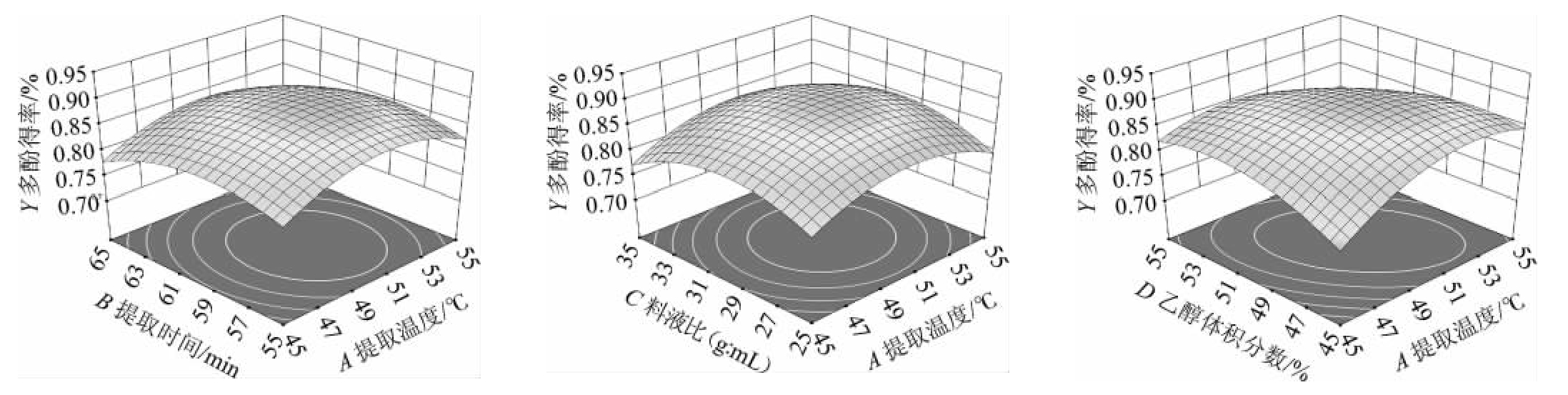
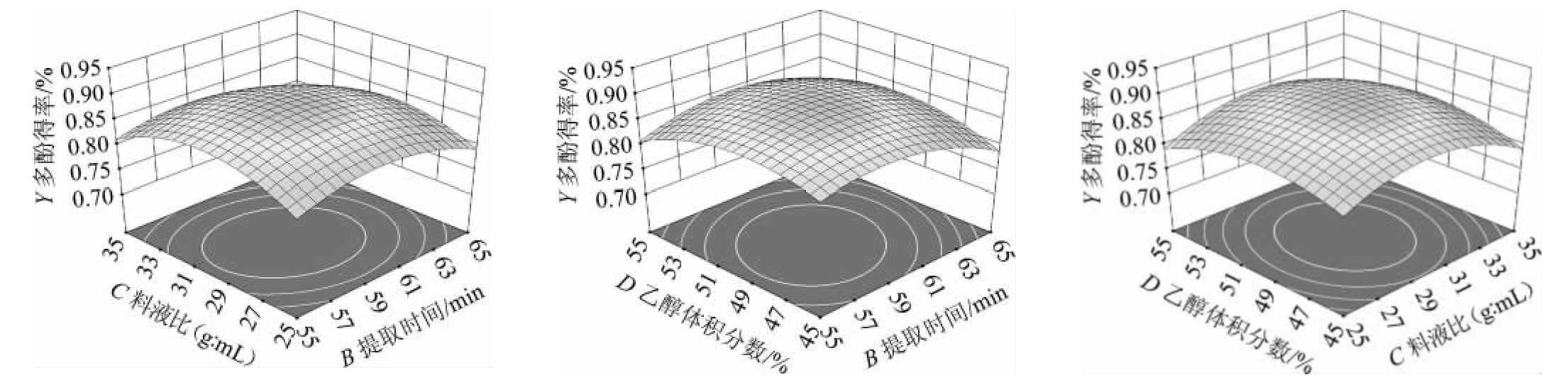
图5 各因素间交互作用对多酚得率影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between each factors on polyphenols yield
由图5可知,响应面等高线图可以直观地反映各因素对响应值的影响,曲面越陡,交互作用越明显,曲面图均存在最高点。等高线的形状可以反映出交互效应的强弱,椭圆形表示两因素交互作用显著[22]。而对等高线图的分析可以看出,这些因素之间的交互作用较为明显,符合方差分析的结果。
根据响应面模型的分析并回归后,得出提取葡萄酒泥中多酚的最佳工艺条件:提取温度47.90 ℃,提取时间51.57 min,料液比1∶25.30(g∶mL),乙醇体积分数56.88%。多酚得率预测值最高可以达到0.95%。综合考虑到实际生产过程中的可行性,将赤霞珠葡萄酒泥中多酚的提取工艺修正为提取温度48 ℃、提取时间52 min、料液比1∶25(g∶mL)、乙醇体积分数57%。在此条件下进行验证试验,得到的多酚得率为0.92%,差异不显著,表明该模型可靠性较高。
2.3 葡萄酒泥多酚体外抗氧化活性分析
分别测定两种粉碎条件下葡萄酒泥多酚的DPPH、ABTS及OH自由基清除率,以1 mg/L抗坏血酸作为阳性对照组,结果见表4。
表4 不同粉碎方式葡萄酒泥多酚抗氧化能力比较
Table 4 Comparison of antioxidant capacity of polyphenols in wine lees by different grinding methods
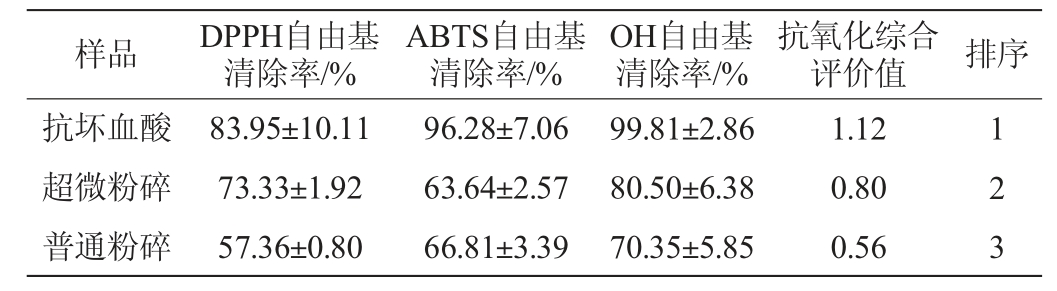
由表4可知,酒泥多酚表现出对DPPH自由基较为明显的反应,超微粉碎获得的样品显著高于普通粉碎样品,其自由基清除率达到了73.33%。ABTS清除率试验结果中,两种粉碎方法的抗氧化活性差异并不明显。其原因可能是由于ABTS法间接检测TEAC值,从而表征提取液与ABTS(氧化后)发生反应的能力,所以其结果与DPPH法有所不同[28-29]。OH自由基是造成人体细胞损伤的主要原因之一,因此测量这个指标具有应用意义[30]。超微粉碎组OH自由基清除率为80.5%显著高于普通组(70.35%)。酒泥多酚经过不同的测试方法获得的抗氧化活性之间有所差别。因此根据模糊判别原理,建立多因素综合评价数学模型来对酒泥提取物中多酚的抗氧化能力进行全面性评价[31]。相较于普通粉碎方式,超微粉碎技术对于超声波提取有正面效果,从而获得更高的抗氧化活性。
3 结论
葡萄酒泥作为葡萄酒厂的一种固体废弃物,其具有较高的经济价值,但是生物利用率较低,相关农副产品开发较少。以赤霞珠葡萄酒泥为原材料,通过响应面试验设计及验证,得到了酒泥中多酚超微粉碎辅助超声波提取工艺参数,并测试其抗氧化指标。结果表明,酒泥中提取多酚的最佳工艺参数为超声功率300 W,提取温度48 ℃,提取时间52 min,料液比1∶25(g∶mL),乙醇体积分数57%,在此条件下,提取物中多酚得率为0.92%,其DPPH、ABTS、OH自由基清除率分别为73.33%、63.64%和80.50%。酒泥中丰富的多酚物质可用于食品、保健品以及日化工业,本研究对赤霞珠酒泥中多酚的提取工艺进行优化,提取物具有较高的抗氧化活性,为后续产品研发生产提供了理论支持。
[1]VARISCO M,ZUFFEREY D,RUGGI A,et al.Synthesis of hydrophilic and hydrophobic carbon quantum dots from waste of wine fermentation[J].Roy Soc Open Sci,2017,4(12):170900.
[2]PEREZ-SERRADILLA J A,CASTRO L D.Role of lees in wine production:A review[J].Food Chem,2008,111(2):447-456.
[3]DROSOU C,KYRIAKOPOULOU K,BIMPILAS A,et al.A comparative study on different extraction techniques to recover red grape pomace polyphenols from vinification byproducts[J].Ind Crop Prod,2015,75:141-149.
[4]MARÍA J,JARA P.Wine lees as a source of antioxidant compounds[J].Antioxidants,2019,8(2):45.
[5]唐璇,李东,雷雨,等.抹茶超微粉碎技术研究进展[J].食品工业,2021,42(8):222-226.
[6]TAO Y,WU D,ZHANG Q A,et al.Ultrasound-assisted extraction of phenolics from wine lees:Modeling,optimization and stability of extracts during storage[J].Ultrason Sonochem,2014,21(2):706-715.
[7]李振江,刘莹,支莉,等.球磨超微粉碎对桦褐孔菌粉体颗粒特性及多糖提取效果的影响[J].中国食品添加剂,2021,32(11):1-8.
[8]JUAN-MATEO J,MAICAS S.Valorization of winery and oil mill wastes by microbial technologies[J].Food Res Int,2015,73(7):13-25.
[9]ALARCÓN M,LÓPEZ-VIAS M,PÉREZ-COELLO M S,et al.Effect of wine lees as alternative antioxidants on physicochemical and sensorial composition of deer burgers stored during chilled storage[J].Antioxidants,2020,9(8):687.
[10]NANNI A,MESSORI M.Effect of the wine lees wastes as cost-advantage and natural fillers on the thermal and mechanical properties of poly(3-hydroxybutyrate-co-hydroxyhexanoate) (PHBH) and poly(3-hydroxybutyrate-co-hydroxyvalerate)(PHBV)[J].J Appl Polym Sci,2020,137(28):469-488.
[11]DAVID G,VANNINI M,SISTI L,et al.Eco-conversion of two winery lignocellulosic wastes into fillers for biocomposites: Vine shoots and wine pomaces[J].Polymers,2020,12(7):15-30.
[12]郭志君,张王飞,江璐,等.葡萄酒泥高价值产物开发及生物炼制研究概况[J].食品与机械,2021,37(5):221-226.
[13]WEI N.Factors evalution of particle size distribution of heavy oil emulsion[J].Adv Mater Res,2013,800:389-392.
[14]BAKIRTZI C,TRIANTAFYLLIDOU K,MAKRIS D P.Novel lactic acid-based natural deep eutectic solvents: efficiency in the ultrasoundassisted extraction of antioxidant polyphenols from common native greek medicinal plants[J].J Appl Res Med Aromat Plants,2016,3(3):120-127.
[15]PARYS S,ROSENBAUM A,KEHRAUS S,et al.Evaluation of quantitative methods for the determination of polyphenols in algal extracts[J].J Nat Prod,2007,70(12):1865-1870.
[16]许立伟,王炳宇,杨馨悦,等.5种浆果果酒抗氧化活性差异及综合评价[J].中国酿造,2021,40(9):200-205.
[17]WOILLEZ M,RILLON J M,COUTIE R P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].J Agr Food Chem,2009,57(5):1768-1774.
[18]NORMAH H,AND HANAPI M J.Antioxidant capacity of the green leafy vegetables using oxygen radical antioxidant capacity(ORAC),2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid(ABTS)and 2,2-diphenyl-1-picrylhydrazyl(DPPH)assays[J].Sci Herit J,2019,3(1):1-7.
[19]TIERNEY M S,SMYTH T J,RAI D K,et al.Enrichment of polyphenolcontents and antioxidant activities of Irish brown macroalgae using foodfriendly techniques based on polarity and molecular size[J].Food Chem,2013,139(1):753-761.
[20]马永强,王艺錡,黎晨晨,等.超声波辅助微乳液法提取番茄红素的工艺研究[J].食品科技,2020,45(11):205-211.
[21]冼丽清,黄东滨,秦高燕,等.百色红茶多酚的提取工艺优化及抗氧化、抑菌活性研究[J].中国食品添加剂,2022,33(4):18-27.
[22]裴斐,陶虹伶,蔡丽娟,等.响应面试验优化辣木叶多酚超声辅助提取工艺及其抗氧化活性[J].食品科学,2016,37(20):24-30.
[23]郭蒙,石慧丽,杨华,等.星宿菜总多酚提取工艺优化及抗氧化活性[J].粮食与油脂,2021,34(2):113-117.
[24]LU J,ZHOU C,RONG O,et al.Optimization of microwave-assisted extraction of flavonoids from Cryptotaenia japonica Hassk using response surface methodology[J].Adv J Food Sci Tech,2013,5(3):310-317.
[25]孙晓波,韦桂凤,王小明,等.Box-Behnken模型优化油茶饼粕多酚提取工艺及抗氧化活性研究[J].食品研究与开发,2022,43(9):109-117.
[26]杨斌,方柄栋,郑峻,等.鹿茸菇多酚提取工艺优化及其抗氧化活性[J].食品研究与开发,2021,42(24):41-49.
[27]吴卫成,忻晓庭,张程程,等.番薯叶多酚提取工艺优化及其生物活性研究[J].中国食品学报,2022,22(5):189-199.
[28]MILLER N J,RICE-EVANS C A.Factors influencing the antioxidant activity determined by the ABTS+radical cation assay[J].Free Radical Res,1997,26(3):195-199.
[29]RODRÍGUEZ-BONILLA P,GANDÍA-HERRERO F,MATENCIO A,et al.Comparative study of the antioxidant capacity of four stilbenes using ORAC,ABTS+,and FRAP techniques[J].Food Anal Meth,2017,10:2994-3000.
[30]NIE J Y,ZHANG Y,LI R,et al.Screening of radical scavenging activity and chemical constituents of the essential oil from star anise by ultra-fast GC electronic nose coupled with DPPH,OH,and ABTS assays[J].J Food Process Pres,2020,45(1):e15022.
[31]陈莹,朱振中,邵志芳,等.抗氧化活性综合评价方法研究[J].应用化工,2012,41(1):123-125,129.