乳酸菌(lactic acid bacteria,LAB)是一种普遍存在于自然界中的益生菌,其本身并非微生物分类学概念,而是对一类可发酵葡萄糖产生乳酸、无芽孢的革兰氏阳性细菌的总称[1]。乳酸菌被公认为是安全的微生物,具有增强机体免疫力、促进机体生长、降压降血脂、抗衰老等作用[2-6]。广泛应用于化工、制药、饲料等领域,其重要性不言而喻。胞外多糖(exopolysaccharides,EPS)是微生物分泌到细胞壁外的黏液多糖和荚膜多糖的总称[7]。研究表明,乳酸菌胞外多糖具有抗氧化、抗肿瘤、降低胆固醇等生物活性[8-11]。此外,乳酸菌胞外多糖有助于细菌形成生物被膜,可以帮助细菌抵御不良环境,如乳酸链球菌素、溶菌酶等,对抗生素、噬菌体和吞噬作用更具有抵抗力[12]。在食品生产中,乳酸菌胞外多糖可作为稳定剂、凝胶剂、乳化剂等,改善食物的流变性和感官特性[13-14]。乳酸菌产生胞外多糖的方式主要为天然菌种发酵,分离纯化过程繁琐,乳酸菌胞外多糖产量低[15]。此外,由于乳酸菌的种类及来源不同,其产生的EPS的结构和特性均有所差异[16],限制了乳酸菌大规模工业化生产和应用,需要进一步进行工艺优化以实现有效和经济的规模化。
发酵动力学是研究发酵过程中微生物生长活动中菌体生长、底物消耗及产物形成之间关系内在规律的方法[17-18]。建立相应动力学方程的数学模型,从而达到认识发酵过程规律,优化发酵工艺,为提高发酵产量提供理论基础[19]。
本研究以胞外多糖为响应值,通过单因素试验和响应面法优化鼠李糖乳杆菌(Lactobacillus rhamnosus)R5产胞外多糖的发酵条件,并构建其产胞外多糖生长过程的动力学模型,为工业化生产乳酸菌胞外多糖提供前期的实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
鼠李糖乳杆菌(Lactobacillus rhamnosus)R5:分离自四川传统泡菜,降胆固醇能力>30%,具有耐酸、耐胆盐能力,保存于本实验室。
1.1.2 培养基
MRS液体培养基[20]:蛋白胨10.0 g,牛肉粉10.0 g,酵母粉5.0 g,柠檬酸氢二胺2.0 g,葡萄糖20.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,吐温80 1.0 mL,蒸馏水1 000 mL。MRS固体培养基:MRS液体培养基中添加琼脂20 g,121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
苯酚、葡萄糖、硫酸、氯仿、正丁醇(均为分析纯):成都市科隆化学品有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
GI54DWS型立式自动蒸汽压力灭菌器:致微(厦门)仪器有限公司;SPX-150B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;HNY-200B恒温培养振荡器:天津市欧诺仪器仪表有限公司;WFJF200分光光度计:尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 鼠李糖乳杆菌R5产胞外多糖发酵条件优化
(1)单因素试验
初始发酵条件:将鼠李糖乳杆菌R5划线接种于MRS固体培养基中,37 ℃活化培养24 h;挑取单菌落接种于MRS液体培养基中,37 ℃活化24 h;按2%(V/V)的接种量接种于MRS液体培养基,37 ℃培养24 h,在此条件下,EPS产量为678.01 mg/L。
在MRS液体培养基的基础上,采用不同氮源替换MRS液体培养基中的蛋白胨、牛肉粉和酵母粉,分别研究氮源种类(蛋白胨、牛肉粉、酵母粉、大豆蛋白胨、胰蛋白胨)(添加量3%)及最佳氮源添加量(1%、2%、3%、4%、5%、6%)、葡萄糖添加量(1%、2%、3%、4%、5%、6%)、接种量(1%、2%、3%、4%、5%、6%)、发酵时间(24 h、36 h、48 h、60 h、72 h)、发酵温度(23 ℃、30 ℃、37 ℃、44 ℃、51 ℃)对鼠李糖乳杆菌R5产EPS的影响。
(2)响应面试验
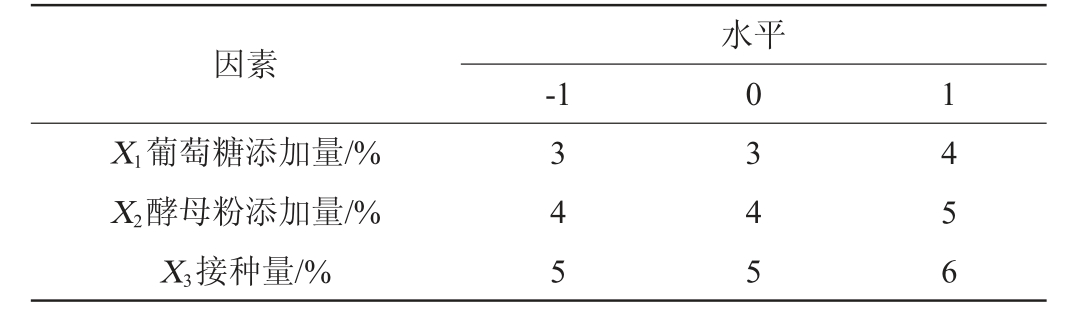
根据单因素试验,选取对鼠李糖乳杆菌R5产EPS影响显著的3个因素葡萄糖添加量(X1)、酵母粉添加量(X2)、接种量(X3)为考察因素,EPS产量(Y)为响应值,利用Design-Expert 8.0.6软件设计3因素3水平响应面试验[21],试验因素与水平见表1。
表1 鼠李糖乳杆菌R5产胞外多糖发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface test for exopolysaccharide production by Lactobacillus rhamnosus R5
1.3.2 胞外多糖含量的测定
参考李仪琳[22]的方法提取胞外多糖,并做适当改进。取发酵液10 mL在4 ℃、8 000 r/min条件下离心10 min,取上清液,加入1/3体积的Sevag试剂(氯仿∶正丁醇=4∶1,V/V),振荡10 min后,4 000 r/min离心15 min,收集上层水相溶液,重复以上操作至两相之间无蛋白质层为止。随后加入3倍体积的冰冻无水乙醇,放置在4 ℃冰箱中冷藏。第2天取出,最终可以观测到多糖沉淀析出,再于4 ℃、6 000 r/min离心30 min,用等体积蒸馏水溶解沉淀,可得胞外多糖提取液,冷冻干燥得到胞外多糖。
采用苯酚-硫酸法测定总糖含量[23],采用3,5-二硝基水杨酸比色法测定还原糖含量[24],并计算胞外多糖含量,其计算公式如下:
EPS含量=总糖含量-还原糖含量
1.3.3 发酵动力学模型的构建
(1)生长动力学模型建立
利用Logistic方程描述鼠李糖乳杆菌R5在优化条件下的生长规律,其微分方程为(1):
式中:dX/dt为菌体的生长速率,g/(L·h);X为菌体质量浓度,g/L;t为发酵时间,h;μm为最大比生长速率,h-1;Xm为最大菌体质量浓度,g/L。
当t=0,X=X0时,对公式(1)进行积分,得到积分式为公式(2):

式中:X0为初始菌质量浓度,g/L。
(2)产物合成动力学模型建立
采用Luedeking-Piret方程描述产物生成随时间变化过程,其微分方程为(3):
式中:dP/dt为产物合成速率,g/(L·h);P为产物的质量浓度,g/L;α为与菌体生长速率有关联的产物合成常数;β为与菌体浓度有关联的产物合成常数。
当t=0,P=0时,对公式(1)和(3)进行积分,得积分式为公式(4):
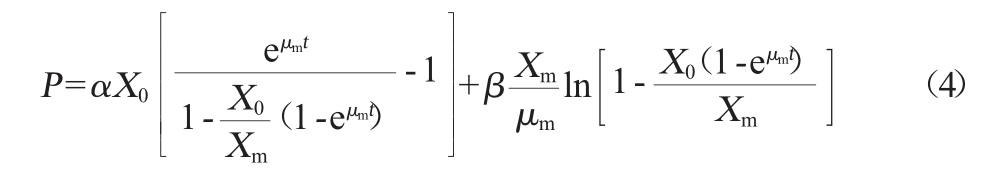
(3)底物消耗动力学模型建立
选用Luedeking方程建立底物消耗动力学模型,其微分方程为(5):
式中:dS/dt为底物消耗速率,g/(L·h);S为葡萄糖质量浓度,g/L,Yx为菌体对底物的得率,g/g;Yp为产物对底物的得率,g/g;θ为菌体维持系数因子,h-1。
当t=0,S=S0,对公式(1)、(3)、(5)进行积分,得积分式为公式(6):
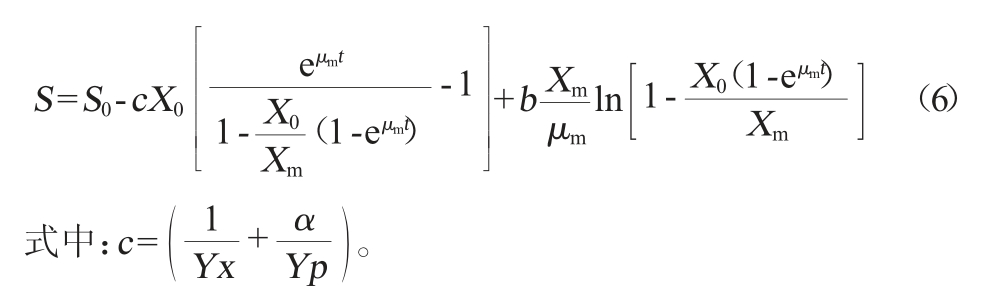
1.3.4 模型验证试验
按照响应面试验的最优条件进行发酵,每隔2 h取样,测定EPS产量、OD600nm值、葡萄糖含量。
1.3.5 数据处理
采用Origin 8.0软件对数据进行处理,并进行模型参数非线性拟合和检验。
2 结果与分析
2.1 鼠李糖乳杆菌R5产胞外多糖发酵条件优化
2.1.1 单因素试验
鼠李糖乳杆菌R5产EPS发酵条件优化单因素试验结果见图1。由图1可知,5种氮源中,酵母粉对EPS产量影响最大,EPS产量达到最高,691.65 mg/L,其添加量为4%时,EPS产量达到最高,为834.30 mg/L。当葡萄糖添加量为4%时,EPS产量最高,为819.74 mg/L。当接种量为5%时,EPS产量最高,为971.28 mg/L。不同发酵时间对鼠李糖乳杆菌R5的EPS产量影响较小,当发酵时间为24 h,EPS产量最高,为675.13 mg/L。当培养温度为37 ℃时,EPS产量最高,为690.67 mg/L。综上,选择最佳氮源种类为酵母粉,酵母粉最佳添加量为4%,葡萄糖最佳添加量为4%,最佳接种量为5%,最佳发酵时间为24 h,最佳发酵温度为37 ℃。
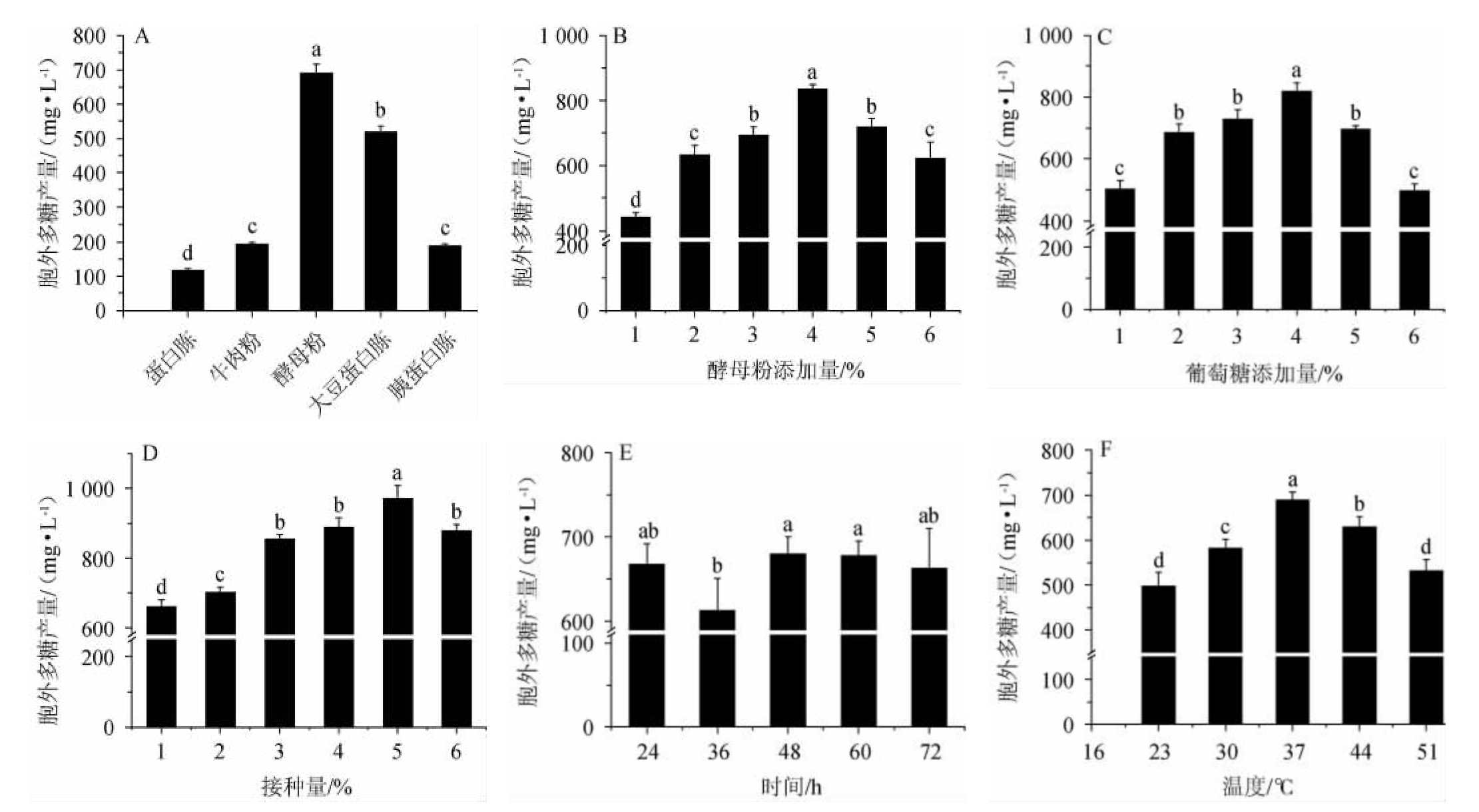
图1 不同发酵条件对鼠李糖乳杆菌R5产胞外多糖的影响
Fig.1 Effect of different fermentation conditions on exopolysaccharide production by Lactobacillus rhamnosus R5
2.1.2 响应面试验结果
根据单因素试验,固定发酵时间为24 h,发酵温度为37 ℃,选取对鼠李糖乳杆菌R5产EPS影响显著的3个因素葡萄糖添加量(X1)、酵母粉添加量(X2)、接种量(X3)为考察因素,以EPS产量(Y)为响应值,利用Design-Expert 8.0软件设计3因素3水平响应面试验[21],试验设计及结果见表2,方差分析见表3。
表2 鼠李糖乳杆菌R5产胞外多糖发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface test for exopolysaccharide production by Lactobacillus rhamnosus R5
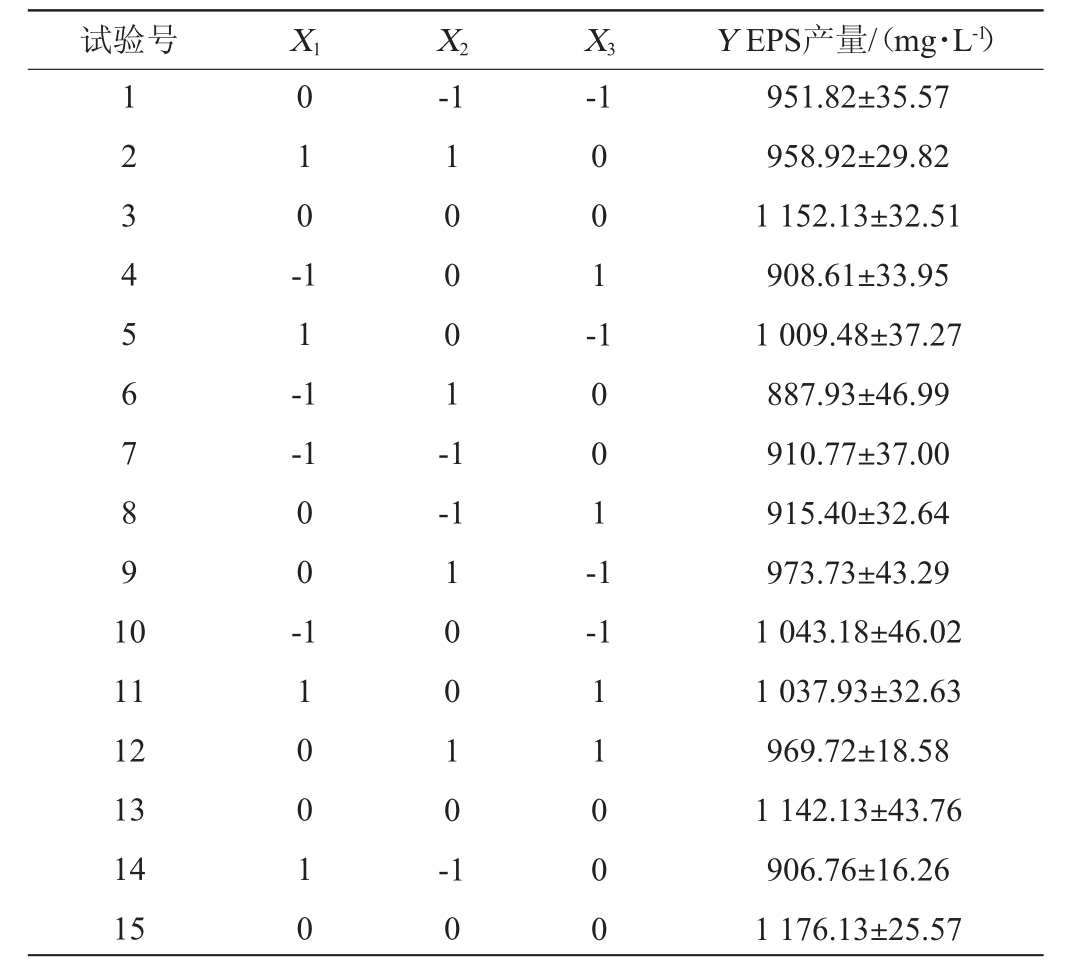
表3 回归模型方差分析结果
Table 3 Variance analysis of the regression model
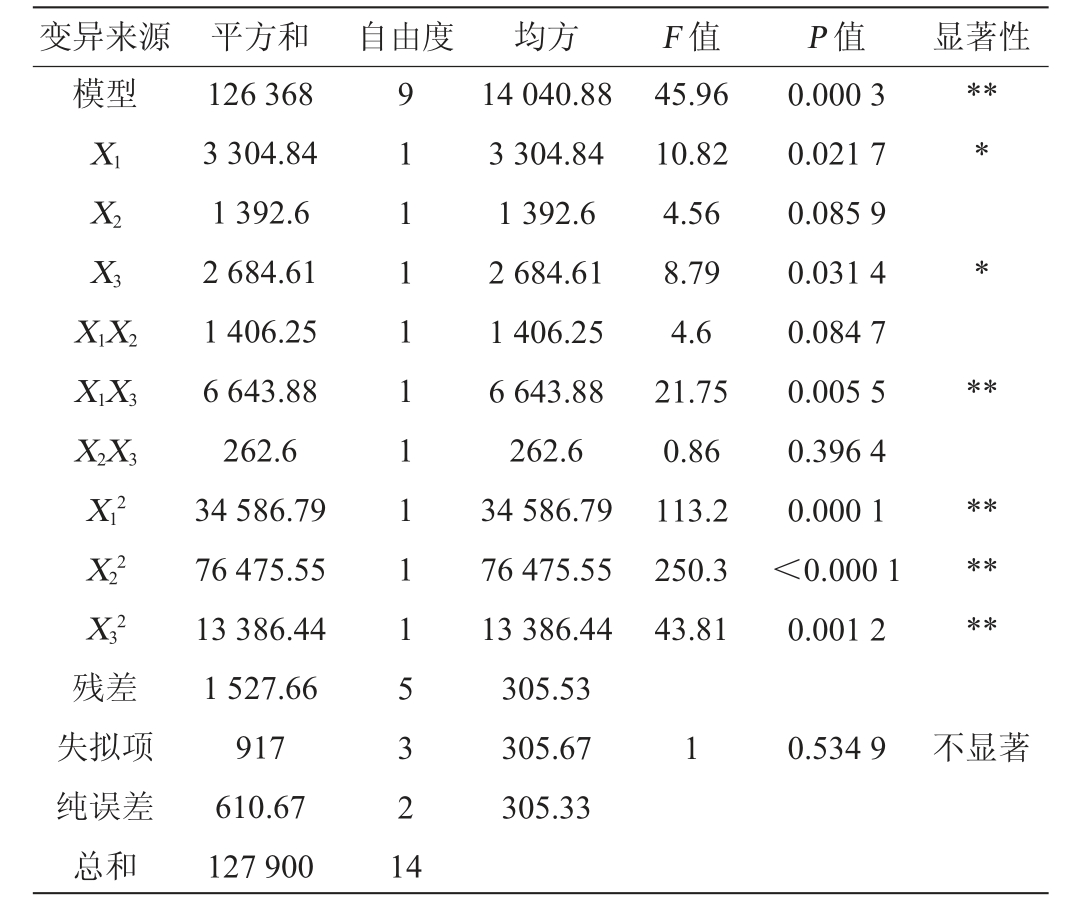
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
通过Design-Expert 8.0.6软件对表2中数据进行多元回归拟合分析,得到二次回归拟合方程:Y=-2 965+515.8X1+1 049.0X2+388X3-96.78X12-143.92X22-60.21X32+18.75X1X2+40.76X1X3+8.10X2X3。
由表3可知,该模型P=0.000 3<0.01,极显著,而失拟项P=0.534 9>0.05,不显著,说明模型拟合度好。根据F值大小可以看出,3个因素对EPS产量的影响次序为:葡萄糖添加量>接种量>酵母粉添加量。模型决定系数R2=0.988 1,表明模型的相关性很好,调整决定系数R2Adj=0.966 6,表明此模型能解释96.66%响应值变化,变异系数(coefficient of variation,CV)表示试验的精确度,其值越大,试验结果的可靠性越低。CV=1.75%,较低,说明模型精确度高,可用此模型对鼠李糖乳杆菌R5的EPS产量进行预测。
通过响应面优化得到最优发酵条件为:葡萄糖添加量4.09%、酵母粉添加量4.05%、接种量4.89%。在该优化条件下,EPS产量的理论值为1 184.31 mg/L,为便于实际操作,将最优条件修正为葡萄糖添加量4%、酵母粉添加量4%、接种量5%,在此条件下进行验证试验,得到EPS产量为1 138.31 mg/L,是优化前(678.01 mg/L)的1.68倍,与预测值基本一致,可见该模型能较好地预测鼠李糖乳杆菌R5产EPS的情况。孔德卉等[25]也做了类似的研究,当接种量为3.5%,培养温度为39 ℃,乳糖质量浓度为45 g/L时,植物乳杆菌(Lactobacillus plantarum)胞外多糖的产量能够达到1 498.91 μg/mL,是优化前(1 012.6 μg/mL)的1.48倍,提高了48%;刘燕[26]研究发现,在培养温度为39 ℃,培养时间14.2 h,初始pH值6.9条件下,德式乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)的EPS产量提高17.8%;胡盼盼[27]研究发现,当发酵温度为37 ℃、发酵时间为12.8 h、初始pH值为7.7、菌体浓度为108 CFU/m L时,副干酪乳杆菌副干酪亚种(Lactobacillus paracasei subsp. paracasei)M5L的胞外多糖产量达到最高,为167.2 mg/mL,是优化前(128.3 mg/mL)的1.3倍。与这些研究结果相比,本研究EPS产量处于一个较高水平。
2.2 鼠李糖乳杆菌R5的发酵动力学模型建立及验证
2.2.1 模型参数求解及模型建立
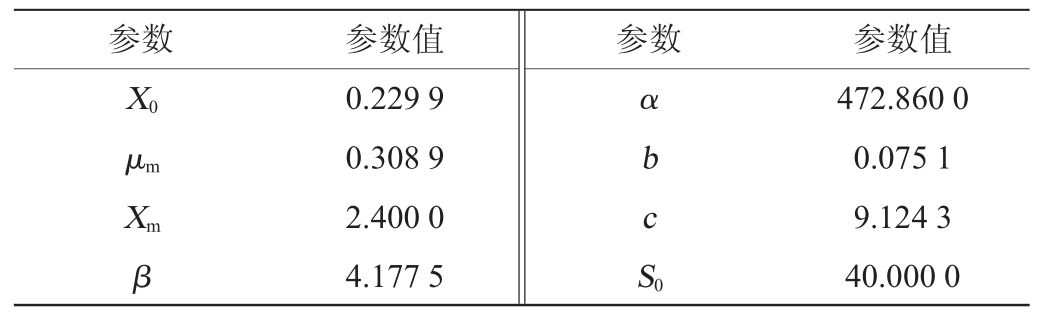
采用Origin8.0软件对鼠李糖乳杆菌R5产EPS的动力学方程(2)、(4)、(6)式进行非线性拟合,所得动力学参数,结果见表4。
表4 发酵动力学模型参数
Table 4 Parameters of fermentation kinetic models
将所得模型参数值代入(2)、(4)、(6)式,得到菌体生长、产物合成和底物消耗动力学模型分别为公式(7)、(8)、(9)。
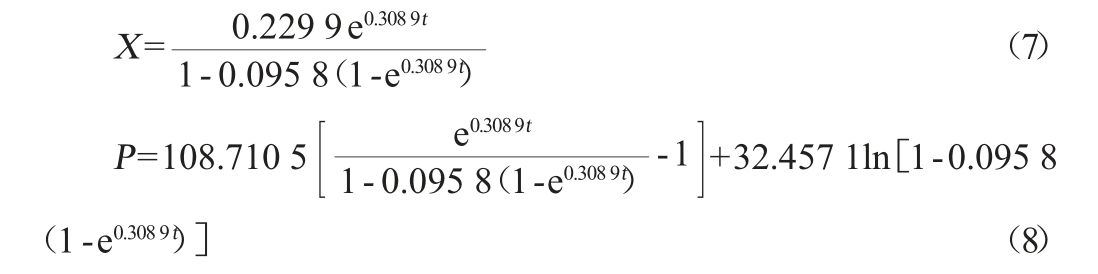
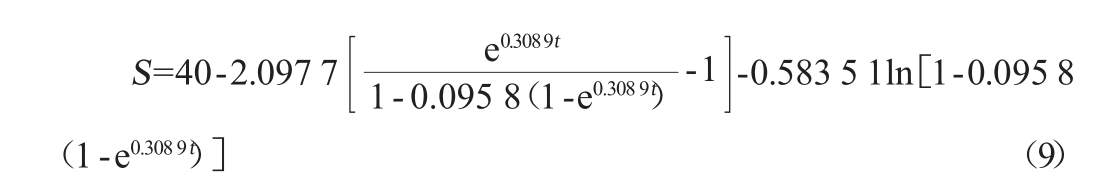
2.2.2 模型验证
为确定实验拟合模型的可靠性,对模型的预测值和试验值进行比对,结果见表5。
表5 鼠李糖乳杆菌R5发酵动力学模型预测值与试验值比较结果
Table 5 Comparison results of predicted values and experimental values of Lactobacillus rhamnosus R5 fermentation kinetics model
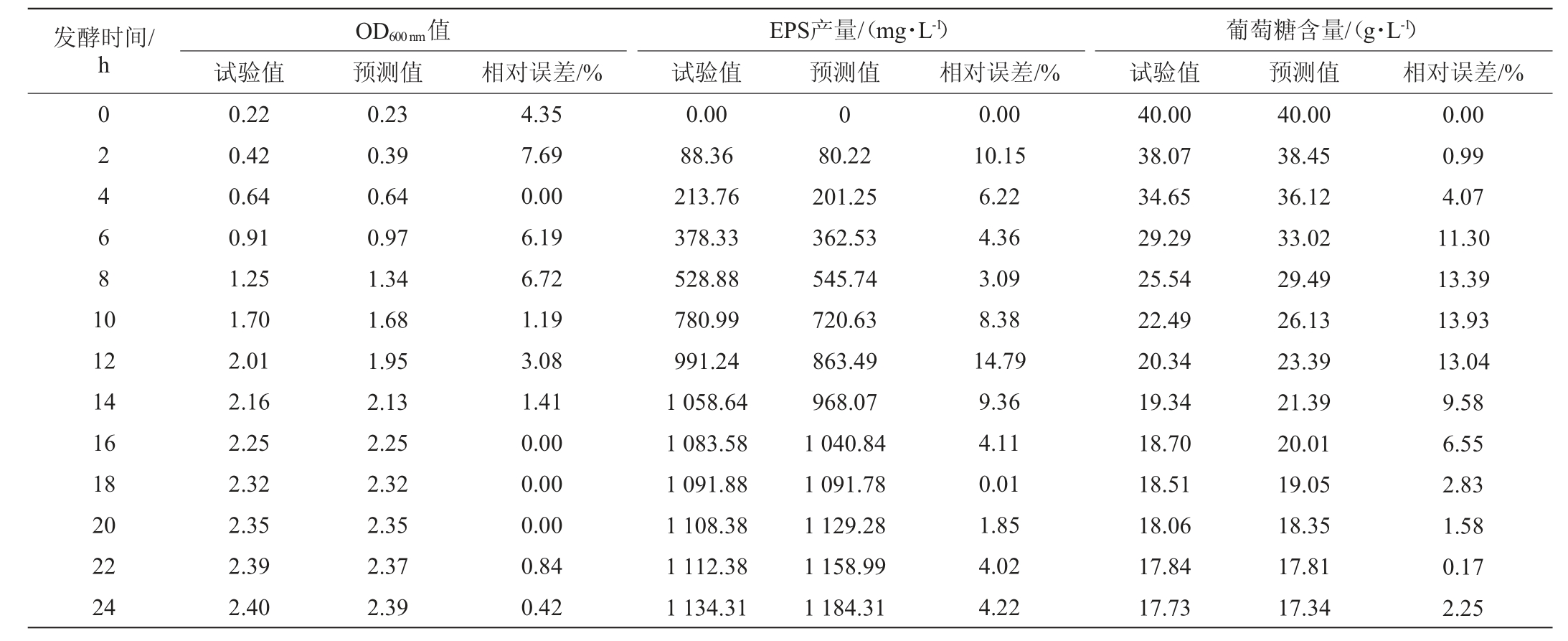
由表5可知,模型的预测值与试验值相对误差均<15%,说明预测值与试验值相近。采用Origin 8.0软件对鼠李糖乳杆菌R5产EPS的发酵动力学模型实验值及理论值分别进行拟合分析,结果见图2。由图2可知,模型拟合曲线的相关系数分别为0.992 5、0.998 9和0.998 8,均>0.98,表明模型的拟合效果良好,能够较好地反映实际的发酵过程。
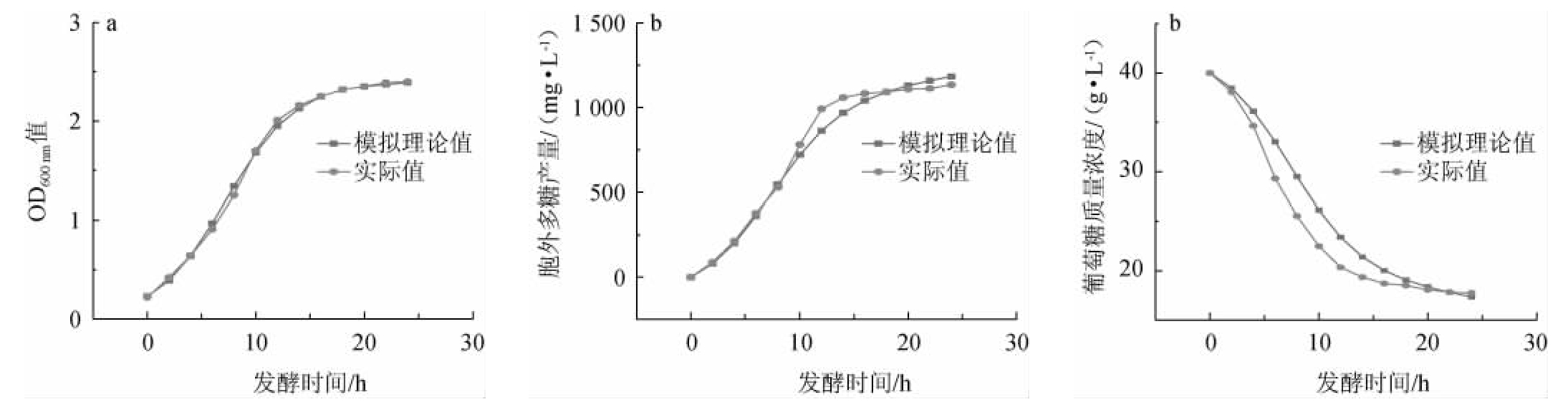
图2 鼠李糖乳杆菌R5产胞外多糖的细胞生长(a)、产物合成(b)、底物消耗(c)动力学模型实验值及理论值的拟合曲线
Fig.2 Fitting curves of cell growth (a),product synthesis (b),substrate consumption (c) for predicted values and experimental values of kinetics model of exopolysaccharide produced by Lactobacillus rhamnosus R5
3 结论
通过单因素试验和响应面试验优化得到鼠李糖乳杆菌R5产EPS的最佳培养条件:葡萄糖添加量4%、酵母粉添加量4%、接种量5%、发酵温度37 ℃、发酵时间24 h,在此优化条件下,EPS产量为1 138.31 mg/L,是优化前(678.01 mg/L)的1.68倍。通过建立发酵动力学模型,可以实时监控发酵过程中菌体生长、产物合成、底物消耗的变化规律。模型拟合结果表明,模型的相关系数均>0.98,拟合情况良好,预测值与试验值相近,相对误差均<15%,模型能很好地反映发酵过程规律,表明可通过构建发酵动力学模型对鼠李糖乳杆菌R5产EPS情况进行预测和描述,为其后序的工业生产应用提供基础理论支持。
[1]周航,王薇薇,王丽,等.饲用乳酸菌制剂的开发利用研究进展[J].动物营养学报,2019,31(5):2012-2021.
[2]JANG S Y,HEO J,PARK M R,et al.Genome characteristics of Lactobacillus fermentum strain JDFM216 for application as probiotic bacteria[J].J Microbiol Biotechnol,2017,27(7):1266-1271.
[3]孙钰薇,张诗瑶,刘志佳,等.发酵食品中乳酸菌的健康功效研究进展[J].食品与发酵业,2021,47(23):280-287.
[4]TIAN F W,CHH F F,WANG G,et al.Lactobacillus rhamnosus CCFM1107 treatment ameliorates alcohol-induced liver injury in a mouse model of chronic alcohol feeding[J].J Microbiol,2015,53:856-863.
[5]李权威,张开屏,赵艳红,等.风干羊肉中乳酸菌的体内外抗氧化特性[J].微生物学通报,2020,47(12):4094-4104.
[6]吴映梅,徐龙泉,王瑶佳,等.薏苡仁乳酸菌发酵工艺优化及活性成分变化分析[J].食品研究与开发,2022,43(17):127-133.
[7]王明哲,杨颖,唐伟敏,等.戊糖乳杆菌YY112产胞外多糖的发酵工艺条件优化[J].浙江农业学报,2020,32(2):327-336.
[8]GHANY K,ELHAFEZ E A,HAMOUDA R A,et al.Evaluation of antioxidant and antitumor activities of Lactobacillus acidophilus bacteria isolated from Egyptian infants[J].Int J Pharmacol,2014,10(5):282-288.
[9]RANI R P,ANANDHARAJ M,RAVINDRAN A D.Characterization of a novel exopolysaccharide produced by Lactobacillus gasseri FR4 and demonstration of its in vitro biological properties[J].Int J Biol Macromol,2018,109:772-783.
[10]SUNGUR T,ASLIM B,KARAASIAN C,et al.Impact of exopolysaccharides(EPSs)of Lactobacillus gasseri strains isolated from human vagina on cervical tumor cells(HeLa)[J].Anaerobe,2017,47:137-144.
[11]LI F S,HU X,QIN L Y,et al.Characterization and protective effect against ultraviolet radiation of a novel exopolysaccharide from Bacillus marcorestinctum QDR3-1[J].Int J Biol Macromol,2022,221: 1373-1383.
[12]DILNA S V,SURYA H K,ASWATHY R G,et al.Characterization of an exopolysaccharide with potential health-benefit properties from a probiotic Lactobacillus plantarum RJF 4[J].LWT-Food Sci Technol,2015,64(2):1179-1186.
[13]ZHU W J,WANG Y Z,YAN F,et al.Physical and chemical properties,percutaneous absorption-promoting effects of exopolysaccharide produced by Bacillus atrophaeus WYZ strain[J].Carbohyd Polym,2018,192:52-60.
[14]王烁,姜静,杜仁鹏,等.乳酸菌胞外多糖的生物合成、特性和应用[J].生物技术,2022,32(3):394-401.
[15]DABA G M,ELNAHAS M O,ELKHATEEB W A.Contributions of exopolysaccharides from lactic acid bacteria as biotechnological tools in food,pharmaceutical,and medical applications[J].Int J Biol Macromol,2021,173:79-89.
[16]DANIEL A,ERICA R,FRESNO J M,et al.Study of exopolysaccharides from lactic acid bacteria and their industrial applications: a review[J].Int J Food Sci Technol,2021,57(1):16-26.
[17]后立琼.苗族酸汤中乳酸菌的分离鉴定及发酵动力学模型研究[D].成都:四川农业大学,2012.
[18]欧红艳,赵良忠,刘婷,等.豆清饮料发酵及贮藏过程中品质变化及动力学研究[J].大豆科学,2021,40(4):528-538.
[19]王园园,王康,金令凯,等.阿维拉霉素发酵工艺优化及动力学模型建立[J].高校化学工程学报,2019,33(5):1156-1163.
[20]雷霜江,吕青遥,王文杰,等.屎肠球菌R40产胆盐水解酶发酵动力学及底物特异性分析[J].中国酿造,2021,40(11):144-148.
[21]JAFARI F,MOVAGHARNEJAD K,SADEGHI E.Infrared drying effects on the quality of eggplant slices and process optimization using response surface methodology[J].Food Chem,2020,333:127423.
[22]李仪琳.乳酸菌胞外多糖制备与结构鉴定及应用研究[D].西安:陕西科技大学,2019.
[23]陶静,凌飞跃,张博,等.乳酸乳球菌胞外多糖提取纯化工艺研究[J].中国食品添加剂,2019,30(10):100-104.
[24]李志霞,聂继云,闫震,等.响应面法对3,5-二硝基水杨酸比色法测定水果中还原糖含量条件的优化[J].分析测试学报,2016,35(10):1283-1288.
[25]孔德卉,蒋家璇.高产胞外多糖能力的乳酸菌筛选及其培养条件的优化[J].兰州文理学院学报,2020,34(3):53-59.
[26]刘燕.高产胞外多糖乳酸菌的筛选及培养基优化方法的研究[D].郑州:河南农业大学,2009.
[27]胡盼盼.乳酸菌胞外多糖发酵条件优化及抗肿瘤活性的研究[J].中国酿造,2020,39(8):187-192.