白酒又称烧酒,是世界六大蒸馏酒之一[1]。由于地理位置、原料及条件的不同,白酒在风味物质组成及含量上有很大的区别[2],而微生物是影响酒类风味物质的主要因素,酵母菌属于多动能性微生物,包括产酒酵母和生香酵母,其作用有酒化功能、酯化功能等[3]。在酿酒过程中,产酒酵母应用非常广泛,生香酵母在近几年才被开发利用,发酵潜力逐渐受到研究者的重视[4]。
白地霉(Geotrichum candidum)属于生香酵母,在发酵过程中的代谢产物含有醇、醛、酯等芳香物质,具有较好的产香能力。研究表明,白地霉对所酿造产品的总体风味能够产生积极的影响,如胡建华[5]将筛选到的白地霉用于酿造清香型基酒中,所产基酒口味纯净,质量明显提高;田宇敏[6]从白酒酒醅中分离筛选出白地霉M5,并与大曲共同发酵,提高了酒的总酯含量和出酒率,酒的香气更加协调;与大曲强化发酵酿醋,总酸和总酯含量分别提高了21.52%和28.22%,醋香气丰富。
本研究以5种粮食为原料,采用固态发酵方法,将实验室保存的白地霉(Geotrichum candidum)S13和白酒曲共同发酵,以总酯含量和出酒率为评价指标,采用单因素试验及响应面试验对固态发酵法酿造白酒发酵条件进行优化,以期提高酯类物质使酒更加绵柔,提高其营养价值,进一步为白酒的生产提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
大米、粘糯米、带皮小麦、优质红高粱、玉米粒、稻壳:市售;安琪白酒曲:安琪酵母股份有限公司;白地霉(Geotrichum candidum)S13:信阳农林学院食品学院实验室保存;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:杭州驰成医药科技有限公司;无水乙醇、氢氧化钠、酚酞、碳酸钠、柠檬酸、硫酸等(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
LDZM-60KCS立式灭菌锅:上海申安医疗器械厂;SWCJ-2FD双人双面净化台:上海坤诚科学仪器有限公司;ZWY-2112B恒温培养振荡器:上海智城分析仪器制造有限公司;HW远红外干燥箱:北京科伟永兴仪器有限公司;JYLY29高速破壁调理机:九阳股份有限公司;NS-D05L型蒸酒器:酿神酿酒机工厂;FE28酸度计:梅特勒-托利多国际有限公司。
1.3 方法
1.3.1 白地霉种子液的制备
将本实验室保藏的白地霉S13接种于PDA斜面培养基28 ℃活化48 h,连续活化3次,然后挑取两环接入100 mL PDA液体培养基中,28 ℃、100 r/min振荡培养48 h,得到白地霉种子液。镜检无杂菌,并稀释计数,浓度为6.4×1011个/mL。
1.3.2 固态发酵法酿造白酒工艺流程及操作要点
原料处理→蒸煮→翻拌冷却→接种→主发酵→蒸馏→原酒→陈酿→白酒
原料的筛选和预处理:参考胡琴等[7]的方法,将所选用5种粮食原料进行挑选,除去发霉变质的原料,按照优质红高粱∶大米∶玉米粒∶粘糯米∶带皮小麦=18∶11∶4∶9∶8(g∶g)配比充分混合,粉碎过80目筛。
蒸煮:将充分混合后的粮粉加入一定量的水浸湿,放入蒸锅蒸煮28 min,要求外观熟透,熟而不黏,内无生芯即可;然后将稻壳放入蒸锅中蒸制18 min,结束后进行灭菌处理。
翻拌冷却:按照混合粮粉∶灭菌稻壳=25∶4(g∶g)的比例混合,翻拌冷却[8-9]。
接种、主发酵:待冷却至35 ℃左右,拌入质量分数0.5%的白酒曲及体积分数13%的白地霉种子液,放入发酵容器中在28 ℃发酵25 d。
蒸馏陈酿:将发酵完全的酒醪摇匀倒入蒸酒器,当有酒液流出时,去掉酒头,用酒瓶接蒸馏白酒,当流出液流速变小时,去掉酒尾。封紧瓶口,放入干燥、阴凉的地方陈酿6个月。
1.3.3 固态发酵法酿造白酒条件优化单因素试验
按照1.3.2的方法处理原料和稻壳,分别考察白地霉接种量(9%、11%、13%、15%、17%)、初始pH值(4、5、6、7、8)、发酵时间(10 d、15 d、20 d、25 d、30 d)和发酵温度(20 ℃、24 ℃、28 ℃、32 ℃、36 ℃)对固态发酵法酿造白酒的出酒率和总酯含量的影响。
1.3.4 固态发酵法酿造白酒条件优化响应面试验
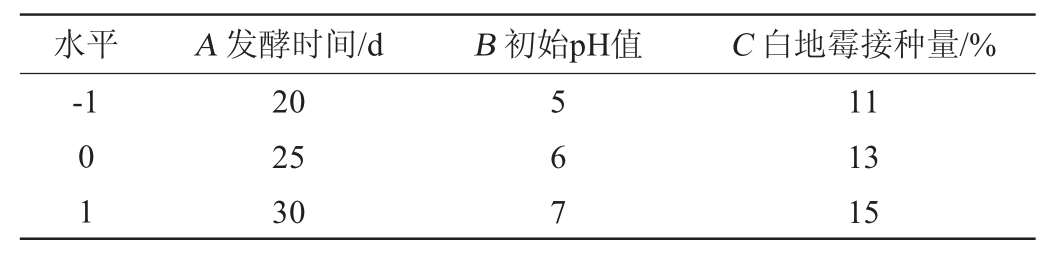
在单因素试验的基础上,通过方差分析,选择发酵时间(A)、初始pH值(B)、白地霉接种量(C)为3个因素,以固态发酵法酿造白酒的出酒率和总酯含量的综合值(Y)为考察指标,设计3因素3水平响应面试验对固态发酵法酿造白酒条件进行优化,响应面试验因素与水平见表1。
表1 固态发酵法酿造白酒条件优化Box-Behnken试验因素及水平
Table 1 Factors and levels of Box-Behnken experiment for Baijiu brewing conditions optimization by solid-state fermentation
1.3.5 测定方法
酒精度、出酒率[10-11]:参照GB 5009.225—2016《食品安全国家标准酒中乙醇浓度》的酒精计法测定原酒酒精度,按照下式计算出酒率:
式中:Y为原料出酒率,%;S为原酒酒精度,%vol;V为原酒酒精体积,mL;M为原粮质量,g。
总酯含量:参照GB/T 10345—2022《白酒分析方法》中的指示剂法。
固态发酵法酿造白酒的出酒率和总酯含量的综合值(Y):在响应面试验分析中,将出酒率和总酯的检测指标采用Hassan方法归一化为0~1之间的值(Dmax)[12-14],其计算公式如下:
式中:di为每组试验所测得的真实值;dmax为试验组中的最高值;dmin为试验组中的最低值。
再将出酒率和总酯的权重分别设为0.4和0.6[15-16],计算综合值(Y),其计算公式如下:
Y=Dmax(总酯含量)×0.6+Dmax(出酒率)×0.4
感官评价:由10位食品专业背景的人员组成评审小组,以GB/T 10781.2—2022《白酒质量要求第2部分:清香型白酒》为基准的感官评估方法,并结合王朝阳[17]的方法进行感官评分,满分100分。固态发酵法酿造白酒感官评分标准见表2。
表2 固态发酵法酿造白酒感官评分标准
Table 2 Sensory evaluation standards of Baijiu brewed by solid-state fermentation

续表

1.3.6 数据处理
试验结果均用“平均值±标准差”表示,采用Design Expert 8.0.6 软件进行响应面试验设计,并运用SPSS 20.0 统计软件对试验结果进行方差分析。每组试验均重复3次。
2 结果与分析
2.1 固态发酵法酿造白酒单因素试验结果分析
2.1.1 白地霉接种量对出酒率及总酯含量的影响
由图1可知,随白地霉接种量的增加,固态发酵法酿造白酒出酒率及总酯含量呈先上升后缓慢下降的趋势;白地霉接种量为13%时,出酒率、总酯含量均达到最大值,分别为17.9%、2.516 g/L;白地霉接种量<13%时,由于体系中的微生物浓度较低导致原料的转化程度低,所产生的酒精和总酯含量较少;白地霉接种量>13%时,出酒率和总酯含量开始缓慢降低,这是因为营养物质有限,当白地霉接种量不断上升,在发酵后期会出现竞争性抑制作用,导致总酯含量降低[18]。综合考虑,选择13%为白地霉的最佳接种量。
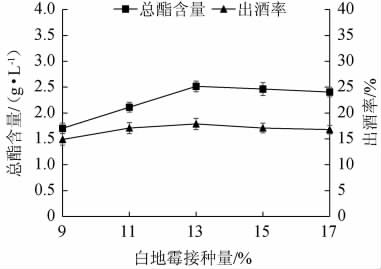
图1 白地霉接种量对总酯含量和出酒率的影响
Fig.1 Effect of Geotrichum candidum inoculum on total esters contents and liquor yield
2.1.2 不同初始pH对总酯含量和出酒率的影响
由图2可知,随着初始pH值的增加,固态发酵法酿造白酒出酒率及总酯含量呈现先上升后下降的趋势;在初始pH值为6时,出酒率、总酯含量均达到最大值,分别为27.52%、1.707 g/L;在初始pH值<6时,出酒率和总酯含量不断升高;在初始值pH>6时,由于初始pH较高,不利于菌种的生长,也会影响体系中酶的活性,所产生的酒精和总酯含量开始下降;在酒类发酵中,由于酵母菌、酒曲发酵产生一些酸性物质导致整个体系内pH值的下降,所以初始pH值过低不利于菌种的活动[19]。综合考虑,选择pH为6作为最佳初始pH值。
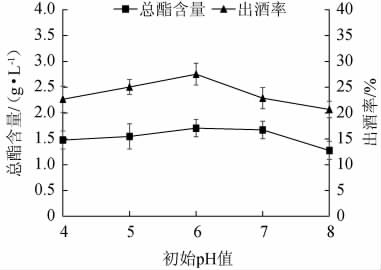
图2 初始pH对总酯含量和出酒率的影响
Fig.2 Effect of initial pH on total esters contents and liquor yield
2.1.3 不同发酵时间对出酒率及总酯含量的影响
由图3可知,随着发酵时间的延长,固态发酵法酿造白酒出酒率及总酯含量呈先上升后下降的趋势;发酵时间为25 d时出酒率、总酯含量均达到最大值,分别为20.768%、2.223 g/L。当发酵时间<25 d时,由于酵母菌前期产酒精速度快,反应较为旺盛,会将原本的原料快速的进行消耗代谢转变为酒精,同时总酯含量也不断的增加[20]。当发酵时间>25 d时,前期发酵酒精的积累会抑制菌种的生长,出酒率开始降低,同时随着时间的延长白地霉进行酯化,酯类在后期也会挥发或者被体内所含有的酯解酶所分解,导致总酯含量降低[21]。综合考虑,选择25 d为白酒固态发酵的最佳时间。
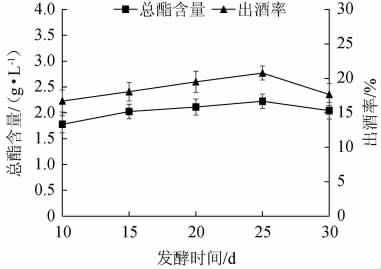
图3 发酵时间对总酯含量和出酒率的影响
Fig.3 Effect of fermentation time on total esters contents and liquor yield
2.1.4 不同发酵温度对出酒率及总酯含量的影响
由图4可知,随着发酵温度的升高,固态发酵法酿造白酒出酒率及总酯含量呈先上升后缓慢下降的趋势;当发酵温度为28 ℃时出酒率、总酯含量均达到最大值,分别为17.7%、2.37 g/L;当发酵温度低于28 ℃时,体系中微生物生长缓慢导致原料的转化程度低,所产生的酒精和总酯含量较少;当发酵温度高于28 ℃时,白酒的出酒率和总酯含量开始下降,这是由于温度的升高会加快酯类的水解及挥发,甚至会引起酒曲中的酵母的死亡[22]。综合考虑,选择28 ℃为白酒固态发酵的最佳温度。
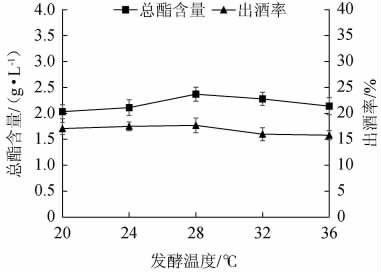
图4 发酵温度对总酯含量和出酒率的影响
Fig.4 Effect of fermentation temperature on total esters contents and liquor yield
2.2 响应面优化试验结果与分析
2.2.1 多元回归方程及方差分析
由表3可知,3个因素经过拟合得到的二次回归方程:Y=0.92+0.15A+0.13B+0.17C-5.5×10-6AB-0.12AC-0.091BC-0.26A2-0.28B2-0.17C2。
表3 固态发酵法酿造白酒条件优化Box-Behnken试验设计及结果
Table 4 Design and results of Box-Behnken experiments for Baijiu brewing conditions optimization by solid-state fermentation
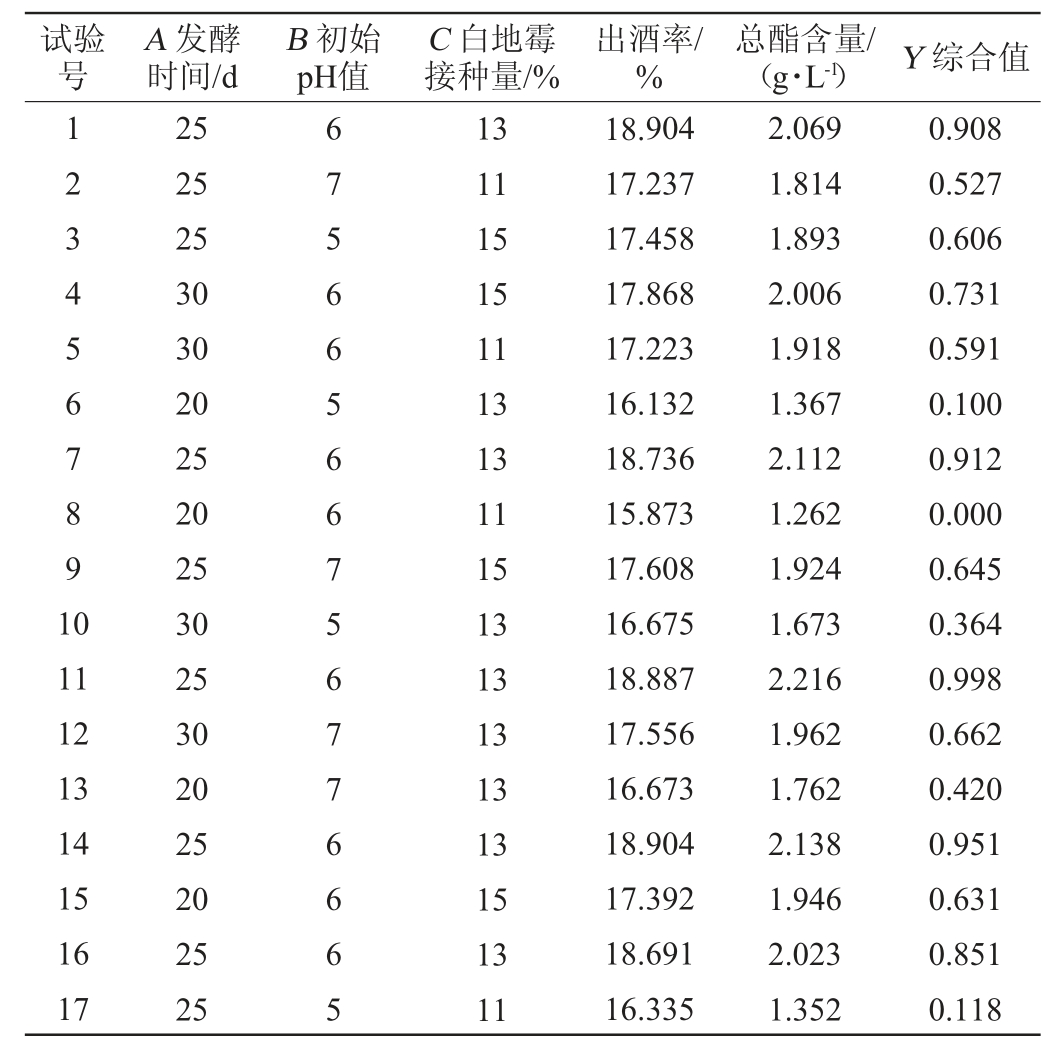
对响应面试验进行方差分析,结果见表4。
表4 固态发酵法酿造白酒条件优化回归模型方差分析
Table 4 Variance analysis of regression model of optimization for Baijiu brewing conditions by solid state fermentation method
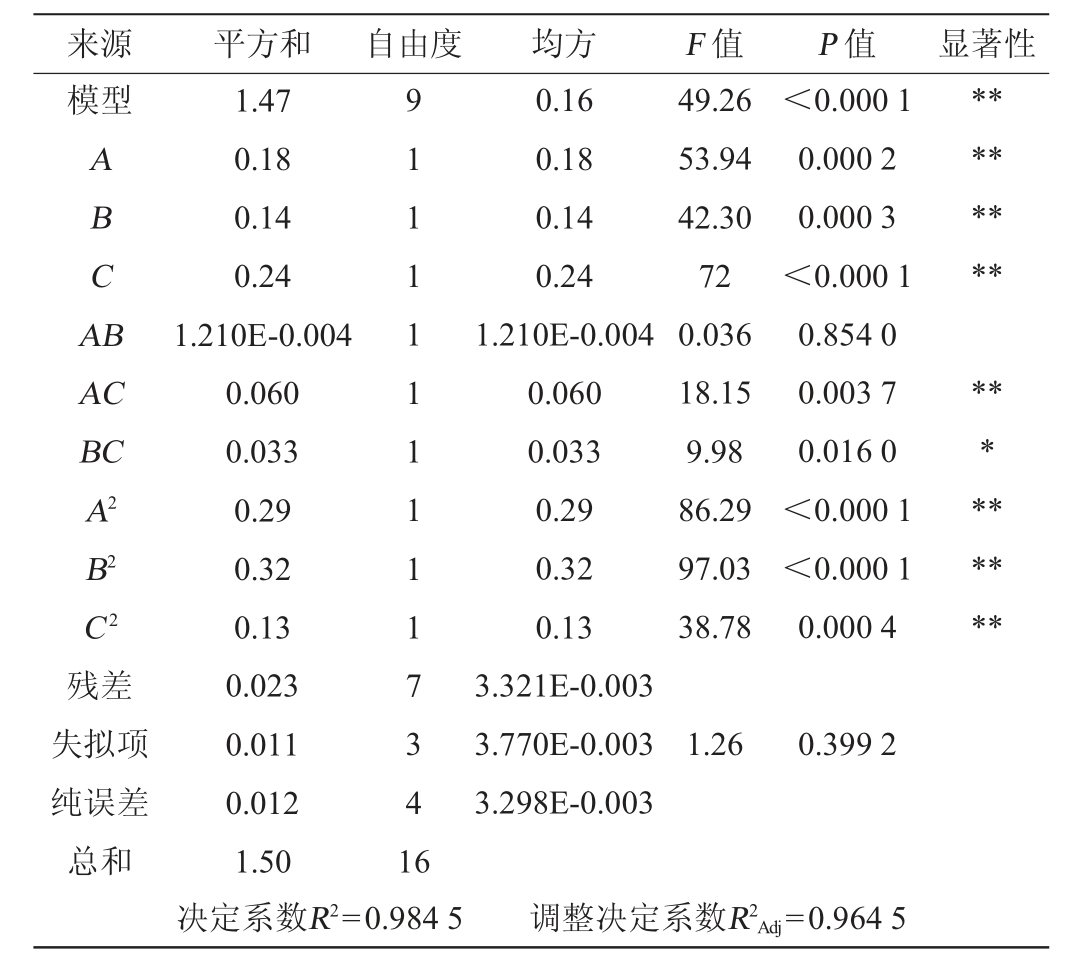
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表4可知,该模型极显著(P<0.01),失拟项不显著(P=0.399 2>0.05),表明回归模型对试验具有很好的拟合性;决定系数R2=0.984 5,调整决定系数R2Adj=0.964 5,表明酒精度的实际值与预测值之间的拟合度较高[23]。在回归模型中,对综合值影响次序为C>A>B。从数据分析中可以看出,一次项A、B、C,交互项AC,二次项A2、B2、C2对综合值的影响均达到了极显著水平(P<0.01),交互项BC对综合值的影响达到显著水平(P<0.05)[24]。
2.2.2 各因素交互作用的响应面分析
用Design-Expert 8.0.6软件进行数据分析,得出白地霉接种量、初始pH值、发酵时间交互作用对综合值影响的响应曲面,结果见图5。
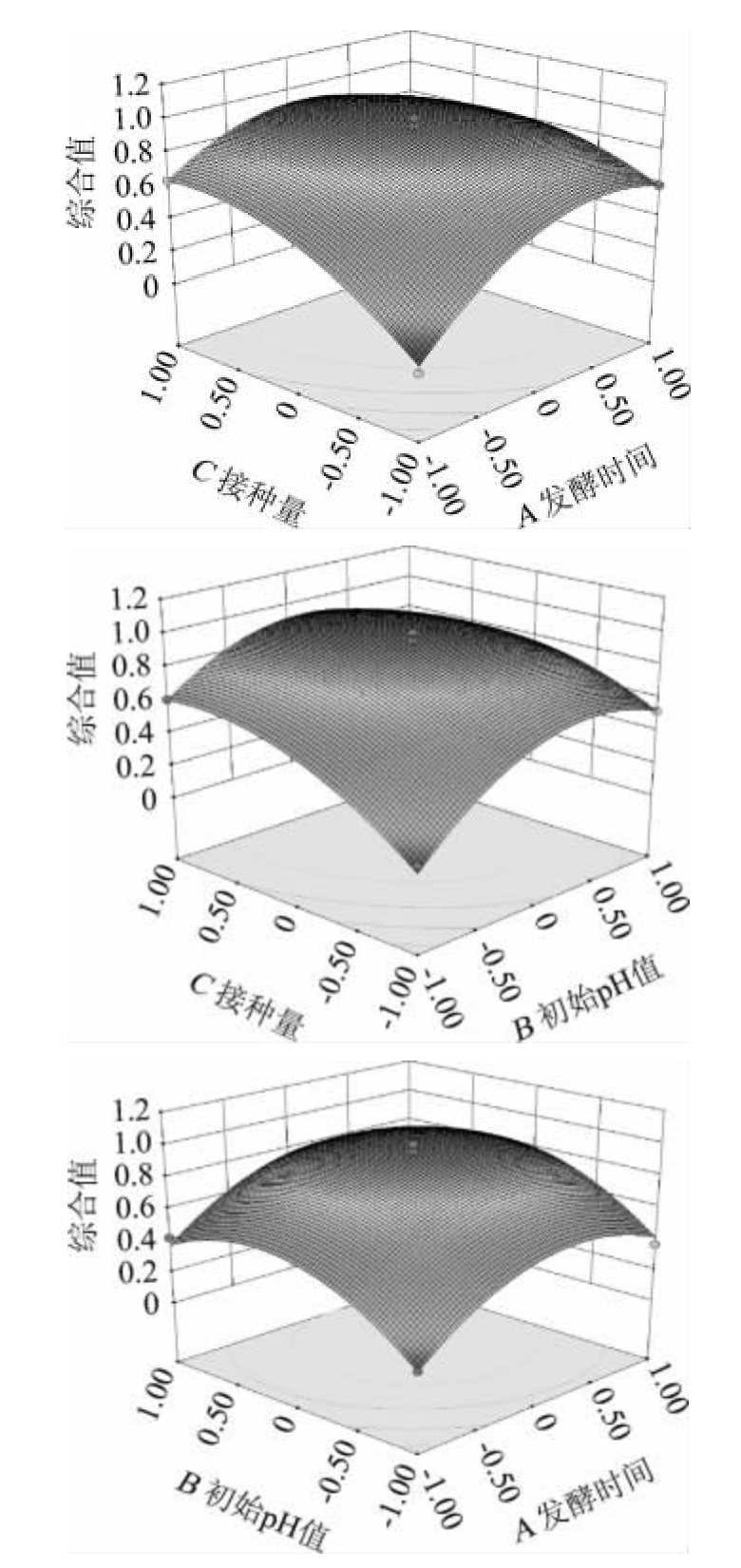
图5 各因素间交互作用对综合值影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on the composite value
由图5可知,等高线呈椭圆形,说明3个因素之间存在互作用[25]。随着A(发酵时间)和C(白地霉接种量)的增加,综合值呈现先增后减的趋势,C对应的曲面坡度比A陡峭,即C对综合值的影响程度大于A;等高线呈椭圆形,表示A和C交互作用极显著(P<0.01)。随着B(初始pH值)和C(白地霉接种量)的增加,综合值呈现先增后减的趋势,C对应的曲面坡度相较于B的陡峭,即C对综合归一值的影响程度大于B;等高线呈椭圆形,表示B和C交互作用显著(P<0.05)。该结果与表5方差分析一致。
最终得出固态发酵法酿造白酒优化条件为发酵时间25.98 d,初始pH值为6.18,白地霉接种量为13.76%,此时出酒率和总酯含量的综合值理论值为0.983。但考虑到实际的情况以及可操作性行,将条件参数修正为发酵时间26 d,初始pH值6.2,白地霉接种量14%。
2.2.3 模型验证
为了验证模型的可行性,用得到的最佳条件进行3次平行验证试验,得到综合值实际值为0.974,与理论值0.983差异不显著(P<0.05),模型验证成功。所获的原酒酒精度为56%vol、出酒率为20.42%,总酯含量为2.12 g/L,感官评分为82.7分,澄清透明,无杂质沉淀,口感醇厚绵甜,香味协调。
3 结论
本试验通过考察白地霉接种量、初始pH值和发酵时间对出酒率和总酯含量的影响,采用固态发酵的方式进行白酒条件的优化,得出优化条件为:发酵时间26 d,初始pH值为6.2,白地霉接种量为14%,白酒曲添加量0.5%;在发酵温度为28 ℃时发酵所获得的原酒中的平均总酯含量为2.12 g/L,平均出酒率为20.42%,感官评分82.7分。本试验仅对白地霉发酵条件进行了优化,后续还可以对原酒进行挥发性成分分析,探究白地霉发酵产生风味物质的组成成分,为白地霉固态发酵白酒的生产和研发提供理论依据和技术参考。
[1]杨帆,周兴鹏,张敬铖,等.混蒸混烧生产清香型白酒条件[J].食品研究与开发,2018,39(9):76-81.
[2]管健,方尚玲,曹敬华,等.大曲清香型白酒固态发酵培养基的优化[J].酿酒,2018,45(6):69-73.
[3]HONG L X,FU G M,LIU T,et al.Functional microbial agents enhance ethanol contents and regulate the volatile compounds in Chinese Baijiu[J].Food Biosci,2021,44:101411.
[4]刘建学,刘金科,李璇,等.白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究[J].食品与机械,2020,36(6):42-49.
[5]胡建华.白地霉在清香型基酒生产中的应用[J].酿酒,2014,41(1):54-56.
[6]田宇敏.基于风味导向产香菌M5的分离鉴定及应用研究[D].晋中:山西农业大学,2019.
[7]胡琴,曹新志,张楷正,等.半固态发酵法酿造苦荞小曲酒糖化条件优化[J].中国酿造,2021,40(4):61-65.
[8]崔海灏.十里香酒产酯酵母的筛选及应用研究[D].保定:河北大学,2020.
[9]尹雅洁,王晓军,姜欣,等.多粮清香型白酒酿造条件的优化[J].食品与发酵工业,2021,47(19):140-145.
[10]邢爽,王亚平,郭学武,等.发酵条件对5种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[11]刘君,李玲珊,赵文鹏,等.中高温大曲产酯酵母代谢产酯性能研究[J].酿酒科技,2021(12):33-38,46.
[12]沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):28-31.
[13]曹长江.孔府家白酒风味物质研究[D].无锡:江南大学,2014.
[14]黄治国,蒲领平,罗慧波,等.浓香型白酒酯化菌协同产酯的条件优化[J].现代食品科技,2021,37(2):64-71.
[15]ZHANG C H,MA Y J,YANG F X,et al.Optimization of medium composition for butyric acid production by Clostridium thermobutyricum using response surface methodology[J].Bioresource Technol,2009,100(18):4284-4288.
[16]靳沛.大曲和麸曲相结合液态发酵白酒的酿造及理化性质的研究[D].沈阳:沈阳农业大学,2020.
[17]王朝阳.清香型大曲白酒产酯酵母的筛选及鉴定[D].太原:山西大学,2019.
[18]刘占奇,李梦,黄梦明,等.响应面法优化液态法白酒生产条件[J].酿酒,2019,46(6):51-54.
[19]刘小改,马美荣,周林艳,等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造,2020,39(10):79-83.
[20]黄婷,敖宗华,王松涛,等.响应面法优化米香型白酒发酵条件[J].食品工业,2016,37(8):69-74.
[21]廖素兰,潘婉华.响应面法优化锥栗桂花糯米白酒发酵条件[J].食品研究与开发,2021,42(14):80-86.
[22]刘梅,黄治国,卫春会,等.响应面法优化窖泥中一株产酯酵母的扩培条件[J].食品研究与开发,2019,40(6):186-193.
[23]游湘淘,余佶,张敏,等.百合多粮白酒半固态法酿造条件及风味研究[J].食品与机械,2021,37(3):168-169.
[24]姚霞,明红梅,周健,等.十个浓香型大曲挥发性风味物质的主成分分析[J].食品研究与开发,2015,36(14):15-20.
[25]张宇森.清香型燕麦白酒条件的优化及其营养成分的研究[D].呼和浩特:内蒙古农业大学,2020.